Похожие презентации:
Составление кластера
1. Мы молоды, мы полны энергии, мы талантливы, у нас всё в жизни хорошо, у нас всё получится!
2.
Составление кластераCaCO3
HCl
Ba(OH)2 ZnCl2 C12H22O11
FeS MgO
Al2(SO4)3 H2SO4 NaOH
Mg3(PO4)2 H2SiO3
CuSO4
3. Кластер
Растворимые веществаНерастворимые вещества
HCl
CaCO3
Ba(OH)2
FeS
ZnCl2
MgO
C12H22O11
Mg3(PO4)2
Al2(SO4)3
H2SiO3
H2SO4
NaOH
CuSO4
4. Составить уравнения химических реакций
NaOH + H2SO4Fe + MgSO4
CaO + CO2
H2SiO3
5.
6. Электролит
7. Цель урока
Изучить процессэлектролитической диссоциации,
объяснить причины
электролитической диссоциации.
8.
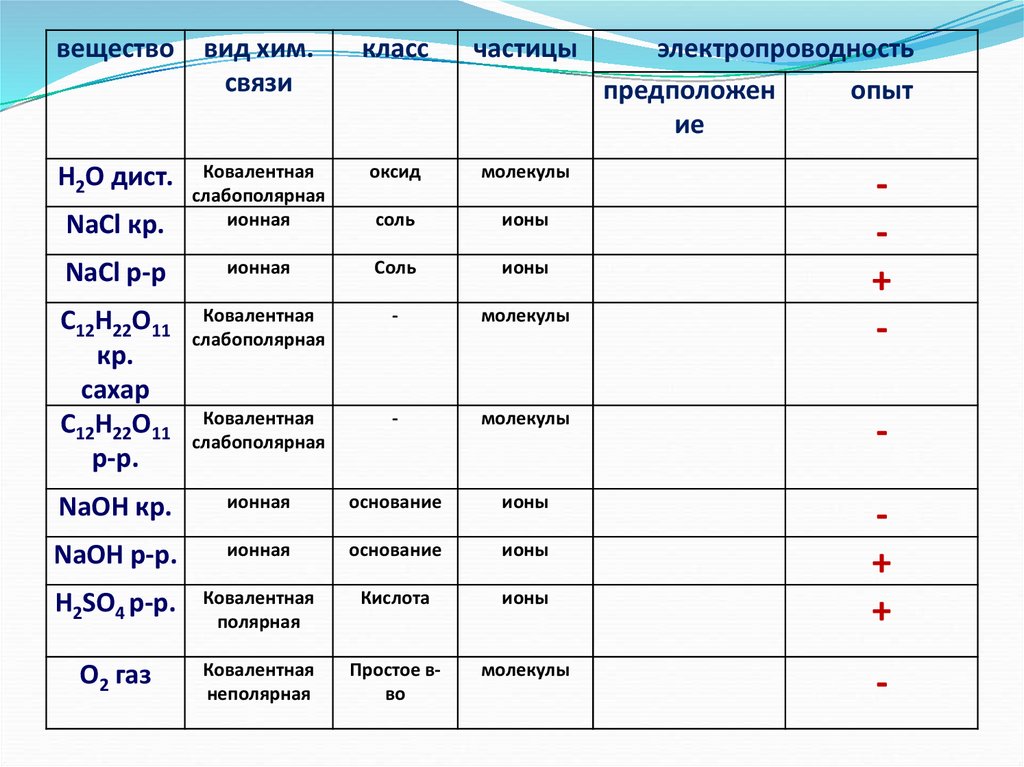
веществоН2О дист.
NaCl кр.
NaCl р-р
C12H22O11
кр.
сахар
C12H22O11
р-р.
NaOH кр.
NaOH р-р.
H2SO4 р-р.
O2 газ
вид хим.
связи
класс
частицы
электропроводность
предположен
опыт
ие
9.
веществовид хим.
связи
класс
частицы
Н2О дист.
Ковалентная
слабополярная
ионная
оксид
молекулы
соль
ионы
NaCl р-р
ионная
Соль
ионы
C12H22O11
кр.
сахар
C12H22O11
р-р.
Ковалентная
слабополярная
-
молекулы
Ковалентная
слабополярная
-
молекулы
-
NaOH кр.
ионная
основание
ионы
NaOH р-р.
ионная
основание
ионы
H2SO4 р-р.
Ковалентная
полярная
Кислота
ионы
+
+
O2 газ
Ковалентная
неполярная
Простое вво
молекулы
NaCl кр.
электропроводность
предположен
опыт
ие
+
-
-
10.
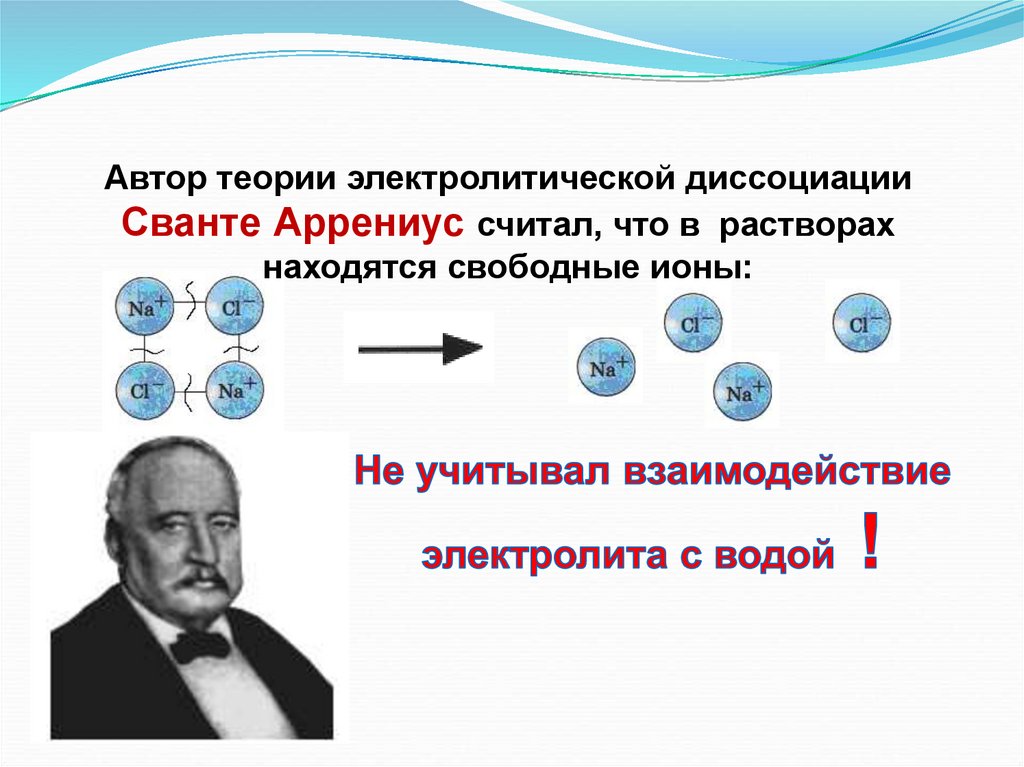
Автор теории электролитической диссоциацииСванте Аррениус считал, что в растворах
находятся свободные ионы:
11. Причину диссоциации объяснили
И.А. Каблуков,В.А. Кистяковский ─ при
растворении электролита
происходит химическое
взаимодействие
растворенного вещества с
водой, которое приводит к
образованию гидратов, а
затем они диссоциируют на
ионы. В растворах находятся
не свободные, а
гидратированные ионы
12. Диполь- молекула воды
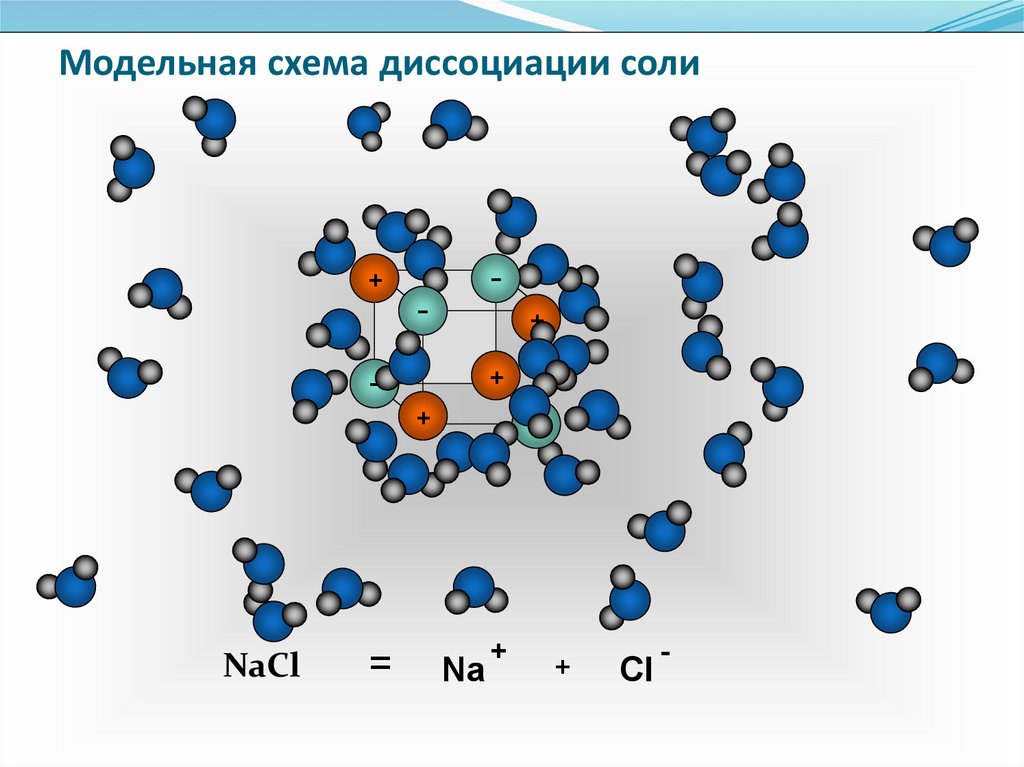
13. Модельная схема диссоциации соли
-+
-
+
+
+
NaCl
=
-
Na
+
+
Cl
-
14. Механизм диссоциации ионного соединения
диполиводы
+
NaCl Na + Cl
гидратированные
ионы
15.
Последовательность процессов,происходящих при диссоциации
веществ с ионной связью:
1)ориентация молекул;
2)гидратация(взаимодействие);
3)диссоциация(распад) кристалла
16. Механизм диссоциации полярной молекулы
+H
H+
-
Cl
Cl-
+
HCl H + Cl
H+
+
Cl-
-
17.
Последовательность процессов,происходящих при диссоциации веществ с
ковалентной полярной связью:
1)ориентация молекул;
2)гидратация(взаимодействие) молекул;
3)ионизация молекул(превращение веществ
ковалентной полярной связи в ионную;
4)диссоциация(распад) кристалла
18.
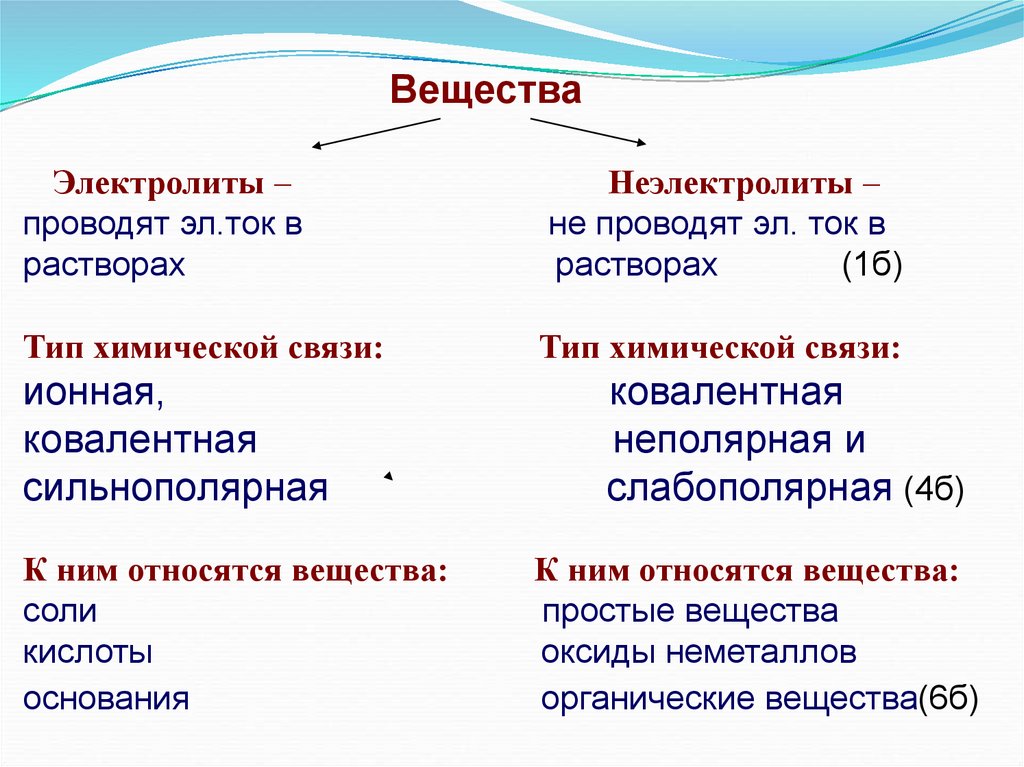
ВеществаЭлектролиты –
проводят эл.ток в
растворах
Неэлектролиты –
не проводят эл. ток в
растворах
(1б)
Тип химической связи:
Тип химической связи:
ионная,
ковалентная
сильнополярная
К ним относятся вещества:
соли
кислоты
основания
ковалентная
неполярная и
слабополярная (4б)
К ним относятся вещества:
простые вещества
оксиды неметаллов
органические вещества(6б)
19. Степень диссоциации (α)
αчисло частиц, распавшихс я на ионы
общее число частиц
20.
ЭлектролитыСильные
Слабые
α ≥ 30%
α ≤ 3%
растворимые соли
сильные кислоты
(H2SO4, HCl, HNO3)
щелочи
слабые кислоты (H2S,
HNO2, H2CO3)
водный раствор
аммиака NH3•H2O
вода
21.
Задание №1Впишите недостающие слова:
1) Все вещества по их способности проводить
электрический ток в растворах делятся на
электролиты и ________________.
неэлектролиты
______________
Процесс распада электролита на ионы называется
электролитической ______________.
диссоциацией
__________________
В растворах электролиты диссоциируют на
положительные и отрицательные
_______________
______________ ионы.
2) Все _____ соли –________,пример– ___________.
Все ______основания –_____,пример– ___________.
22.
ЗаданиеПокажите выигрышный путь, состоящий из названий
веществ или растворов, которые:
а) проводят электрический ток
Хлорид натрия
(р-р)
Раствор сахара
Сульфат натрия
(р-р)
Вода, насыщенная
O2
Серная кислота
(р-р)
Спирт
Дисциллированная
вода
Азотная кислота
(р-р)
Гидроксид натрия
(р-р)
б) не проводят электрический ток
Дисциллированная
вода
Сахар (тв.)
Раствор сахара
Минеральная вода
Соляная кислота
Нитрат натрия (р-р)
Известковая вода
Гидроксид калия
(р-р)
Карбонат кальция
(тв.)
23.
ЗаданиеСоотнесите:
1.
А) Электролиты
Б) Неэлектролиты
2.
Электролиты:
А) NaCl
Б) KOH
В) HNO3
1) Кислоты
2) Оксиды
3) Простые вещества
4) Соли
5) Основания
Ионы в растворе электролита:
+
1) OH¯
4) K
+
2) H
5) NO3¯
–
+
3) Na
6)Cl
24. РЕФЛЕКСИЯ
Сегодня я узнал…..Было интересно……
Теперь я могу………
Я приобрел……
Я научился………
25.
Домашнее задание:Подготовка проекта « Электролитическая
диссоциация и электролиты в быту»
упр.1,5 - «3»;
упр.1,5,4 - «4»;
упр.1,5,4,3 - «5»






















 Химия
Химия








