Похожие презентации:
Химические свойства металлов
1.
2.
Цель: рассмотреть общиехимические свойства металлов
Задачи урока:
1. Охарактеризовать важнейшие химические
свойства металлов;
2. На примере реакций, характеризующих
химические свойства, повторить окислительновосстановительные реакции;
3. Продолжить формирование умения работать с
лабораторным оборудованием.
3.
Взаимодействие металлов снеметаллами
Металлы вступают в реакцию с простыми веществами: кислородом,
хлором, серой и другими.
Взаимодействуя с кислородом:
1. Ме I группы главной подгруппы (искл. Li) образуют пероксиды
Ме + О2 Me2O2
2. Остальные Ме образуют оксиды
Ме + O2 MexOy
4.
Взаимодействие металлов скислотами
1. Найдите ошибки в уравнениях электронного баланса:
Zn + HCl ZnCl2 + H2
Zn0 + 2e Zn+2
1
2
2H+1 – 2e H20
1
Верно ли определены окислитель и восстановитель? Поясните ответ.
Zn – окислитель;
HCl – восстановитель за счёт Cl-1
5.
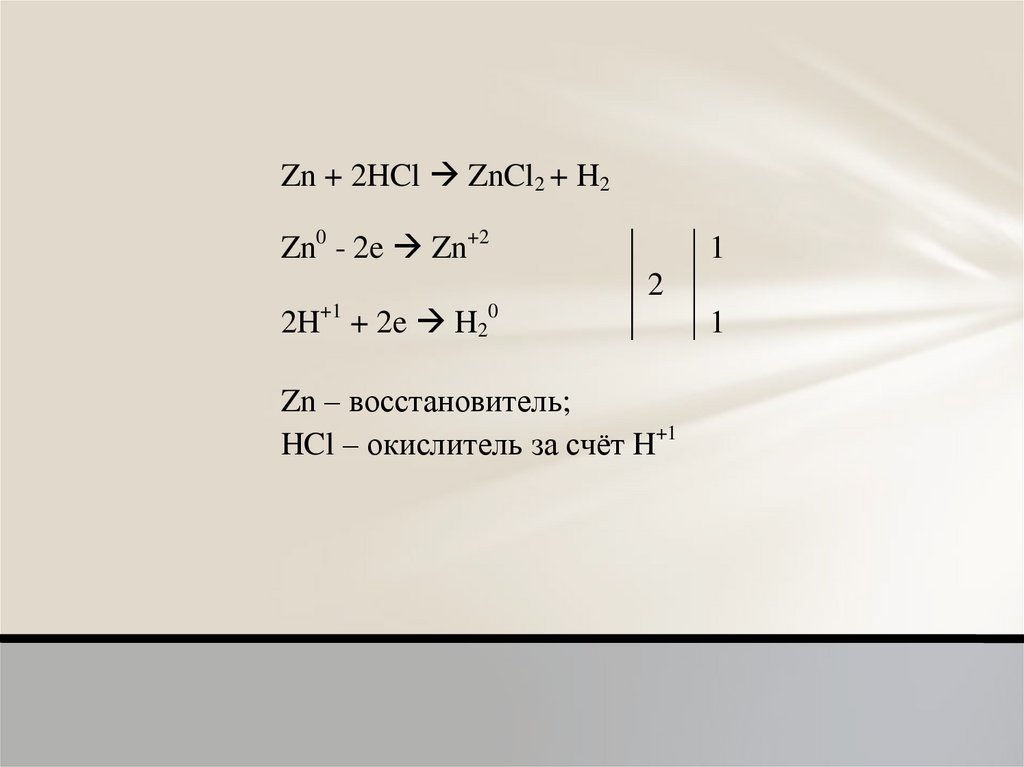
Zn + 2HCl ZnCl2 + H2Zn0 - 2e Zn+2
1
2
2H+1 + 2e H20
Zn – восстановитель;
HCl – окислитель за счёт H+1
1
6.
Взаимодействие металлов сводой
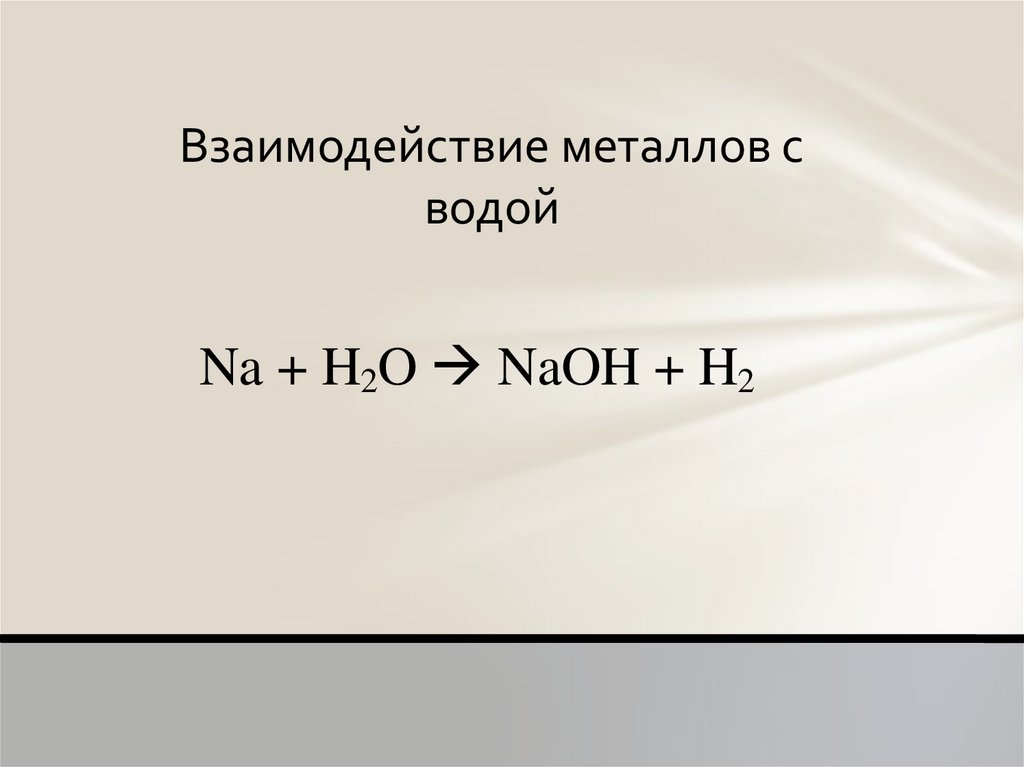
Na + H2O NaOH + H2
7.
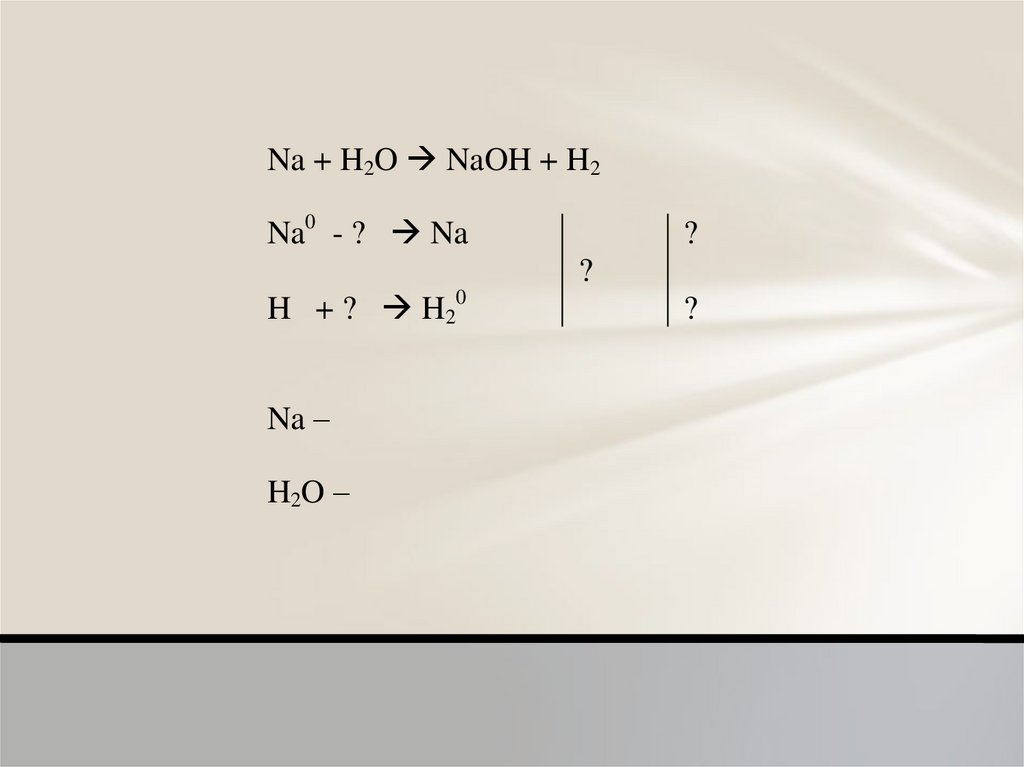
Na + H2O NaOH + H2Na0 - ? Na
?
?
H + ? H20
Na –
H2O –
?
8.
Взаимодействие металлов сводой
А) Щелочные металлы и щелочноземельные Ca и Ba c водой образуют гидроксиды
соответствующих металлов и водород!
2 Na 0 2 H 2 1O 2 Na 1OH H 20
Na 0 e Na 1 2
2 H 1 2e H 20 1
Ca 0 2 H 2 1O Ca 2 OH 2 H 20
Б) Mg, Al, Mn, Zn, Cr, Fe, Ni, Pb с водой реагируют при нагревании с образованием оксидов
металлов и водорода.
1
2
t
1
2
t
Zn H O Zn 2O H 20
0
Pb H O Pb 2 O H 20
0
В) Cu, Ag, Au с водой не реагируют
Cu H 2 O
9.
Взаимодействиеметаллов с растворами
солей
Fe + CuSO4 (раствор) ?
Cu + MgCl2 (раствор) ?
10.
Взаимодействие металлов срастворами солей
Fe + CuSO4 Cu + FeSO4
Ме, вступающий в реакцию должен быть более активным, чем тот Ме ,
который образуется.
Сu + MgCl2
11.
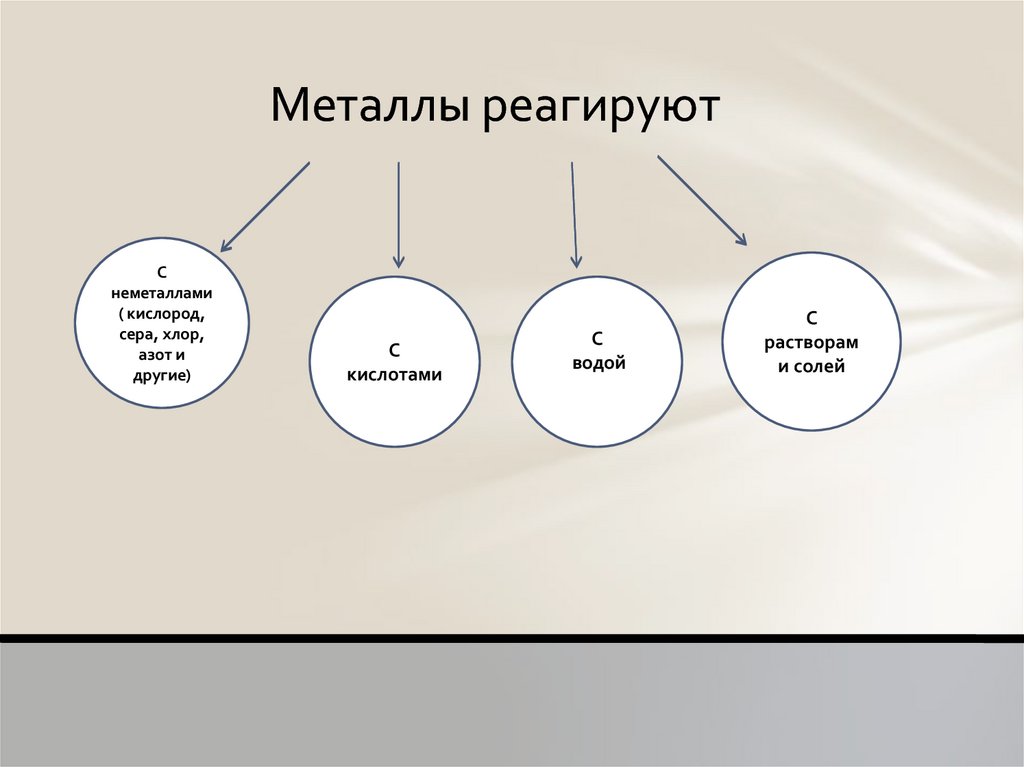
Металлы реагируютС
неметаллами
( кислород,
сера, хлор,
азот и
другие)
C
кислотами
С
водой
С
растворам
и солей
12.
Домашнее задание:§ 11 учить;
1 уровень: составить уравнения реакций,
отражающие химические свойства
цинка;
2 уровень: расставить коэффициенты в
уравнениях методом электронного
баланса.








 Химия
Химия








