Похожие презентации:
Кислоты. Состав кислот (8 класс)
1.
Тема: «Кислоты»8 класс
Яппарова Алсу Наилевна,
учитель химии второй
квалификационной категории
МОУ «Каратунская СОШ»
2.
Что такое кислоты?Кислотами называют сложные вещества, молекулы
которых состоят из атомов водорода, способных
замещаться на атомы металлов, и кислотных
остатков.
Кислоты – это электролиты,
которые при диссоциации образуют
катионы водорода
и анионы кислотного остатка.
H Cl = H+ + Cl –
H2 SO 4 = 2 H+ + SO42-
3. Состав кислот
H ClH2SO4
H3PO4
1. Кислоты – это простые или сложные вещества?
2. Что общего в составе кислот?
3. Сформулируйте определение данного класса.
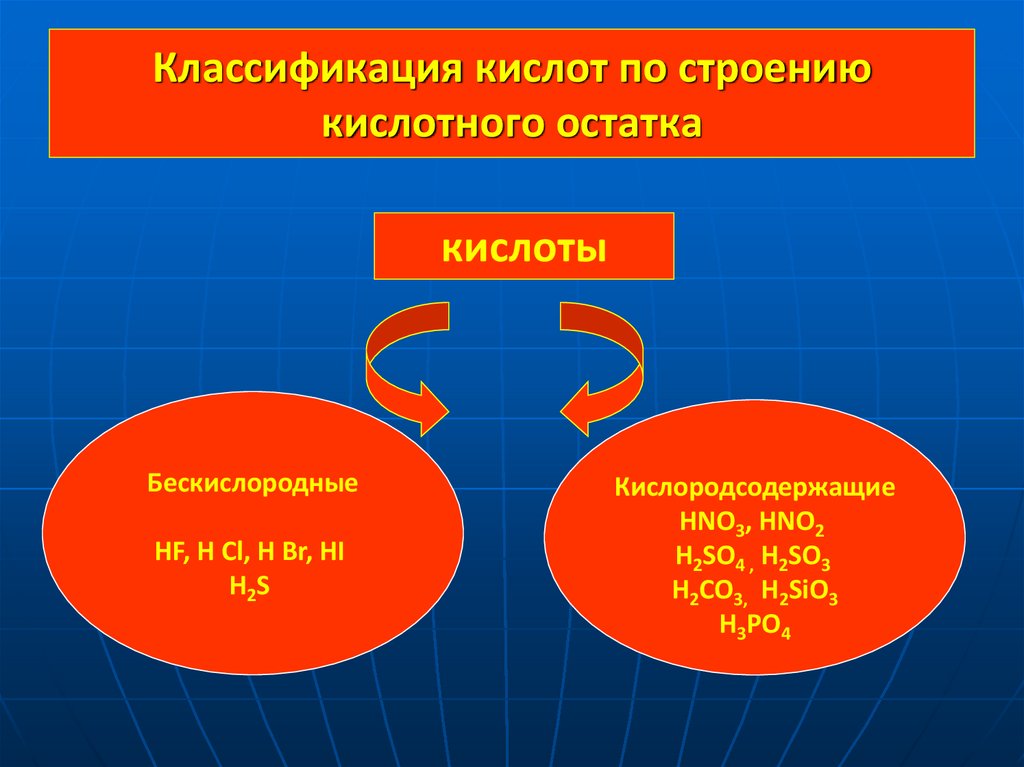
4. Классификация кислот по строению кислотного остатка
кислотыБескислородные
HF, H Cl, H Br, HI
H2S
Кислородсодержащие
HNO3, HNO2
H2SO4 , H2SO3
H2CO3, H2SiO3
H3PO4
5.
Нахождение кислот в природеЛимонная кислота содержится в
лимонах, яблочная кислота - в
яблоках, щавелевая кислота - в
листьях щавеля.
В пчелином яде, в волосках крапивы, в иголках
сосны и ели содержится муравьиная кислота.
Муравьи, защищаясь от врагов, разбрызгивают
капельки муравьиной кислоты.
При скисании виноградного сока
и молока, при квашении капусты
образуется молочная кислота.
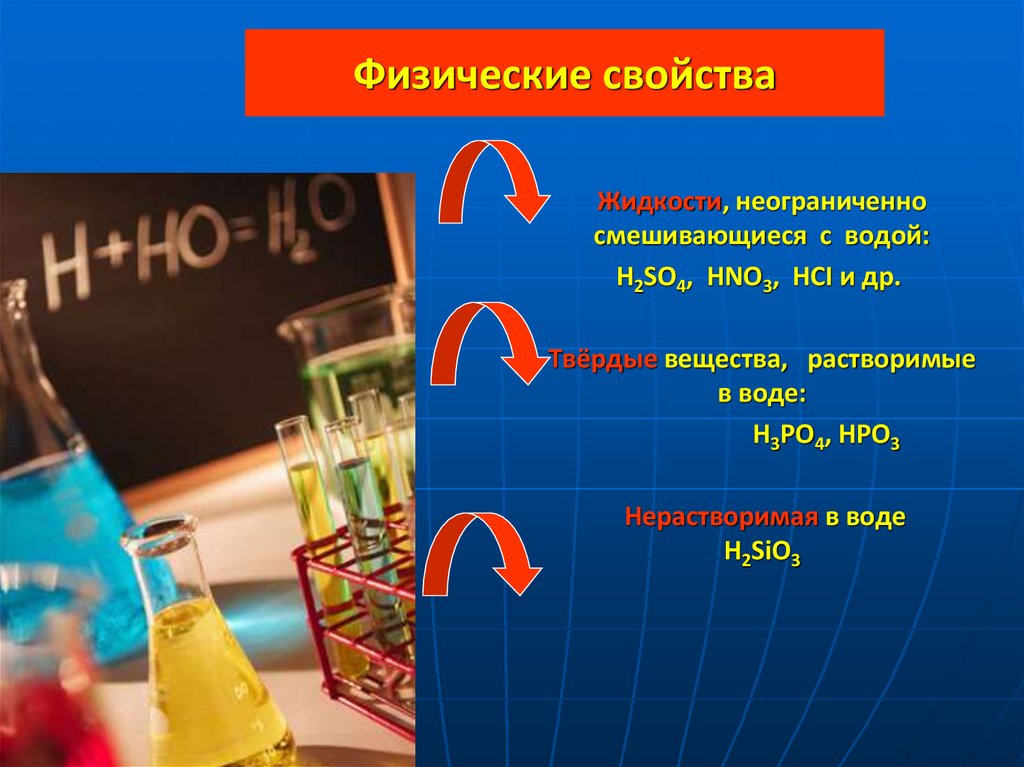
6. Физические свойства
Жидкости, неограниченносмешивающиеся с водой:
H2SO4, HNO3, HCI и др.
Твёрдые вещества, растворимые
в воде:
H3PO4, HPO3
Нерастворимая в воде
H2SiO3
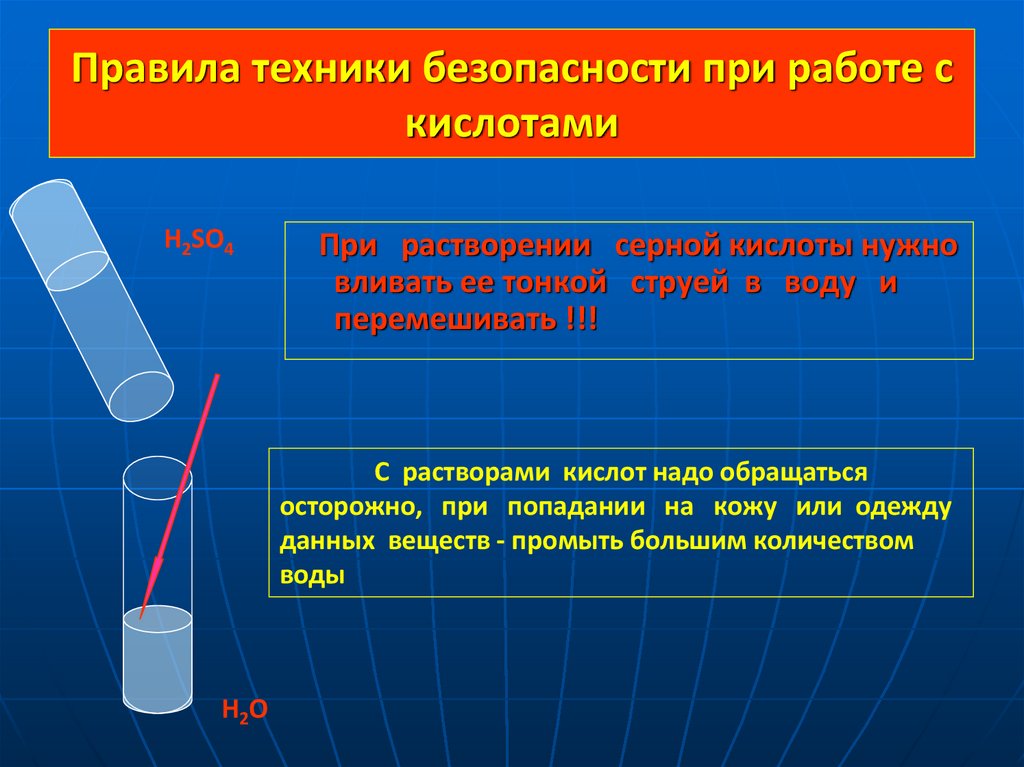
7. Правила техники безопасности при работе с кислотами
H2SO4При растворении серной кислоты нужно
вливать ее тонкой струей в воду и
перемешивать !!!
С растворами кислот надо обращаться
осторожно, при попадании на кожу или одежду
данных веществ - промыть большим количеством
воды
Н2О
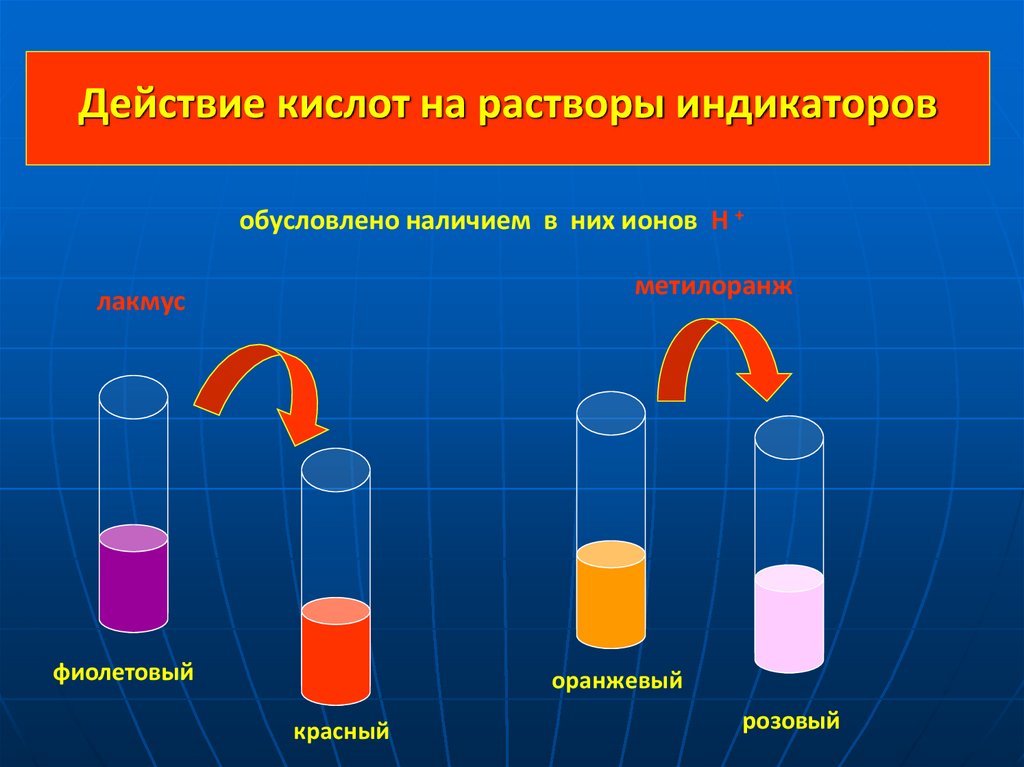
8.
Действие кислот на растворы индикаторовобусловлено наличием в них ионов Н +
метилоранж
лакмус
фиолетовый
оранжевый
красный
розовый
9.
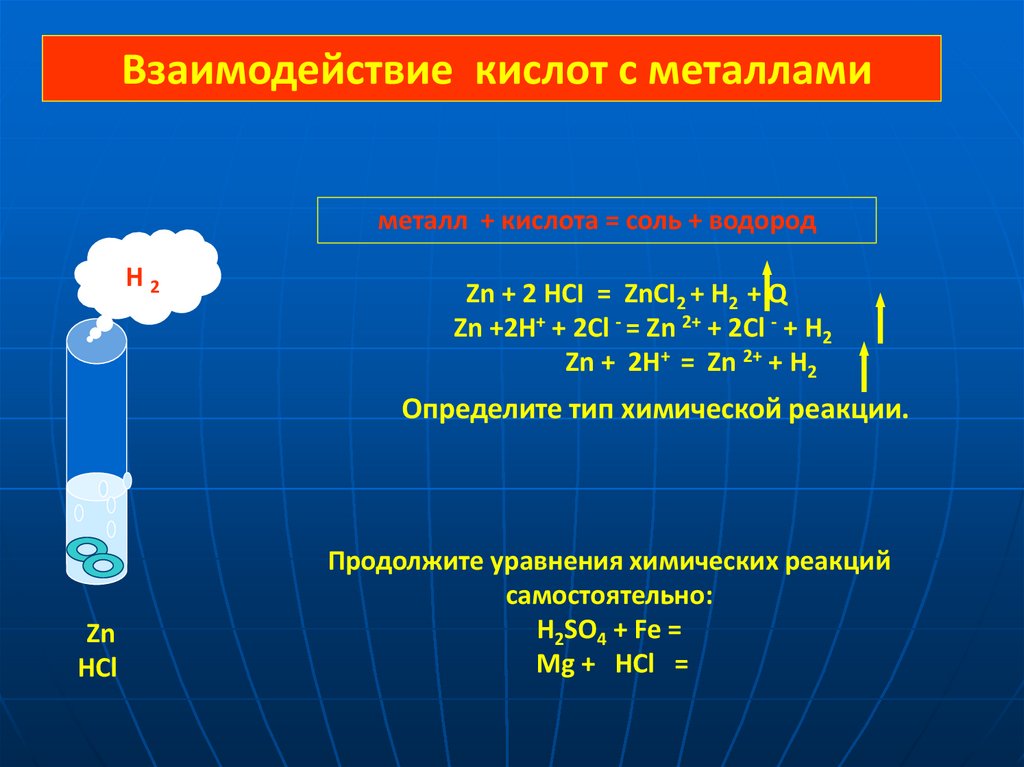
Взаимодействие кислот с металламиметалл + кислота = соль + водород
H2
Zn + 2 HCI = ZnCI2 + H2 + Q
Zn +2H+ + 2Cl - = Zn 2+ + 2Cl - + H2
Zn + 2H+ = Zn 2+ + H2
Определите тип химической реакции.
Zn
HCl
Продолжите уравнения химических реакций
самостоятельно:
H2SO4 + Fe =
Mg + HCl =
10.
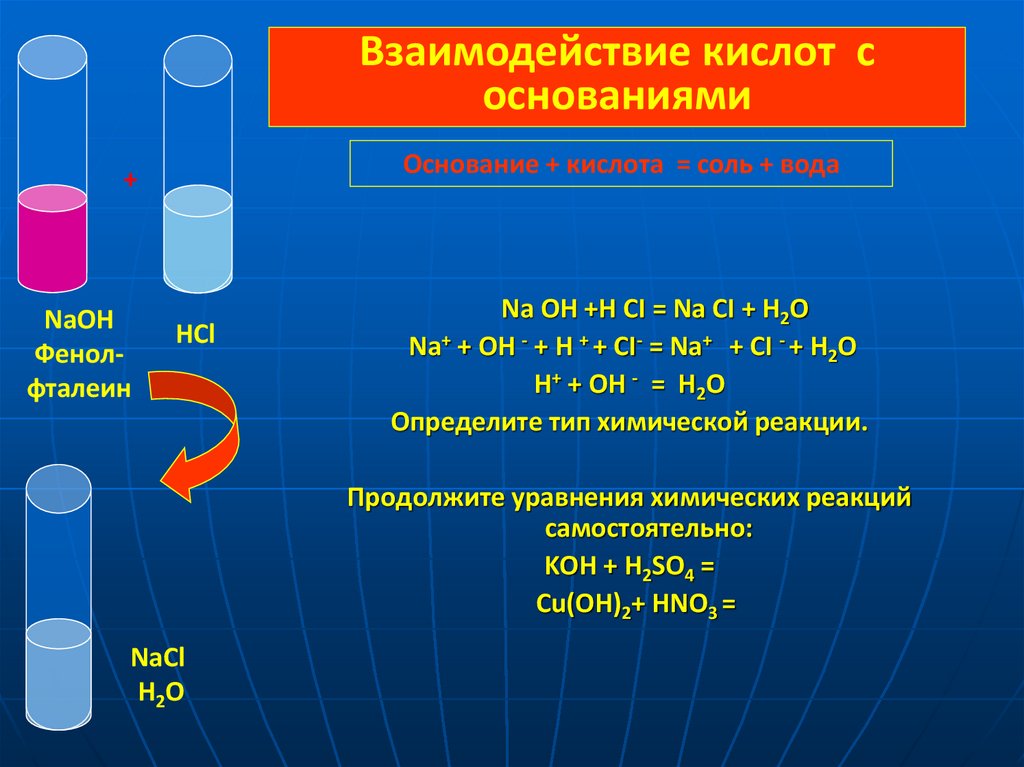
Взаимодействие кислот соснованиями
Основание + кислота = соль + вода
+
NaOH
Фенолфталеин
HCl
Na OH +H CI = Na CI + H2O
Na+ + OH - + H + + CI- = Na+ + CI - + H2O
Н+ + OH - = H2O
Определите тип химической реакции.
Продолжите уравнения химических реакций
самостоятельно:
KOH + H2SO4 =
Cu(OH)2+ HNO3 =
NaCl
H2O
11.
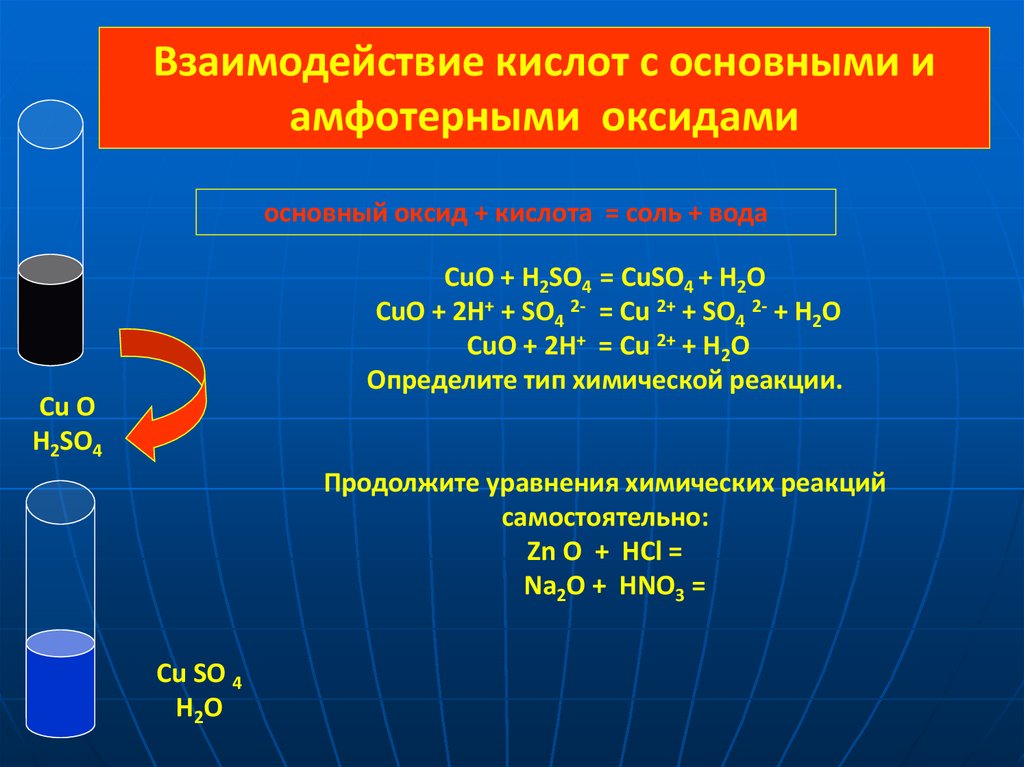
Взаимодействие кислот с основными иамфотерными оксидами
основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ + SO4 2- = Cu 2+ + SO4 2- + H2O
CuO + 2H+ = Cu 2+ + H2O
Определите тип химической реакции.
Cu O
H2SO4
Продолжите уравнения химических реакций
самостоятельно:
Zn O + HCl =
Na2O + HNO3 =
Cu SO 4
H2O
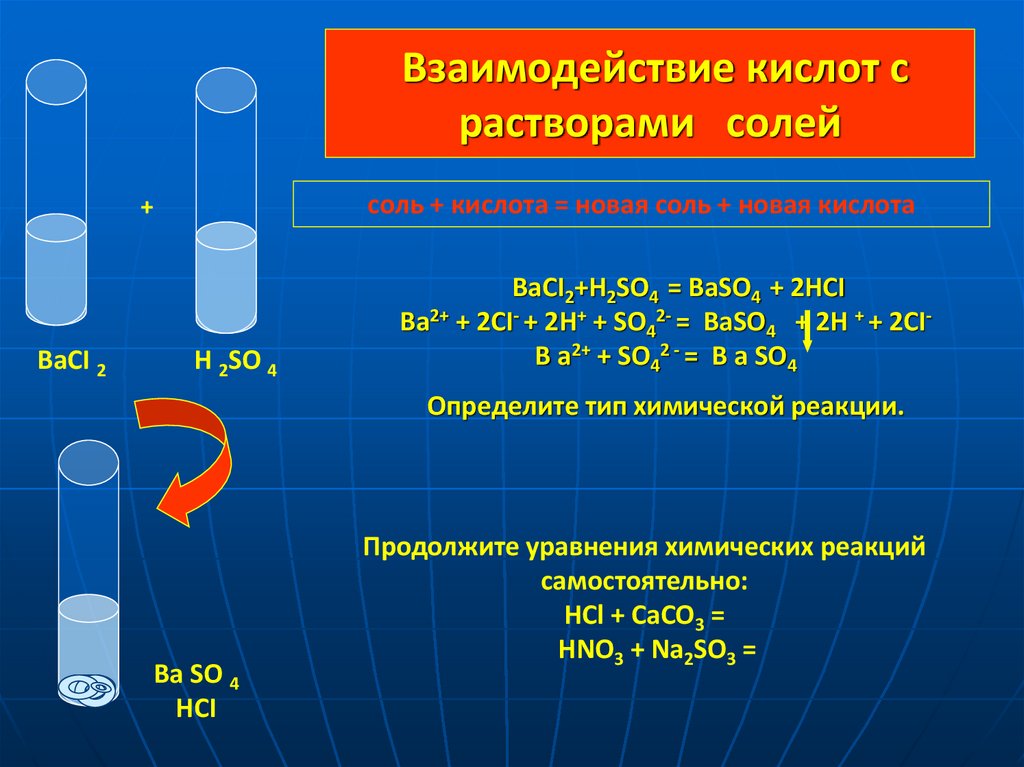
12. Взаимодействие кислот с растворами солей
соль + кислота = новая соль + новая кислота+
BaCI 2
H 2SO 4
BaCI2+H2SO4 = BaSO4 + 2HCI
Ba2+ + 2CI- + 2Н+ + SО42- = BaSO4 + 2H + + 2CIB a2+ + SО42 - = B a SО4
Определите тип химической реакции.
Ba SO 4
HCI
Продолжите уравнения химических реакций
самостоятельно:
HCl + CaCO3 =
HNO3 + Na2SO3 =
13.
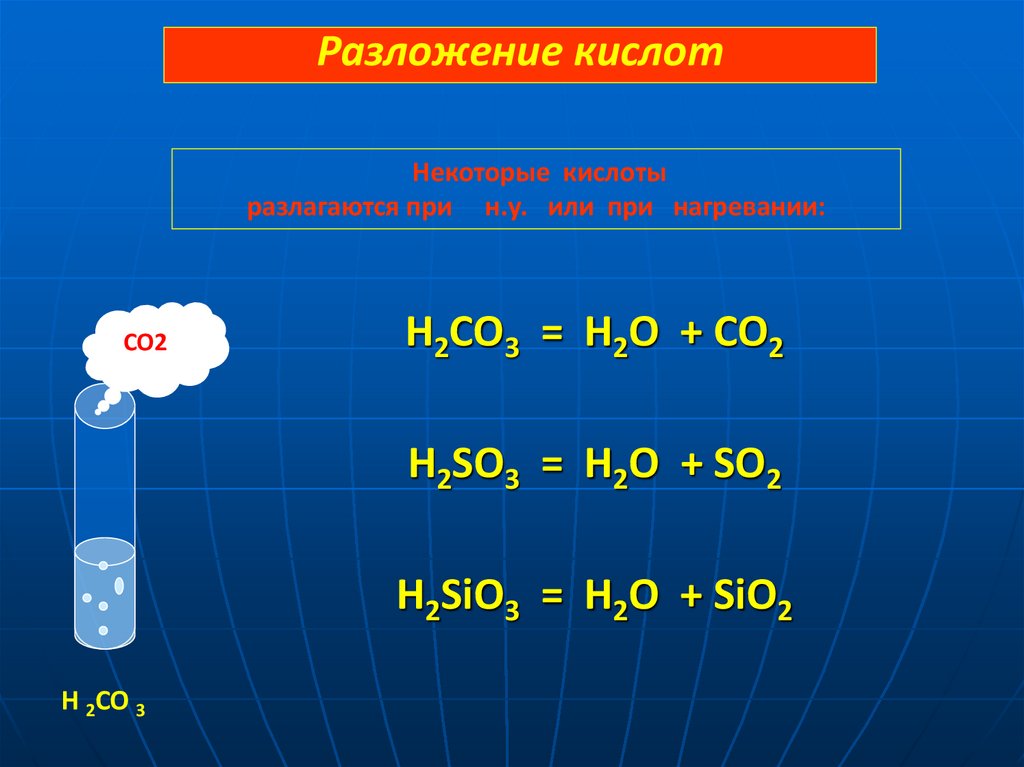
Разложение кислотНекоторые кислоты
разлагаются при н.у. или при нагревании:
CO2
H2CO3 = H2O + CO2
H2SO3 = H2O + SO2
H2SiO3 = H2O + SiO2
H 2CO 3
14. Способы получения кислот
1. Взаимодействие кислотных оксидов с водой:P2O5+ 3H2O = 2H3PO4
SO3 + H2O = …
SO2 + H2O = …
СO2 + H2O = …
2. Взаимодействие водорода с соответствующим
неметаллом:
H2+ CI2 = 2HCI
H2 + S = …
H2 + I2 = …
3. Взаимодействие концентрированных кислот с
кристаллическими солями:
2NaCI + H2SO4 = Na2SO4 + 2HCI
КCI + H2SO4 = …
15. Проверьте свои знания (№1)
1.С какими из перечисленных веществ реагируетсоляная кислота:
Ba(OH)2, AgNO3, Na Cl, Hg, Na2O, Fe, ZnO, CO2?
2. Выполните цепочку превращений
(получите сульфат цинка разными
способами):
ZnSO4
ZnSO4
H2SO4
ZnSO4
BaSO4
16.
Проверьте свои знания (№2)3. Закончите молекулярные уравнения возможных реакций
и запишите соответствующие им ионные уравнения:
Al2О3 + H Cl =
Mg + H2SO4 =
HNO3 + Zn SO4 =
H Cl + Cu S =
FeCl 3 + KOH =
Ca CO3 + HNO3 =
4 Выполните цепочку превращений:
S
SO2
SO3
H2SO4
CuSO4
CuSO4
CuSO4







 Химия
Химия








