Похожие презентации:
Неметаллы: общая характеристика
1.
2.
Неметаллы:общая характеристика.
9 класс
3.
План• 1. Положение элементов
неметаллов в П.С.
• 2. Особенности строения атомов
неметаллов
• 3. Особенности строения простых
веществ-неметаллов
• 4. Физические свойства
неметаллических простых веществ
• 5. Химические свойства
неметаллов.
4.
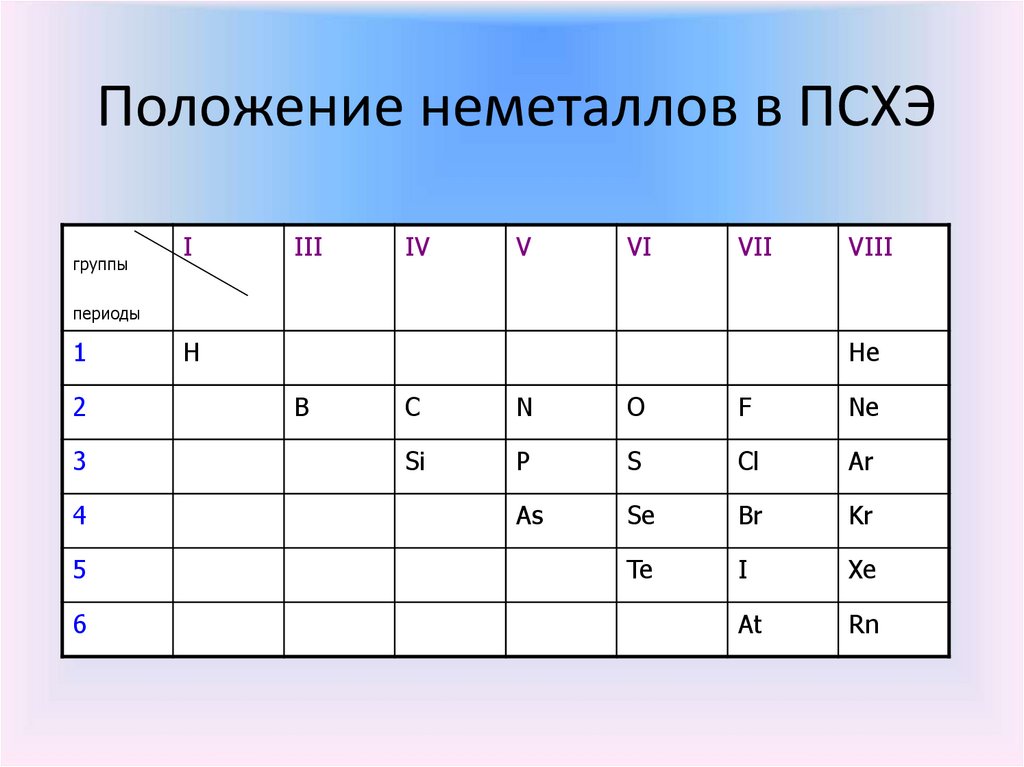
Положение неметаллов в ПСХЭгруппы
I
III
IV
V
VI
VII
VIII
периоды
1
2
3
4
5
6
H
He
B
C
N
O
F
Ne
Si
P
S
Cl
Ar
As
Se
Br
Kr
Te
I
Xe
At
Rn
5.
Положение НеМе в ПСХЭ Д.И. МенделееваГр у п п ы э л е м е н т о в
I
II
III
IV
V
VI
VII
VIII
1
2
Н 1,00797 He 4,0026
1
1 (H)
2
2
5
6
7
8
В 10,811
С 12,0112
N 14,0067
O 15,9994
F 18,99849 Ne 10
20,163
3
3
14 Р 15 S 16 Cl 17 Ar 18
Si 28,086
30,9738
32,064
35,453
39,948
Бор
Углерод
Азот
Кислород
Кремний
Фосфор
Сера
Водород
Гелий
Фтор
Неон
Хлор
Аргон
4
4
5
6
5
7
8
6
9
33
34
35
36
В ПСХЭ Д.И. Менделеева As 74,9216
Kr 83,80
Se 78,96
Br 79,904
Криптон
Мышьяк
Селен
Бром
граница, отделяющая
металлы от неметаллов,
проходит по следующим
52
53 Xe 131,30
54
Te
I
127,60
126,904
неметаллам – элементам
Ксенон
Теллур
Иод
главных подгрупп: B; Si;
As; Te; At. Неметаллы
86
располагаются правее и
At 85
210 Rn [222]
Радон
Астат
выше этой границы.
7 10
Высшие
оксиды
ЛВС
R2O
RO
R2O 3
RO2
R2O 5
RO3
R2O 7
RH4
RH3
H2R
HR
RO4
6.
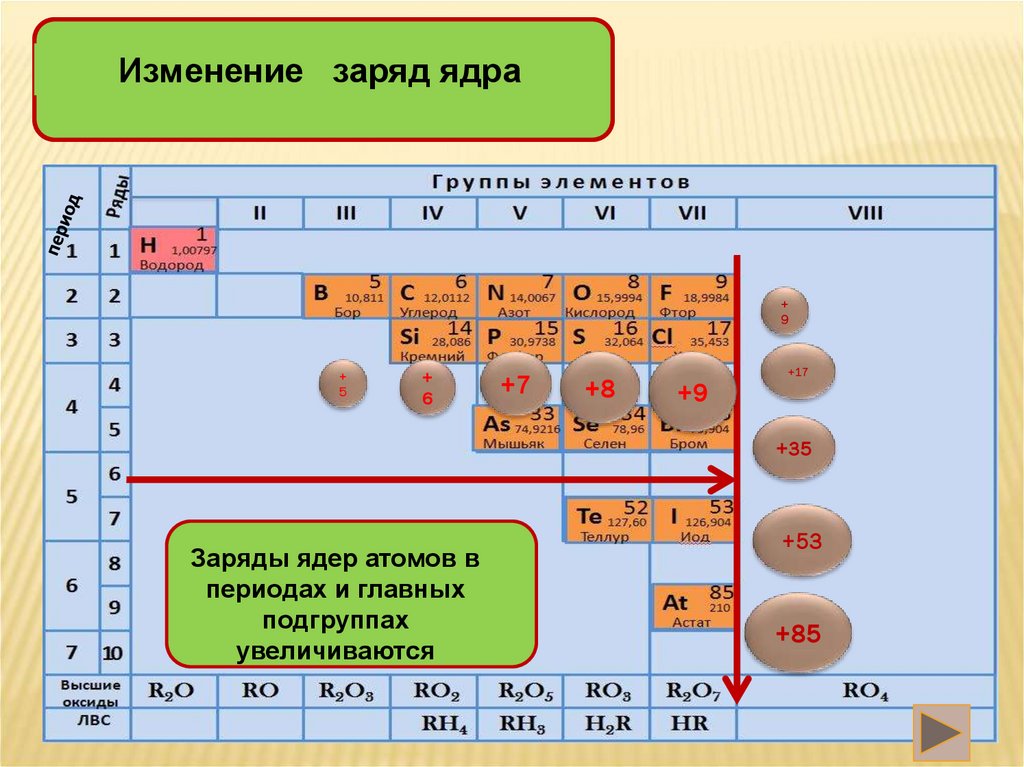
Изменение заряд ядра+
9
+
5
+
6
+7
+8
+9
+17
+35
Заряды ядер атомов в
периодах и главных
подгруппах
увеличиваются
+53
+85
7.
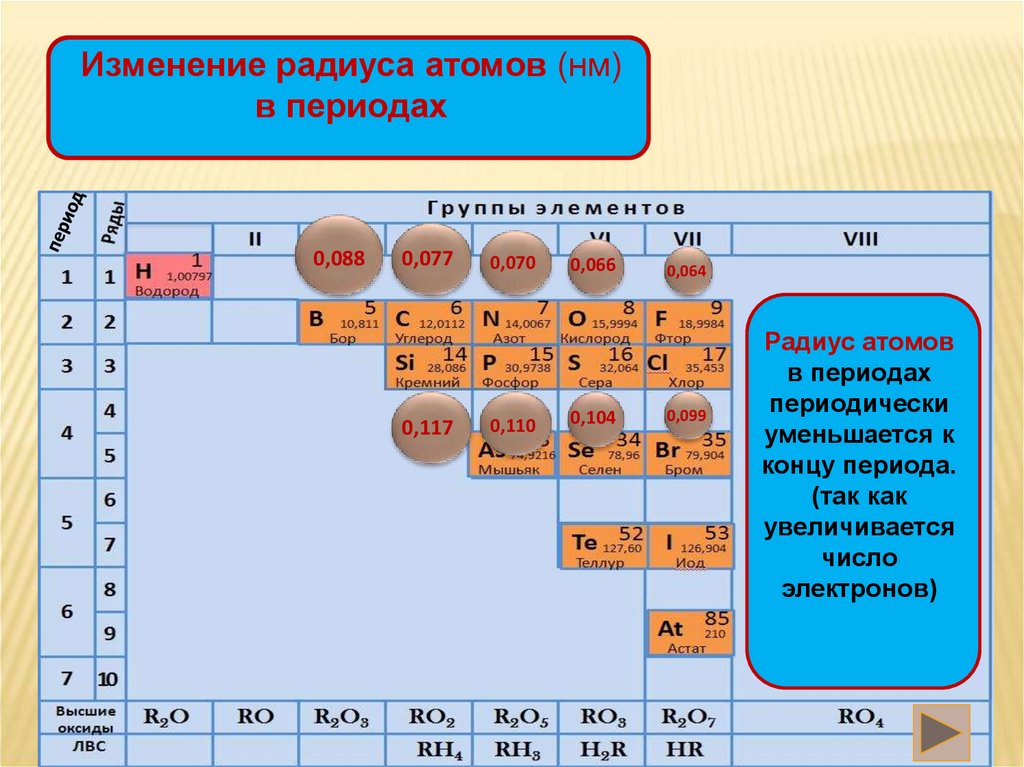
Изменение радиуса атомов (нм)в периодах
0,088
0,077
0,117
0,070
0,110
0,066
0,104
0,064
0,099
Радиус атомов
в периодах
периодически
уменьшается к
концу периода.
(так как
увеличивается
число
электронов)
8.
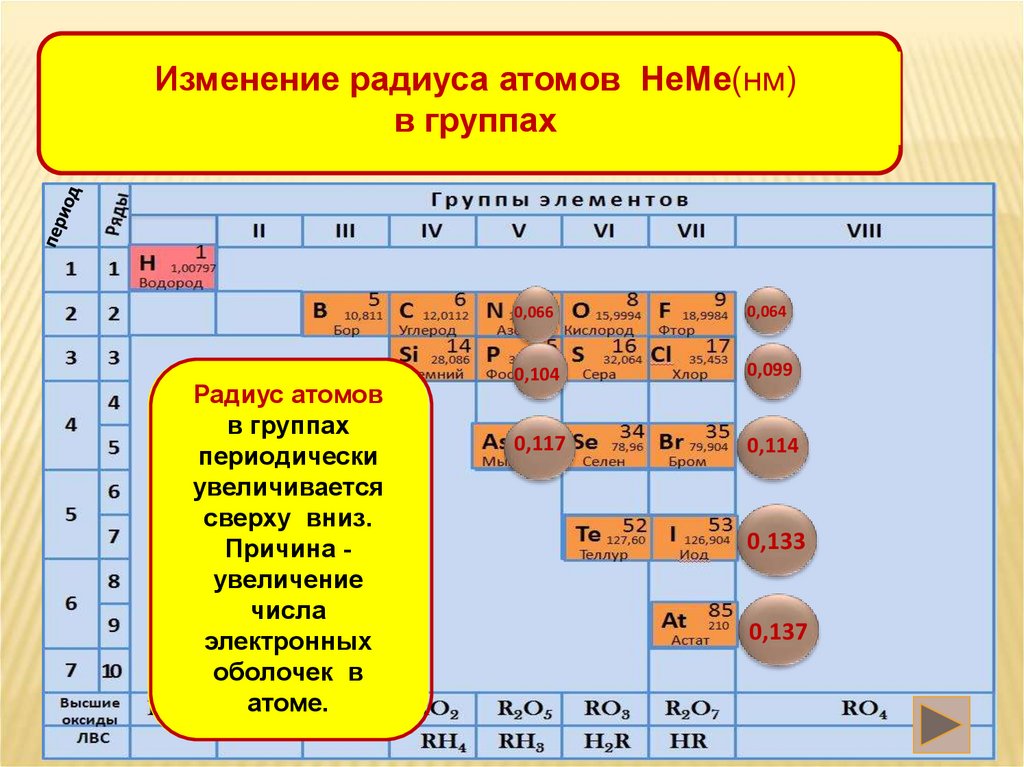
Изменение радиуса атомов НеМе(нм)в группах
Радиус атомов
в группах
периодически
увеличивается
сверху вниз.
Причина увеличение
числа
электронных
оболочек в
атоме.
0,066
0,064
0,104
0,099
0,117
0,114
0,133
0,137
9.
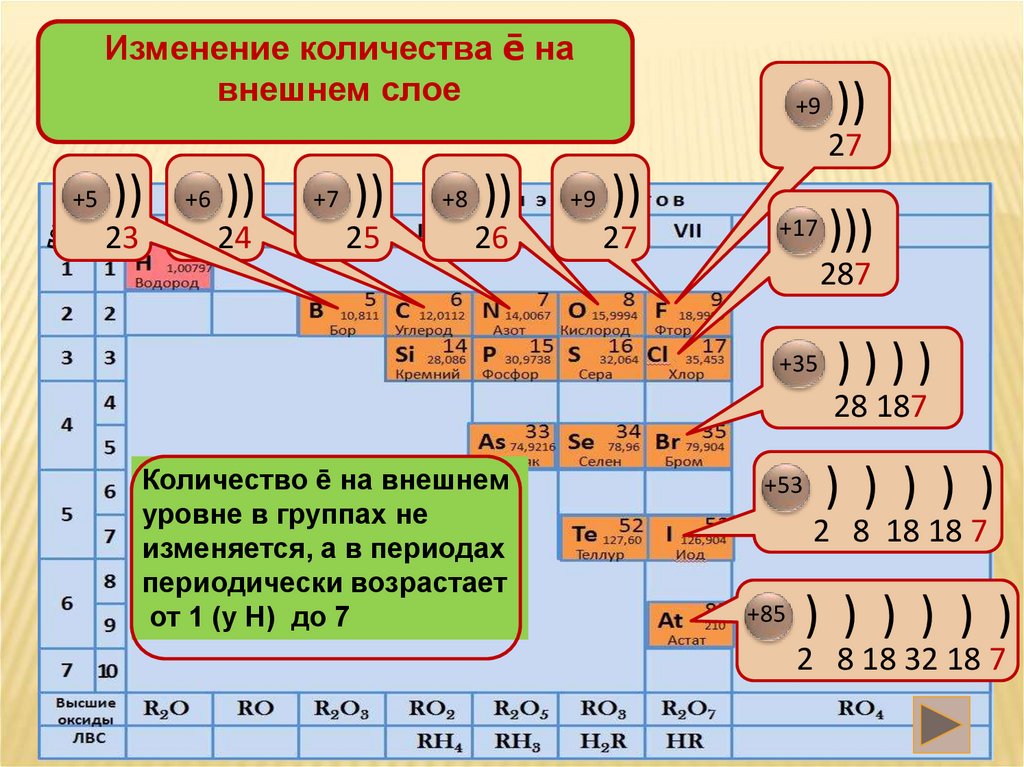
Изменение количества ē навнешнем слое
+9
))
27
+5
))
23
+6
))
24
+7
))
25
+8
))
26
+9
))
27
+17
)))
287
+35
))))
28 187
Количество ē на внешнем
уровне в группах не
изменяется, а в периодах
периодически возрастает
от 1 (у Н) до 7
+53
) ) ) ) )
2 8 18 18 7
+85
) ) ) ) ) )
2 8 18 32 18 7
10.
Электроотрицательность– это способность атомов химического
элемента притягивать к себе
электроны других атомов.
H Si P C S Br Cl N O F
усиление
ЭО
11.
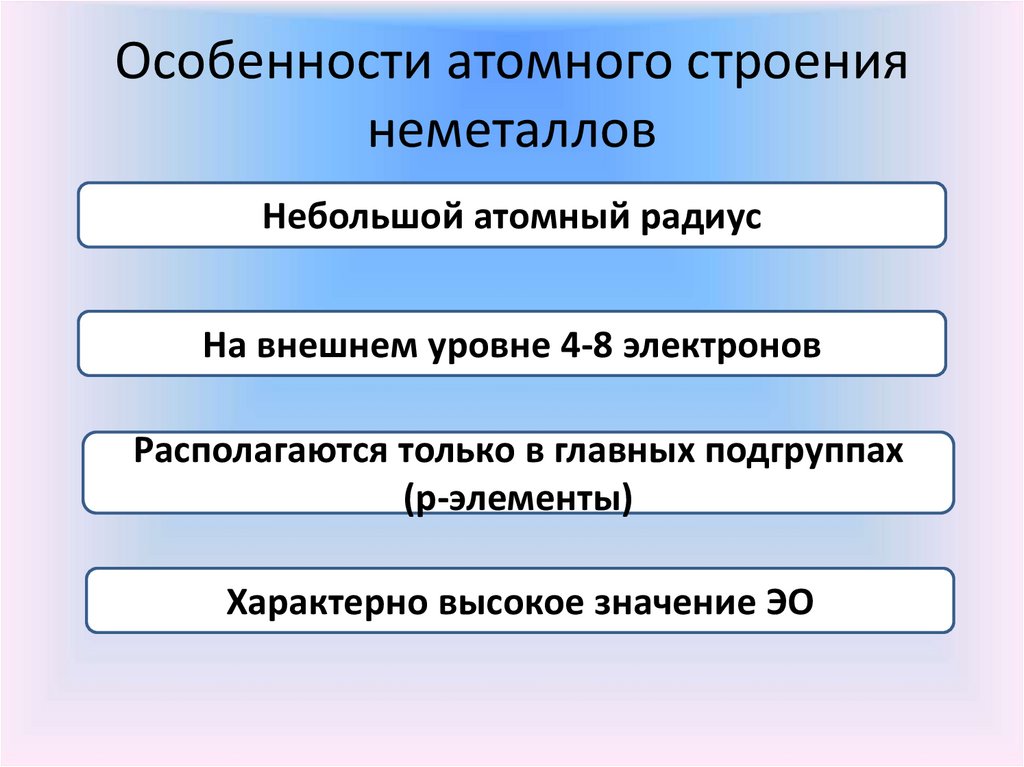
Особенности атомного строениянеметаллов
Небольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
(р-элементы)
Характерно высокое значение ЭО
12.
ФИЗИЧЕСКИЕ СВОЙСТВАПРОСТЫХ ВЕЩЕСТВ
13.
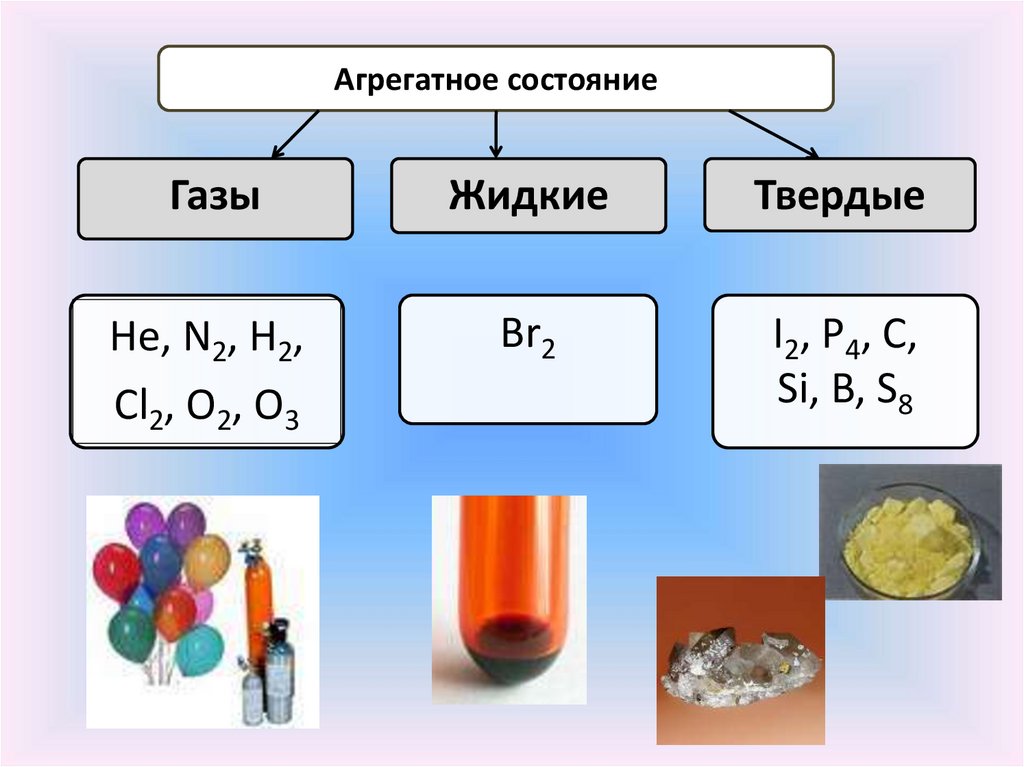
Агрегатное состояниеГазы
Жидкие
Твердые
Не, N2, Н2,
Cl2, O2, O3
Br2
I2, P4, C,
Si, B, S8
14.
Цвет неметалловЧЕРНЫЙ
БЕЛЫЙ
ФОСФОР
ФОСФОР
ГРАФИТ
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР
15.
Цвет неметалловКРАСНЫЙ
ЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
ФОСФОР
СЕРА
ЙОД
БЕСЦВЕТНЫЙ
УГЛЕРОД
16.
Температура плавления• 3 8000 С – у графита
• - 2100 С - азота
17.
Аллотропия – способностьатомов одного химического
элемента образовывать
несколько простых веществ,
различных по своим
свойствам
18.
Аллотропия• Разное типы кристаллических решеток
Р - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная
19.
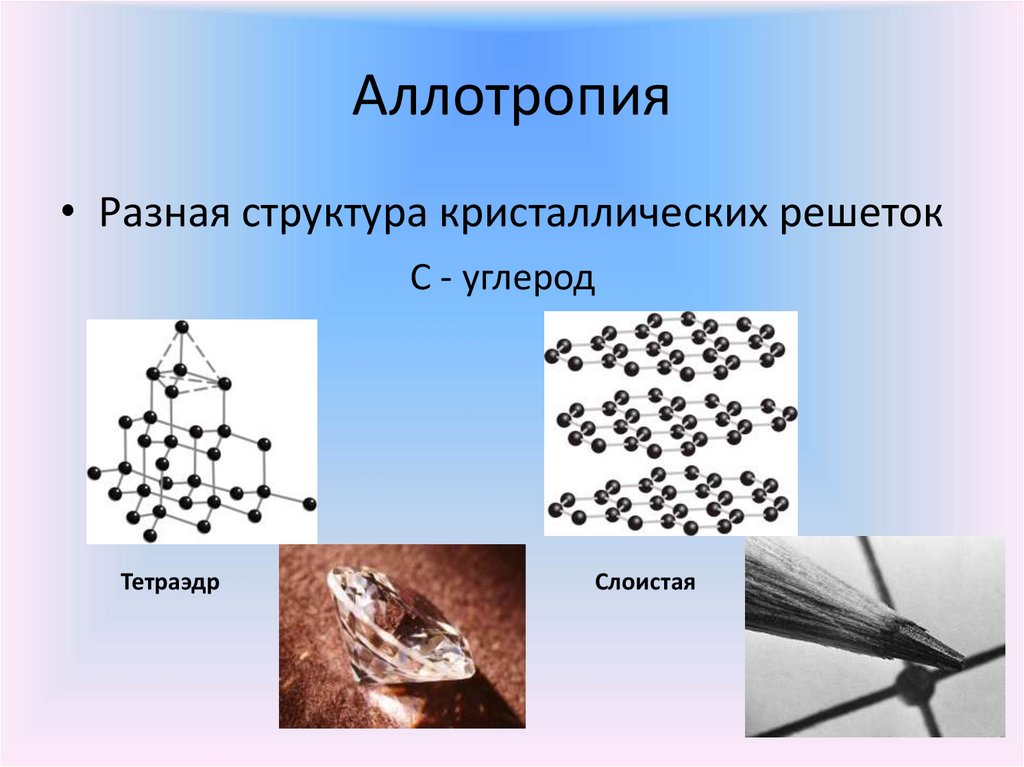
Аллотропия• Разная структура кристаллических решеток
С - углерод
Тетраэдр
Слоистая
20.
Аллотропия• Разный состав молекул
О - кислород
Кислород
Озон
21.
Аллотропия неметаллов22.
Химические свойства• Ярко выражены окислительные
свойства
• В меньшей степени
восстановительные (с более
электроотрицательными
элементами)
23.
Всегда ли неметаллыокислители?
Взаимодействие кислорода с
неметаллами:
+4 -2
S + O2 SO2
0
0
S0 – 4ē S+4 окисление,
восстановитель
O20 + 4ē 2O-2 восстановление,
окислитель
24.
25.
Химические элементыМеталлы
Положение в Периодической
системе
Особенности
строения
атомов
1. Количество
электронов на
внешнем
электронном
слое
2. Радиус атома
3.
Окислительновосстановитель
ные свойства
Неметаллы
26.
Простые веществаМеталлы
Тип химической связи
Кристаллическая решетка
Общие физические свойства
1. Состояние при обычных
условиях
2. Цвет
3. Блеск
4. Пластичность или
хрупкость
5. Тепло- и
электропроводность
Неметаллы
27.
Домашнее задание• § 18
• Заполнить таблицу


















 Химия
Химия








