Похожие презентации:
Гидролиз солей. Тема 8
1.
Гидролизсолей
Доцент кафедры ХИМ
Ковынева Н.Н.
2.
ГИДРОЛИЗ СОЛЕЙgidro – вода, lisis – распад
– это реакция взаимодействия ионов,
входящих с состав соли, с водой,
которая приводит к образованию слабого
электролита и сопровождается изменением
среды раствора.
Возможность протекания гидролиза
связана с образованием слабых электролитов –
кислот или оснований.
2
3.
ГИДРОЛИЗ СОЛЕЙgidro – вода, lisis – распад
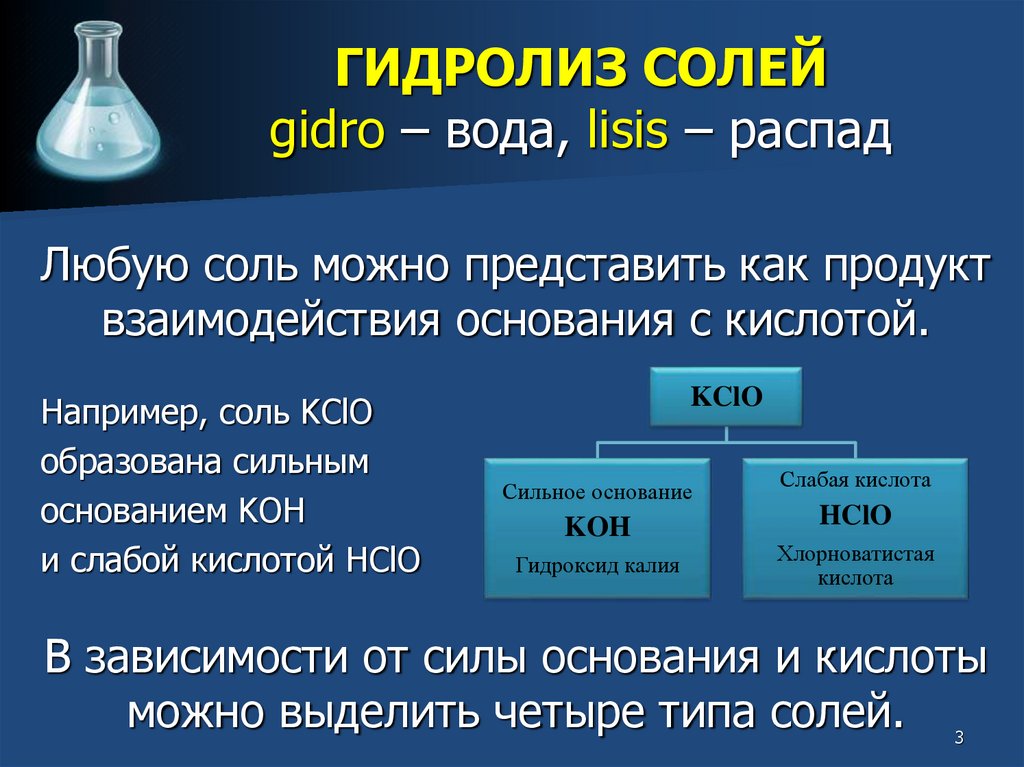
Любую соль можно представить как продукт
взаимодействия основания с кислотой.
Например, соль KClO
образована сильным
основанием KOH
и слабой кислотой HClO
KClO
Сильное основание
KOH
Гидроксид калия
Слабая кислота
HClO
Хлорноватистая
кислота
В зависимости от силы основания и кислоты
можно выделить четыре типа солей.
3
4.
Соль, образованнаясильным основанием и
слабой кислотой
Соль, образованная
слабым основанием и
сильной кислотой
KNO2 = K+ + NO2-
ZnBr2 = Zn2+ + 2Br-
Если среди
образовавшихся
ионов присутствуют
анионы слабой
кислоты, то гидролиз
протекает по аниону
Если среди
образовавшихся ионов
присутствуют катионы
слабого основания,
то гидролиз протекает
по катиону
4
5.
Соль, образованнаяслабым основанием и
слабой кислотой
Соль, образованная
сильным основанием и
сильной кислотой
Al2S3 = 2Al3+ + 3S2-
KCl = K+ + Cl-
Если среди
образовавшихся ионов
присутствуют катионы
слабого основания и
анионы слабой кислоты,
то гидролиз протекает
и по катиону, и по аниону
Соли такого типа
гидролизу
не подвергаются
5
6.
Гидролиз солей, образованныхсильным основанием и слабой кислотой
В водном растворе соли происходят два процесса:
1) незначительная обратимая
диссоциация молекул воды:
2) полная диссоциация соли
(сильного электролита):
6
7.
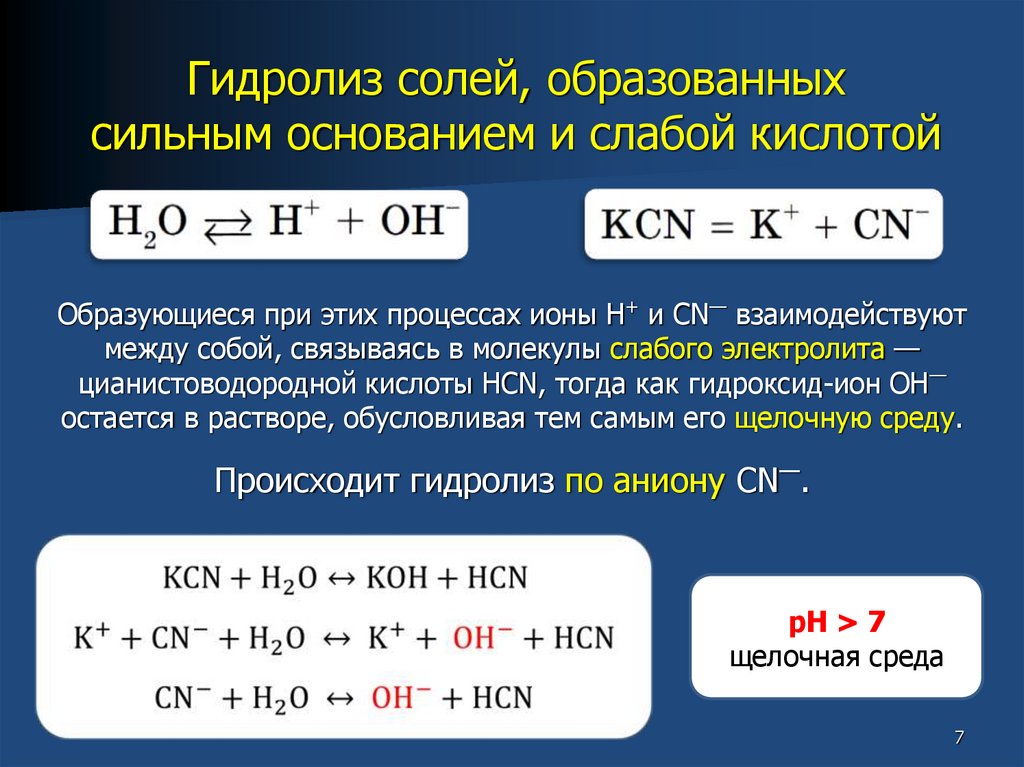
Гидролиз солей, образованныхсильным основанием и слабой кислотой
Образующиеся при этих процессах ионы Н+ и CN— взаимодействуют
между собой, связываясь в молекулы слабого электролита —
цианистоводородной кислоты HCN, тогда как гидроксид-ион ОН—
остается в растворе, обусловливая тем самым его щелочную среду.
Происходит гидролиз по аниону CN—.
pH > 7
щелочная среда
7
8.
Ступенчатый гидролиз солей, образованныхсильным основанием и слабой кислотой
Продукты первой ступени
гидролиза: кислая соль
гидрокарбонат натрия
NaHCO3 и гидроксид
натрия NaOH.
Продукты второй ступени
гидролиза: гидроксид натрия и
слабая угольная кислота Н2СО3.
Гидролиз по второй ступени
протекает в значительно
меньшей степени,
чем по первой ступени.
8
9.
Гидролиз солей, образованныхслабым основанием и сильной кислотой
В водном растворе соли происходят два процесса:
1) незначительная обратимая
диссоциация молекул воды:
2) полная диссоциация соли
(сильного электролита):
9
10.
Гидролиз солей, образованныхслабым основанием и сильной кислотой
Образующиеся при этом ионы OH— и NH4+ взаимодействуют между
собой с получением NH4ОН (слабый электролит), тогда как ионы Н+
остаются в растворе, обусловливая тем самым его кислую среду.
Происходит гидролиз по катиону NH4+.
pH < 7
кислая среда
10
11.
Ступенчатый гидролиз солей, образованныхслабым основанием и сильной кислотой
Продукты первой ступени
гидролиза: основная соль
гидроксинитрат никеля
NiOHNO3 и сильная
азотная кислота HNO3.
Продукты второй ступени
гидролиза: гидроксид никеля и
сильная азотная кислота НNО3.
Гидролиз по второй ступени
протекает в значительно
меньшей степени,
чем по первой ступени.
11
12.
Гидролиз солей, образованныхслабым основанием и слабой кислотой
слабое
трехкислотное
основание
слабая
двухосновная
кислота
В водном растворе соли происходят два процесса:
1) незначительная обратимая
диссоциация молекул воды:
2) полная диссоциация соли
(сильного электролита):
12
13.
Гидролиз солей, образованныхслабым основанием и слабой кислотой
Ионы Н+ и S2— взаимодействуют между собой, связываясь в молекулы
слабого электролита — сероводородной кислоты H2S,
ионы Al3+ и ОН— взаимодействуют между собой, связываясь в молекулы
слабого электролита — гидроксида алюминия Al(OH)3.
Происходит гидролиз и по катиону Al3+, и по аниону S2—.
pH ≈ 7
нейтральная среда
13
14.
Количественно гидролиз характеризуетсястепенью гидролиза h и константой гидролиза Кг.
Степень гидролиза – отношение концентрации соли,
подвергающейся гидролизу (Сгидр.), к общему количеству
концентрации растворенной соли (Со).
h = (Сгидр./Со)·100%
Степень гидролиза зависит от природы соли,
концентрации соли и температуры раствора.
Константа гидролиза есть константа равновесия процесса
гидролиза, и по своему физическому смыслу определяет
степень необратимости гидролиза.
Чем больше Кг, тем необратимее гидролиз.
14
15.
КГ соли, гидролизующейся по аниону[H2O] имеет наибольшую величину, которая в ходе реакции
практически не изменяется, поэтому ее можно условно
считать постоянной. Тогда помножив числитель и
знаменатель на концентрацию протонов и введя постоянную
концентрацию воды в константу, получим:
т.к.
Чем меньше КД слабой кислоты, анион которой
входит в состав соли, тем больше KГ.
15
16.
КГ соли, гидролизующейся по катиону[H2O] можно условно считать постоянной.
Тогда помножив числитель и знаменатель на концентрацию
гидроксид-ионов и введя постоянную концентрацию воды в
константу, получим:
т.к.
Чем меньше КД слабого основания,
катион которого входит в состав соли, тем больше KГ.
16
17.
КГ соли, гидролизующейся и по катиону,и по аниону
Числитель и знаменатель дроби умножаем на [H+]·[OH–],
поэтому выражение для KГ принимает вид:
17
18.
КГ обратно пропорциональна КД слабогоэлектролита, участвующего в образовании соли.
Если в образовании соли участвуют два слабых
электролита, то KГ обратно пропорциональна
произведению их констант диссоциации.
18
















 Химия
Химия








