Похожие презентации:
Основы молекулярной физики и термодинамики
1.
Раздел 2. Основы молекулярнойфизики и термодинамики.
Тема: ОСНОВЫ МОЛЕКУЛЯРНОКИНЕТИЧЕСКОЙ ТЕОРИИ
2.
1. Основные положения МКТ1. Все вещества состоят из частиц молекул, атомов и ионов.
2. Частицы вещества беспрерывно и
беспорядочно движутся.
3. Частицы вещества взаимодействуют
друг с другом.
3.
2. Размеры и масса молекул иатомов
Молекула - это самая
маленькая
частица
вещества,
которая
обладает его основными
химическими свойствами.
Молекула
состоит
из
атомов.
Атом - наименьшая частица
вещества, которая не
делится при химических
реакциях.
4.
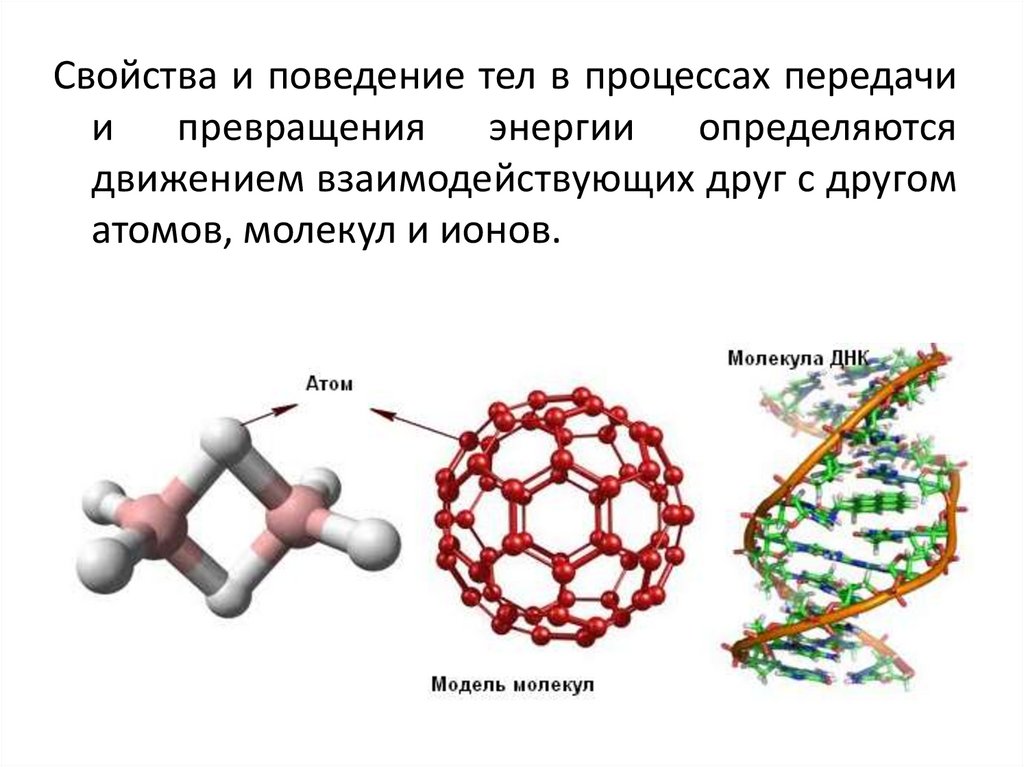
Свойства и поведение тел в процессах передачии превращения энергии определяются
движением взаимодействующих друг с другом
атомов, молекул и ионов.
5.
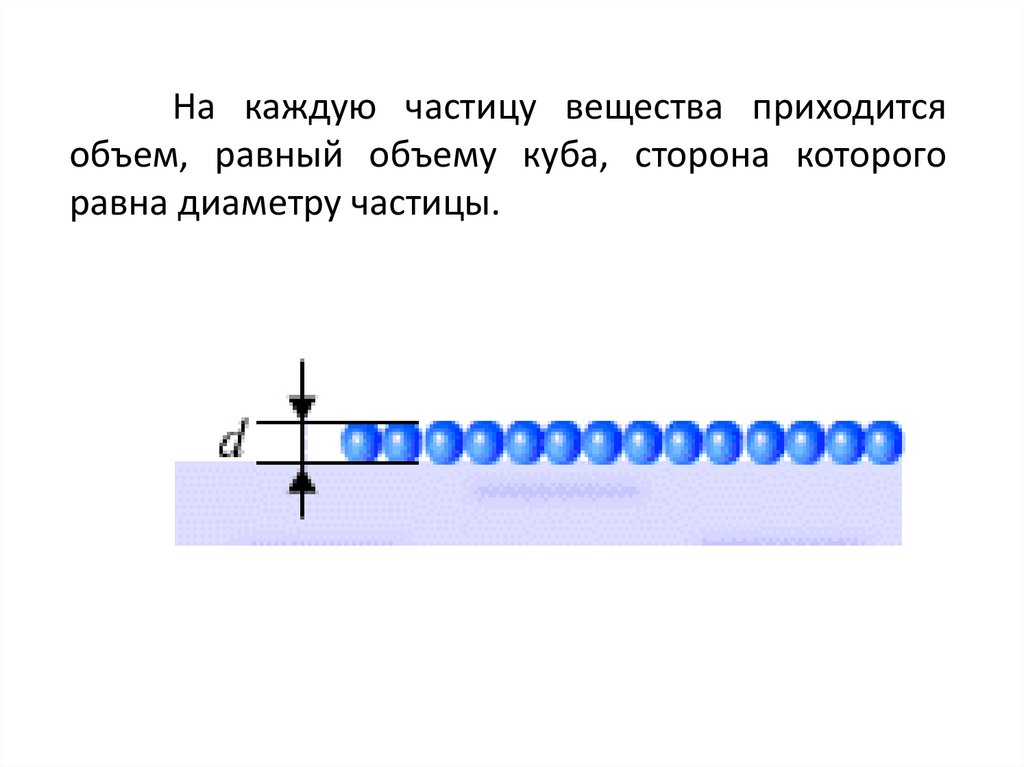
На каждую частицу вещества приходитсяобъем, равный объему куба, сторона которого
равна диаметру частицы.
6.
Оценка размера молекулы.Оценка массы молекулы.
7.
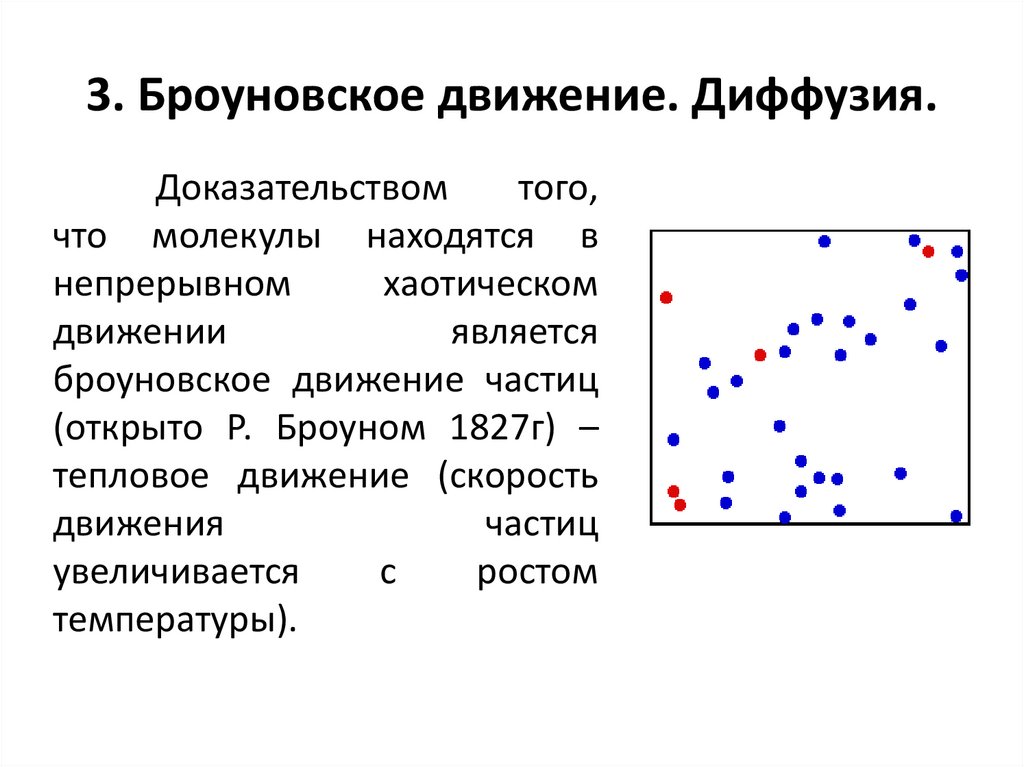
3. Броуновское движение. Диффузия.Доказательством
того,
что молекулы находятся в
непрерывном
хаотическом
движении
является
броуновское движение частиц
(открыто Р. Броуном 1827г) –
тепловое движение (скорость
движения
частиц
увеличивается
с
ростом
температуры).
8.
Ещеодним
доказательством
хаотического
движения
является диффузия - проникновение
молекул одного вещества в промежутки
между молекулами другого вещества.
Диффузия
стремится
приблизить
систему
к
состоянию
термодинамического равновесия.
9.
Диффузия (началопроцесса)
Диффузия
(установившеес
я положение)
10.
4. Силы и энергиямежмолекулярного воздействия.
Между молекулами существуют молекулярные
силы, которые имеют электромагнитную
природу
и
позволяют
объяснить
возникновение сил упругости.
Когда вещество сжимают, между молекулами
возникает сила отталкивания, когда внешние
силы растягивают вещество, между ними
возникает сила притяжения.
Силы взаимодействия обратно пропорционально
зависят от расстояния между молекулами.
11.
Все тела, находящиеся под действием сил,обладают энергией. Атомы и молекулы
обладают потенциальной энергией.
Потенциальная
энергия
считается
положительной
при
отталкивании,
отрицательной - при притяжении.
12.
5. Строение газообразных, жидких и твердых тел.Скорости движения молекул и их измерение.
Газы
Частицы газа не связаны
межмолекулярными
силами притяжения и
движутся
свободно,
равномерно
заполняя
весь предоставленный им
объем.
13.
ЖидкостиВ таком состоянии
наблюдается
упорядоченное
относительное
расположение
соседних частиц.
Основное свойство
жидкостей
–
текучесть.
14.
Твердые телаПостоянство формы и
объема
вещества,
атомы и молекулы
жестко связаны друг с
другом,
образуя
пространственные
кристаллические
решетки.
15.
Существуютразновидности
твердого
вещества, называемые аморфными телами
(отсутствует кристаллическая решетка).
Аморфное состояние – это неустойчивое
состояние, которое с течением времени
переходит в кристаллическое.
Еще одно агрегатное состояние – это плазма,
газ, в котором имеется большое количество
положительно и отрицательно заряженных
ионов, а также свободных электронов.
16.
Химические характеристики веществаМолярная масса
Плотность вещества
Количество
вещества
Концентрация
частиц
17.
Фазовые переходы вещества18.
Скорость частиц вещества19.
6. Идеальный газ. Основное уравнение МКТИдеальный газ – это упрощенная модель реальных
газов.
Основные отличия идеального газа от реального
газа:
1. Частицы идеального газа - сферические тела
очень
малых
размеров,
практически
материальные точки.
2. Между
частицами
отсутствуют
силы
межмолекулярного взаимодействия.
3. Соударения частиц являются абсолютно
упругими.
20.
Вследствиетеплового
движения, частицы газа
время
от
времени
ударяются о стенки
сосуда.
Складываясь
друг с другом, силы
ударов
отдельных
частиц
образуют
некоторую
силу
давления,
постоянно
действующую на стенку.
21.
Cила, с которой молекулыдействуют на стенку
сосуда,
прямо
пропорциональна числу
молекул, содержащихся
в единице объема (это
число
называется
концентрацией молекул
и обозначается n), массе
молекулы mo, среднему
квадрату их скоростей и
площади стенки сосуда.
22.
Основное уравнение МКТЗависимость
давления
идеального
газа
от
концентрации
и
от
средней
кинетической
энергии
частиц
выражается
основным
уравнением
молекулярнокинетической
теории
идеального газа.
23.
24.
7. Газовые законы. Термодинамическая шкалатемпературы. Уравнение состояния идеального
газа.
С помощью уравнения состояния идеального
газа можно исследовать процессы, в
которых масса газа и один из параметров
(давление, объем или температура)
остается постоянным, а изменяются только
остальные два.
Такие процессы называют изопроцессами
или термодинамическими.
25.
Термодинамические процессы1.
Изотермический –
процесс
изменение
состояния
системы
при
постоянной
температуре.
26.
2. Изохорный - процессизменения состояния
системы
при
постоянном объеме
27.
3. Изобарный - процессизменения состояния
системы
при
постоянном давлении
28.
Газовыезаконы
29.
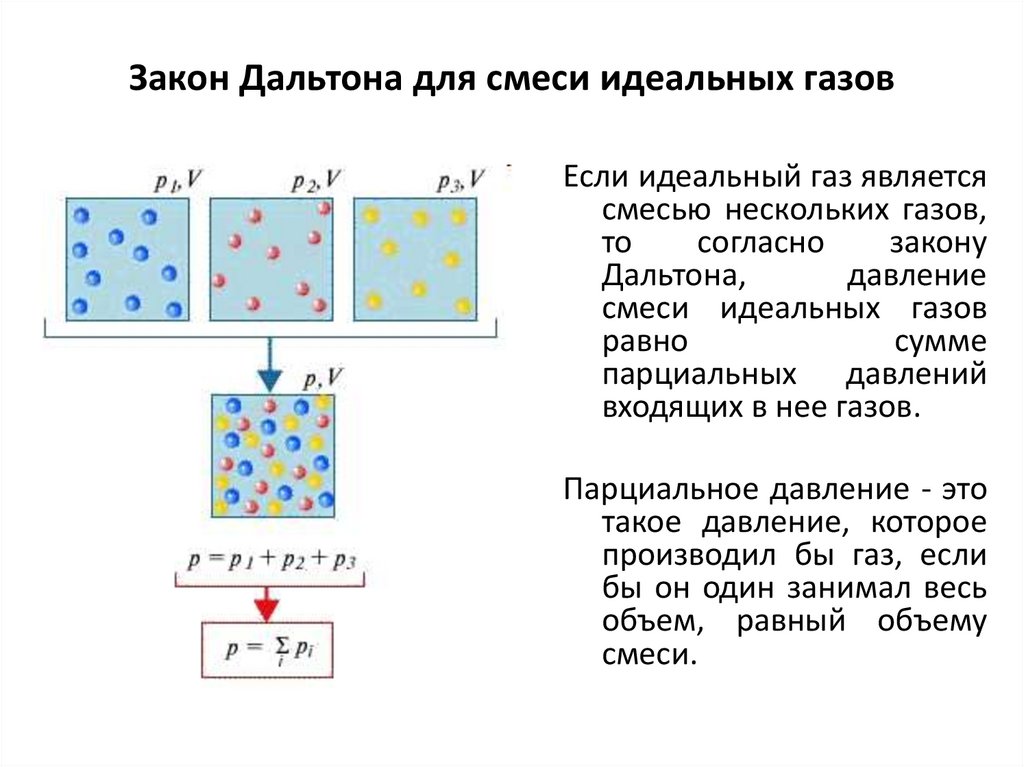
Закон Дальтона для смеси идеальных газовЕсли идеальный газ является
смесью нескольких газов,
то
согласно
закону
Дальтона,
давление
смеси идеальных газов
равно
сумме
парциальных давлений
входящих в нее газов.
Парциальное давление - это
такое давление, которое
производил бы газ, если
бы он один занимал весь
объем, равный объему
смеси.
30.
Термодинамическая шкала температурыПри взаимодействии тел происходит
теплообмен, который длится до тех
пор, пока температуры тел не
выровняются
и не установится
тепловое равновесие, т.е. состояние
при котором все макроскопические
параметры в системе сколь угодно
долго остаются неизменными.
31.
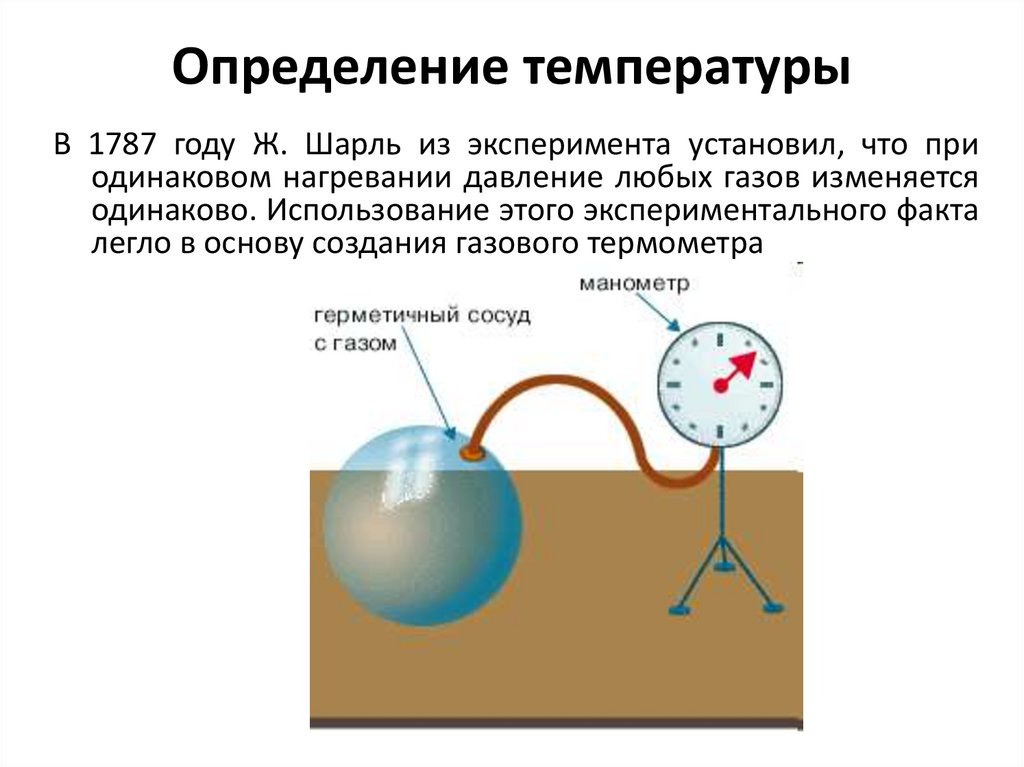
Определение температурыВ 1787 году Ж. Шарль из эксперимента установил, что при
одинаковом нагревании давление любых газов изменяется
одинаково. Использование этого экспериментального факта
легло в основу создания газового термометра
32.
Температурные шкалы33.
Уравнение состояния идеального газаСостояние идеального газа и процессы,
проходящие
в
нем,
определяются
количеством частиц (молекул), из которых
состоит газ, и их параметрами, такими как
масса, диаметр, скорость, энергия и пр.
Такие
параметры
называются
микроскопическими
или
микропараметрами.
34.
35.
Состояние газов можно охарактеризоватьнемногим числом физических величин,
относящимся не к каждой молекуле, а ко
всему газу в целом.
Такие
параметры
называются
макроскопическими или макропараметрами.
Если состояние газа не меняется, то не
меняются и эти параметры.
36.
37.
Основные итоги1 моль - это количество
вещества,
в
котором
содержится столько же
частиц, сколько атомов
содержится в 12 граммах
углерода.
1 а.е.м. = 1,66· 10-27 кг.
(атомная единица
массы)
Постоянная Авогадро численно равна количеству
частиц, содержащихся в 1 моле любого вещества: Na
= 6·1023 моль-1. Масса 1 моля вещества называется
молярной массой (М).
































 Физика
Физика








