Похожие презентации:
Основы молекулярной физики и термодинамики
1. Основы молекулярной физики и термодинамики
Газовые законыМодель идеального газа
Уравнение КлапейронаМенделеева
2. Введение
Молекулярная физика и термодинамика –разделы физики, в которых изучаются макроскопические
процессы в телах, связанные с огромным числом
содержащихся в телах атомов и молекул.
Молекула – наименьшая частица данного
вещества, сохраняющая его свойства
Атом
–
наименьшая
химического
элемента,
свойства
частица
данного
сохраняющая
его
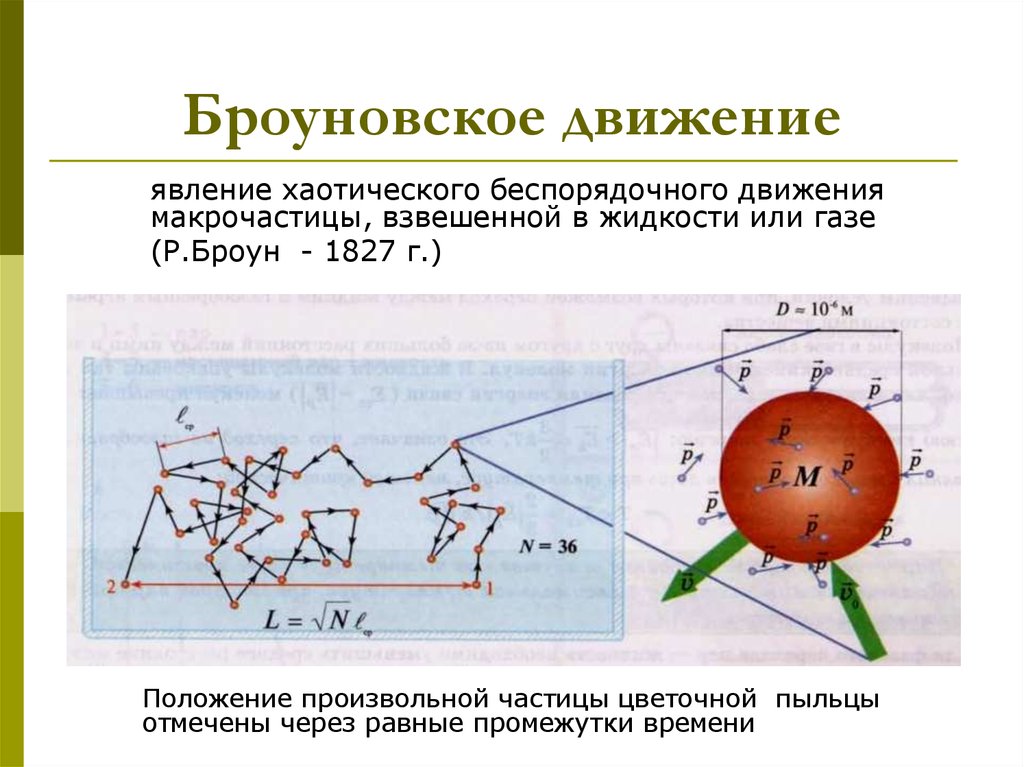
3. Броуновское движение
явление хаотического беспорядочного движениямакрочастицы, взвешенной в жидкости или газе
(Р.Броун - 1827 г.)
Положение произвольной частицы цветочной пыльцы
отмечены через равные промежутки времени
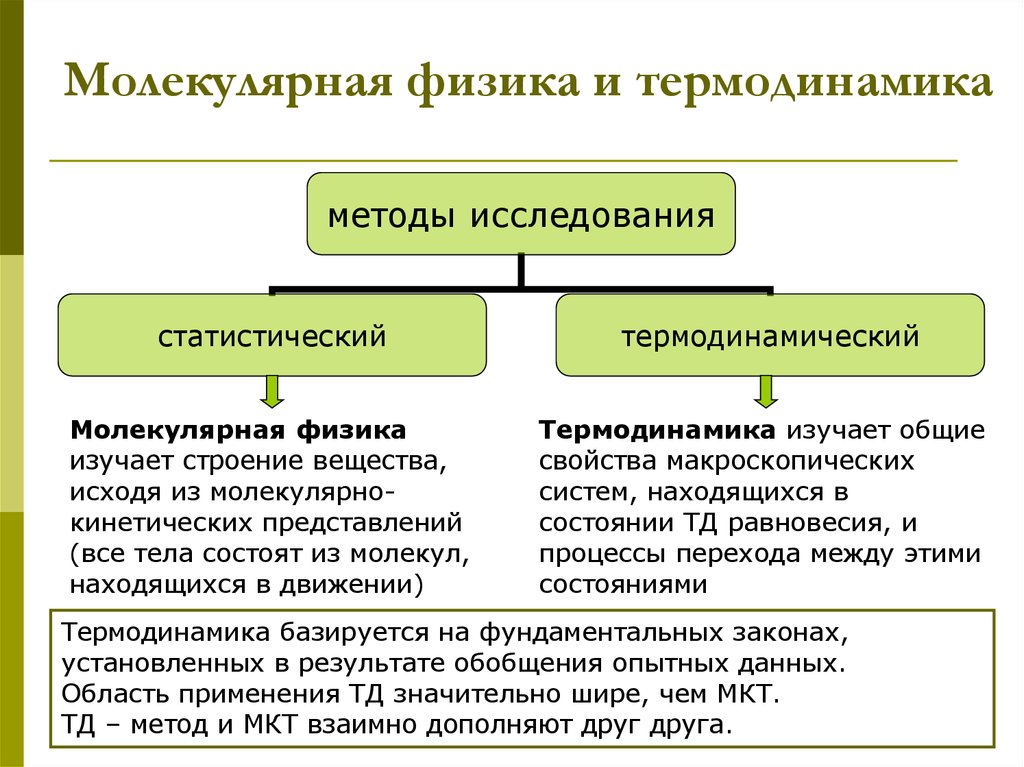
4. Молекулярная физика и термодинамика
методы исследованиястатистический
Молекулярная физика
изучает строение вещества,
исходя из молекулярнокинетических представлений
(все тела состоят из молекул,
находящихся в движении)
термодинамический
Термодинамика изучает общие
свойства макроскопических
систем, находящихся в
состоянии ТД равновесия, и
процессы перехода между этими
состояниями
Термодинамика базируется на фундаментальных законах,
установленных в результате обобщения опытных данных.
Область применения ТД значительно шире, чем МКТ.
ТД – метод и МКТ взаимно дополняют друг друга.
5. Термодинамическая система
ТД - система – совокупность макроскопических тел,которые взаимодействуют и обмениваются энергией как
между собой, так и с другими телами (внешней средой)
Термодинамические параметры – величины,
характеризующие состояние термодинамической системы в
любой момент времени: температура, давление, объем
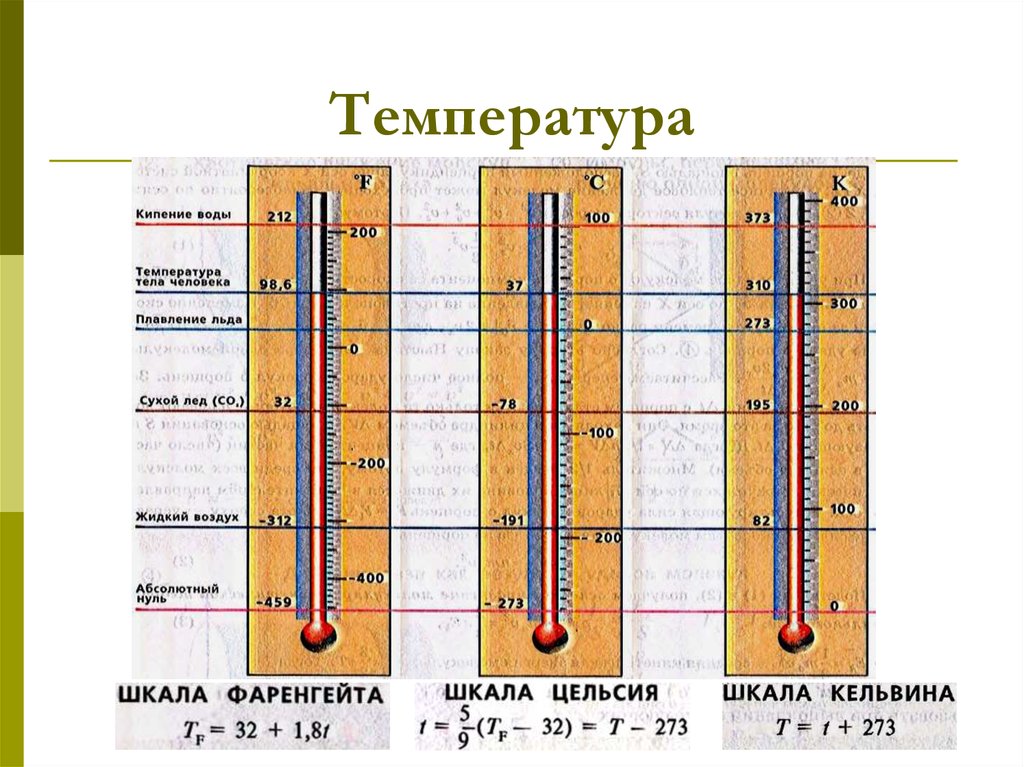
6. Температура
7. Единицы измерения количества вещества
1 моль – количество вещества, в котором находитсястолько же частиц, сколько содержится атомов в 0,012 кг
изотопа углерода C¹².
1 моль любого вещества содержит одинаковое
количество частиц, называемое постоянной Авогадро:
N A 6,022 10 моль
23
1
Молярная масса – масса одного моля вещества
m
M
N
NA
масса одной частицы
- число молей
m
m0
N
M
m0
NA
8. Модель идеального газа
Собственныйобъем молекул
пренебрежимо мал по сравнению с
объемом сосуда
Между молекулами отсутствуют
силы взаимодействия
Столкновения молекул газа между
собой и со стенками сосуда
абсолютно упругие
9. Изопроцессы
Изопроцессы – термодинамические процессы,происходящие при одном постоянном
термодинамическом параметре и неизменной
массе газа
Изотермический процесс T=const
Изобарный процесс
p=const
Изохорный процесс
V=const
T1
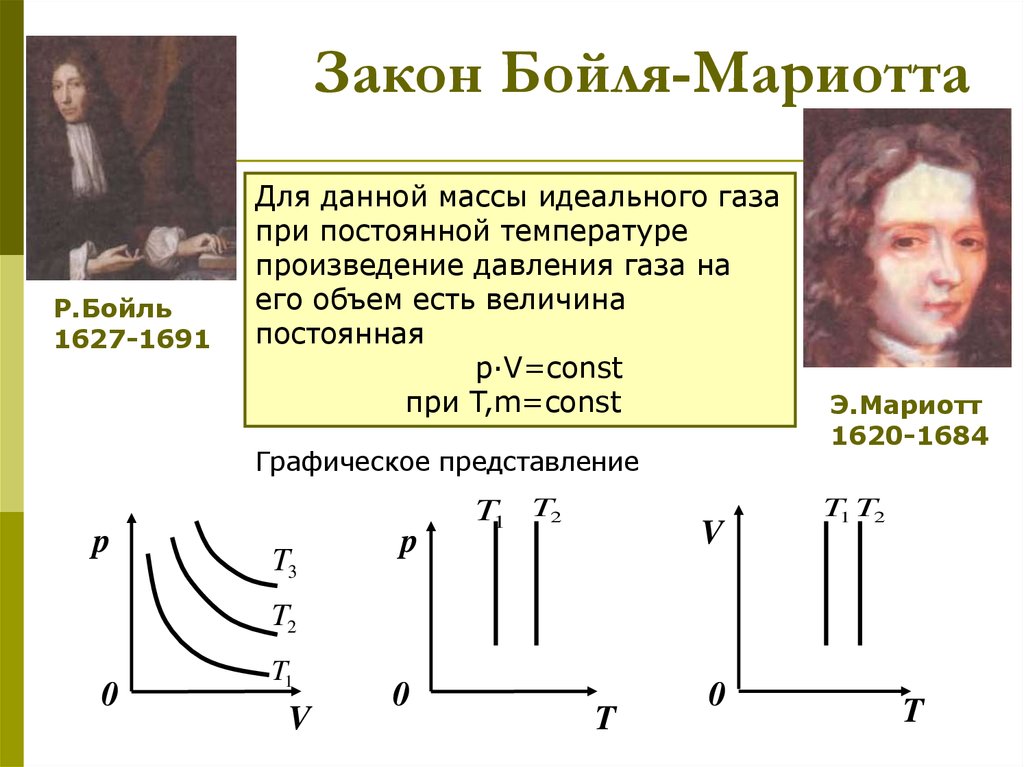
10. Закон Бойля-Мариотта
Р.Бойль1627-1691
Для данной массы идеального газа
при постоянной температуре
произведение давления газа на
его объем есть величина
постоянная
p·V=const
при T,m=const
Графическое представление
p
T3
p
T1 T2
V
Э.Мариотт
1620-1684
T1 T2
T2
0
T1
V
0
T
0
T
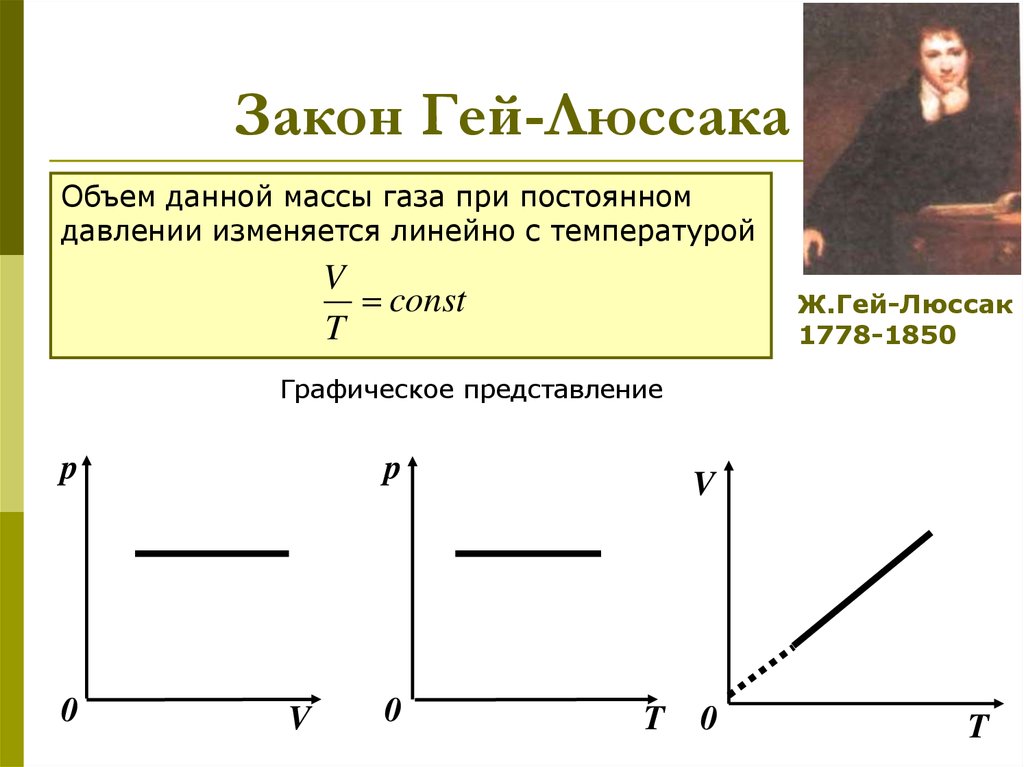
11. Закон Гей-Люссака
Объем данной массы газа при постоянномдавлении изменяется линейно с температурой
V
const
T
Ж.Гей-Люссак
1778-1850
Графическое представление
p
0
p
V
0
V
T
0
T
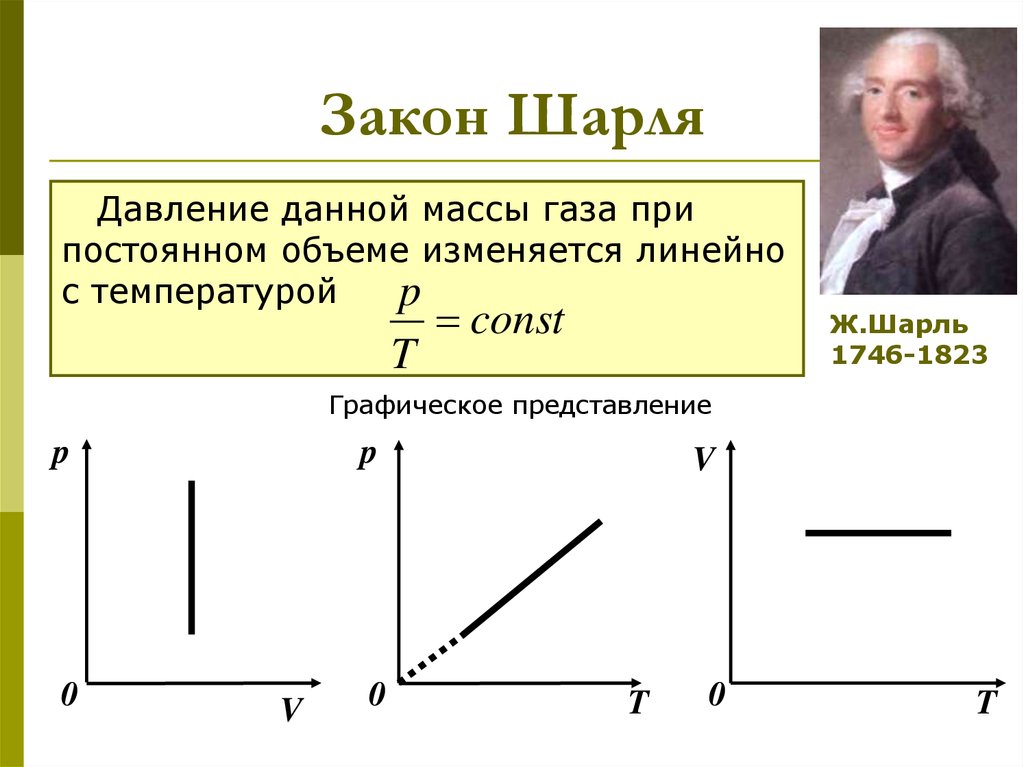
12. Закон Шарля
Давление данной массы газа припостоянном объеме изменяется линейно
с температурой
p
T
const
Ж.Шарль
1746-1823
Графическое представление
p
0
p
V
0
V
T
0
T
13. Уравнение Клапейрона-Менделеева
Уравнение КлапейронаМенделееваУравнение состояния – уравнение, связывающее
термодинамические параметры, однозначно описывающие
состояние термодинамической системы в любой момент времени.
pV
const
T
-уравнение Клапейрона
pV
R
T
уравнение КлапейронаМенделеева
R= 8.31 Дж/К моль
Б.Клапейрон
1799-1864
Д.И.Менделеев
1834-1907
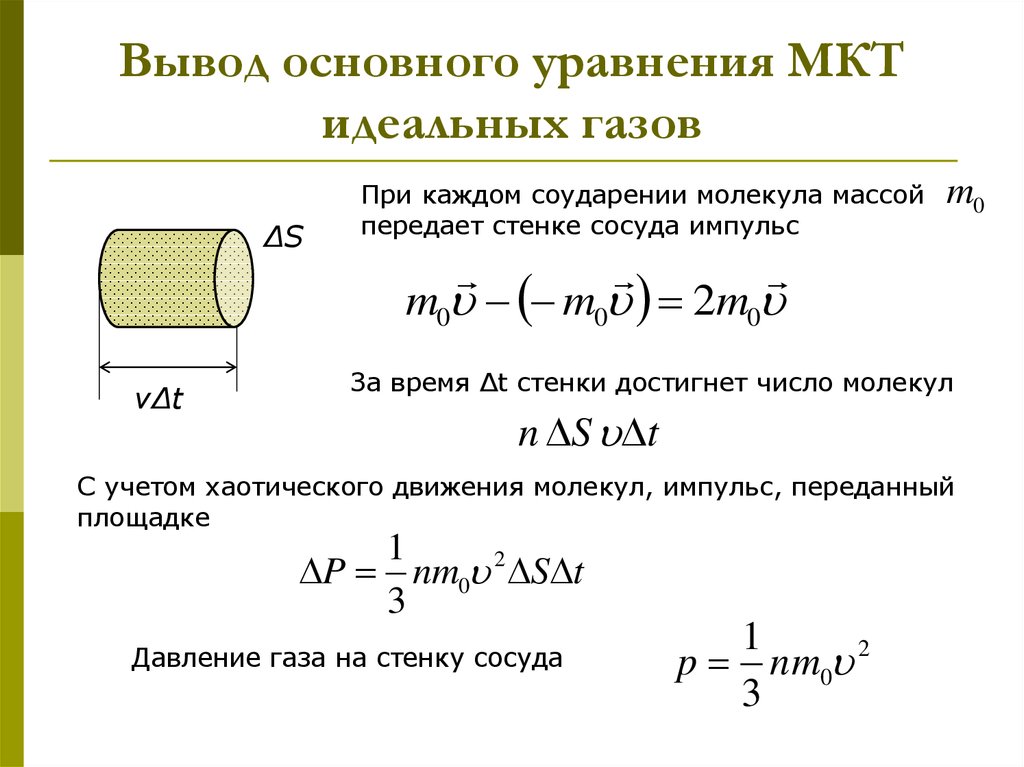
14. Вывод основного уравнения МКТ идеальных газов
ΔSПри каждом соударении молекула массой
передает стенке сосуда импульс
m0
m0 m0 2m0
νΔt
За время Δt стенки достигнет число молекул
n S t
С учетом хаотического движения молекул, импульс, переданный
площадке
1
P nm0 2 S t
3
Давление газа на стенку сосуда
1
p n m0 2
3
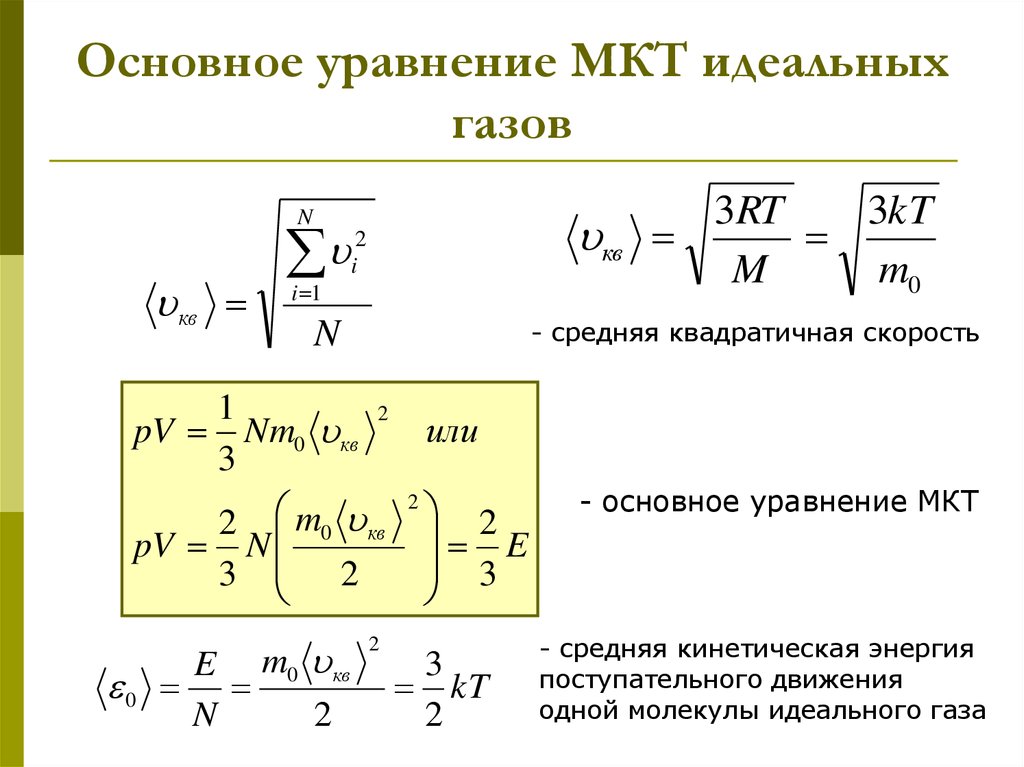
15. Основное уравнение МКТ идеальных газов
квN
кв
2
i
i 1
- средняя квадратичная скорость
N
1
2
pV Nm0 кв
3
2 m0 кв
pV N
3 2
0
E m0 кв
N
2
3RT
3kT
M
m0
2
или
2
2
E
3
3
kT
2
- основное уравнение МКТ
- средняя кинетическая энергия
поступательного движения
одной молекулы идеального газа
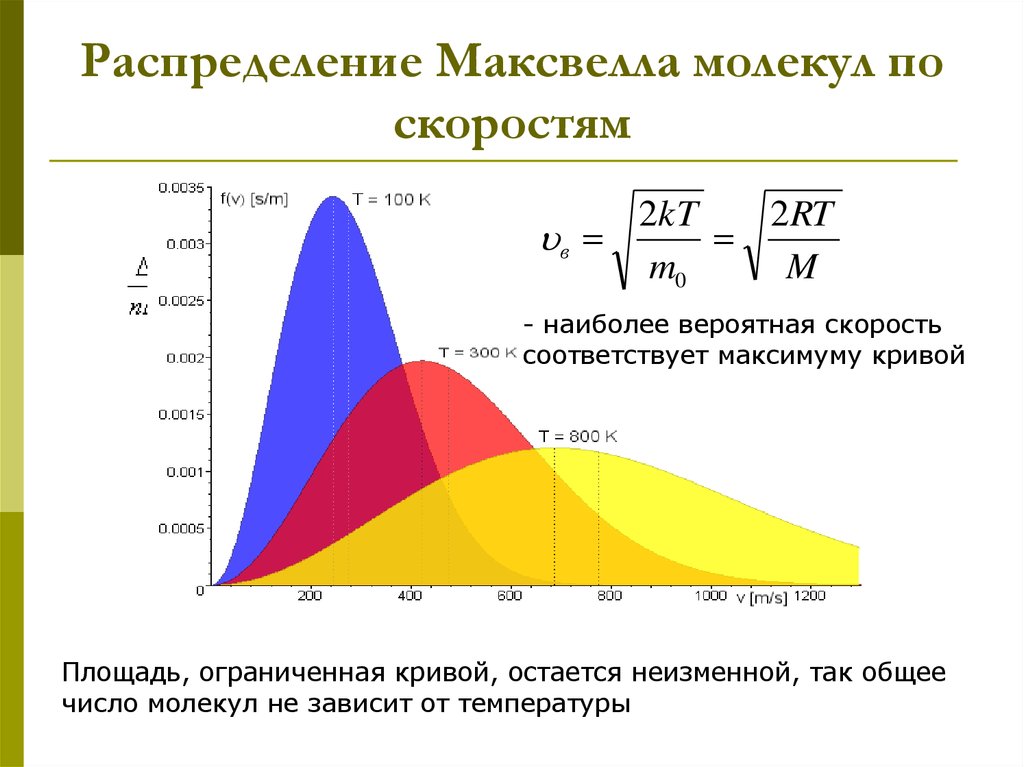
16. Распределение Максвелла молекул по скоростям
2kT2 RT
в
m0
M
- наиболее вероятная скорость
соответствует максимуму кривой
Площадь, ограниченная кривой, остается неизменной, так общее
число молекул не зависит от температуры
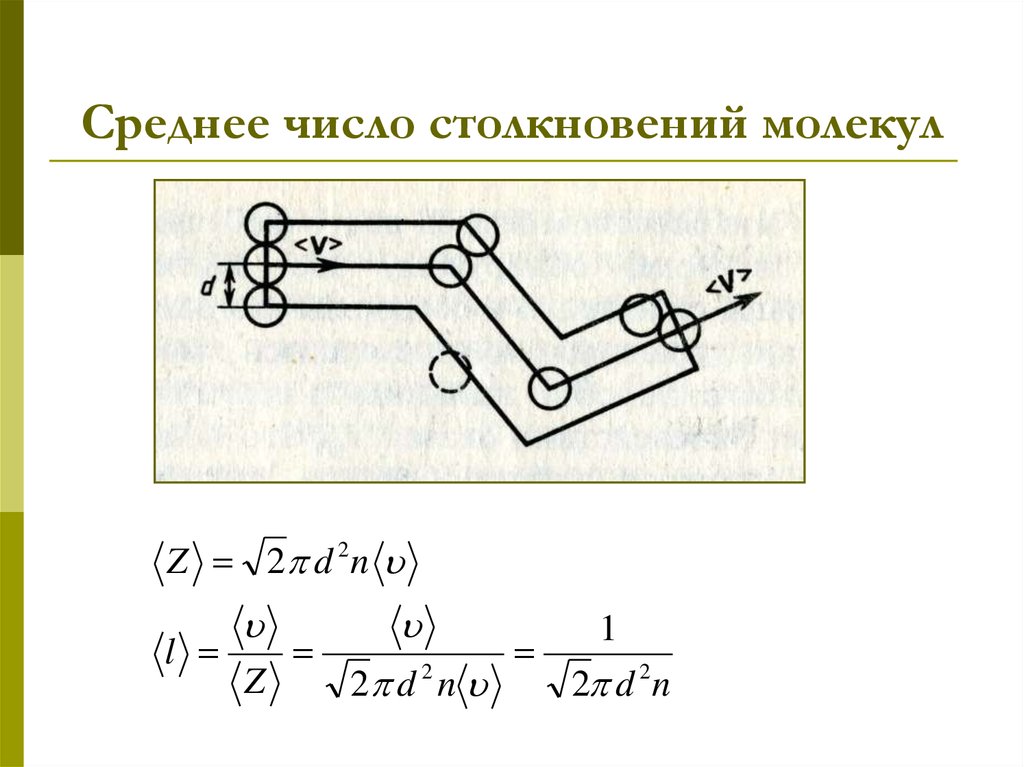
17. Среднее число столкновений и средняя длина свободного пробега молекул
lZ
- средняя длина свободного пробега молекул –
расстояние, которое проходят молекулы между 2-мя
последовательными столкновениями
средняя скорость
Z среднее число столкновений молекул за 1с
Эффективный диаметр молекулы d –
минимальное расстояние, на которое
сближаются при столкновении центры 2-х
молекул
d
18. Среднее число столкновений молекул
Z 2 d 2n1
l
2
Z
2 d n
2 d 2 n
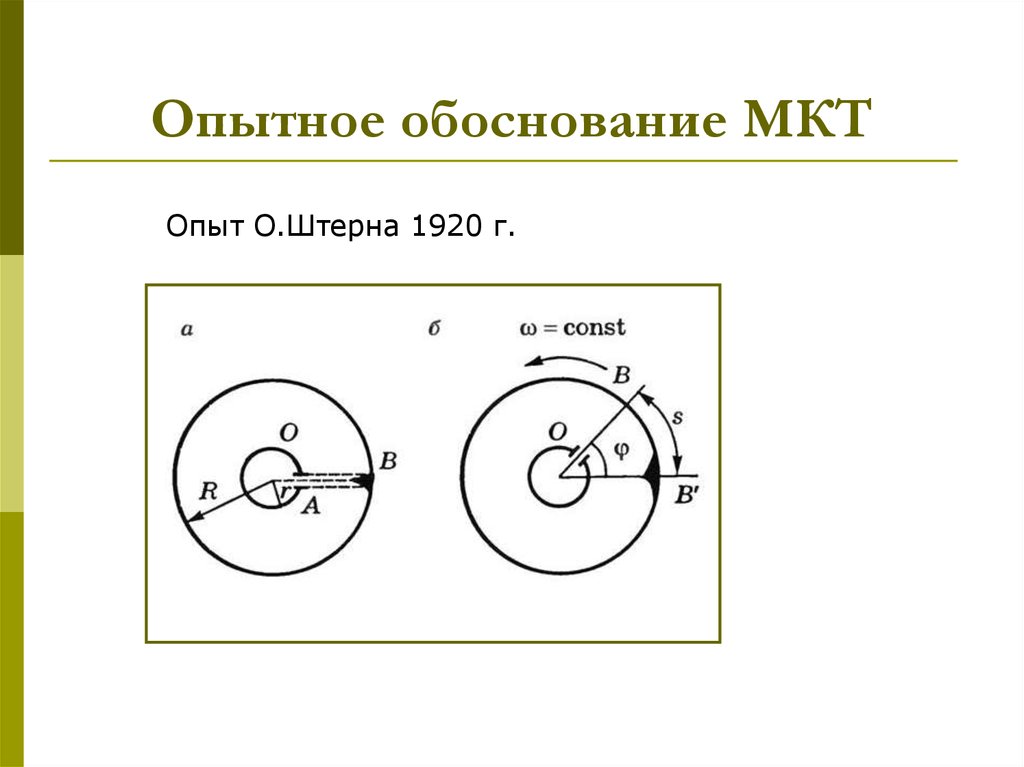
19. Опытное обоснование МКТ
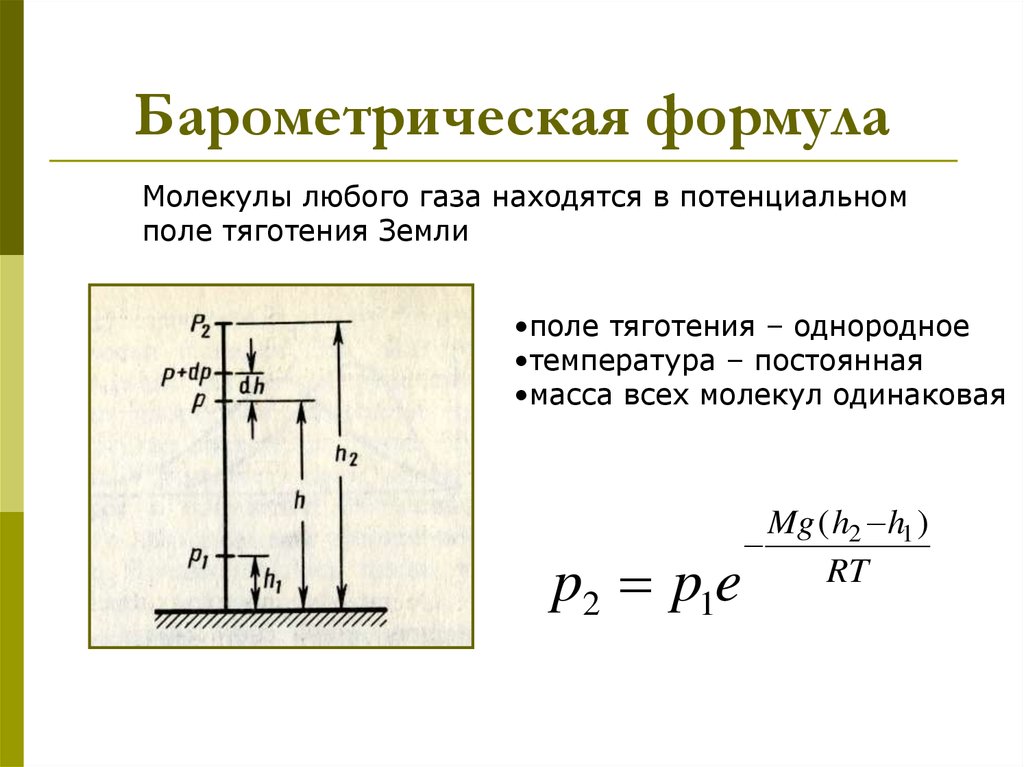
Опыт О.Штерна 1920 г.20. Барометрическая формула
Молекулы любого газа находятся в потенциальномполе тяготения Земли
•поле тяготения – однородное
•температура – постоянная
•масса всех молекул одинаковая
p2 p1e
Mg ( h2 h1 )
RT








 Физика
Физика








