Похожие презентации:
Молекулярная физика и основы термодинамики
1. МОЛЕКУЛЯРНАЯ ФИЗИКА И ОСНОВЫ ТЕРМОДИНАМИКИ
ЕГЭ. ФИЗИКАРЕПЕТИЦИЯ ПО ФИЗИКЕ
Владимир Петрович Сафронов 2015
г. Ростов-на-Дону
звоните т. 8 928 111 7884
пишите safron-47@mail.ru
МОЛЕКУЛЯРНАЯ ФИЗИКА И
ОСНОВЫ ТЕРМОДИНАМИКИ
2. ОСНОВЫ МОЛЕКУЛЯРНО–КИНЕТИЧЕСКОЙ ТЕОРИИ
Основные понятия и определенияОпытное обоснование основных положений молекулярно-кинетической
теории (МКТ).
Молекулярно–кинетическая теория объясняет строение и свойства тел
движением и взаимодействием атомов, молекул и ионов,
из которых состоят тела.
1) Все тела состоят из молекул или атомов
Подтверждается химическими реакциями, прямыми микроскопическими
наблюдениями, диффузией (проникновением молекул и атомов одних
веществ в промежутки между молекулами и атомами других веществ).
ГАЗ
2) Атомы и молекулы находятся в непрерывном хаотическом движении.
Подтверждается диффузией и броуновским движением — хаотическим
движением микрочастиц под действием беспорядочных соударений молекул
жидкости или газа.
3) Молекулы и атомы взаимодействуют между собой.
На близких расстояниях отталкиваются,
при увеличении ЖИДКОСТЬ
расстояния притягиваются,КРИСТАЛЛ
на расстоянии,
намного большем диаметра молекул, практически не взаимодействуют.
Подтверждается упругими свойствами твердых тел, жидкостей и газов.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
3. Газ, жидкость, твердое тело
В газах молекулы находятся на больших расстояниях и слабо взаимодействуютдруг с другом, т.к. их кинетическая энергия >> потенциальной.
Поэтому, газы занимают весь предоставленный объем и легко сжимаются.
Жидкости имеют определенный объем, но не имеют формы, принимая форму
сосуда. Отличаются малой сжимаемостью.
Кинетическая энергия их молекул примерно равна потенциальной.
Молекулы жидкости колеблются относительно некоторых временных положений
равновесия, меняя их скачками. Этим объясняется текучесть жидкости.
Жидкости имеют температуру кипения, которая повышается с увеличением
внешнего давления.
Аморфные твердые тела это очень вязкие жидкости. Не имеют температуры
плавления (смола, пластмасса, стекло).
Твердые тела отличаются постоянством формы и объема. Кинетическая энергия
их молекул << потенциальной. Молекулы хаотически колеблются относительно
некоторых положений равновесия – узлов кристаллической решетки.
Свойства кристаллических твердых тел зависят от направления воздействия —
анизотропия кристаллов.
Кристаллы имеют постоянную температуру плавления, которая зависит от
внешнего давления.
В.П. Сафронов 2015 safron-47@mail.ru
4. Идеальный газ
Считается, что молекулы такого газа состоят из материальных точек,и не взаимодействуют друг с другом на расстоянии.
Соударения таких молекул являются абсолютно упругими.
Понятия и обозначения
m0 — масса атома, молекулы
, моль — мера количества вещества
N — число атомов, молекул
NA = 6∙1023 моль-1 — число Авогадро
m = m0N — масса вещества
µ, кг/моль — молярная масса (табл. М.)
= m /V — плотность вещества
µ = m0NA — масса одного моля вещества
n = N /V — концентрация молекул
= N/NA=m/µ
= m0 n
m= µ
R = 8,31 Дж/(мольК )
— универсальная газовая постоянная
k = R/NA = 1,38∙10-23 Дж/К
— постоянная Больцмана
P = Fn/S, Па — давление
V ,м3— объем
Т, К (кельвин) —абсолютная температура
Т,К = 273 К + t C
Термодинамические параметры P,V,T —
определяют состояние газа, жидкости, твердого тела.
Абсолютная температура T является мерой средней кинетической энергии молекул.
Термодинамическое равновесие — состояние системы, при котором температура и
давление в любой точке системы одинаковы.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
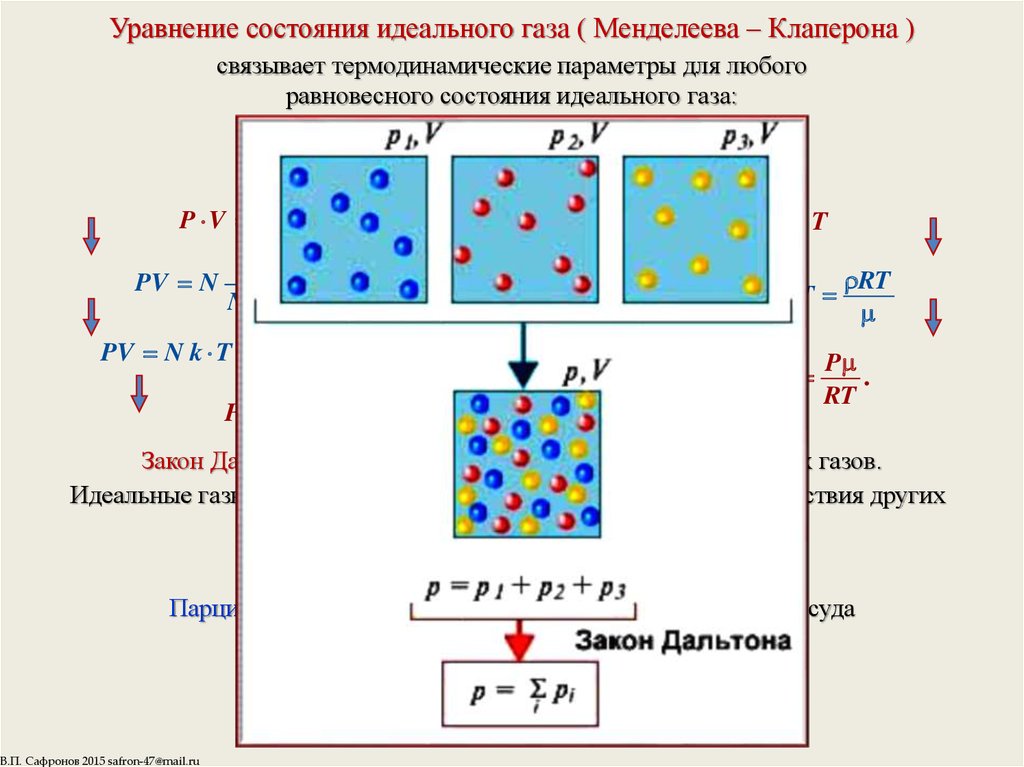
5. Уравнение состояния идеального газа ( Менделеева – Клаперона )
связывает термодинамические параметры для любогоравновесного состояния идеального газа:
P V R T
N
m
P V
R T
P V R T
NA
R
RT
mR
R
PV N
T N k T
P
T
T
NA
V
N
PV N k T P k T nkT
RT
P
V
P
.
RT
P nkT
Закон Дальтона для парциальных давлений смеси идеальных газов.
Идеальные газы в смеси ведут себя независимо, не замечая присутствия других
газов:
P P1 P2 ... Pn 1 2 ... n
Парциальное давление газа — давление газа на стенки сосуда
при отсутствии других газов.
В.П. Сафронов 2015 safron-47@mail.ru
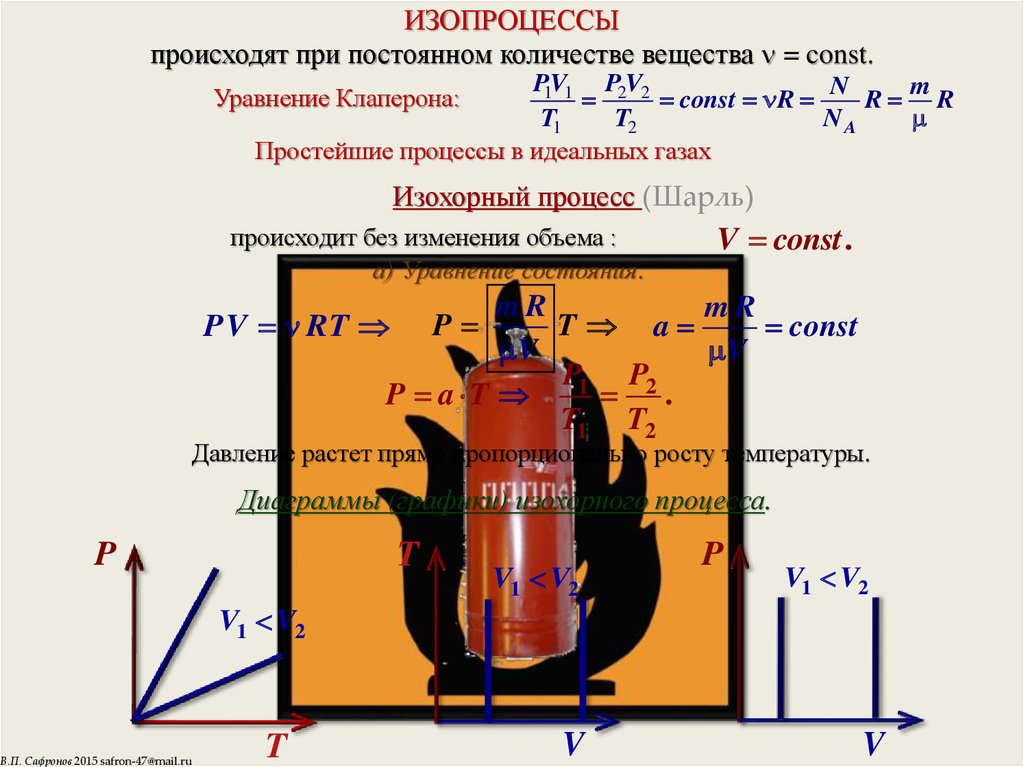
6. ИЗОПРОЦЕССЫ происходят при постоянном количестве вещества = const.
ИЗОПРОЦЕССЫпроисходят при постоянном количестве вещества = const.
PV
PV
N
m
1 1
2 2 const R
R R
T1
T2
NA
Простейшие процессы в идеальных газах
Уравнение Клаперона:
Изохорный процесс (Шарль)
происходит без изменения объема :
а) Уравнение состояния.
V const .
mR
mR
T a
const
PV RT P
V
V
P1 P2
P a T
.
T1 T2
Давление растет прямо пропорционально росту температуры.
Диаграммы (графики) изохорного процесса.
P
T
V1 V2
P
V1 V2
V1 V2
В.П. Сафронов 2015 safron-47@mail.ru
T
V
V
7. Изобарный процесс (Гей-Люссак)
происходит при постоянном давлении P const .а) Уравнение состояния.
mR
mR
V
T
b
const
PV RT
P
P
V V
V b T 1 2 .
T1 T2
Объем газа растет пропорционально температуре.
Диаграммы (графики) изобарного процесса
T
V
P1 P2
T
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
P1 P2
P
V
P1 P2
P
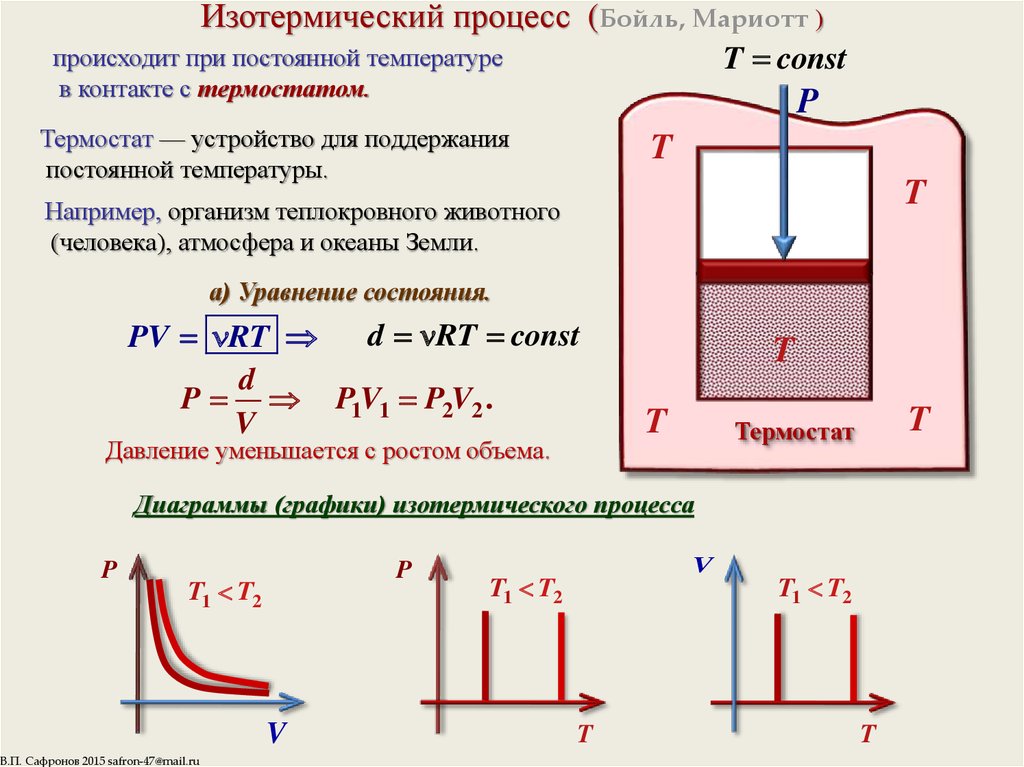
8. Изотермический процесс (Бойль, Мариотт )
T constпроисходит при постоянной температуре
в контакте с термостатом.
P
Термостат — устройство для поддержания
постоянной температуры.
T
T
Например, организм теплокровного животного
(человека), атмосфера и океаны Земли.
а) Уравнение состояния.
d RT const
PV RT
d
P P1V1 P2V2 .
V
Давление уменьшается с ростом объема.
T
T
T
Термостат
Диаграммы (графики) изотермического процесса
P
P
T1 T2
V
В.П. Сафронов 2015 safron-47@mail.ru
V
T1 T2
T
T1 T2
T
9. Основное уравнение молекулярно–кинетической теории идеального газа (основное уравнение МКТ)
Число степеней свободы молекулыi — это количество независимых координат, необходимое
для определения положения молекулы в пространстве.
z
Одноатомный газ имеет молекулы, состоящие из одной
материальной точки. Материальная точка обладает
тремя степенями свободы (i = 3), так как
может двигаться вдоль осей X,Y,Z.
y
x
z
x
Двухатомный газ имеет молекулы, состоящие из двух жестко
связанных материальных точек и обладает пятью степенями
свободы (i = 5): может двигаться вдоль осей X,Y,Z
и вращаться вокруг осей X, Z.
(Относительно оси Y момент инерции молекулы равен нулю).
y
z
x
y
Многоатомный газ имеет молекулы, состоящие из трех
и более жестко связанных между собой материальных точек.
Такая молекула, как любое абсолютно твердое тело,
обладает шестью степенями свободы (i = 6)
— тремя поступательными и тремя вращательными.
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
10. Средняя квадратичная скорость молекулы
u = vср, м/с.За счет хаотичности движений и столкновений кинетические энергии
молекул газа близки по значениям.
Будем считать, что любая молекула идеального одноатомного газа
обладает средней кинетической энергией:
2
m0vср
m0 u 2 1
m0vi2
Eср
,
2
2
N
2
— кинетическая энергия i-ой молекулы, тогда
m0vi2
2
средняя квадратичная скорость молекулы
vср u
Так как,
vср
Ecp
2
m0 vср
2
В.П. Сафронов 2015 safron-47@mail.ru
N
vi2 .
i 1
3
3kT
3kT
2
kT vср
vср
2
m0
m0
3kN AT
3RT
vср
;
N A m0
Таким образом,
1
N
vср
vср
3PV
3P
vср
;
m
3kT
3RT
3PV
3P
.
m0
m
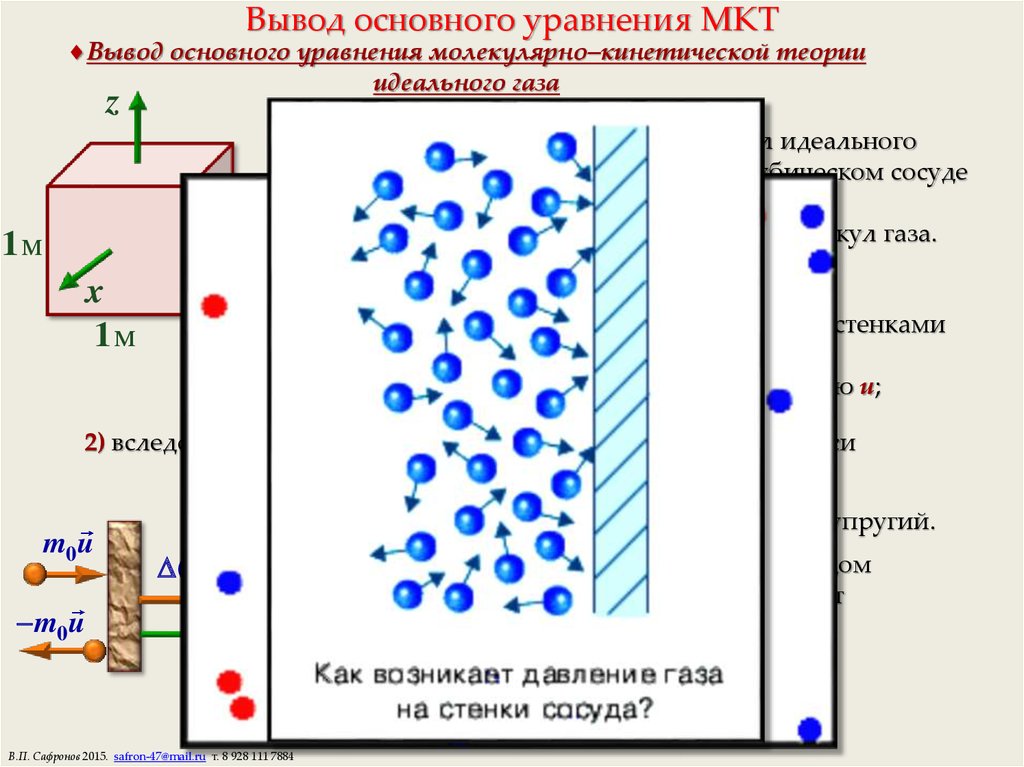
11. Вывод основного уравнения МКТ
Вывод основного уравнения молекулярно–кинетической теорииидеального газа
z
y
1м
Считаем, что:
1м
x
1м
Рассмотрим движение n молекул идеального
одноатомного газа, находящихся в кубическом сосуде
объемом V = 1 м3, тогда
n — численно равно концентрации молекул газа.
1) молекулы между столкновениями со стенками
сосуда движутся равномерно
со средней квадратичной скоростью u;
2) вследствие хаотичности движения молекул вдоль каждой оси
координат движется n/3 молекул;
m0 u
m0 u
3) удар молекул о стенку сосуда — абсолютно упругий.
( m0u)
y
В.П. Сафронов 2015. safron-47@mail.ru т. 8 928 111 7884
По закону сохранения импульса при каждом
упругом соударении молекула передает
стенке (y = 0,5) импульс:
m0u m0u ( m0u) 2m0u.
12. Основное уравнение МКТ.
4) За одну секунду молекула совершает u/2 таких передач,а переданный импульс станет равным по величине m0u2.
5) Вдоль каждой оси координат движется n/3 молекул, которые 1
2
nm
u
.
0
за одну секунду передадут 1 м2 поверхности грани куба импульс 3
6) По второму закону Ньютона изменение импульса грани куба в единицу
времени равно средней силе давления частиц.
Так как площадь грани y = 0,5 равна 1 м2, эта сила численно
равна давлению газа.
7) Поэтому, основное уравнение МКТ
1
1
2
nm0 u 2 nm0vср
3
3
n = N/V — концентрация молекул газа,
m0 , u = vср — масса и средняя квадратичная скорость молекулы.
P
Другие формы основного уравнения МКТ
2
2 m0vср
2
1 2
P nEср ; P 2 N Eср PV 2 U ; U 3 PV .
P vср ; P n
3
3
2
3
2
3
3V
3
3
U NEср PV RT — внутренняя энергия одноатомного идеального газа.
2
2
2
m0 vср
3
Ecp
kT — средняя кинетическая энергия молекулы,
2
2
Абсолютная температура является мерой средней кинетической энергии молекул.
В.П. Сафронов 2015 safron-47@mail.ru









 Физика
Физика








