Похожие презентации:
Положение в ПС
1.
2.
положение в ПСстроение атома
физические свойства (аллотропные модификации)
химические свойства
3.
Оксиды углерода (II) и (IV)4.
ЦЕЛЬ УРОКА:изучить состав, строение, свойства и
применение оксидов углерода (II) и
(IV)
5.
строениесостав
свойства
применение
6.
ОКСИД УГЛЕРОДА (II) СОУГАРНЫЙ ГАЗ
СТРОЕНИЕ МОЛЕКУЛЫ СО
7.
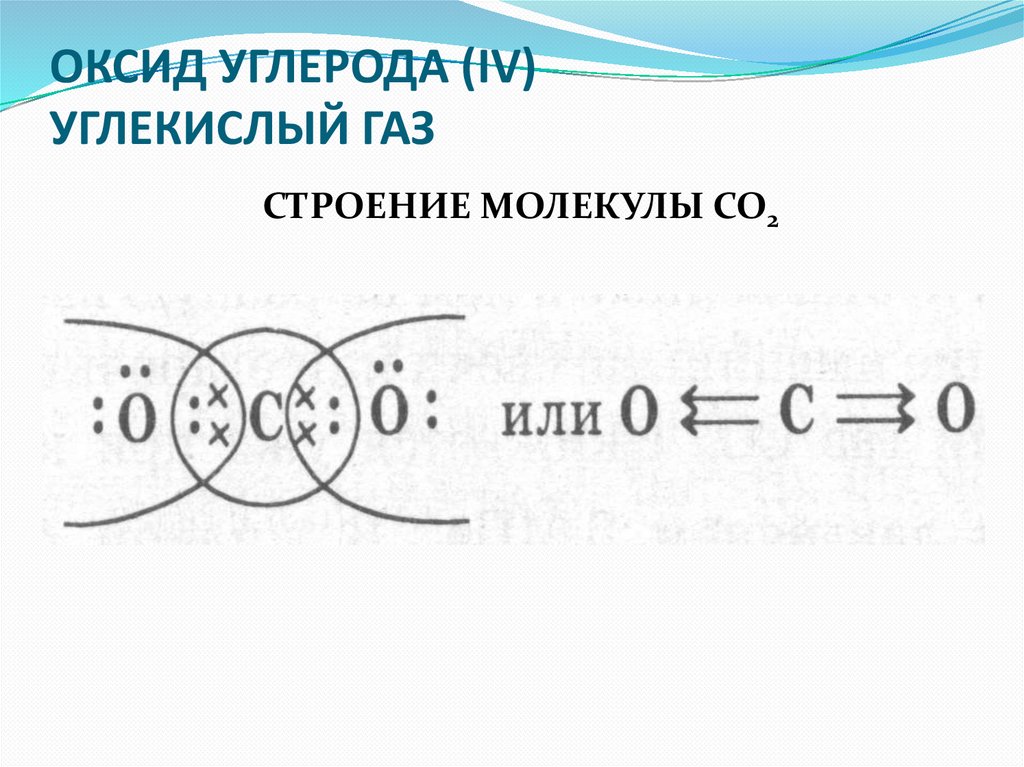
ОКСИД УГЛЕРОДА (IV)УГЛЕКИСЛЫЙ ГАЗ
СТРОЕНИЕ МОЛЕКУЛЫ СО2
8.
Физические свойстваОксид углерода (II)
Газ без цвета, без
запаха, немного легче
воздуха,
плохо растворим в
воде.
Ядовит!
Оксид углерода (IV)
Газ без цвета, без
запаха, тяжелее
воздуха, хорошо
растворим в воде.
9.
Физиологическое воздействиеОксид углерода (II)
ЯД! Он соединяется
с гемоглобином,
нарушая тканевое
дыхание и вызывая
кислородное
голодание тканей.
Оксид углерода (IV)
Не токсичен, но не
поддерживает
дыхание.
Раздражающий кожу
и слизистые
оболочки. В высоких
концентрациях
вызывает быстрое
удушье вследствие
недостатка
кислорода.
10.
Получение и распознаваниеуглекислого газа
СаСО3 + HCl CaCl2 + СО2 + Н2О
СО2 + Са(ОН)2 СаСО3 + Н2О
СО2 + Са(ОН)2 Са(НСО3)2
11.
Получение угарного газаС+О2 =СО2 (избыток кислорода)
С+ СО2 = 2СО(недостаток кислорода)
В лаборатории:
t, Н2SО4
НСООН
Н2О + СО
муравьиная
кислота
12.
Задание №4Из предложенного перечня выберите вещества,
которые будут взаимодействовать с углекислым
газом и запишите уравнения реакций:
O2
H2O
Ca(OH)2
HNO3 MgO
13.
Задание №4Из предложенного перечня выберите вещества,
которые будут взаимодействовать с углекислым
газом и запишите уравнения реакций:
O2
H2O
Ca(OH)2
HNO3 MgO
14.
Химические свойства оксидауглерода (II)
Оксид углерода (II) на воздухе горит голубоватым
пламенем:
2СО + О2 = 2СО2
Восстанавливает металлы из их оксидов:
Fe2O3 + CO = Fe + CO2
15.
ПрименениеОксид углерода
(II)
Оксид углерода (IV)
• В пищевой
• В смеси с H2 и другими
горючими газами в качестве
топлива;
Восстановитель в
металлургии ;
• Для обработки мяса
животных и рыбы, придает
им ярко красный цвет и вид
свежести, не изменяя вкуса.
промышленности
используется как
консервант;
В качестве разрыхлителя
теста;
Сухой лёд используется в
качестве хладагента в
ледниках и морозильных
установках;
Баллоны с жидкой
углекислотой широко
применяются в качестве
огнетушителей;
Для производства
газированной воды и
лимонада;
16.
Химический диктантИз предложенного перечня высказываний
выберите те, которые являются истинными для
1 вариант: угарного газа
2 вариант: углекислого газа
17.
Ответы.1 вариант 1, 3, 4, 5, 7, 10, 11, 13, 16, 18, 21
2 вариант 2, 3, 4, 6, 8, 9, 12, 14, 15, 17, 19, 20
18.
Критерии оценок:20 - 21 балл – “5”,
16 – 19 баллов – “4”,
10 -15 баллов – “3”,
менее 10 баллов – “2”.
19.
Домашнее задание.Если у вас есть ошибки с 1 по 12 вопрос физические
свойства,
Если ошибки с 13 по 15 вопрос повторите строение
молекул.
Если ошибки допущены с 16 по 21 вопрос, обратите
внимание на химические свойства оксидов.
§26, 27 упр. 8 стр.90


















 Химия
Химия








