Похожие презентации:
Оксиды углерода
1. HHРа
Оксиды углеродаД/З: п.21, упр.6-7 стр.114
HHРа
2. Нахождение в природе
Один израспространенных
оксидов – диоксид
углерода CO2 –
содержится в составе
вулканических газов.
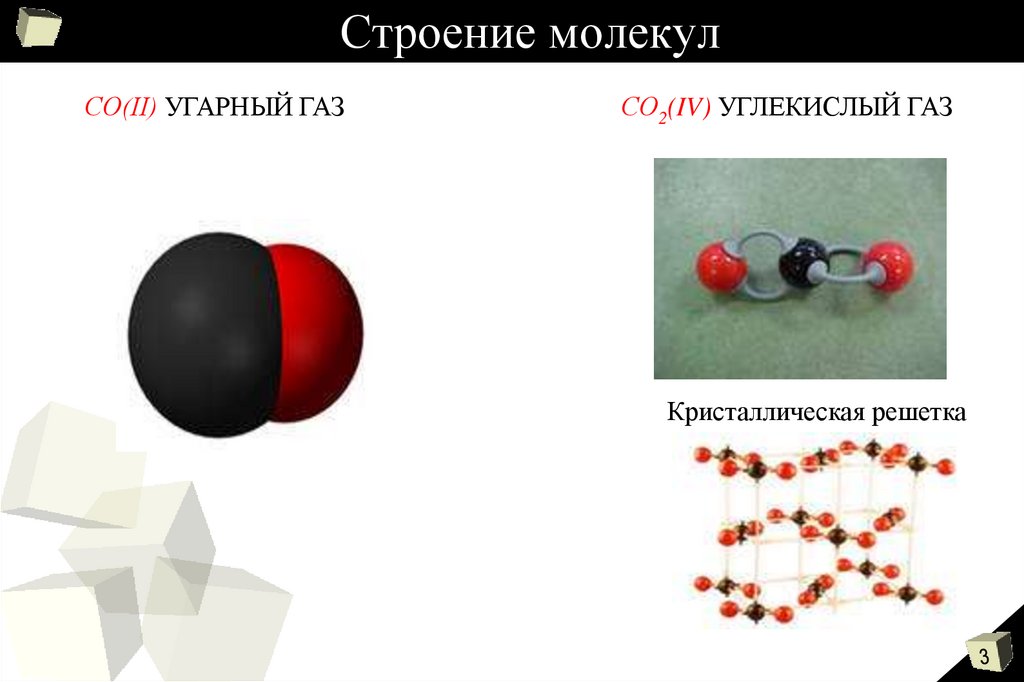
3. Строение молекул
СО(II) УГАРНЫЙ ГАЗСО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Кристаллическая решетка
4.
Сравнительная характеристика оксидовСО(II) УГАРНЫЙ ГАЗ
СО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Получение:
1. В лаборатории:
НСООН→Н2О+СО↑
2.В промышленности:
С+О2= СО2↑+ Q
СО2+C= СО↑ - Q
1. В лаборатории:
СаСО3+2НСl→CaCl2+H2O+CO2 ↑
2.В промышленности:
СаСО3→СаО+CO2 ↑
5. Сравнительная характеристика оксидов
СО(II) УГАРНЫЙ ГАЗСО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Физические свойства:
Безцветный газ, без запаза, легче
воздуха, плохо растворим в воде.
Сильный яд!!! Связываясь с
гемоглобином крови, нарушает ее
транспортную функцию и вызывает
удушье.
Безцветный газ, без запаза, в 1,5 раза
тяжелее воздуха, мало растворим в
воде, не поддерживает горение,
дыхание.
6. Химические свойства:
Сравнительная характеристика оксидовСО(II) УГАРНЫЙ ГАЗ
СО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Химические свойства:
1. Восстановительные свойства:
2СО+О2= 2СО2↑
1.Взаимодействие с основными оксидами:
СО2+СаО=СаСО3
2. Взаимодействие с водой:
CuО+СО=СО2↑ +Cu
Fе2О3+СО=СО2↑ +Fе
2. Горение:
2СО+О2= 2СО2↑
СО2+Н2О↔Н2СО3
3.Взаимодействие с основаниями
(качественная реакция):
СО2+Са(ОН)2=СаСО3 +Н2О
7. Применение
СО2(IV) УГЛЕКИСЛЫЙ ГАЗПрименяется при производстве соды,
сахара, газирования воды и
напитков, для наполнения
огнетушителей, “сухой лед”хранение продуктов, искусственный
лед в ледовых дворцах, используется
при фотосинтезе, применяются
сварки на его основе.
8. Применение
СО(II) УГАРНЫЙ ГАЗПрименяется для обработки мяса
животных и рыбы, придает им ярко
красный цвет и вид свежести, не
изменяя вкусовых качеств
Является хорошим восстановителем
в металлургическом производстве.
Образуется при неполном сгорании
кокса в доменной печи.
Используется для обезболивания,
при трансплантации органов.








 Химия
Химия








