Похожие презентации:
Общая характеристика оксидов
1. Тема: Общая характеристика оксидов
2. Оксиды-это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Общая формула оксидов:ЭnOm
3.
4.
5. Несолебразующими называют такие оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами и не образуют солей.
Примеры несолеобразующих оксидов: NO; N2O; CO; SiO.6.
Солеобразующиминазываются оксиды,
которые взаимодействуют с
кислотами или с щелочами
с образованием соли и
воды.
7. Солеобразующие оксиды:
8. Кислотные оксиды-это такие оксиды, которым соответствуют кислоты (оксиды неМе или металлов с валентностью 3-7) CO2 - H2CO3
SO2-H2SO3Mn2O7-HMnO4
9.
Нерастворимый в водекислотный оксид
SiO2
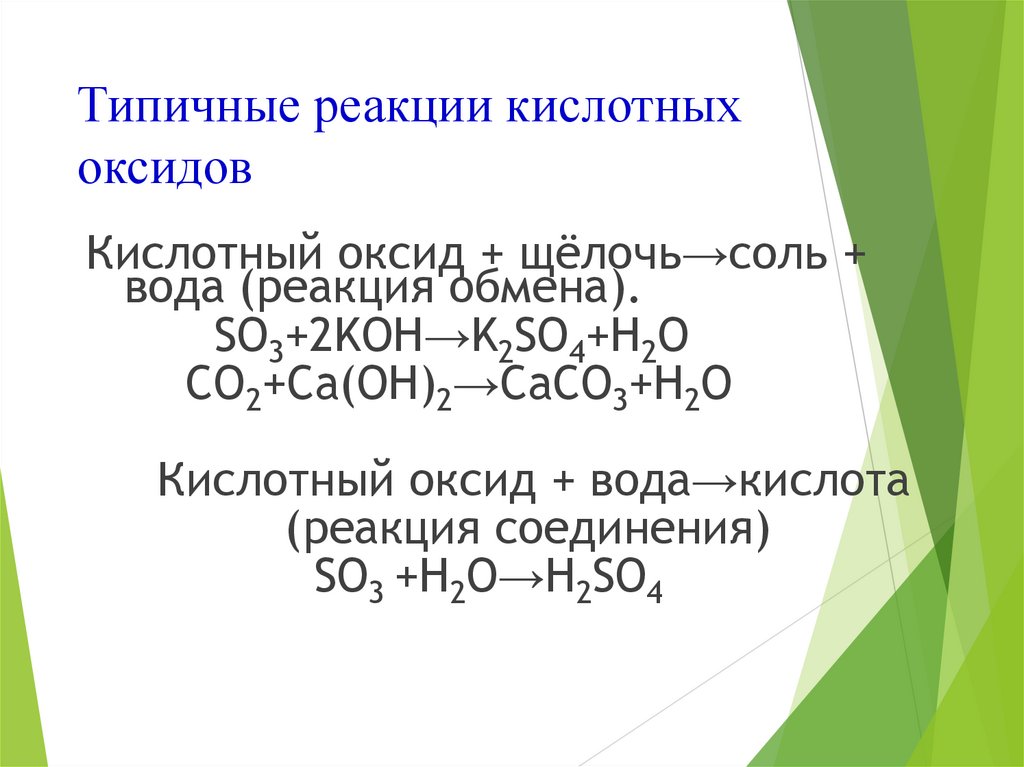
10. Типичные реакции кислотных оксидов
Кислотный оксид + щёлочь→соль +вода (реакция обмена).
SO3+2KOH→K2SO4+H2O
CO2+Ca(OH)2→CaCO3+H2O
Кислотный оксид + вода→кислота
(реакция соединения)
SO3 +H2O→H2SO4
11. Основные оксиды-это такие оксиды, которым соответствуют основания (Ме с валентностью- 1 и 2)
K2O – KOHBaO- Ba(OH)2
Li2O-LiOH
SrO-Sr(OH)2
12. Типичные реакции основных оксидов
Основный оксид + кислота→соль + вода(реакция обмена)
CuO + H2SO4→CuSO4 + H2O
K2O +2HCl→2KCl + H2O
Основный оксид + вода→щёлочь
(реакция соединения)
K2O + H2O→2KOH
Ca O + H2O→Ca(OH)2
13. Общие свойства оксидов:
Основный оксид + кислотныйоксид→ соль
(реакция соединения)
Li2O + CO2 → Li2CO3
SO2 + MgO → MgSO3
14. Методы получения оксидов:
1. Взаимодействие простых веществс кислородом
S + O2 = SO2
2.Взаимодействие сложных веществ
с кислородом
СН4 + 2O2 = CO2 + 2H2O
3.Дегидратация нерастворимых
оснований
Cu(OH)2 = CuO + H2O
4.Дегидратация некоторых кислот Н2SO3 = SO2 + H2O
5.Разложение некоторых солей СаСО3 = СаO + CO2
15. Задания для закрепления изученной темы:
1).Какие из перечисленных веществ являются оксидами?КОН; SiO2; H2SO4; CaO; NaCl; N2O3; Fe2O3; Zn(OH)2; Al2O3.
2)Какие из перечисленных веществ являются основными и
кислотными оксидами? Дать им названия.
Li2O; SO3; FeO; Mn2O7;CO2; BaO; SiO2
16. Задание 3:Осуществить следующие превращение:
алюминий→оксид алюминия →гидроксидалюминия→бромид алюминия→алюминий.
Напишите уравнения реакций.
17. Выводы:
1)повторили определение«оксидов»,
2)рассмотрели классификацию
оксидов по агрегатному состоянию
и способности образовывать соли,
3)изучили свойства основных и
кислотных оксидов, а также их
общие свойства.
















 Химия
Химия








