Похожие презентации:
Концентрации растворов
1.
Концентрациирастворов
2.
Концентрация — величина,характеризующая количественный состав
раствора.
3.
Согласно правилам ИЮПАК, концентрациейрастворённого вещества (не раствора)
называют отношение количества
растворённого вещества или его массы к
объёму раствора (моль/л, г/л), то есть это
отношение неоднородных величин.
4.
На практике часто приходится иметь дело срастворами, имеющими строго заданное
содержание в них растворенного вещества.
Примеры:
Во-первых, это приготовление различных лекарственных растворов.
Если в аптеке случайно произойдет ошибка с количеством лекарства в
его растворе, то последствия могут быть самыми плачевными.
5.
Во-вторых, многие химические реакции проводят врастворах. И здесь ошибки могут приводить к печальным
результатам. Например, если фотограф ошибется при
растворении проявителя, то фотографии либо не
проявятся, либо будут испорчены.
6.
Другой пример: если залить в аккумуляторраствор, в котором содержание серной кислоты
будет меньше или больше требуемого, то
аккумулятор либо не будет работать, либо
выйдет из строя.
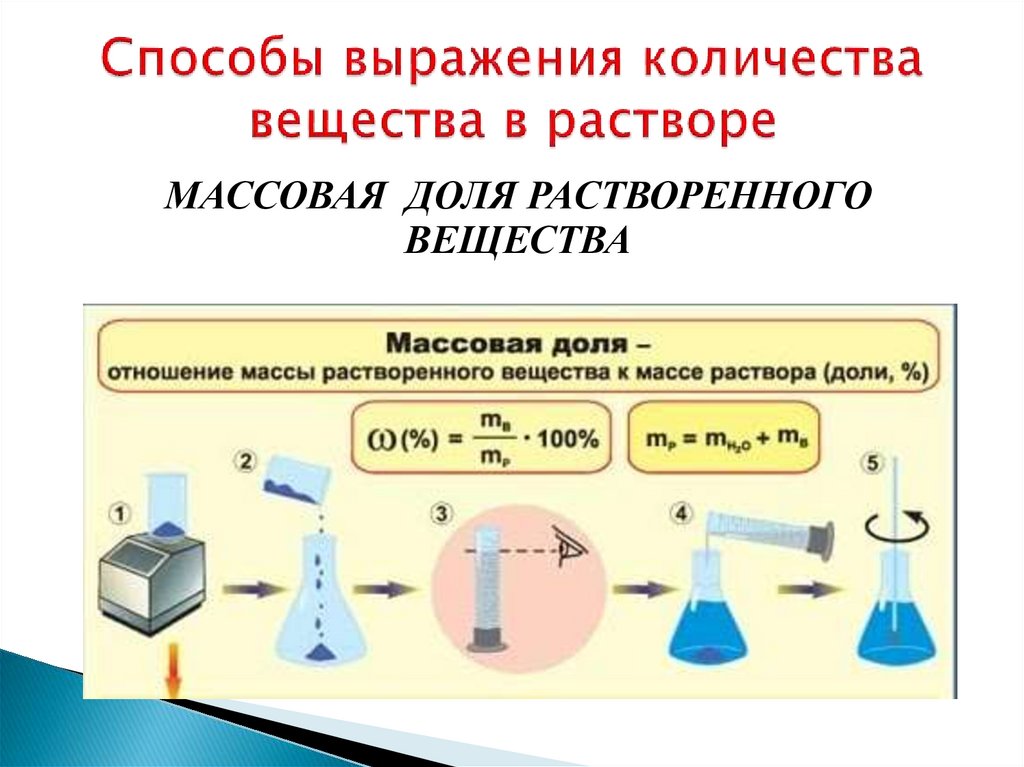
7.
МАССОВАЯ ДОЛЯ РАСТВОРЕННОГОВЕЩЕСТВА
8.
Пример. Для лечения гипертонической болезни(повышенное давление) применяют 25%-ный раствор
сульфата магния MgSO4. Это означает, что в 100 г
такого раствора содержится 25 г MgSO4. Здесь выделено
слово “раствора”. Действительно, если мы взвесим 25 г
сульфата магния и просто растворим в 100 г воды, то
нужного нам раствора не получим.
9.
Как же приготовить 25%-ный раствор? Надо взвесить навесах 25 г безводного сульфата магния и отмерить
мензуркой 75 мл воды (либо взвесить на весах 75 г воды,
что одно и то же). Затем сульфат магния надо высыпать в
воду и перемешать до полного растворения. Получится
100 г раствора (25 г + 75 г = 100 г), в котором массовая
доля сульфата магния составляет точно 25 %.
10.
Молярная концентрация веществаМолярная концентрация С – это отношение
количества растворенного вещества v (в молях)
к объему раствора V в литрах.
n (вещества)
С=
V (раствора)
где С – молярная концентрация раствора;
n(вещества) – количество вещества, моль;
V – объём раствора (л)
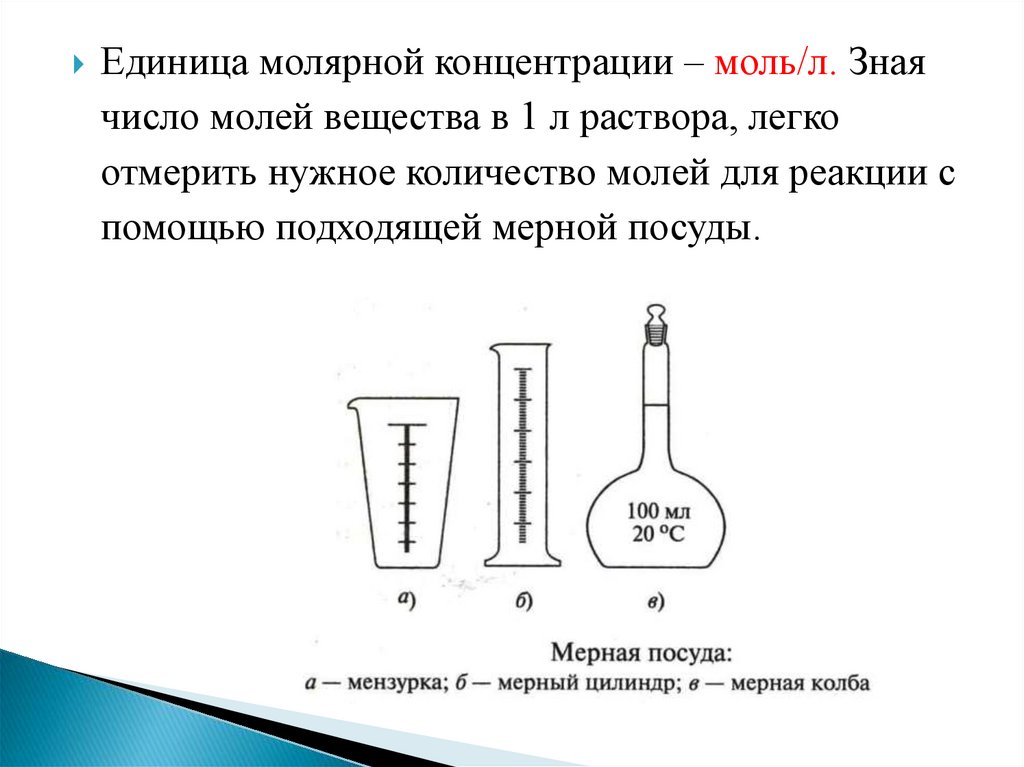
11.
Единица молярной концентрации – моль/л. Знаячисло молей вещества в 1 л раствора, легко
отмерить нужное количество молей для реакции с
помощью подходящей мерной посуды.
12.
Последовательность приготовления молярногораствора хлорида натрия (1моль/л NaCl): а) берут
мерную колбу емкостью 1 л; б) помещают в колбу навеску
кристаллического NaCl. в) в колбу добавляют немного
дистиллированной воды, растворяют кристаллы и
доливают раствор водой до метки 1 л, после чего
тщательно перемешивают.
13.
Мерная колба представляет собой сосуд с тонкой шейкой, на которойпо стеклу нанесена кольцеобразная метка. Если заполнить мерную
колбу жидкостью до метки, то ее объем составит ровно 1 л. Возьмем
такую колбу и приступим к приготовлению нужного нам раствора
NaCl.
Молекулярный вес NaCl составляет (23 + 35,5) = 58,5. Следовательно,
молярная масса NaCl (масса 1 моль) равна 58,5 г. Взвесим это
количество NaCl на весах и поместим кристаллы в мерную колбу.
Затем добавим немного воды и растворим кристаллы, покачивая
колбу. Когда вся соль растворится, дольем раствор водой до метки.
Мерные колбы делают таким образом, что объем раствора достигает
точно 1 л, когда водный мениск (уровень воды, слегка изогнутый
силами поверхностного натяжения) касается метки своей нижней
частью. После этого раствор аккуратно перемешаем.
Мы получим раствор с молярной концентрацией
С(NaCl) = 1 моль/л
14.
Молярную концентрацию(или МОЛЯРНОСТЬ растворов) принято
обозначать буквой М. Например, раствор
концентрации 1 М содержит 1 моль вещества на
литр раствора. Такой раствор
называют МОЛЯРНЫМ. Раствор концентрации
0,1 М содержит 0,1 моль вещества на литр
раствора и называется ДЕЦИМОЛЯРНЫМ.
Растворы концентрации 0,01 М (или 0,01 моль на
литр) иногда называют САНТИМОЛЯРНЫМИ.
15.
Задача 1.Раствор объемом 500 мл содержит NaOH массой 5 г. Определить
молярную концентрацию этого раствора.
Д а н о:
Решение:
V(р-ра NaOH )=500мл = 0,5 л
M(NaOH) = 40 г/моль
m(NaOH )=5г
Вычисляем число моль в 5 г NaOH.
_____________________
n(NaOH)=m(NaOH)/M(NaOH);
Найти: C(NaOH ) = ?
n =5г/40г/моль=0,125 моль
Вычисляем молярную концентрацию раствора.
C=n (NaOH)/V(р-ра NaOH);
C=0,125 моль/0,5 л =0,25моль/л;
Ответ:C(NaOH ) =0,25моль/л
16.
Задача 2Вычислить массу хлорида натрия NaCl, содержащегося в растворе
объемом 200 мл, если его молярная концентрация 2 моль/л.
Д а н о:
V(р-ра NaCl )=200мл=0,2 л
Решение
C(NaCl )=2 моль/л
Вычисляем количество вещества NaCl
Найти: m(NaCl)=?
в растворе
C (NaCl) = n (NaCl)/V(р-ра NaCl); n(NaCl)=С(NaCl)·V(р-ра NaCl);
n(NaCl)=2моль/л·0,2л=0,4 моль
Вычисляем массу NaCl:
m(NaCl)=M(NaCl) * n(NaCl); M(NaCl)=58,5г/моль
m(NaCl)=58,5г/моль·0,4 моль=23,4г NaCl
Ответ: m(NaCl)=23,4г
17.
Каждый способ выражения концентрациираствора удобен в зависимости от цели, которую
преследует химик или технолог.
Процентные концентрации более удобны в
технике, медицине, экологии. Молярные
концентрации чаще встречаются в лабораторной
практике.
18.
Решить задачи1) В 500 мл раствора содержится 56 г
гидроксида калия. Определите молярную
концентрацию раствора.
2) В 100 мл раствора содержится 0,98 г серной
кислоты. Определите молярную концентрацию
данного раствора.
3) Какая масса уксусной кислоты СН3СООН
содержится в 250 мл 0,2 М раствора?
















 Химия
Химия








