Похожие презентации:
Галогены. Агрегатное состояние и цвет галогенов
1.
Учитель химии МОУ «СОШ № 84»г. Саратова
Сыщикова Анастасия
Александровна
2.
ныФтор
3.
Строение атомов галогенов• 1) На внешнем уровне по 7 электронов;
• 2) Число энергетических уровней
увеличивается;
• 3) Радиус атома растет;
• 4) Электроотритцательность
уменьшается;
• 5) Окис
4.
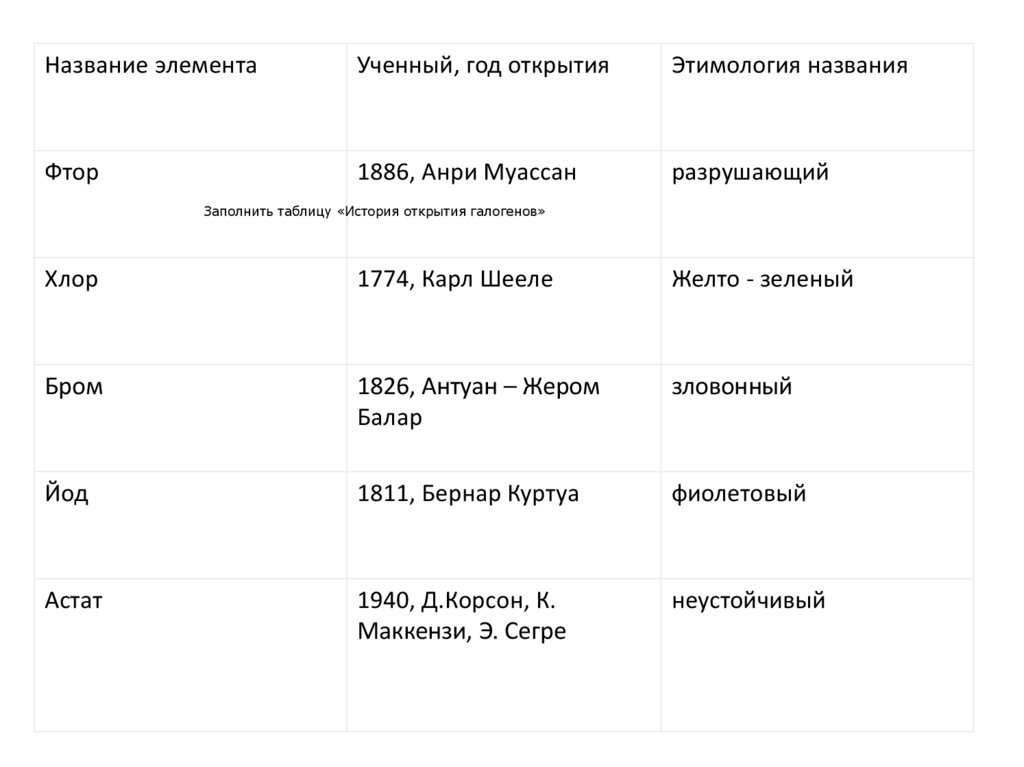
Название элементаУченный, год открытия
Этимология названия
Фтор
1886, Анри Муассан
разрушающий
Заполнить таблицу «История открытия галогенов»
Хлор
1774, Карл Шееле
Желто - зеленый
Бром
1826, Антуан – Жером
Балар
зловонный
Йод
1811, Бернар Куртуа
фиолетовый
Астат
1940, Д.Корсон, К.
Маккензи, Э. Сегре
неустойчивый
5.
6.
7.
8.
Вопросы для проверки:№1. При обычных условиях является жидким:
1)Бром
2)Хлор
3) Йод
4) Фтор
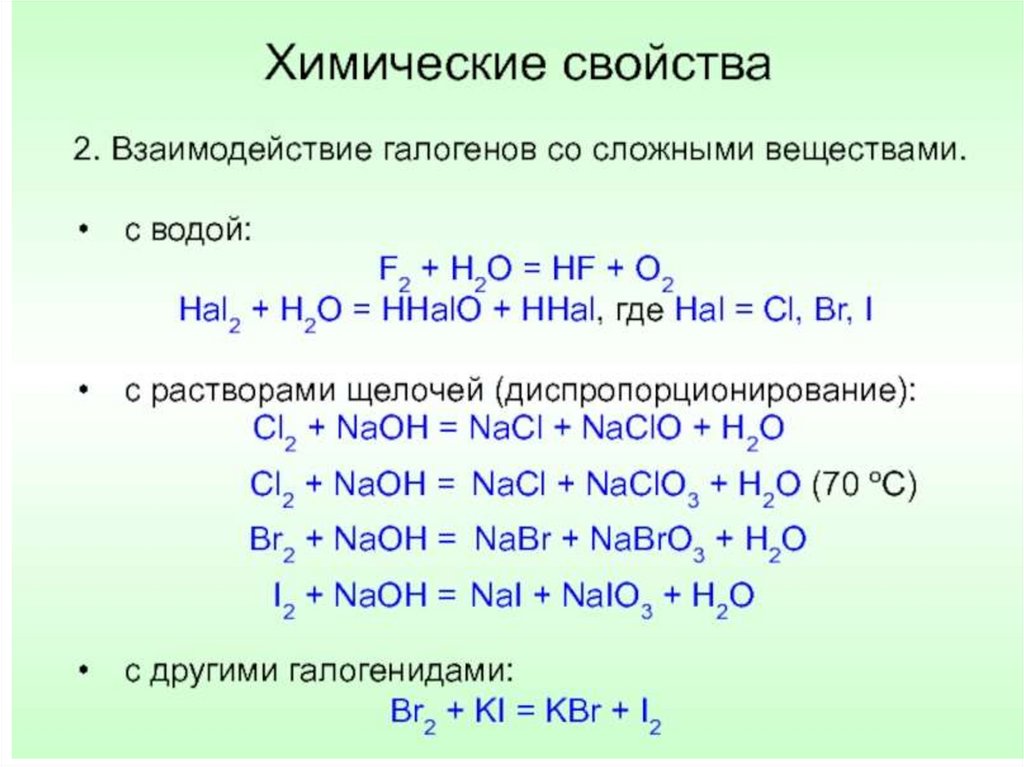
№ 2. Не идет реакция в растворе
1) Br2 + Cl2 =
3) NaBr + Cl2 =
2) Cl2 + NaI =
4)KI + Br2 =
№ 3. Распределите галогены в порядке увеличения их
окислительных свойств
1) Фтор
2) Хлор
3) Йод
4)Бром
№ 4. В реакции раскаленных железных опилок с хлором
образуется
1)FeCl
2) FeCl2
3) FeCl3
4) FeCl4
№ 5. Активно реагирует с водой
1)Йод
2) Хлор
3) Бром
4) Фтор





 Химия
Химия








