Похожие презентации:
Коллигативные свойства растворов. Диффузия (Д)
1.
"Коллигативные свойства растворов"1
2.
Коллигативные (коллективные) свойстварастворов это свойства зависящие от количества
частиц (молекул или ионов) растворенного
вещества, а не от природы растворенных частиц.
К коллигативным свойствам относятся:
1. диффузия;
2. осмос, осмотическое давление;
3. понижение давления насыщенного пара
растворителя над раствором
4. повышение температуры кипения и
понижения температуры замерзания.
2
3.
Диффузия (Д) - это самопроизвольныйпроцесс выравнивания концентрации
растворенного вещества в растворе.
Причиной Д является хаотическое тепловое
движение молекул и ионов, наблюдающееся при
соприкосновении растворов различной
концентрации.
Д частиц направлена из раствора с большей
концентрацией в раствор с меньшей конц-цией
до выравнивания концентраций.
После этого Д прекращается и наступает
диффузное равновесие
3
4.
Благодаря Д в биосистемах происходит :1) перемещение питательных веществ и
продуктов обмена веществ в тканевых
жидкостях.
2) мы ≈ на 80% состоим из воды - это вещество
с низкой вязкостью, Д в ней идет хорошо,
однако Д это самая медленная стадия
обмена веществ и от ее скорости зависит в
конечном счете скорость любого
метаболического процесса.
4
5.
Понижение давления пара растворителя:(нелетучее вещество в летучем растворителе)
Закон Рауля:
а) Парциальное давление насыщенного
пара данного компонента над раствором
прямо пропорционально его мольной доле:
P P
o
H 2O
Рауль Франсуа
(10.05.1830 – 1.06.1901)
·N H2O
б) Относительное понижение давления
растворителя равно мольной доле
растворенного вещества.
P
o
H 2O
o
H 2O
P
P
NA
5
6.
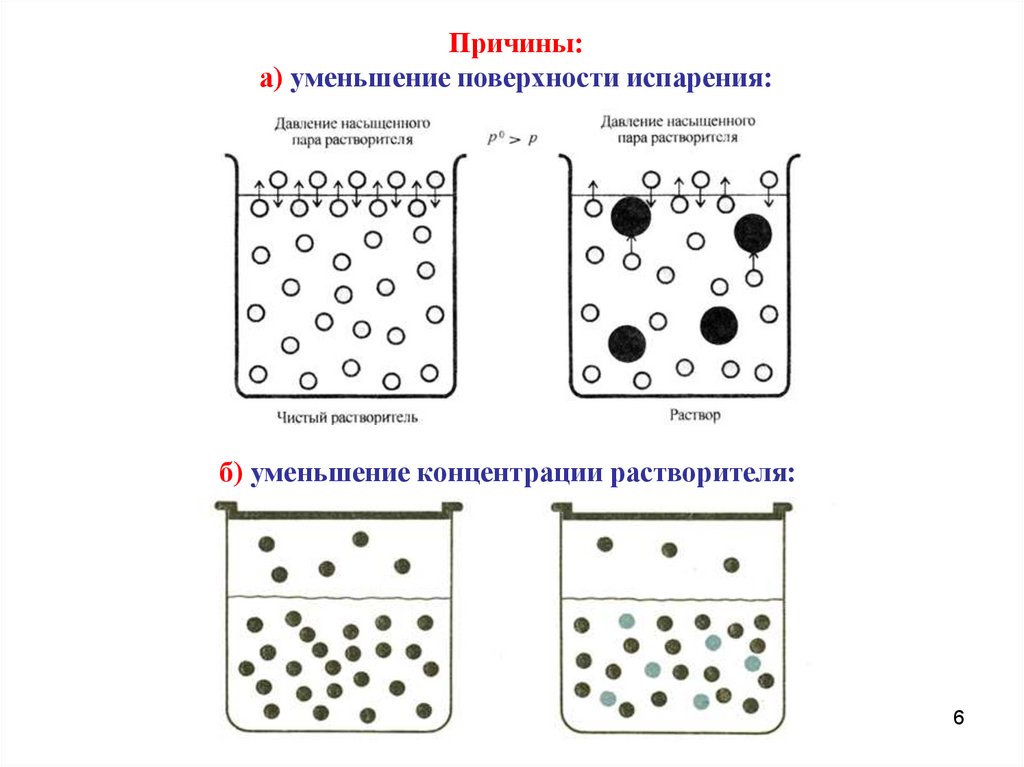
Причины:а) уменьшение поверхности испарения:
б) уменьшение концентрации растворителя:
6
7.
Для идеальных растворов понижение давлениянасыщенного пара растворителя не зависит от природы
растворенного нелетучего вещества.
Для
реальных
растворов,
где
имеют
место
межмолекулярные взаимодействия, в это уравнение
необходимо ввести изотонический коэффициент:
p p
i 1
iN A , причем :
0
i 1
p
0
для электролитов
для неэлектролитов
i 1
7
8.
Следствия из закона РауляКипение происходит, когда давление пара над
жидкостью равно внешнему давлению. Например:
tкип(H2O) =100° при P =101,3 кПа
Замерзание происходит, когда давление пара
над жидкостью равно давлению пара над
выпадающими из нее кристаллами твердой фазы.
Например: tзамерз (H2O) =0°C при P=101,3 кПа
8
9.
При добавлении к воде небольшогоколичества нелетучего не электролита, по закону
Рауля происходит снижение давления пара
растворителя над раствором при этом:
1. чтобы достичь кипения раствор нужно нагреть
до более высокой температуры, поэтому всегда:
t кип (р-ра) > t кип (H2O)
( 1следствие)
2. соответственно и замерзание раствора будет
происходить при более низкой температуре,
поэтому всегда:
t замерз (р-ра) < t замерз (H2O)
( 2 следствие)
9
10.
Рауль установил, что:повышение tкип и понижение tзамерз растворов
пропорционально моляльной концентрации
раствора (Cm), т.е.
∆t кип = Кэб· Cm
∆t замерз = Ккр· Cm
Кэб(H2O) = 0,516
Ккр(H2O) =1,86
Кэб - эбулиоскопическая константа
Ккр - криоскопическая константа
10
11.
Кэб и Ккр зависят от природырастворителя и показывают: на сколько
повышается tкип и понижается tзамерз р-ра,
если он содержит 1 моль растворенного
вещества в 1 кг раст-теля.
Такое выражение концентрации
называется моляльностью:
m(x) · 1000
Cm(x)
моль
=
M (x) · mраст-теля
кг
11
12.
Эбулиоскопия - способ определения М веществаТ кип К э ·Сm
Кэ – эбулиоскопическая константа (град/моль·кг);
m – моляльность (число моль в-ва в 1000 г р-рителя;)
m в ва ·1000
Т кип К э
M·m р ля
m в ва ·1000
М Кэ
Т кип ·m р ля
12
13.
Криоскопия – понижение ТзамерзПрисутствие растворенного вещества понижает
температуру замерзания раствора.
Причина - молекулам растворителя сложней образовать
гомогенные кристаллы твердой фазы.
13
14.
Т зам К Кр . ·СmТ зам ерз. К криоск.
mв в а ·1000
M ·m р л я
mв ва ·1000
М Кэ
Т кип ·m р ля
Криоскопия - способ определения молекулярных
масс веществ.
14
15.
Экспериментально определив ∆tкип и ∆tзамерз,можно рассчитать молекулярные массы для
веществ, которые нельзя подвергать жесткому
воздействию, например для биополимеров - белков,
нуклеиновых кислот и т.д.
Достаточно легко измерив ∆P , ∆tкип и ∆tзамерз
крови, лимфы, мочи - можно рассчитать,
суммарную концентрацию всех частиц,
обуславливающих коллигативные свойства р-ра.
15
16.
ОСМОС это направленныйсамопроизвольный процесс перехода молекул
растворителя через полупроницаемую
мембрану (ППМ) из растворителя в раствор
или из раствора с меньшей концентрацией в
раствор с большей концентрацией.
ППМ должна отвечать определенным
требованиям: ее поры должны пропускать
молекулы растворителя, но задерживать
молекулы растворенного вещества. Такими
свойствами обладают клеточные мембраны
животного и растительного происхождения,
мочевой пузырь...
16
17.
Причина осмоса - стремлениевещества распределяться равномерно по
всему объему растворителя.
17
18.
Вода проходя через ППМ оказывает на неедавление называемое осмотическим давлением.
Осмотическое давление численно равно силе
приходящейся на единицу поверхности ППМ,
которую нужно приложить, чтобы предотвратить
проникновение молекул растворителя (например
H2O) в раствор.
Осмос идет до выравнивания концентраций,
т.е. как любой самопроизвольный процесс до
наступления осмотического равновесия, когда
гидростатическое давление уравновесит
осмотическое давление.
18
19.
Закон Вант-ГоффаМожно рассчитать и по уравнению
Ван -Гоффа: πосм = C(X)RT где :
C(X)- молярная концентрация
R- универс. газовая постоянная;
T - температура по Кельвину
Вант-Гофф и Вильгельм
Оствальд в лаборатории
Осмотическое давление вещества
в растворе равно тому давлению,
которое бы оно оказывало, если бы
находилось в том же объеме, будучи в
газообразном состоянии.
Уравнение осмотического давления находит широкое
применение, при определении молекулярных весов
макромолекул (каучук, целлюлоза, белки)
19
20.
Осмотическое давлениедовольно просто определить
практически, используя простейший
осмометр. Расчеты производят по
уравнению:
πосм =ρqh
где
ρ- плотность кг/м;
h-высота столба жидкости, м;
q- 9,8 м/с ускорение силы тяжести.
20
21.
Осмос. Осмотическое давление.Осмос - самопроизвольная диффузия молекул растворителя
через полупроницаемую мембрану
Мембрана пропускает молекулы растворителя,
но задерживает молекулы растворенного вещества.
21
22.
Осмометрыа) с животной мембраной
б) с фарфоровой мембраной, пропитанной феррицианидом меди
в) для прямого измерения осмотического давления
22
23.
Коллигативные свойства растворов электролитовЗаконы Вант-Гоффа , Рауля и следствия из
него не применимы для концентрированных
растворов и растворов электролитов, так как
экспериментальные значения ∆P, ∆t кип, ∆t замерз
и π оказались выше рассчитанных по
соответствующим формулам.
Объяснение этому дала ТЭД Аррениуса,
согласно которой все вещества делятся на:
1) неэлектролиты, например C12H22O11(сахароза)
2) электролиты, например NaCl
23
24.
1моль этих веществ (как и любых других)содержит 6,02·1023 молекул. При растворении в воде
число частиц не электролита не меняется.
При растворении же в воде электролита идет
диссоциация
NaCl → Na+ + Cl‾
т.е число частиц удваивается:
2·6,02·1023 ионов в растворе.
Однако коллигативные свойства раствора NaCl не
удваиваются как ожидалось бы, а будут несколько
меньше.
24
25.
Объяснение этому дали Дебай и Хюккель:1) в растворах электролитов действуют силы притяжения
между катионом и анионом
2) Между одноименно заряженными ионами действуют
силы отталкивания
3) каждый ион в растворе оказывается как бы в
атмосфере ионов противоположного заряда
4) каждый ион со своей ионной атмосферой еще и
гидратирован, т.е. окружен молекулами воды
гидратная оболочка
В результате всех этих взаимодействий уменьшается : тепловое
движение ионов, электропроводность, коллигативные свойства,
активность ионов, возникает несоответствие между реальной
концентрацией частиц (C)
25
26.
Чтобы использовать законы Вант-Гоффа иРауля к растворам электролитов, Вант-Гофф ввел
изотонический коэффициент (i).
Это поправочный коэффициент, который
учитывает увеличение числа частиц в растворе
электролита из-за диссоциации на ионы.
i показывает, во сколько раз истинная
концентрация кинетически активных частиц в
растворе электролита больше, чем в растворе
неэлектролита с той же концентрацией.
26
27.
Коэффициент Вант-Гоффа (i) можно определить:i
C эл
π эл.
t зам. эл.
t кип . эл.
Pосм.эл.
C неэл
π неэл.
t зам. неэл.
t кип . неэл.
Pосм.неэл.
27
28.
Онкотическое давление– это осмотическое давление, создаваемое за счет
наличия белков в биожидкостях организма; оно
составляет 0,5% от общего осмотического
давления плазмы ( 0.025 – 0.04 атм )
Разрушение белков при гнойных процессах
сильно увеличивает величину онкотического
давления.
При заболеваниях, сопровождающихся уменьшением концентрации белков крови, онкотическое
давление падает. Возникают так называемые
онкотические отеки подкожной клетчатки.
Онкотическое давление играет важную роль в процессах
28
всасывания жидкости из тканей в кровеносные сосуды.
29.
Осмотическое давление плазмы крови человека 7.4-7.8 атм( 740 – 780 кПа)
Осмолярная концентрация - суммарное молярное
количество всех кинетически активных частиц,
содержащихся в 1 литре раствора, независимо от их
формы, размера и природы ( 0.29 – 0.30 моль/л)
29
30.
Физиологические растворы0,9%-ный ( 0,15 М ) раствор NаСl и 5% - ный ( 0,3М ) раствор
глюкозы создают такое же давление как кровь, следовательно,
они будут изотоническими по отношению к крови.
Истинно физиологическими !!!
считаются растворы, включающие соли, белки и
другие вещества в пропорциях, соответствующих их
содержанию в крови человека и используемые в
аппарате «искусственная почка»
30
31.
ИзоосмияИзоосмия - постоянство осмотического давления
физиологических сред (фундаментальное физикохимическое требование гомеостаза).
Нарушение изоосмии оказывается губительным
для организма гораздо раньше, чем наступает
плазмолиз или лизис клеток.
Понижение осмотического давления (избыток
воды, потеря солей) вызывает рвоту, судороги,
затемнение сознания, вплоть до гибели организма.
Повышение же осмотического давления (потеря
воды, избыток солей) вызывает их отеки, в первую
31
очередь подкожной клетчатке.
32.
Изо-, гипер- и гипотоническиеИзотонические - с одинаковым осмотическим
давлением (0.9%)
Гипертонические - с большим осмотическим
давлением (>0.9%)
Гипотонические - с меньшим осмотическим
давлением (<0.9%)
Во всех случаях, когда в кровяное русло,
мышечную ткань, спинномозговой канал в
терапевтических целях вводят р-ры, необходимо
избегать «осмотического конфликта».
32
33.
Осмотический шок вызывает пребывание в воде,которая либо неестественно богата минеральными
веществами, либо, наоборот, неестественно бедна ими.
33
34.
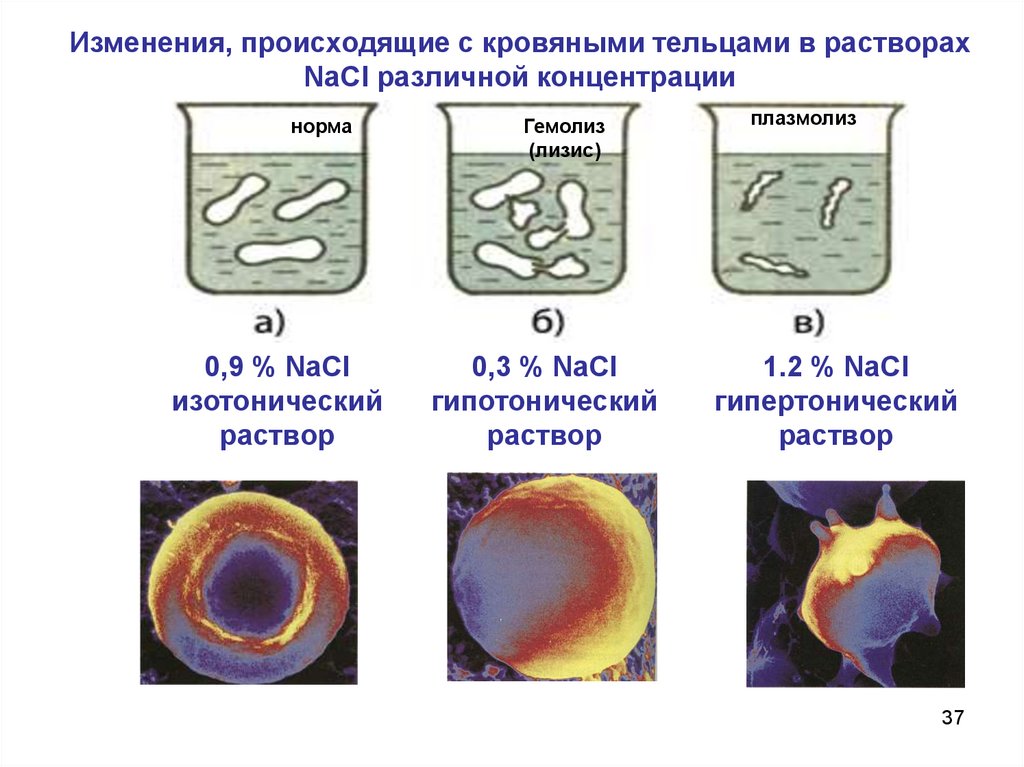
Изменения, происходящие с кровяными тельцамив растворах NaCl различной концентрации
При введении гипо- и гипертонических р-ров
наблюдается:
1) осмотический шок
2) осмотический конфликт
34
35.
Рабочие «горячих» цехов должны питьподсоленную воду, так как в результате
повышенного потоотделения
осмотическое давление у них понижается !
35
36.
Лизис, плазмолиз, гемолиз.Лизис - разрыв клетки при введении гипотонического
по отношению к крови раствора
Гемолиз - разрыв эритроцитных оболочек при введении
гипотонического по отношению к крови раствора
Плазмолиз - обезвоживание эритроцитов при введении
гипертонического по отношению к крови раствора
Начальная стадия гемолиза происходит при снижении
36
осмотического давления до 3,5–3,9 , а полный гемолиз при 2,5- 3,0 атм.
37.
Изменения, происходящие с кровяными тельцами в растворахNaCl различной концентрации
норма
0,9 % NaCl
изотонический
раствор
Гемолиз
(лизис)
0,3 % NaCl
гипотонический
раствор
плазмолиз
1.2 % NaCl
гипертонический
раствор
37
38.
Консервированиепродуктов питания
происходит благодаря
уничтожению
микроорганизмов
вследствие их
плазмолиза.
Плазмолиз также
наблюдается при
посыпании ягод или
фруктов сахаром, а
овощей, мяса или
рыбы - солью.
38
39.
Тургор – это осмотическое набухание клетки споявлением сильного внутреннего давления.
Тургор определяет объем и форму клеток.
Испарение воды листьями в окружающую
среду поддерживается накоплением воды через
ствол и ветви за счет осмотического давления.
39
40.
Нарушения водного обменаГипергидратация – избыточное поступление воды в
организм либо недостаточное ее выведение при:
избыточном введение физ. растворов, циррозе
печени, питье морской воды, введении
гипертонических р-ров,
введении жидкости через зонд, острой почечной
недостаточности
40
41.
Гипогидратация – обезвоживание организмавследствие значительного снижения поступления
воды в организм, либо чрезмерные её потери при:
диарее, рвоте, сахарном диабете, кишечной
непроходимости, ожогах, потере крови…
При дегидратации быстрая потеря 20%
жидкости смертельна.
41
42.
Значение осмотического давления1. Слабительное действие глауберовой соли Na2SO4·10H2O
и горькой соли MgSO4·7H2O объясняется тем. что плохая их
всасываемость стенками желудка вызывает интенсивный
переход воды внутрь кишечника, способствуя
послабляющему действию.
2. Перитонеальный диализ. При острых отравлениях в
брюшную полость вводят избыток сильного электролита с
одновременным обильным введением влаги в желудок и
кишечник.
Происходит интенсивный переход воды из
желудочно-кишечного тракта в брюшную полость,
увлекающий с собой токсическое вещество.
42
43.
3. При очистке ран от гноя и носителей инфекциииспользуют гипертонические марлевые повязки,
пропитанные 10%-ным раствором NaCI или
этанолом .
4. При глаукоме гипертонические растворы
вводят внутривенно чтобы снизить внутриглазное
давление.
5. Осмотическая очистка морской воды
43
44.
6. Осмос и диализ - основа ряда физиологическихпроцессов: усвоение пищи, окислительные
процессы связанные с дыхательной цепью,
распределение питательных веществ, жидкостной
обмен в тканях, выделение продуктов жизнедеятельности.
7. Осмос при купании
В пресной воде болевые ощущения, резь в глазах
более заметны (осмос воды направлен внутрь
глазного яблока).
В морской воде замечается покраснение глаз с
незначительными болевыми ощущениями (осмос
воды направлен из глазного яблока в морскую воду)
44










































 Химия
Химия








