Похожие презентации:
Коллигативные свойства растворов. Лекция №3
1.
КрасГМУ, кафедра биохимии с курсами медицинской, биологической итоксикологиеской химии
Лекция №3 для студентов
специальности стоматология
Коллигативные свойства
растворов
Лектор: старший преподаватель Светлана Ивановна Пащенко
Красноярск 2023г.
2.
Цель лекцииДать представление о коллигативных
свойствах разбавленных растворов
электролитов для понимания роли осмоса
в биологии и медицине.
Дать представление о способах
нахождения молярных масс
неизвествных веществ с помощью
законов Рауля
3.
План лекцииПонятие о коллигативных свойствах разбавленных
растворов электролитов и неэлектролитов.
Диффузия
Осмос и осмотическое давление.
Закон Вант Гоффа. Изотонический коэффициент.
Значение осмоса в биологии и медицине.
Тоничность растворов, гемолиз и плазмолиз,
физиологические растворы.
Давление насыщенного пара раствора.
Закон Рауля. Следствия закона Рауля: изменение
температуры фазовых переходов (tкип , tпл).
Криоскопия и эбулиоскопия.
4.
Коллигативные свойстварастворовэто свойства растворов, не зависящие от
природы частиц растворенного вещества, а
зависящие только от их концентрации.
К ним относятся:
1 Диффузия
2 Осмос, осмотическое давление (Р)
3 Понижение давления насыщенного пара(ДНП)
растворителя над раствором.
4,5 Понижение температуры замерзания (Тз) и
повышение температуры кипения (Тк) раствора.
-
5.
ДИФФУЗИЯ6.
СКОРОСТЬ ДИФФУЗИИКоличество вещества, переносимого за счёт
диффузии
через единичную площадь поверхности в
единицу времени,
называется СКОРОСТЬЮ ДИФФУЗИИ
7.
Диффузия8.
9.
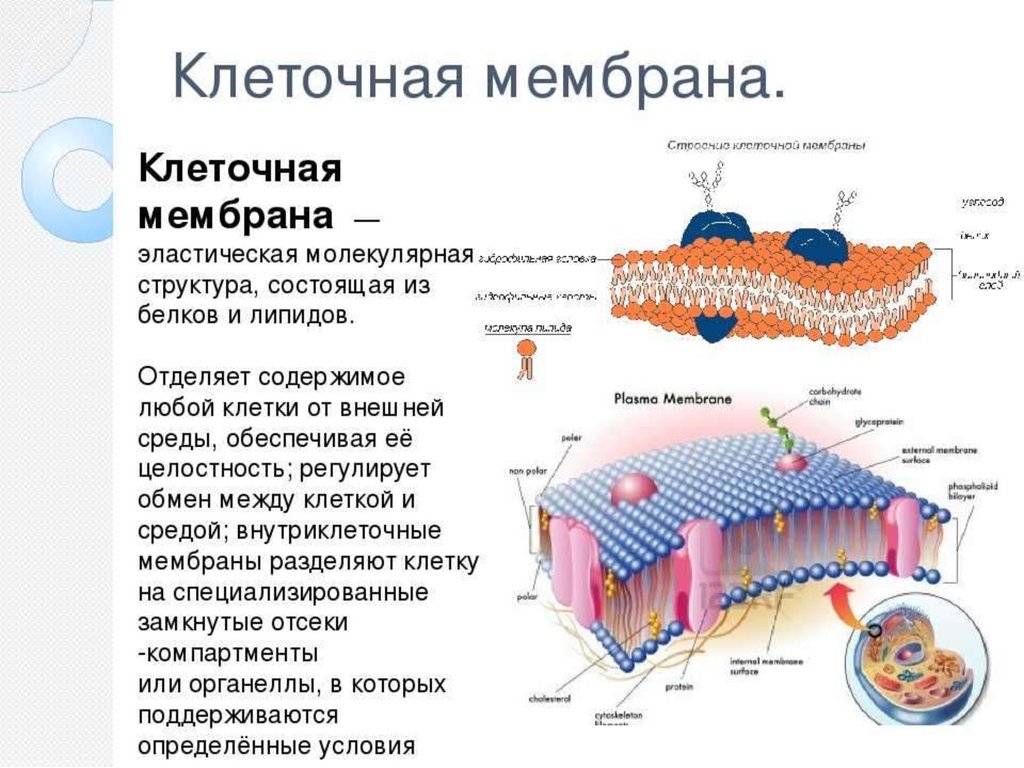
Осмос. Осмотическое ионкотическое давление.
Осмос наблюдается в живой клетке, окруженной
полупроницаемой мембраной, которая служит
для её защиты и регуляции внутриклеточной
среды.
п/п мембраны м.б животными (стенки кишечника
или мочевого пузыря) растительными (оболочка
клетки) или искусственными (пленки целлофана,
глиняные с Cu2[Fe(CN6)] в порах). Они
пропускают молекулы воды и наглядно
объясняют явление осмоса.
10.
11.
Осмос-односторонняя диффузия молекул растворителячерез п/п мембрану из растворителя в раствор
или из раствора меньшей концентрации
в раствор большей концентрации.
В сосуд с водой поместили второй
сосуд с п/п мембраной и
раствором сахара (х). Вода
устремиться через п/п
мембрану в раствор сахара.
Наблюдается диффузия –
самопроизвольный процесс
выравнивания концентраций, и
уровень жидкости во
внутреннем сосуде повышается
на величину h.
h
п-п мембрана
12.
13.
При этом действует двесилы:
-
-
молекулы воды, проходя через п/п мембрану создают силу
Р (гидростатич), равную Росм и тем >, чем > С (сахара) в
растворе;
столб жидкости высотой h создает гидростатическое
давление (Р), действующие в противоположном
направлении и тем >,чем > высота h.
Осмос прекратится, когда Росм =Р (гидростатич.)
Вывод: Росм– сила, вызывающая осмос или гидростатическое
давление столба жидкости высотой h, от которого
прекращается осмос
14.
Осмотическое давлениеОсмотическим давлением Р – называют избыточное
гидростатическое давление, возникающее в результате
осмоса
и приводящее к выравниванию скоростей взаимного
проникновения
молекул растворителя сквозь мембрану с избирательной
проницаемостью. В организме Росм 740 -780 кПА
Онкотическое давление – это осмотическое давление,
создаваемое за счёт наличия белков в биожидкостях организма 2.5-4,0 кПа
15.
16.
ТОНИЧНОСТЬ17.
Изотонический коэффициент18.
Изотонический коэффициентЭлектролиты, диссоциируют на ионы и число
частиц в растворе увеличивается.
Σ всех частиц в р-ре(ионы,молекулы)
i= /
первоначальное число молекул
У электролитов i >1;у неэлектролитов i=1.
19.
С учетом степени диссоциации (α) и n-числа ионовиз 1 молекулы электролита:
i=1+α (n-1)
Для бинарных электролитов(n=2 иона): NaCl,
NaHCO3, MgSO4 i= 1+ α
Для тринарных электролитов(n=3 иона): Na2SO4,
CaCl2, Na2HPO4 i=1+2 α
При сильном разбавлении сильных электролитов
α →1, отсюда
i (NaCl)=2; i (CaCl2) =3
20.
Закон Вант – Гоффа (1887г) дляочень разбавленных растворов.
Р
Р
осм
=i С(х)RТ,
не зависит от природы растворенного вещества и
растворителя, а зависит от молярной концентрации
растворенного вещества и Т(К).
(R= 0,083 атм.л/к.моль)
осм
-
Р
На практике Росм определяют по понижению Тз, т.к. в
очень разбавленных растворах С(х)~Сm и
∆ Тз
осм
=i RT*
Кз
21.
Значение осмоса-
-
-
Упругость, тургор клеток;
Эластичность тканей, форма органов;
Распределение воды между кровью, тканями,
клетками;
Постоянный объем крови (~5л), у беременных
женщин (~6л),
Специфические свойства биомембран клеток.
Они задерживают ВМС (белки) и пропускают
НМС тремя путями.
22.
ЭКЗООСМОС - плазмолиз –сжатие оболочки клетки
23.
ЭНДООСМОС- гемолизэретроцитов крови
Тургор –клетка набухает
24.
Гемолиз и плазмолиз эритроцитов врастворах NaCl разной концентрации.
c1=c2 (наруж.)
c1>c2
c1<c2
Р 1= Р 2 (наруж.) Р 1> Р 2(нар.) Р 1 <Р 2(нар.)
Изо-
ГипоГемолиз
гиперт.р-р
Плазмолиз
25.
Росм создаваемое белками плазмы, называетсяонкотическим давлением.
Р онк = 0,03-0,04 атм невелико, но его роль в
распределении воды между кровью и тканями
значительна.
При голодании, беременности, нарушении
пищеварения, болезни почек концентрация
плазменных белков понижается, вызывая
понижение Р онк. Вода поступает в ткани, и
возникают онкотические отеки («голодные»,
«почечные»).
26.
В гипотоническом растворе осмос воды в клетку,где c и Росм >. Происходит «осмотический шок»
- гемолиз эритроцитов: клетка набухает, Росм
увеличивается, оболочка разрывается и
гемоглобин выливается в плазму. Образуется
прозрачная «лаковая» кровь. Полный гемолиз
при Росм =2,5-3 атм.
В гипертоническом растворе осмос воды из
клетки в раствор, где c и Росм >. Наблюдается
плазмолиз – дегидратация, сжатие,
высушивание клетки.
27.
Осмотическое давлениекрови (5л),
Состоящей из истинного раствора – плазмы (3,5 л) и
эмульсии форменных тел, не влияющих на Р крови.
Состав плазмы:
90% H2O,6-8% белков, 0,9 % электролитов (>NaCl);~2%:
липиды (0,8%), глюкоза (0,1%), аминокислоты и другие
органические кислоты.
Рпл = Р нмс + Р вмс = (7,7-8,1)атм при Т=37°С
эл-ты,неэл-ты белки
Uз Тз(крови)=0,56
Р пл = 0,56/1,86*0,83*(273+37)=7,65атм
28.
По отношению к Р плазмы другие биожидкости можноразделить на 3 группы:
1.изотонические, Р = Р пл=7,7 атм;спинно-мозговая
жидкость, материнское молоко
2.гипотонические, Р < Р пл; слюна, моча
разбавленная(после обильного питья)
3.гипертонические, Р > Р пл; в очаге воспаления
Рповышается до 25 атм; моча концентрированная
(утренняя) Р повышается до 17 атм.
29.
Применение в медицинеизотонических и гипертонических
растворов.
Изотонические растворы: 0,9% NaCl (физ.раствор),
раствор Рингера и другие заменители крови – при
обезвоживании, кровопотерях, 5% раствор глюкозы
вводят в/в в больших количествах.
Гипертонические растворы:
10% NaCl наружно ввиде марлевых повязок для оттока
гноя из раны;
10%CaCl2 при аллергических отеках, кровотечениях;
20%, 40% глюкоза при глаукоме, отеке мозга.
Чтобы избежать «осмотического конфликта» такие растворы
вводят в/в очень медленно и в небольших количествах.
30.
Na2SO4*10H2O(глауберова соль),
MgSO4*4H2O(горькая соль) обладает
слабительным действием, из-за их плохой
всасываемости кишечный сок становится
гипертоничным (Росм ), вода поступает в
кишечник, оказывая слабительное действие.
В быту при заготовке овощей и фруктов
используют рассол (NaCl) и сахарный сироп. Они
обладают стойким плазмолизом, и
микроорганизмы погибают.
31.
Например, рассчитайте Росм(0,9%NaCl) при 37°С.Решение:
1)По формуле
ω%(X)*10ρ
0,9*10*1
С(Х)=
=
=0,15моль/л
M(X)
58,5
2) Р =ic(x)RT=2*0,15*0,83*310=7,65 атм
Вывод: Р(0,9% NaCl)= Р пл=7,65атм при 37°С,
т.е. изотоничен плазме.
32.
1 закон Рауля (1886 г) для оченьразбавленных (идеальных)
растворов.
В изолированной (закрытой) системе, содержащей
растворитель (H2O) устанавливается равновесие между
H2O(ж) испарение H2O(пар)
конденсация
Когда v исп = v конд, то, пар, находящийся в равновесии с
жидкостью, называют насыщенным, а его давление
P°называют ДНП чистого растворителя
Т
P° .
Для H2O: О°С- P° =4,6 мм.рт.ст.
20°С – 17,4 мм.рт.ст.
100°С- 760 мм.рт.ст.
Чистая H2O закипает, когда P°=Рвнеш
33.
P° > Р РастворСравним 2 закрытые системы,
содержащие чистый растворитель и
раствор с нелетучим неэлектролитом,
например, сахаром.
Гидротированные молекулы сахара в
поверхностном слое жидкости затруднят
испарение воды и новое состояние
равновесия наступит при меньшем ДНП
растворителя над раствором. (Р)
Вода
34.
По закону Рауля:«При постоянной температуре относительное
понижение ДНП растворителя над
раствором нелетучего неэлектролита равно
молярной доле растворенного вещества»
(N(X2))
P° - Р
n(X2)
m(x)г
= N(X2); N(X2)=
; n(x)=
,моль
P°
n(X2) +n(X1)
M(x) г/моль
Чем > концентрация растворенного вещества (Х2), тем ниже
Р.
35.
2 закон РауляЯвляется следствием 1 закона и
рассматривает обратимые
превращения H2O(т,ж,г)
Диаграмма зависимости Р от Т.
Раствор имеет Р <P°
↓Тз и ↑Тк
на величину ∆ Т:
∆Тз = Тз(р-ль) – Тз(р-р)=
(О° - Тз(р-р)>0)
∆Тк = Тк(р-р) – Тк(р-ль) =(Тк
(р-р) - 10О°)>0
36.
По 2 закону Рауля:↓∆Тз и ↑∆Тк растворов нелетучих веществ
прямо пропорциональны моляльной концентрации
раствора Сm(моляльная).
↓∆ Тз=КзСm(моляльная). ↑∆ Тк=КэСm (моляльная)., где
Сm (моляльная). = m(x) /M(x)*m(р-ль)
Моляльная концентрация (Сm) равна количеству
моль вещества в 1 кг растворителя;
37.
Кз – криоскопическаяКэ – эбулиоскопическая константы.
Они зависят от природы растворителя и
численно равны:
Кз = ∆Тз, Кэ = ∆Тк при Сm = 1 моль/кг
(физический смысл данных констант).
Для H2O: Кз=1,86 град.кг/моль; Кэ=0,52
град.кг/моль
38.
Применение 2 закона РауляКриометрия и эбулиометрия – определение
молекулярной массы растворимых веществ по
↓∆Тз и ↑∆Тк
Кз*m(x) г
Кэ* m(x)
М(х)=
М(х)=
∆ Тз*m(р-ль),кг
∆Тк*m(р-ль),кг
-При гололеде для понижения травматизма дороги
посыпают солью. Тз понижается и лед тает.
- Овощи и фрукты не замерзают при температуре
-1°С: при гидролизе полисахаридов число частиц
(глюкозы) повышается и Тз клеточного сока
понижается.
-
39.
На практике i определяют по ↓Тз, ↑Тк, изменению Р :∆ Тз(прак)
i=
=
Р(прак)
∆ Тк(прак)
=
∆ Тз(теор)
∆Тк(теор)
Р(теор)
В числителе экспериментальные данные для электролитов, а
в знаменателе – неэлектролитов той же концентрации.
Законы Рауля и Вант-Гоффа для электролитов:
P°-Р
=iN(X2);
P°
∆Тз=iКзСm; ∆Тк=iКэСm;
Р =ic(X)RТ
40.
ВЫВОДЗаконы Рауля лежат в основе экспериментальных методов
определения молярных масс растворимых веществ
эбулиоскопии и криоскопии , - основанных соответственно
на измерении температур кипения и температур
замерзаниярастворов этих веществ. А также этот метод
применяется для изотонического коэффициента, степени
электролитической диссоциации.








































 Химия
Химия








