Похожие презентации:
Сложные эфиры. Сложные эфиры в растениях
1.
Урок химии в 10 классе : «Сложныеэфиры»
Подготовила учитель химии МАОУСОШ №23
города Липецка Коблякова Н.В.
2.
Сложные эфиры в растениях3.
4.
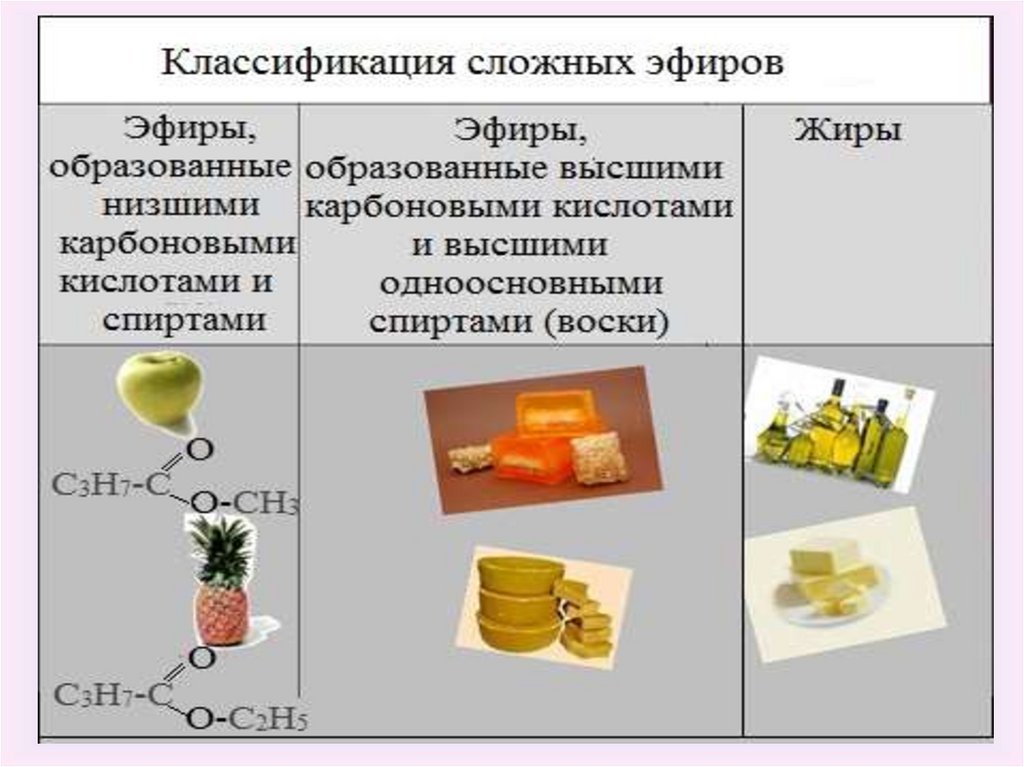
Сложные эфиры –соединения с общей формулой R–COOR',
где R и R' - углеводородные радикалы.
Получение
1854 год Пьер Эжен Марселен
Бертло - синтез сложных
эфиров - реакция
этерификации.
В начале XIX века Мишель
Шеврель –гидролиз сложных
эфиров –(жиров).
5.
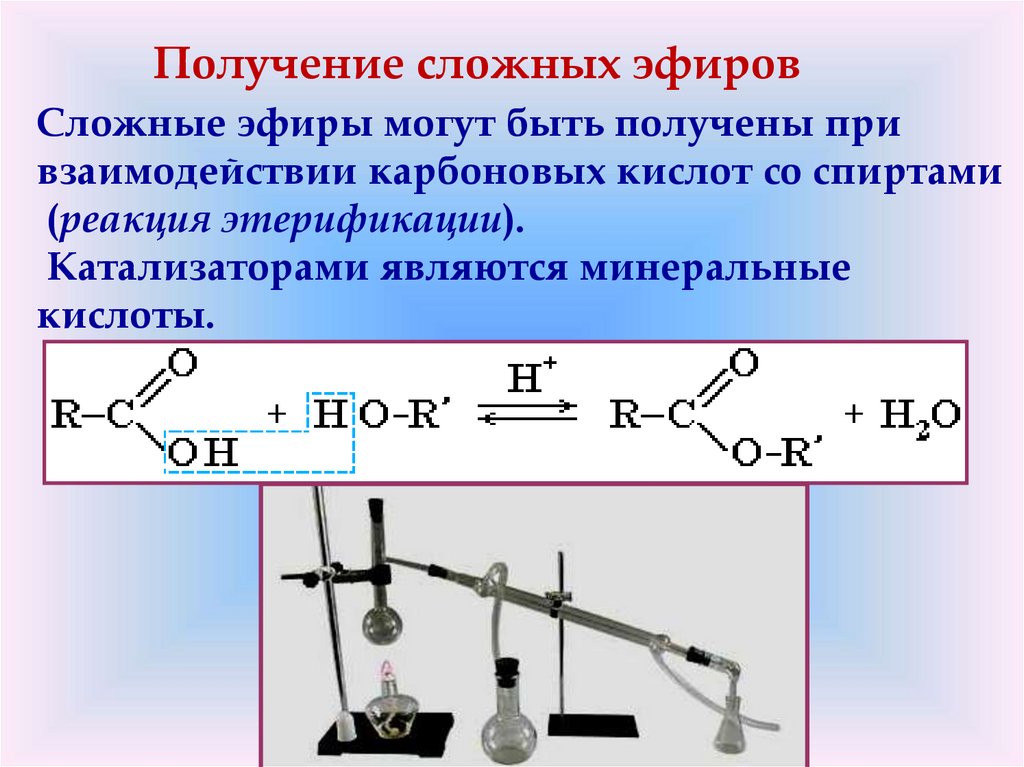
Получение сложных эфировCложные эфиры могут быть получены при
взаимодействии карбоновых кислот со спиртами
(реакция этерификации).
Катализаторами являются минеральные
кислоты.
6.
7.
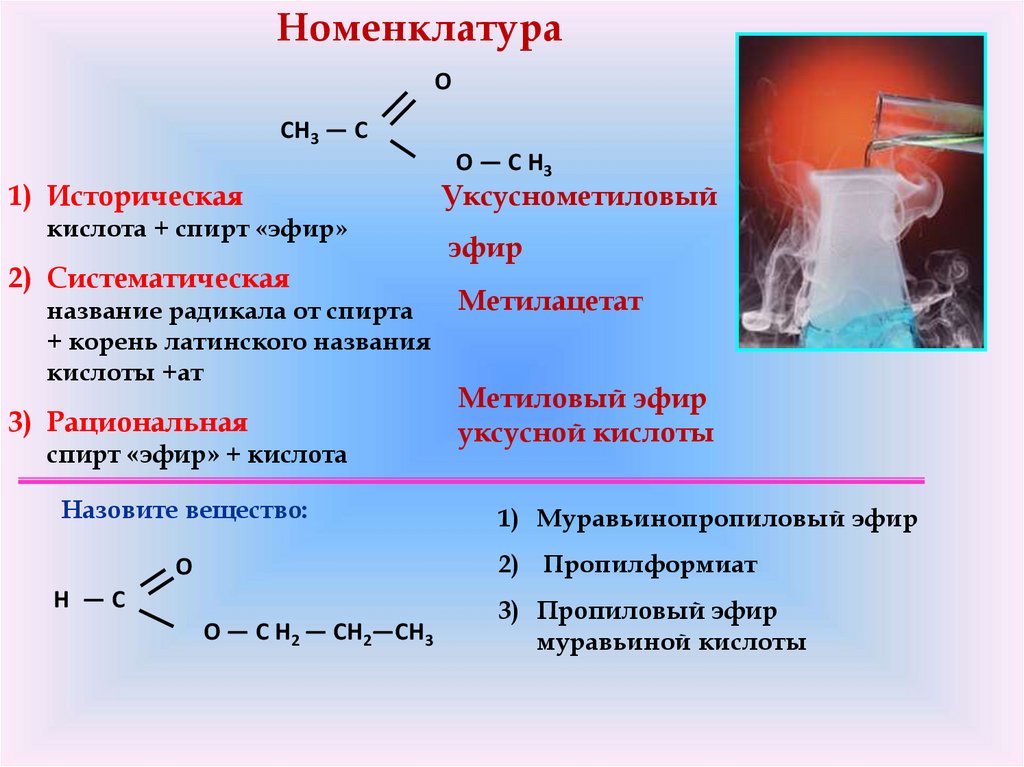
НоменклатураO
CH3 — C
1) Историческая
кислота + спирт «эфир»
2) Систематическая
название радикала от спирта
+ корень латинского названия
кислоты +ат
3) Рациональная
спирт «эфир» + кислота
Назовите вещество:
O — C H3
Уксуснометиловый
эфир
Метилацетат
Метиловый эфир
уксусной кислоты
1) Муравьинопропиловый эфир
2) Пропилформиат
O
H —C
O — C H2 — CH2—CH3
3) Пропиловый эфир
муравьиной кислоты
8.
Виды изомерии1) Структурная
2) Межклассовая (карбоновые кислоты)
CnH2nO2
Составьте структурные формулы 3 изомеров для данного
эфира и назовите изомеры по рациональной номенклатуре:
O
H —C
O — C H2 — CH2—CH3
O
CH3 — C
O — C H2 — CH3
O
Этиловый эфир уксусной кислоты
CH3 — CH2— CH2 — C
O
CH3 — CH2 — C
O — CH3
Метиловый эфир пропионовой кислоты
OH
Масляная кислота
9.
Физические свойства сложных эфировЛетучие жидкости, мало растворимые в воде,
хорошие растворители, обладают приятными запахами
10.
АРОМАТ ЦВЕТОВ, ЯГОД, ФРУКТОВ —НАЛИЧИЕ В НИХ СЛОЖНЫХ ЭФИРОВ.
11.
Химические свойства сложных эфиров1) Реакция гидролиза.
O
CH3 — C
O
+
H2O
CH3 —
+
C
O — C H2 — CH3
C2H5OH
OH
Этиловый эфир уксусной кислоты
уксусная кислота
этиловый спирт
2) Реакция со щелочами.
O
CH3 — C
O
+
NaOH
CH3 —
O — C H2 — CH3
Этиловый эфир уксусной кислоты
+
C
C2H5OH
ONa
ацетат натрия
этиловый спирт
12.
ЗаданиеСоставьте уравнения реакций, характерных для
пропилового эфира муравьиной кислоты.
O
O
+
H —C
H2O
H—
C
C3H7OH
+
C3H7OH
OH
O — C 3H 7
O
O
H —C
+
+
O — C 3H 7
NaOH
H—
C
ONa
13.
14.
15.
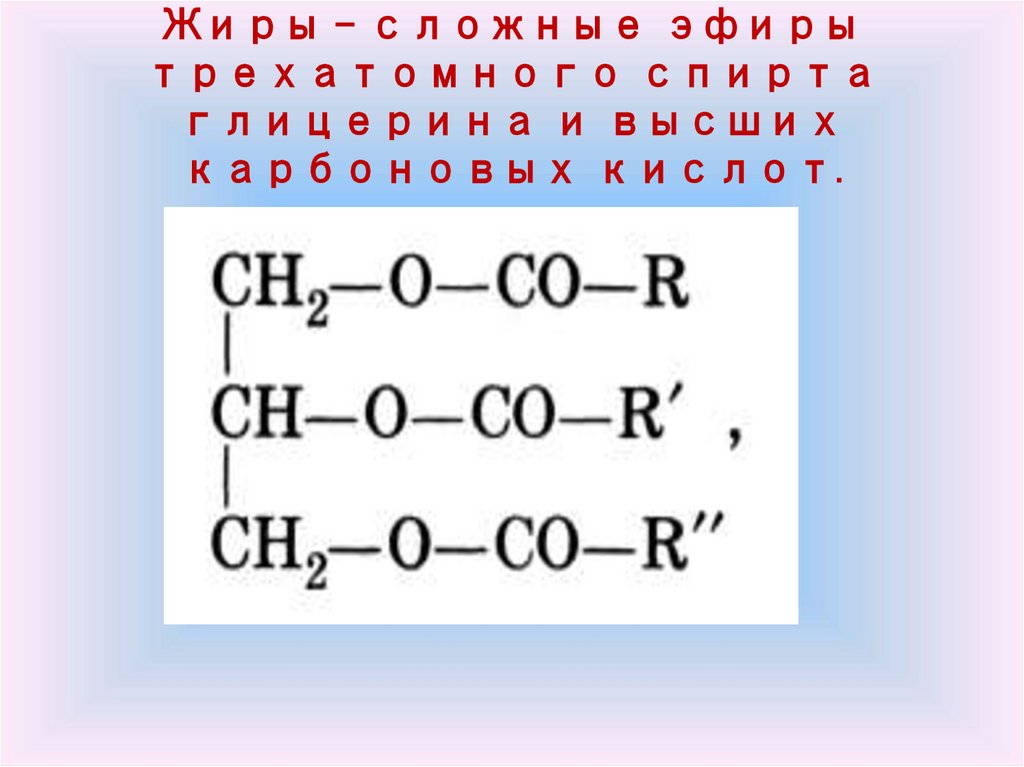
Жиры – сложные эфирытрехатомного спирта
глицерина и высших
карбоновых кислот.
16.
История получения первого жираВ 1854 французский химик Марселен Бертло
(1827–1907) провел реакцию этерификации, то есть
образования сложного эфира между глицерином
и жирными кислотами, и таким образом впервые
синтезировал жир.
Впервые химический состав жиров определил в начале
прошлого века французский химик Мишель Эжен
Шеврёль, основоположник химии жиров.
Действуя водными растворами кислот и щелочей на
различные жиры, он получил в результате реакции
гидролиза (омыления) открытый еще Шееле глицерин
и неизвестные ранее химические соединения –
различные жирные кислоты, многим из которых он и дал
названия. А «сладкое масло» Шееле Шеврёль назвал
глицерином.
17.
Классификация жировЖиры
Жиры растительные
Твердые жиры
Жиры животные
Жидкие жиры Твердые жиры
Жидкие жиры
Кокосовое
масло
Подсолнечное,
оливковое, льняное
масла
Бараний,
говяжий,
свиной жир
Рыбий жир
18.
Физические свойстваПри комнатной температуре жиры представляют собой твердые, мазеобразные
или жидкие вещества.
Жиры не имеют строго определенной температуры плавления вследствие того,
что они состоят из смеси различных триглицеридов.
Жиры кипят только в очень высоком вакууме при остаточном давлении меньше
10–3 мм: тристеарин – 253°/0,001 мм, трилаурин – 188°/0,001 мм. Плотность всех
жиров, за исключением трибутирина, обычно колеблется в пределах 0,91–0,97.
Жиры сильно преломляют световые лучи; при 40° коэффициент преломления
равен 1,458–1,472.
Чистые жиры – плохие проводники электричества.
Диэлектрическая проницаемость жиров составляет 3,0–3,2. Теплопроводность
жиров при 20° – около 0,0004 кал/сек. см. Теплоемкость жиров колеблется от 0,3 до
0,5 ккал/кг град.
В воде жиры практически нерастворимы, но образуют с ней эмульсии.
Жиры хорошо растворимы в органических растворителях: эфире, бензоле,
бензине, хлороформе, четыреххлористом углероде и др.
19.
Химические свойства• Наиболее важная в практическом плане реакция – гидрирование жиров.
Гидрированием жидких жиров получают твердые сложные эфиры.
Гидролиз жиров
Водный
Щелочной
Гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла — натриевые или
калиевые соли высших карбоновых кислот.
20.
21.
Применение1. Пищевая промышленность
2. Фармацевтика
3. Производство мыла,
косметических изделий
4. Производство смазочных
материалов
22.
1. Вещество, формула которогоназывается
,
1) метилацетатом;
3) метилформиатом;
2) метилэтиловым эфиром;
4) этилацетатом.
2. В результате гидролиза жидкого жира образуются:
1) твердые жиры и глицерин; 2) глицерин и предельные кислоты;
3) глицерин и непредельные кислоты;
4) твердые жиры
и смесь кислот.
3. В каком веществе жиры не растворяются?
1) в бензоле;
3) в воде;
2) в бензине;
4) в хлороформе.
4. Для превращения жидких жиров в твердые используют реакцию:
1) дегидрогенизации;
3) гидрогенизации;
2) гидратации;
4) дегидроциклизации.
5. В результате гидрирования жидких жиров образуются:
1) твердые жиры и непредельные кислоты;
3) твердые жиры
и глицерин;
2) твердые жиры и предельные кислоты;
4) твердые жиры.
6. Для получения мыла используют реакцию:
1) гидрогенизации жиров;
3) этерификации карбоновых кислот;
2) щелочного гидролиза жиров;4) гидратации алкинов.
7. В организме процесс переваривания жиров начинается с реакции:
1) гидролиза;
3) гидрирования;
2) полимеризации;
4) дегидрирования.
23.
Задание на домП.13,вопросы 1-5.Подготовить сообщение на
тему: «Мыла: виды, свойства,применение»




















 Химия
Химия