Похожие презентации:
Сложные эфиры
1.
Тема:«СЛОЖНЫЕ ЭФИРЫ»
2. Общая формула:
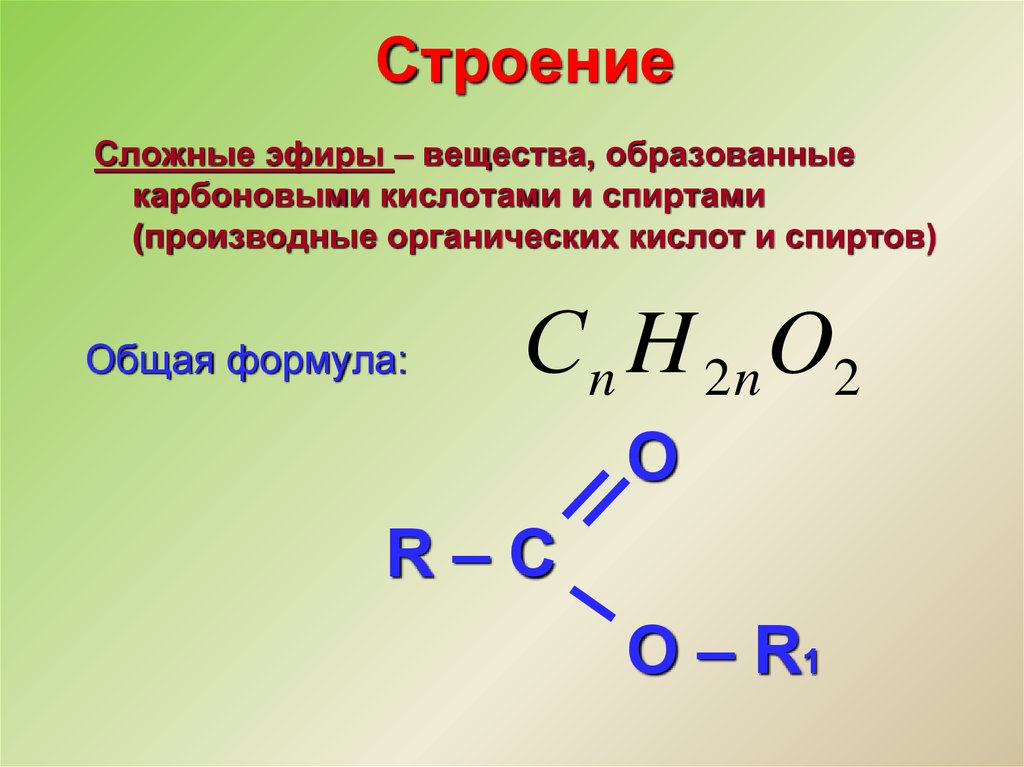
СтроениеСложные эфиры – вещества, образованные
карбоновыми кислотами и спиртами
(производные органических кислот и спиртов)
Общая формула:
С n H 2 n O2
O
R–C
O – R1
3.
4.
Тищенко Вячеслав Евгеньевич1861-1941
Российский химикорганик. В 1906 году
открыл реакцию
сложноэфирной
конденсации,или
диспропорционирование
альдегидов с
образованием сложных
эфиров под
воздействием
алкоголятов алюминия.
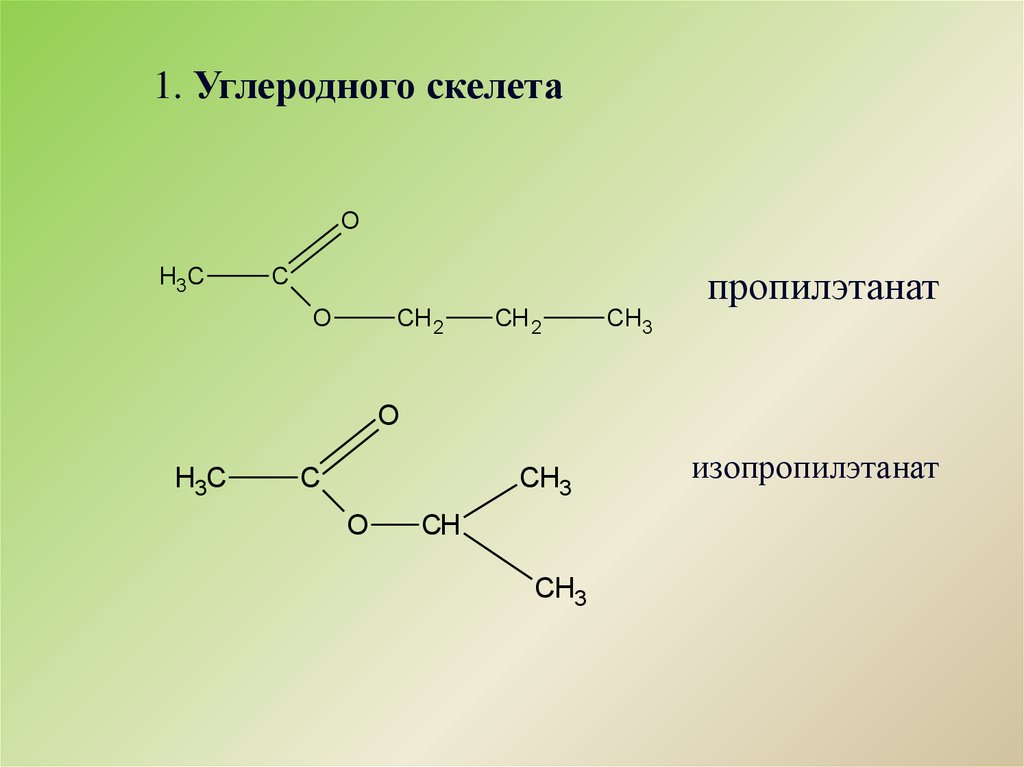
5. Изомерия сложных эфиров
1. Изомерия углеродного скелета:СН3СООСН2СН2СН3 пропилацетат
СН3СООСНСН3 ИЗОпропилацетат
│
СН3
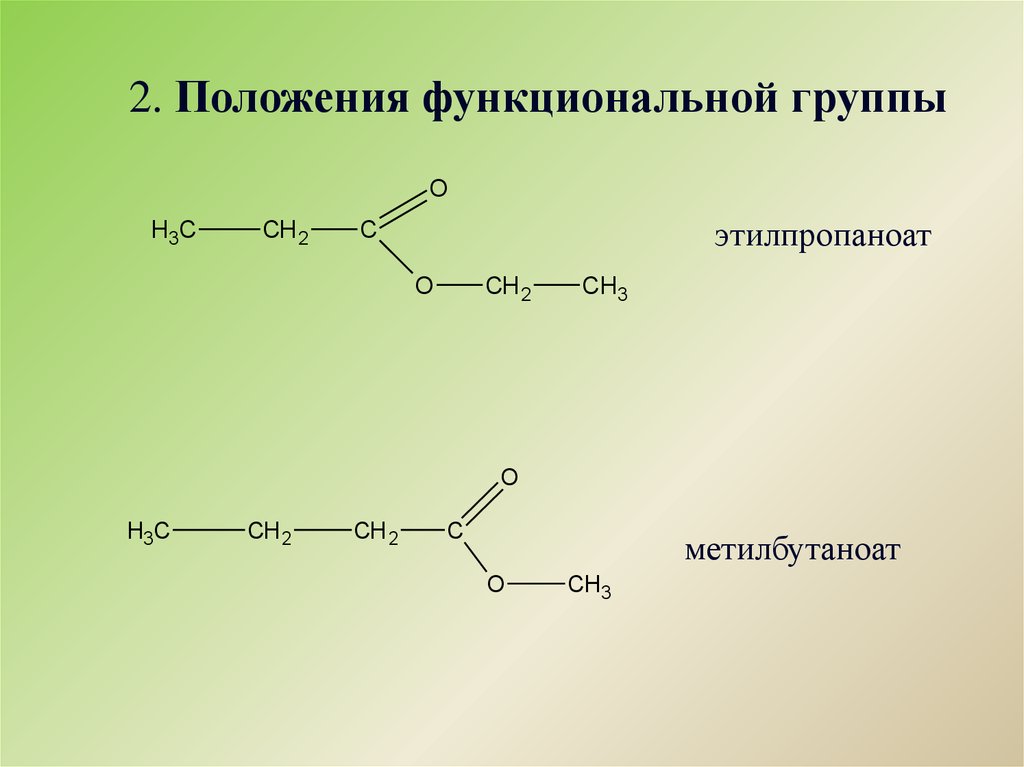
2. Положения функциональной группы
3. Межклассовая изомерия (с
карбоновыми кислотами) С2Н5СООН
пропановая кислота
СН3СООСН3
метилацетат
6.
7.
1. Углеродного скелетаO
H3C
С
СН 2
O
СН 2
пропилэтанат
CH3
O
H3C
С
CH3
O
СН
CH3
изопропилэтанат
8.
2. Положения функциональной группыO
H3C
СН 2
этилпропаноат
С
СН 2
O
CH3
O
H3C
СН 2
СН 2
С
метилбутаноат
O
CH3
9.
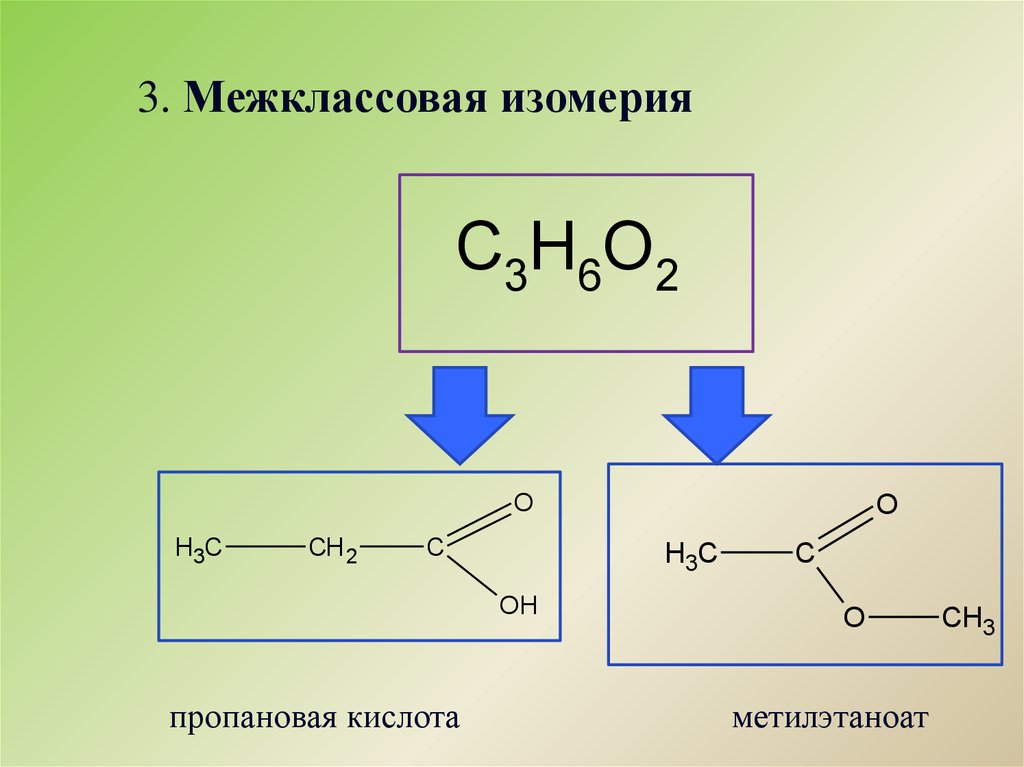
3. Межклассовая изомерияС3Н6О2
O
H3C
СН 2
С
H3C
OH
пропановая кислота
O
С
O
метилэтаноат
CH3
10.
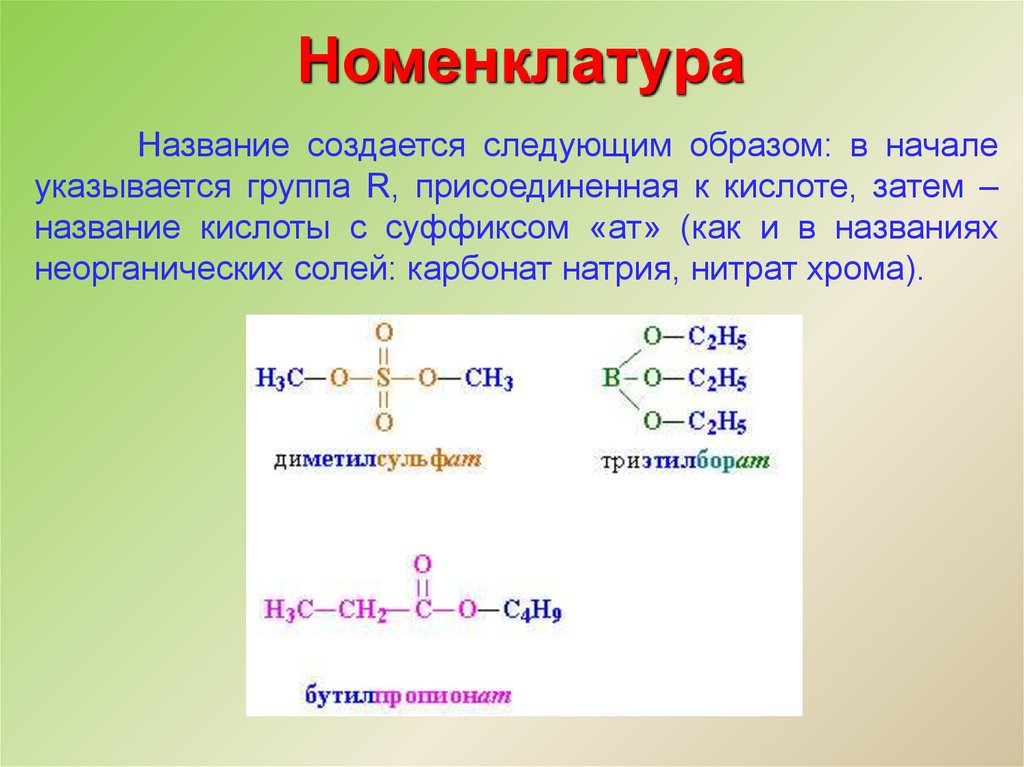
НоменклатураНазвание создается следующим образом: в начале
указывается группа R, присоединенная к кислоте, затем –
название кислоты с суффиксом «ат» (как и в названиях
неорганических солей: карбонат натрия, нитрат хрома).
11.
НоменклатураВ основе номенклатуры лежат два способа названия
сложных эфиров:
1) по названию радикала спирта и кислотного остатка
кислоты (как соли).
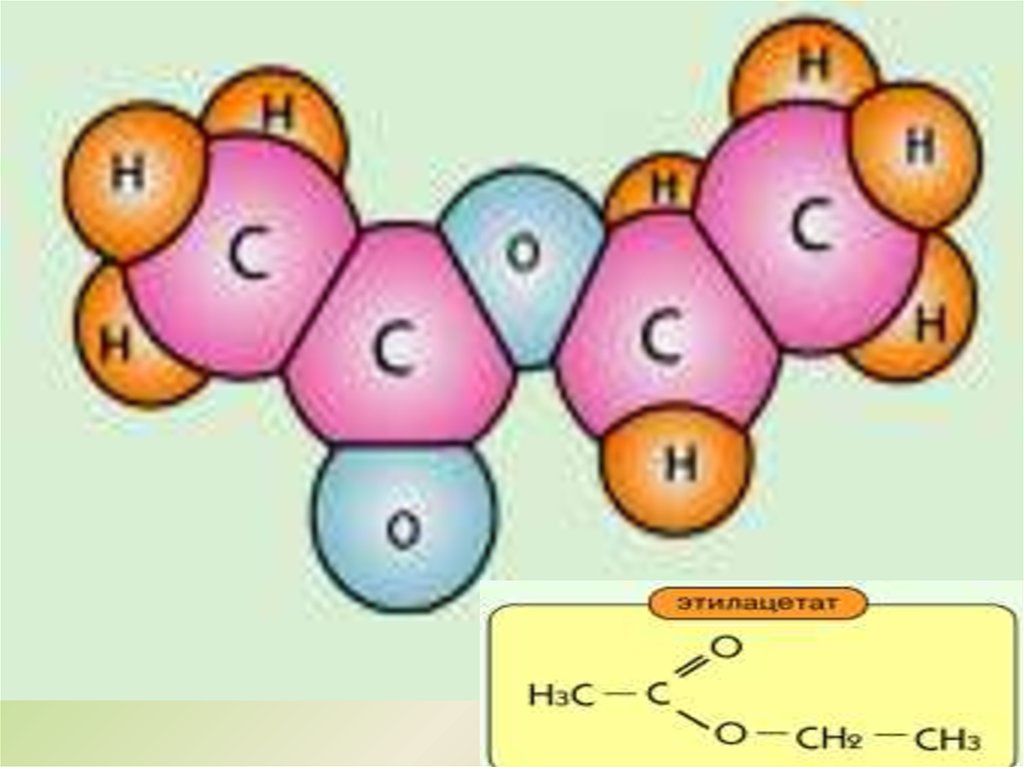
Например: этил-ацетат
2) полное название эфира по радикалу спирта и
названию кислоты.
Например: этиловый эфир уксусной кислоты.
12. Агрегатные состояния
Сложные эфиры имеют следующие физические свойства:• Жидкое (жидкости)
Бесцветные или слабоокрашенные;
Нерастворимые в воде;
Растворимые в органических растворителях (спиртах);
Легче воды;
Имеющие характерные запахи;
Летучие и горючие.
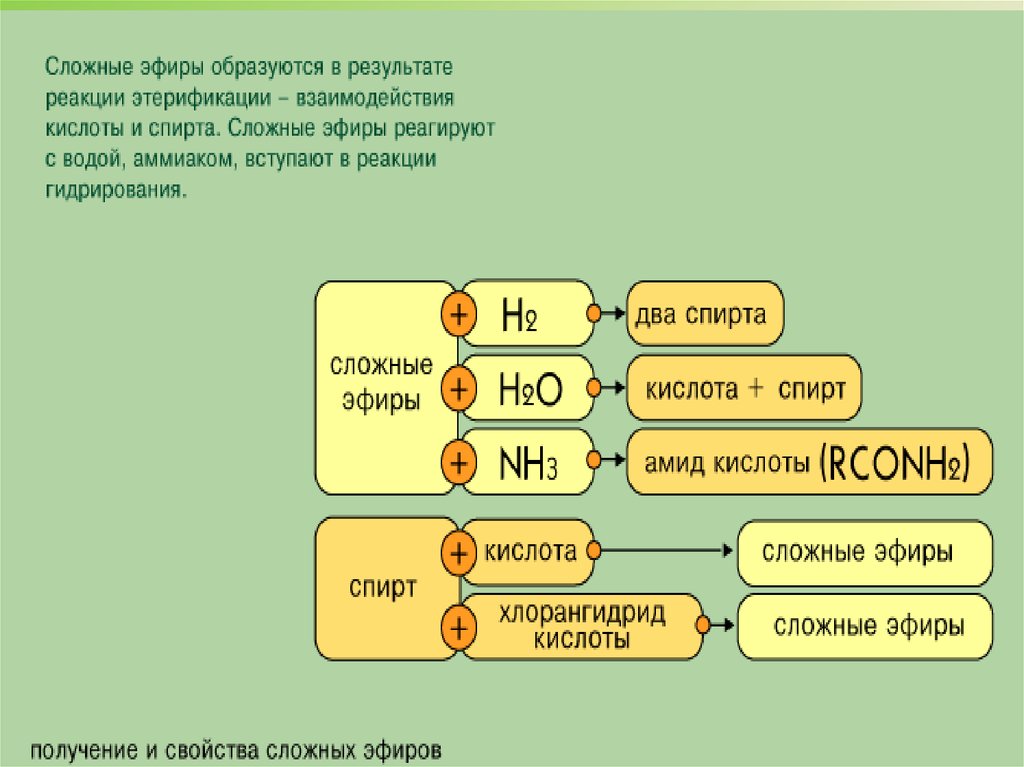
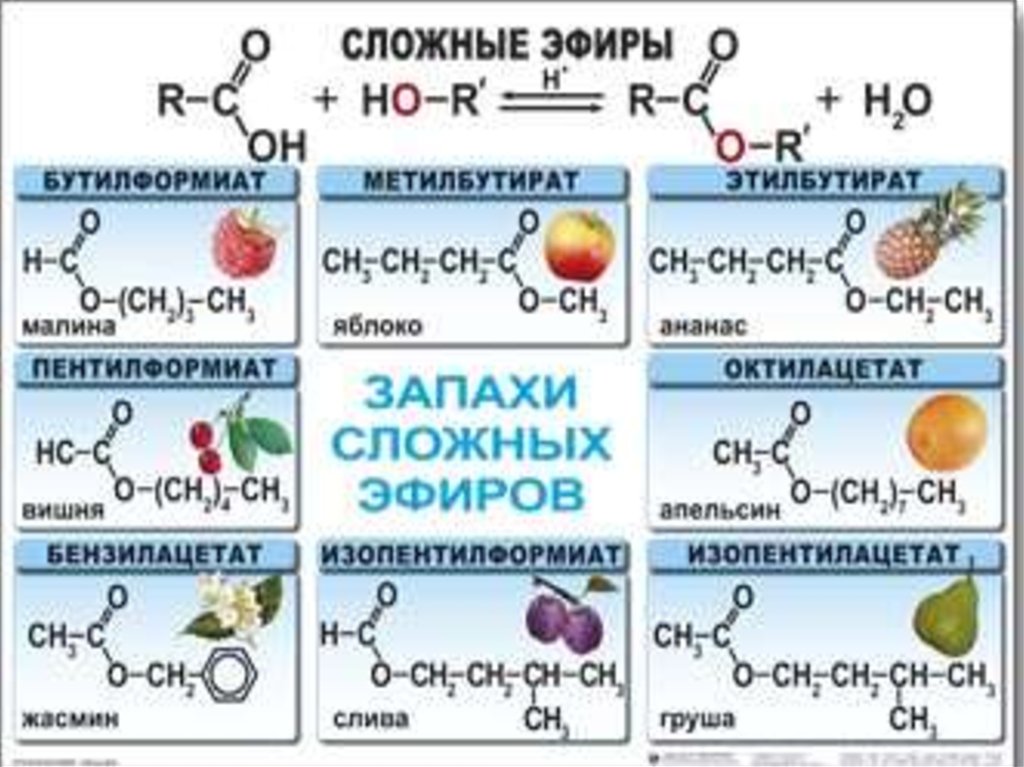
13. Реакции этерификации
Реакция образования сложного эфира из спирта и кислотыэтерификация
гидролиз
Реакция получения этилового эфира муравьиной кислоты
Реакция получения пропилового эфира уксусной кислоты
14.
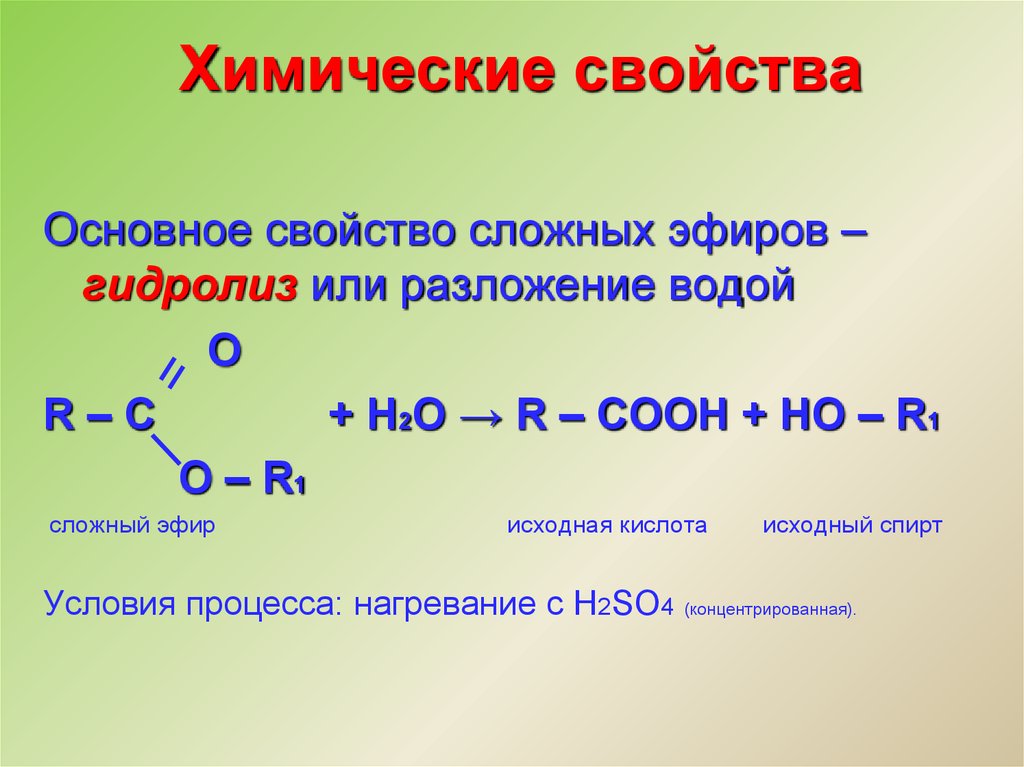
15. Химические свойства
Основное свойство сложных эфиров –гидролиз или разложение водой
O
R–C
+ H2O → R – COOH + HO – R1
O – R1
сложный эфир
исходная кислота
исходный спирт
Условия процесса: нагревание с H2SO4 (концентрированная).
16. Зависимость свойств от строения:
Запах хризантемНССООСН2СН С Н
2
6
5
2 - фенилэтилформиат
17.
ЖАСМИНОВЫЙ ЗАПАХС2 Н 5СОО СН 2С6 Н 5
Бензил-ацетат
18. Зависимость свойств от строения:
Запах вишниO
H–C
O – C5H11
Пентил-формиат
(амил-формиат)
или
Пентиловый
(амиловый) эфир
муравьиной кислоты
19. Зависимость свойств от строения:
Запах абрикосовО
С3Н7 – С
О – С2Н5
Этил-пропионат
или
Этиловый эфир
пропионовой кислоты
20. Зависимость свойств от строения:
Запах грушО
Н 3С – С
О – изо-С5Н11
Изоамилацетат
или
Изоамиловый (пентиловый)
эфир уксусной кислоты
21. Зависимость свойств от строения:
Запах яблокО
Изо-С4Н9 – С
О – С 2Н 5
Этиловый эфир
изовалериановой
кислоты
22.
23. Нахождение в природе
Сложные эфиры входят в состав различныхплодов, ягод, фруктов.
Запах может определять только
один сложный эфир (ананас,
вишня, слива, яблоки и др.)
или сложное сочетание
разных сложных эфиров
«букет» (в землянике аромат
40 разных сложных эфиров).
24. Нахождение в природе
Пчелиный воск –эфирпальмитиновой кислоты и
мирицилового спирта
С15Н31СООС31Н63
25. Применение сложных эфиров
Ароматизаторы применяемые в пищевой промышленностисладости
йогурты
газированные напитки
26. Применение сложных эфиров
В бытовой химии:парфюмерия
растворители, лаки, краски и др.
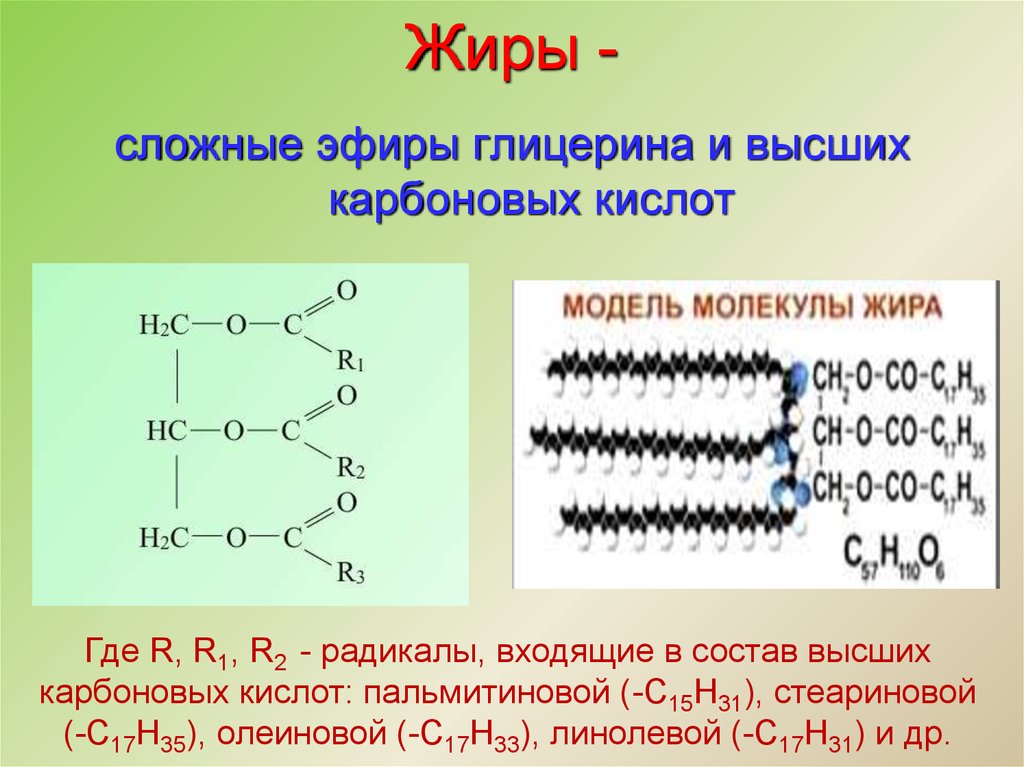
27. Жиры -
Жиры сложные эфиры глицерина и высшихкарбоновых кислот
Где R, R1, R2 - радикалы, входящие в состав высших
карбоновых кислот: пальмитиновой (-С15Н31), стеариновой
(-С17Н35), олеиновой (-С17Н33), линолевой (-С17Н31) и др.
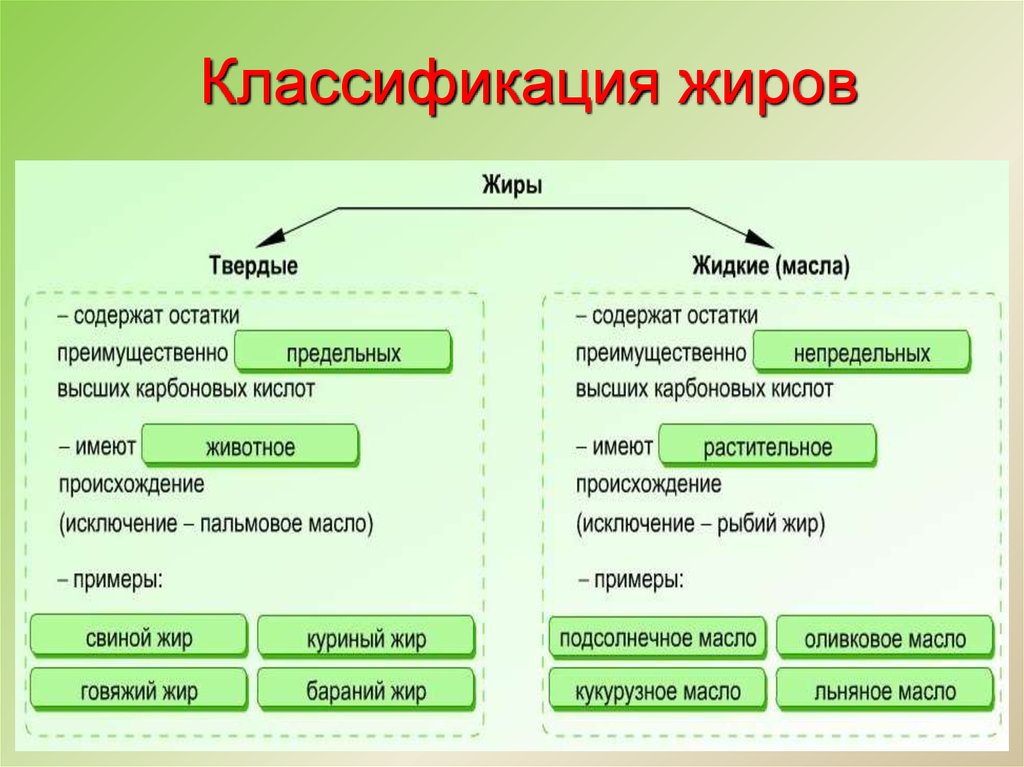
28. Классификация жиров
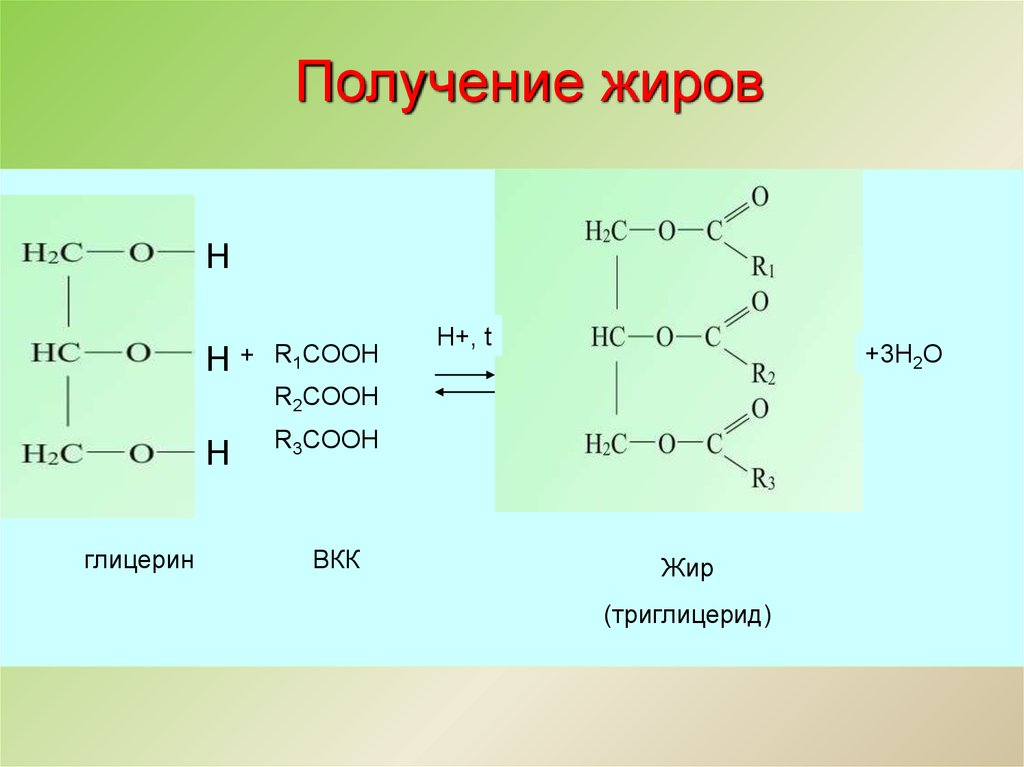
29.
Получение жировН
Н
+ R1COOH
H+, t
+3Н2О
R2COOH
Н
глицерин
R3COOH
ВКК
Жир
(триглицерид)
30. Твердые жиры
31. Жидкие жиры
Оливковое, подсолнечное, льняное масла32. Применение жиров
33.
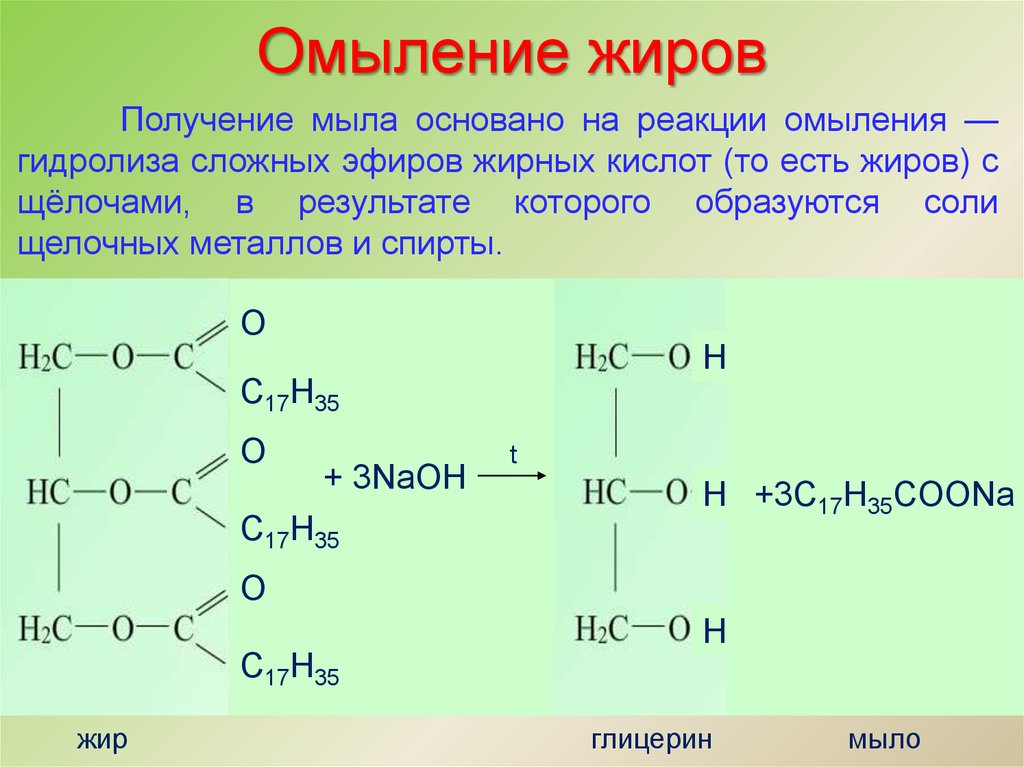
Омыление жировПолучение мыла основано на реакции омыления —
гидролиза сложных эфиров жирных кислот (то есть жиров) с
щёлочами, в результате которого образуются соли
щелочных металлов и спирты.
О
H
С17Н35
О
+ 3NaOH
С17Н35
t
H +3C17H35COONa
О
С17Н35
жир
H
глицерин
мыло
34. Функции жиров
Энергетическая(при полном расщеплении 1г жира до СО2 и
Н 2О освобождается 38,9 кДж энергии);
Структурная
(жиры – важный компонент каждой клетки);
Защитная
(жиры накапливаются в подкожных тканях и
тканях, окружающих внутренние органы).






















 Химия
Химия








