Похожие презентации:
Щелочные металлы и их соединения
1.
2.
Щелочные металлы и ихсоединения
3.
План урока:1) Щелочные металлы и их химические свойства
2) Оксиды щелочных металлов и их химические свойства
3) Щёлочи и их химические свойства
4.
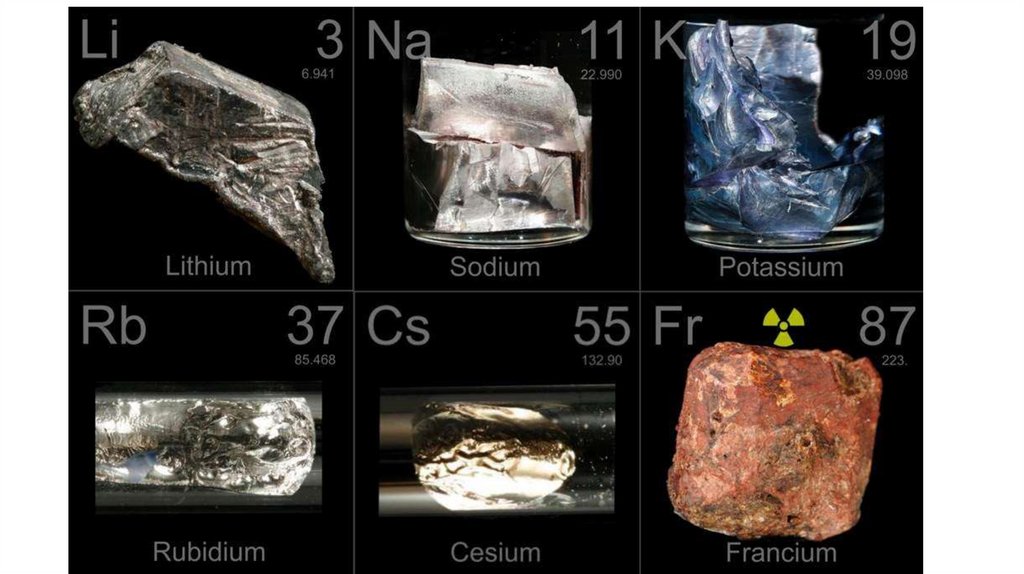
Щелочные металлыГруппа:
Максимальная степень окисления:
Минимальная степень окисления:
Особенность всех металлов: нет отрицательных с.о.!
Li -> Na -> K -> Rb -> Cs -> Fr
А) металлические и восстановительные свойства:
Б) электроотрицательность:
В) Радиус атома:
Г) активность металлов:
5.
Химическая активность щелочных металлов возрастает приувеличении атомной массы, поскольку при этом увеличивается
радиус атома и уменьшается сила притяжения валентного
электрона к ядру.
https://www.youtube.com/watch?v=k2cx_niDHAc&t=246s
6.
Щелочные металлы с простыми веществами4Li + O2 = 2Li2O оксид лития
2Na + O2 = Na2O2 пероксид натрия
K + O2 = KO2 надпероксид калия
Но как же получить оксиды натрия и калия?
Na2O2 + 2Na = 2Na2O
KO2 + … = K2O
7.
Гидриды – это соединения щелочных и щелочноземельныхметаллов с водородом (не путать с ЛВС).
2Na + H2 = 2NaH
K + H2 =
Гидриды разлагаются водой: 2NaH + H2O = 2NaOH + H2
8.
Щелочные металлы с водойЩ.Ме + вода = щёлочь + водород
2Li + 2H2O = 2LiOH + H2
Rb + H2O =
9.
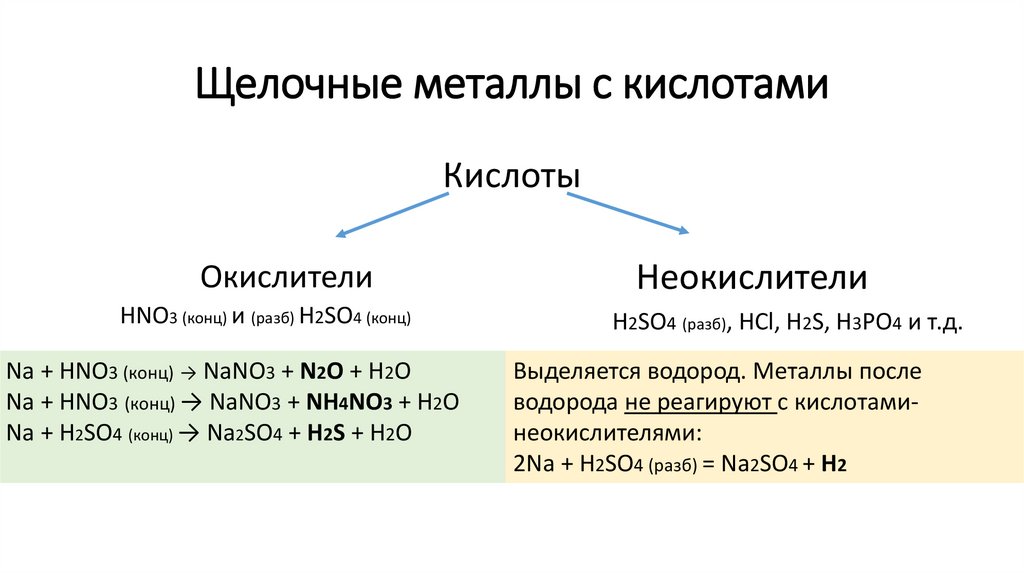
Щелочные металлы с кислотамиКислоты
Окислители
HNO3 (конц) и (разб) H2SO4 (конц)
Na + HNO3 (конц) → NaNO3 + N2O + H2O
Na + HNO3 (конц) → NaNO3 + NH4NO3 + H2O
Na + H2SO4 (конц) → Na2SO4 + H2S + H2O
Неокислители
H2SO4 (разб), HCl, H2S, H3PO4 и т.д.
Выделяется водород. Металлы после
водорода не реагируют с кислотаминеокислителями:
2Na + H2SO4 (разб) = Na2SO4 + H2
10.
Оксиды щелочных металлов1. Основный оксид + вода = щёлочь
(растворимое/малорастворимое основание)
2. Основный оксид + кислотный оксид = соль
3. Основный оксид + амфотерный оксид = двойная соль
4. Основный оксид + кислота = соль + вода
11.
Щёлочи (растворимые/малорастворимыеоснования)
1) Основание + кислота = соль + вода
2) Основание + кислотный оксид = соль + вода
3) Основание + амфотерный оксид = двойная соль + вода
4) Основание 1 + соль 1 = основание 2 + соль 2
Условия: основание 1 и соль 1 – растворимые. Основание 2 или
соль 2 выпадают в осадок.
12.
ПрактикаРешите цепочку превращений:
Na→ Na2O2 → N2O → Na2SO4 → Cu(OH)2
13.
Закончите уравнения реакций. Какиереакции не пойдут? Объясните выбор.
1) Na2O + H2O =
2) MgO + H2O =
3) BaCl2 + NaOH =
4) FeCl2 + NaOH =
14.
Получите нерастворимое основаниеMg(OH)2 из соли хлорида магния.
15.
Домашнее задание1) Решите цепочку превращений: Na→ Na2O2 → Х → NaCl → Fe(OH)3
2) Закончите реакции. Какие из этих реакций невозможны и
почему: а) Li2O + H2O=…; б) ZnO + H2O = …; в) KOH + ZnCl2 =…; г) KOH
+ LiCl =…; д) Li + H2 =… ; е) Cu + H2 =…; ж) KO2 + K = … з) KH + H2O =…
3) Получите нерастворимое основание гидроксид железа (II) из
соли бромида железа (II)













 Химия
Химия








