Похожие презентации:
Типы химических реакций
1. Типы химических реакций
Вострецов Олег ИгоревичУчитель химии
30.10.12
2.
Химическая реакция — превращение
одного или нескольких исходных
веществ в отличающиеся от них по
химическому составу или строению
вещества (продукты реакции).
CaO+H2O=Ca(OH)2
4HNO3=2H2O+4NO2+O2
CuSO4+Fe=FeSO4+Cu
AgNO3+KBr=AgBr +КNO3
SO2+O2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Что объединяет все эти реакции?
В чём их отличие?
Как мы можем назвать процесс, который
протекает?
SO3
3.
Химическиереакции происходят:
при смешении или
физическом контакте
реагентов самопроизвольно
при нагревании
при участии катализаторов
действии света
электрического тока
механического воздействия
и т. п.
4.
• Все реакции сопровождаются тепловыми эффектами.• При разрыве химических связей в реагентах
выделяется энергия, которая, в основном, идет на
образование новых химических связей.
5.
• Реакции, протекающие свыделением теплоты и света
называются РЕАКЦИЯМИ ГОРЕНИЯ
• Реакции, протекающие с
выделением теплоты,
называются –
ЭКЗОТЕРМИЧЕСКИМИ (+Q)
(от греч. «экзо» – наружу)
4Al+3O2=2Al2O3+Q
• Протекающие с поглощением
теплоты –
ЭНДОТЕРМИЧЕСКИМИ (-Q)
(от греч. «эндо» – внутрь)
N2+O2 2NO-Q
6.
Какие условия должны выполняться, чтобыпроизошла химическая реакция?
1. Необходимо, чтобы реагирующие вещества
соприкоснулись и
чем больше площадь их
соприкосновения, тем быстрее произойдет
химическая реакция.
2. Некоторые реакции идут без нагревания, и только
для некоторых реакций оно необходимо.
3. Некоторые реакции протекают под действием
электрического тока и света.
7.
• Реакция разложения одного сложноговещества с образованием нескольких
новых
веществ, называется реакцией
разложения.
• Например:
• 2KMnO4 K2MnO4+ MnO2 + O2
•=
•+
8.
Подавляющее большинство реакцийразложения эндотермичны и требуют
для своего проведения повышенной
температуры. Например:
2 HgO – 2 Hg + O2
CaCO3 – CaO + CO2
Cu(OH)2 – CuO + H2O
2
3
Al(OH)3 – Al2O3 + H2O
9.
1)2)
3)
4)
5)
6)
7)
8)
Выберите уравнения реакций
разложения:
CaO + CO2 = CaCO3
CO2 + 2NaOH = Na2CO3 + H2O
Fe + S = FeS
2H2O = 2H2 + O2↑
CuO + H2 = Cu + H2O
Zn + 2HCl = ZnCl2 + H2↑
ZnO + H2SO4 = ZnSO4 + H2O
Cu(OH)2 = CuO + H2O
10.
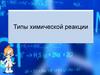
Реакции соединения – химические реакции, вкоторых из двух или нескольких менее сложных
по элементному составу веществ получается
более сложное вещество
Например:
NH3 + CO2 + H2O = NH4HCO3
Подавляющее большинство реакций соединения
экзотермичны.
•+
•=
11.
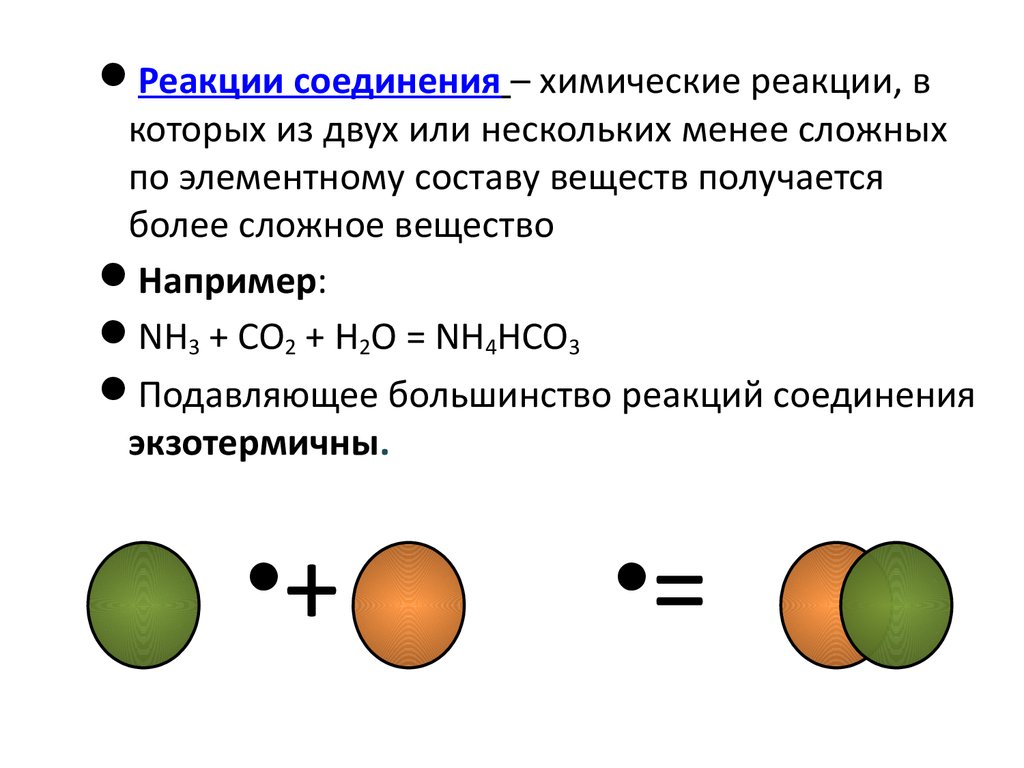
Fe + S - FeS2 Zn + O2 - 2 ZnO
4 Fe +3 O2 - 2 Fe2O3
CaO + H2O - Ca(OH)2
12.
Выберите уравнения реакцийсоединения:
1) 2HgO = 2Hg + O2
2) CaCO3 = CaO + CO2
3) CuSO4 + Fe = Cu + FeSO4
4) CuO + H2 = Cu + H2O
5) 2H2 + O2 = 2H2O
6) H2SO4 + 2KOH = K2SO4 + 2H2O
7) BaO + SO2 = BaSO3
13.
Реакция, протекающая между простыми исложными веществами, при которой
атомы простого вещества замещают атомы
одного из элементов в сложном
веществе, называется реакцией замещения.
Zn + 2HCl = ZnCl2 + H2
2Fe +3H2O = Fe2O3 +3H2
•+
•=
•+
14.
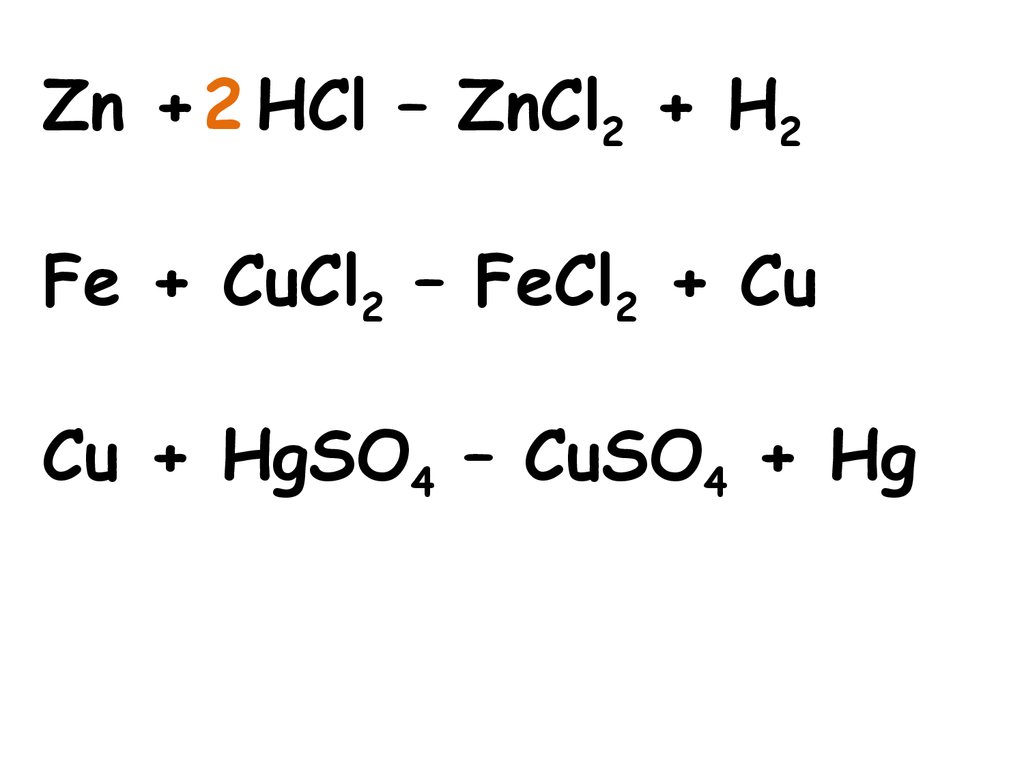
Zn + 2 HCl – ZnCl2 + H2Fe + CuCl2 – FeCl2 + Cu
Cu + HgSO4 – CuSO4 + Hg
15.
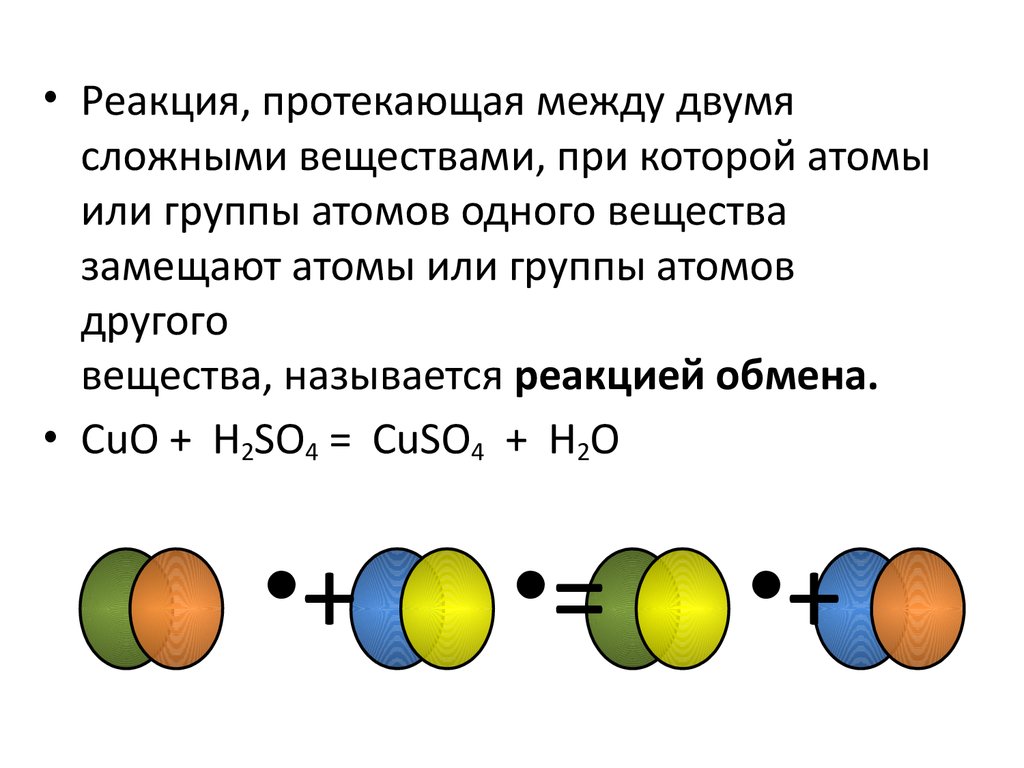
• Реакция, протекающая между двумясложными веществами, при которой атомы
или группы атомов одного вещества
замещают атомы или группы атомов
другого
вещества, называется реакцией обмена.
• CuO + H2SO4 = CuSO4 + H2O
•+
•=
•+
16.
CuO +2 HCl – CuCl2 + H2OMgO + H2SO4 – MgSO4 + H2O
AgNO3 + HCl – AgCl + HNO3
17.
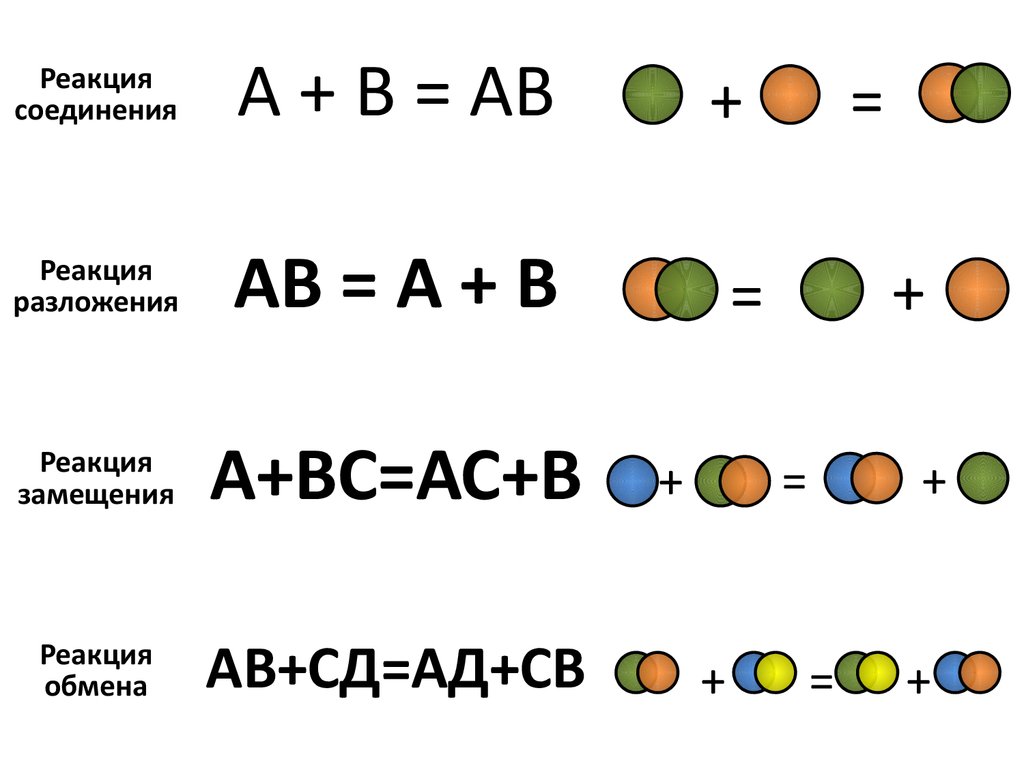
Реакциясоединения
А + В = АВ
Реакция
разложения
АВ = А + В
Реакция
замещения
А+ВС=АС+В
Реакция
обмена
АВ+СД=АД+СВ
+
=
+
=
=
+
+
+
=
+
18. Домашнее задание
• Учебник с. 40-41, выполнить упражнения 56 (с. 47).• Повторить учебный материал о химической
формуле (параграф 10).
• Творческое задание из тетради.
19.
Домашнее задание:Оформить на альбомном листе работу,
где необходимо привести примеры
разных типов реакций и нарисовать
рисунки, иллюстрирующие эти типы.
Примеры таких работ приведены на
следующих слайдах.









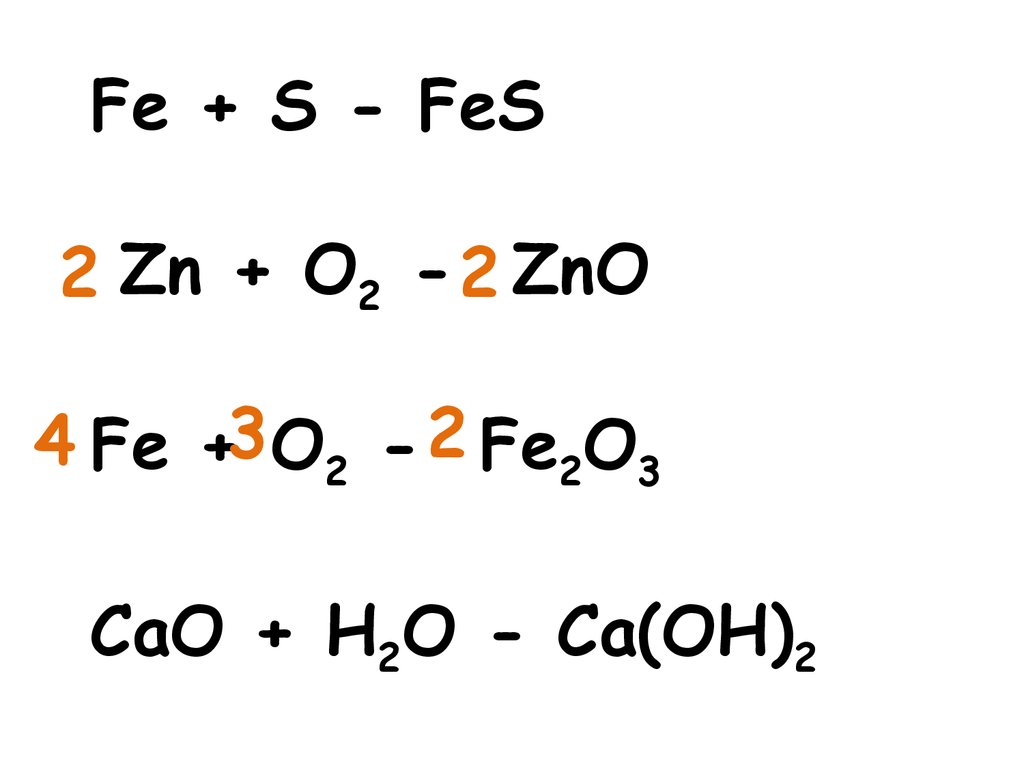








 Химия
Химия