Похожие презентации:
Теория электролитической диссоциации
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
1.11.
12.
13.
2.14.
15.
16.
3.17.
18.
19.
20.
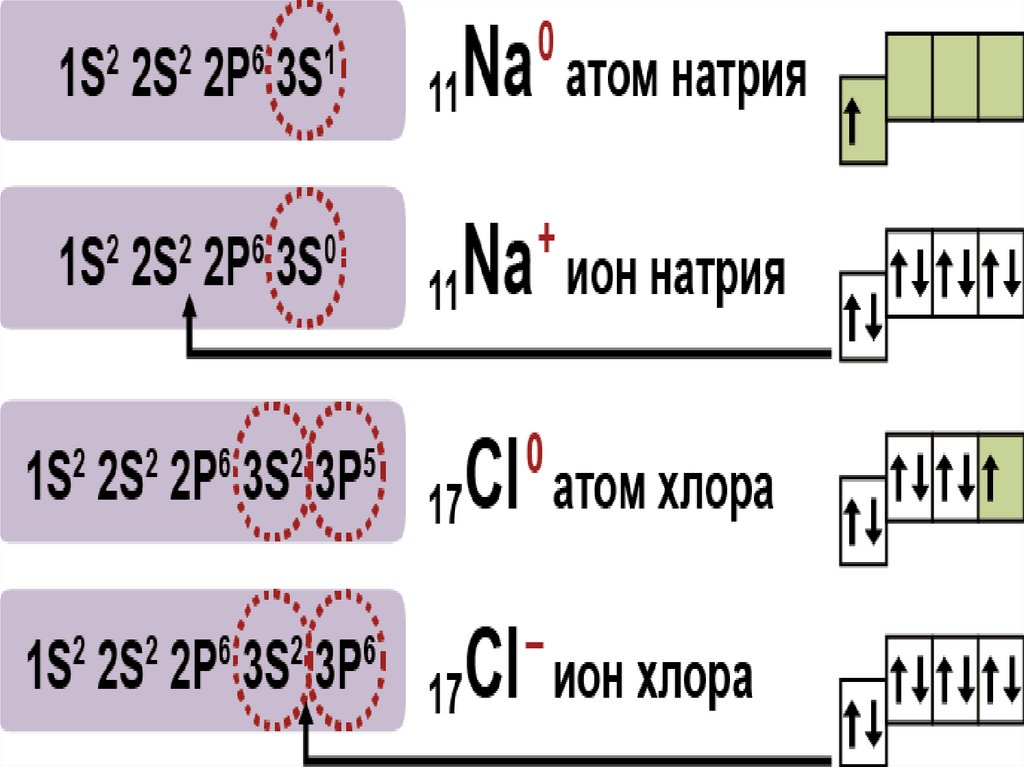
21. Сильные и слабые электролиты
αnν дисс
nν общ
Зависит
от:
-природы
электролита
- от t °
- от с
Слабые
< 3%
H2S H2SiO3
H2CO3
дисс
общ
Средней силы
3%< <30%
H3PO4 HF HNO2 H2SO3
Сильные >30%
1.Растворимые соли
2.Щелочи: LiOH NaOH KOH RbOH
CsOH FrOH Ca(OH)2 Sr(OH)2 Ba(OH)2
3.Кислоты HCl, HBr, HI HNO3
HClO4 H2SO4 HMnO4 HClO H CrO
3
2
4
22.
23.
Условия, влияющие на ЭДКонцентрация электролита
Температура
СH3COOН <=> СH3COO- + Н+
Природа электролита
24.
25.
26. Проверь свои знания
1. Ионы2. Катионы
3. Анионы
4. Электролиты
5. Неэлектролиты
6. Сильные
электролиты
7. Слабые
электролиты
8.Электролитичес-
кая диссоциация
1. Заряженные частицы
2. Положительно заряженные ионы
3. Отрицательно заряженные ионы
4. Вещества, растворы и расплавы
которых проводят электрический ток
5. Вещества растворы и расплавы
которых не проводят электрический ток
6. Электролиты, в растворах которых
все молекулы распались на ионы
7. Вещества частично
диссоциирующие на ионы
8. Процесс распада электролитов на
ионы при растворении в воде или
расплавлении
27.
28.
29.
30. Условия протекания реакций ионного обмена
31.
32.
33.
34. Практическое задание: через написания уравнений возможных реакций выяснить условия протекания реакций ионного обмена
35.
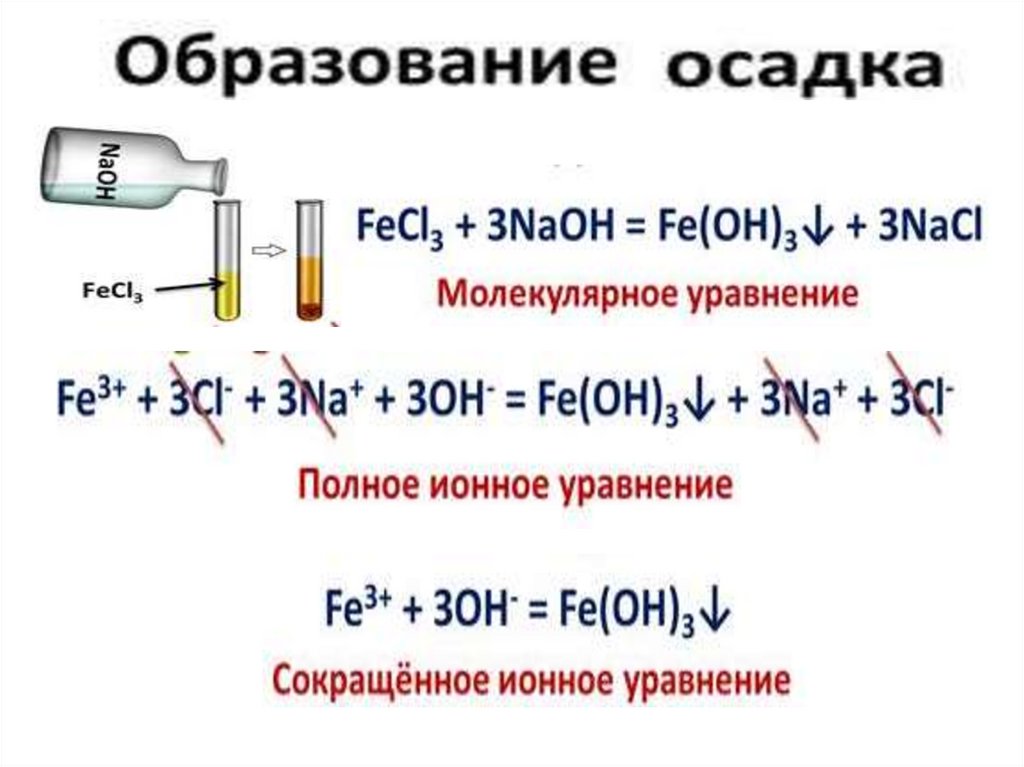
1. Реакции ионного обмена,протекающие с
образованием осадка.
H 2 SO4 AgNO 3 CuSO 4
BaCI 2
NaOH NaI
36. 2. Реакции ионного обмена, протекающие с образованием воды.
HClHNO3
NaOH
H2SO4
37. 3. Реакции ионного обмена, протекающие с образованием газа.
СаСО3К2СО3
НСl
38.
CO2Na3PO4 С какими из указанных H 2SO4
веществ будут
реагировать:
H 2S
Fe(OH)2
ΝaΟΗ
HCI
Cu(NO 3 ) 2
Na 2O
NaOH
CaSO4
39.
• 2NaOH + H2SO4 = Na2SO4 + 2H2O• 2NaOH + H2S = Na2S + 2H2O
• Na3PO4 +3HCl = 3NaCl + H3PO4
• NaOH + HCl = NaCl + H2O
• Na2O + 2HCl = 2NaCl + H2O
• 2Na3PO4 +3 Cu(NO3)2 =6 NaNO3 + Cu3(PO4)2↓
• Fe(OH)2↓ + 2HCl = FeCl2 + 2H2O
• 2NaOH + CO2 = Na2CO3 + H2O






































 Химия
Химия








