Похожие презентации:
Cтроение атомов химических элементов и электронных оболочек
1.
2. Cтроение атомов химических элементов и электронных оболочек
М.В. Ломоносов• Вещества состоят из молекул, а
молекулы из атомов.
• Молекула – мельчайшая частица
вещества, сохраняющая состав и
свойства
данного
вещества,
физически неделимая.
• Атом - мельчайшая частица вещества,
химически неделимая.
• При
физических явлениях состав
веществ
не
изменяется,
при
химических явлениях- изменяется, из
одних веществ получаются другие.
• Химические реакции заключаются в
образовании новых веществ из тех же
самых атомов, из которых состоят
первоначальные вещества.
3. Основные положения атомно-молекулярного учения 1741 год
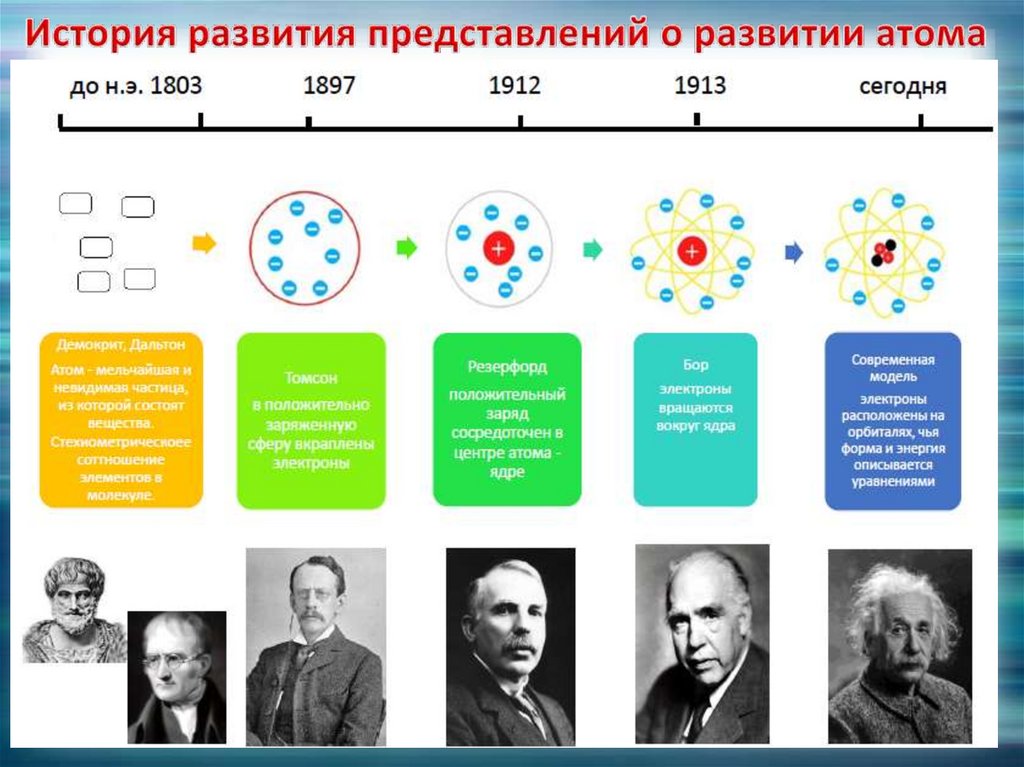
4. История развития представлений о развитии атома
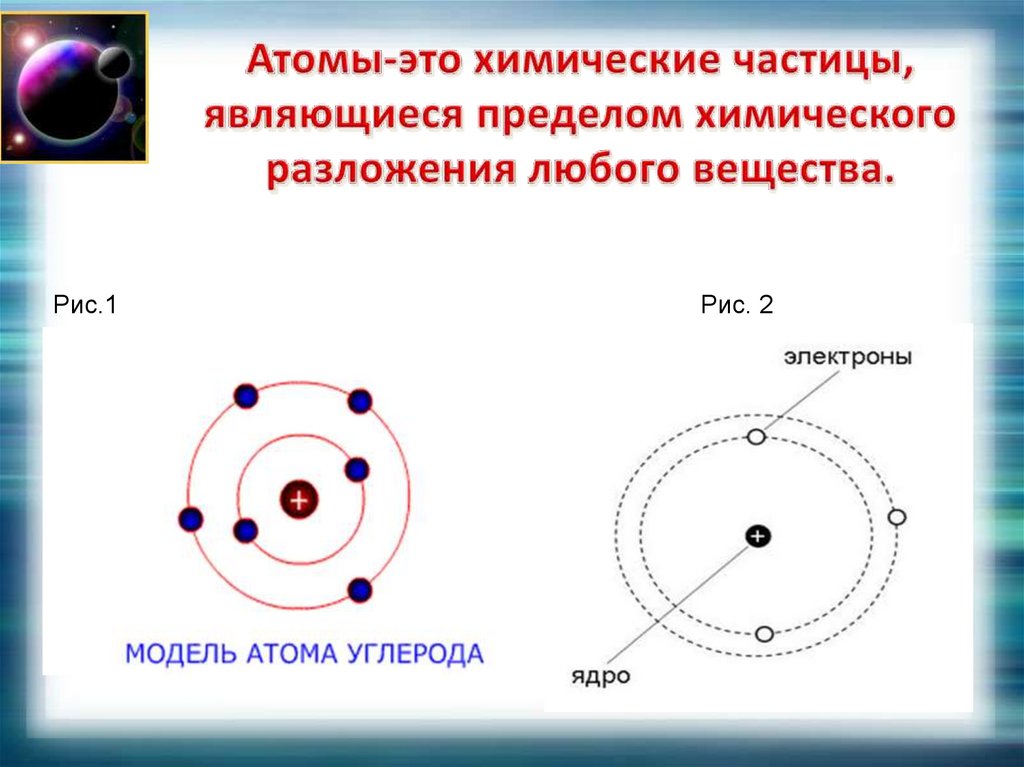
Рис.1Рис. 2
5. Атомы-это химические частицы, являющиеся пределом химического разложения любого вещества.
6.
7.
Атом – это микрочастица, которая имеет форму шара.Атом – сложная система, состоящая из ядра и
электронов.
Ядро находится в центре атома и имеет очень
маленький размер, но почти вся масса атома
сосредоточена в ядре.
Ядро имеет положительный заряд, величина которого
определяется числом протонов в нем.
Электроны движутся вокруг ядра, имеют ничтожно
малую массу и размеры, обладают отрицательным
зарядом.
Атом – нейтральная частица, поэтому число протонов и
электронов в атоме одинаково.
Порядковый номер элемента показывает: положение
элемента в периодической системе, количество
протонов и электронов.
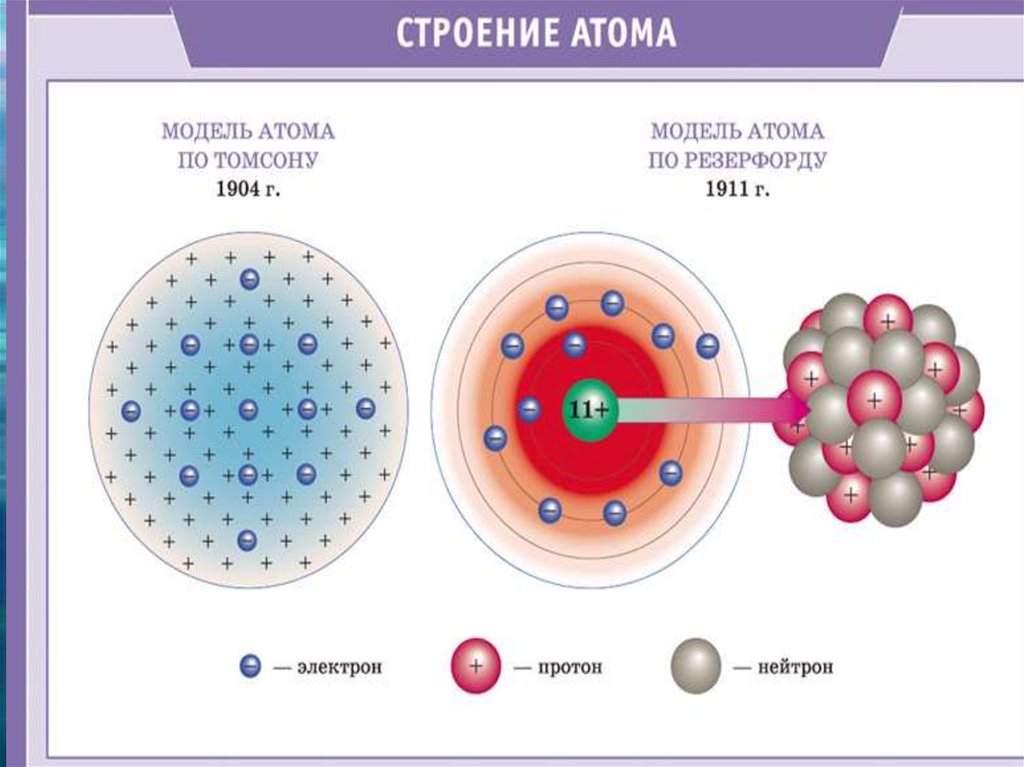
8. Планетарная модель атома
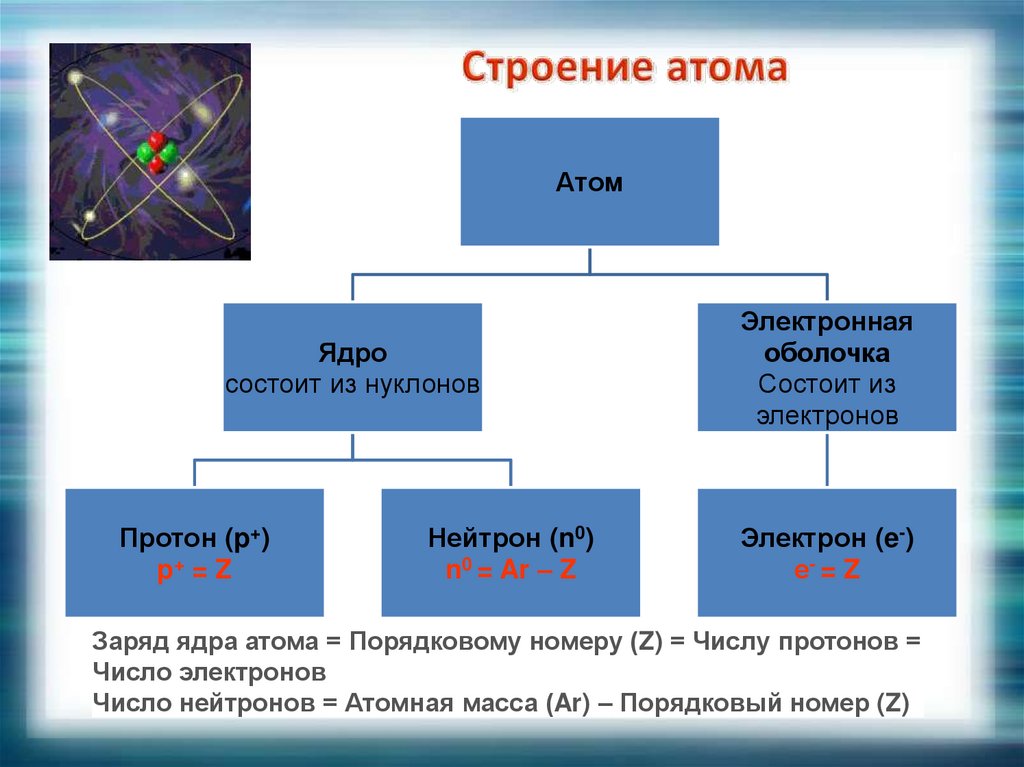
АтомЯдро
состоит из нуклонов
Протон (p+)
p+ = Z
Нейтрон (n0)
n0 = Ar – Z
Электронная
оболочка
Состоит из
электронов
Электрон (e-)
е- = Z
Заряд ядра атома = Порядковому номеру (Z) = Числу протонов =
Число электронов
Число нейтронов = Атомная масса (Ar) – Порядковый номер (Z)
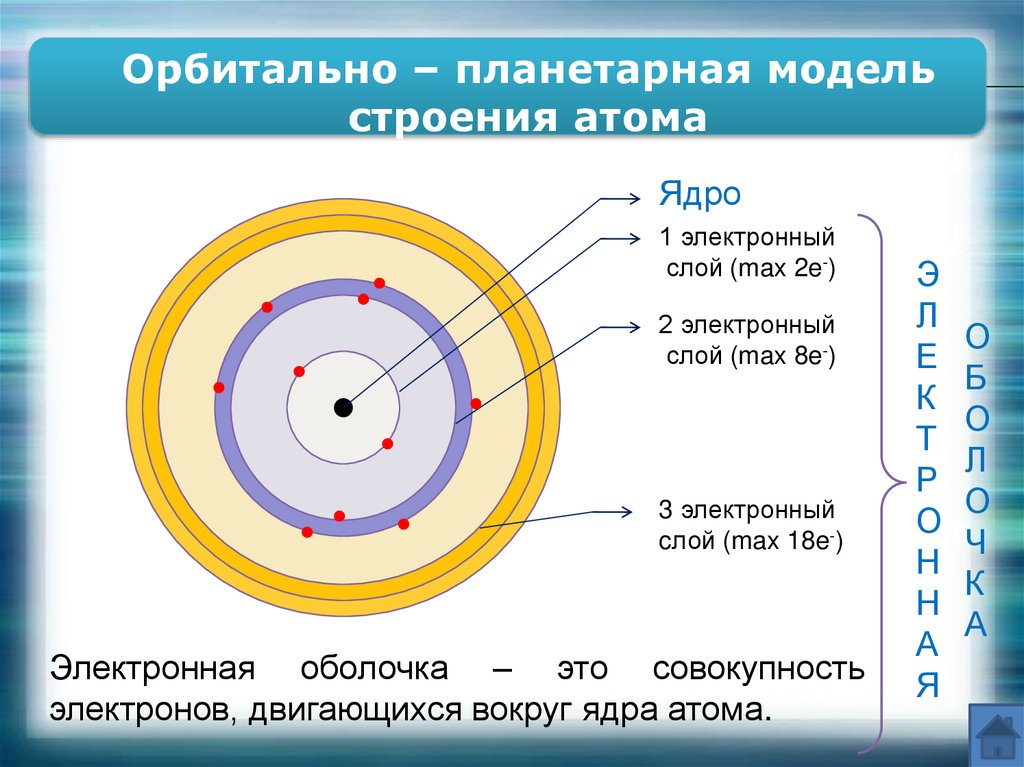
9. Строение атома
Орбитально – планетарная модельстроения атома
Ядро
1 электронный
слой (max 2e-)
2 электронный
слой (max 8e-)
3 электронный
cлой (max 18e-)
Электронная оболочка – это совокупность
электронов, двигающихся вокруг ядра атома.
Э
Л
О
Е
Б
К
О
Т
Л
Р
О
О
Ч
Н
К
Н
А
А
Я
10.
Порядок заполнения электронами орбиталейатома определяется тремя законами природы:
1. Принцип наименьшей энергии - электроны
заполняют орбитали в порядке возрастания энергии
орбиталей.
2. Принцип Паули - на одной орбитали не может
быть больше двух электронов.
3. Правило Хунда - в пределах подуровня
электроны сначала заполняют свободные орбитали
(по одному), и лишь после этого образуют
электронные пары.
11.
Строение электронных оболочек атомовЭлектроны
в(N)совпадает
электронной
оболочке
Номер
n
Число
Номер
– главное
электронов
группы
периода
квантовое
совпадает
число
на
уровне
с –числом
определяет
рассчитывается
с электронов
числом
число
располагаются
на
энергетических
уровнях.
энергетических
энергетических
по
на
формуле.
последнем энергетическом
уровней
уровней
элемента.
.
уровне.
N = 2n2
Период
3
3
Группа
n = 1, N = 2 . 12 = 22
V
5
n = 2, N = 2 . 22 = 88
15
Общее число электронов
е=
Р
30,9748
Фосфор
Проверка
15
12.
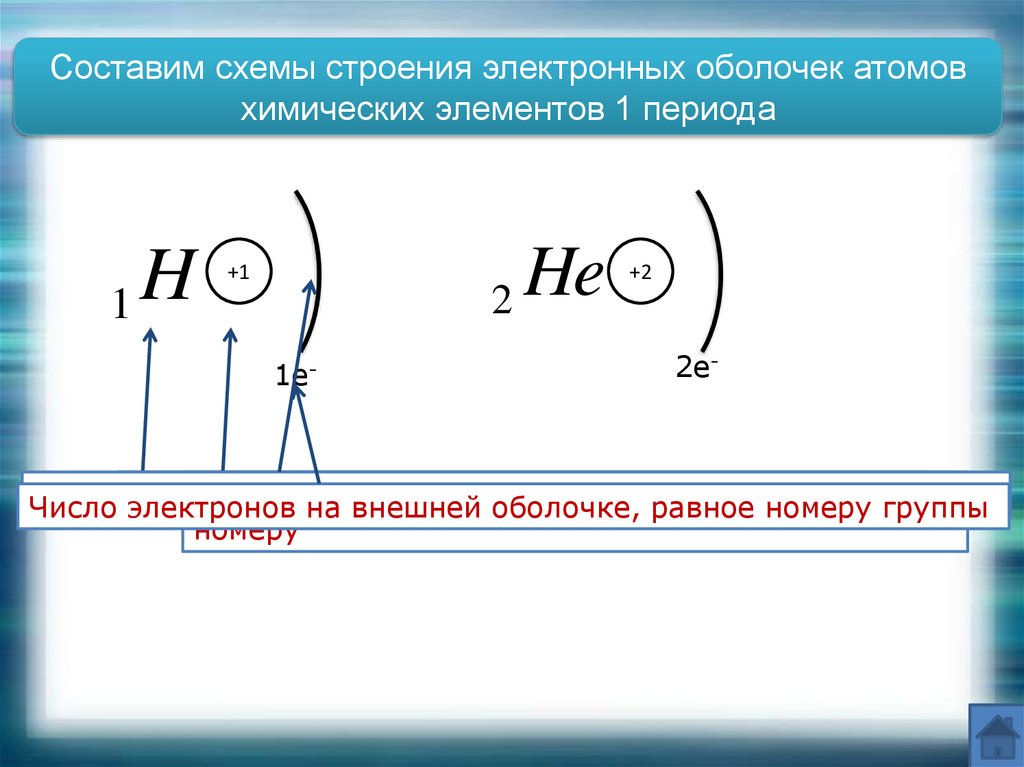
Составим схемы строения электронных оболочек атомовхимических элементов 1 периода
H
1
2 He
+1
1e-
+2
2e-
Электронная
Химический
Заряд
оболочка
ядра
знак
атома
(число
водорода
водорода,
оболочек
и его равный
порядковый
равно
номеру
порядковому
номер
периода)
Число
электронов
на
внешней
оболочке,
равное
номеру
группы
номеру
13.
Составим схемы строения электронных оболочек атомовхимических элементов 2 периода
4 Be
+3
3 Li
2e- 2e-
2e- 1e-
7N
+6
C
6
2e- 4e-
9F
5B
+4
2e- 7e-
2e- 3e-
8O
+7
2e- 5e-
10 Ne
+9
+5
+8
2e- 6e-
+10
2e- 8eАтом неона имеет завершенную
электронную оболочку
14.
Составим схемы строения электронных оболочек атомовхимических элементов 3 периода
11 Na
12 Mg
+11
2e- 8e- 1e-
14 Si
2e- 8e- 4e-
17 Cl
+13
2e- 8e- 3e-
2e- 8e- 2e-
15 P
+14
13 Al
+12
+15
16 S
+16
2e- 8e- 5e-
+17
2e- 8e- 7e-
18 Ar
2e- 8e- 6e+18
2e- 8e- 8e-
15.
Строение электронной оболочки атомаАтомная орбиталь - состояние электрона в атоме.
Каждой орбитали соответствует электронное
облако.
Орбитали
реальных
атомов
в
основном
(невозбужденном) состоянии бывают четырех
типов: s, p, d и f.
Электронное облако - часть пространства, в
которой
электрон
можно
обнаружить
с
вероятностью 90 (или более) процентов.
16.
1. s-орбитали заполняются в первуюочередь. Затем заполняются р-орбитали
2. На каждой орбитали (клеточке) может
находиться не более 2 электронов.
3. Электрон обозначается стрелочками
или
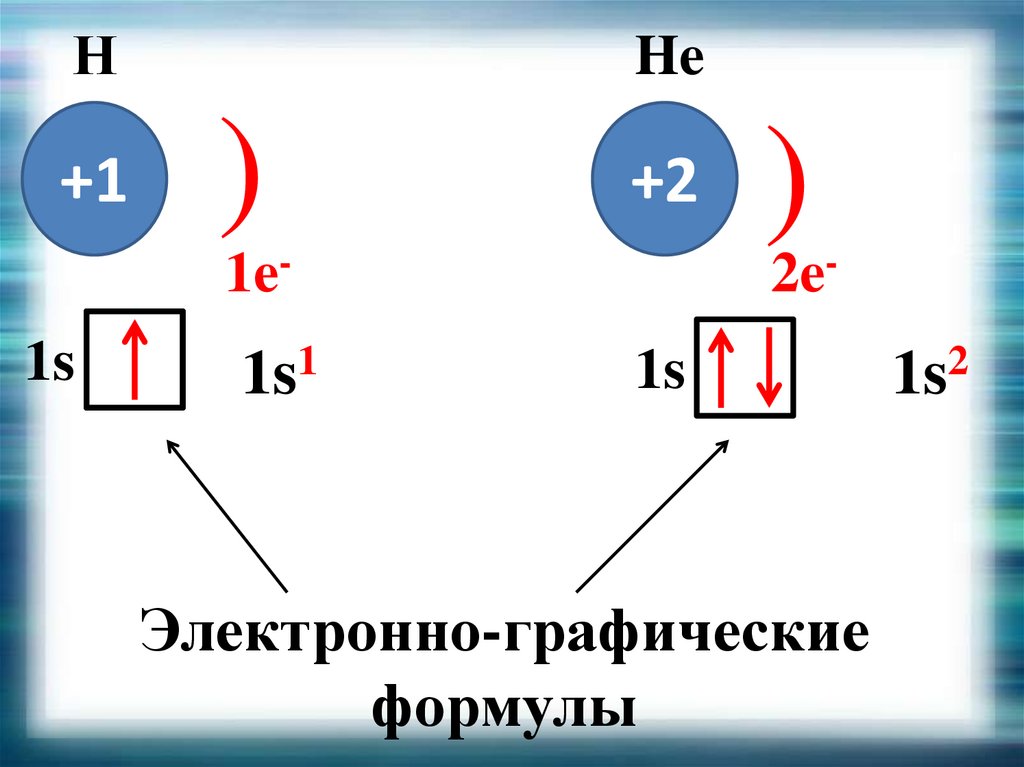
17.
Н+1
He
)
+2
1e1s
1
1s
)
2e-
1s
Электронно-графические
формулы
2
1s
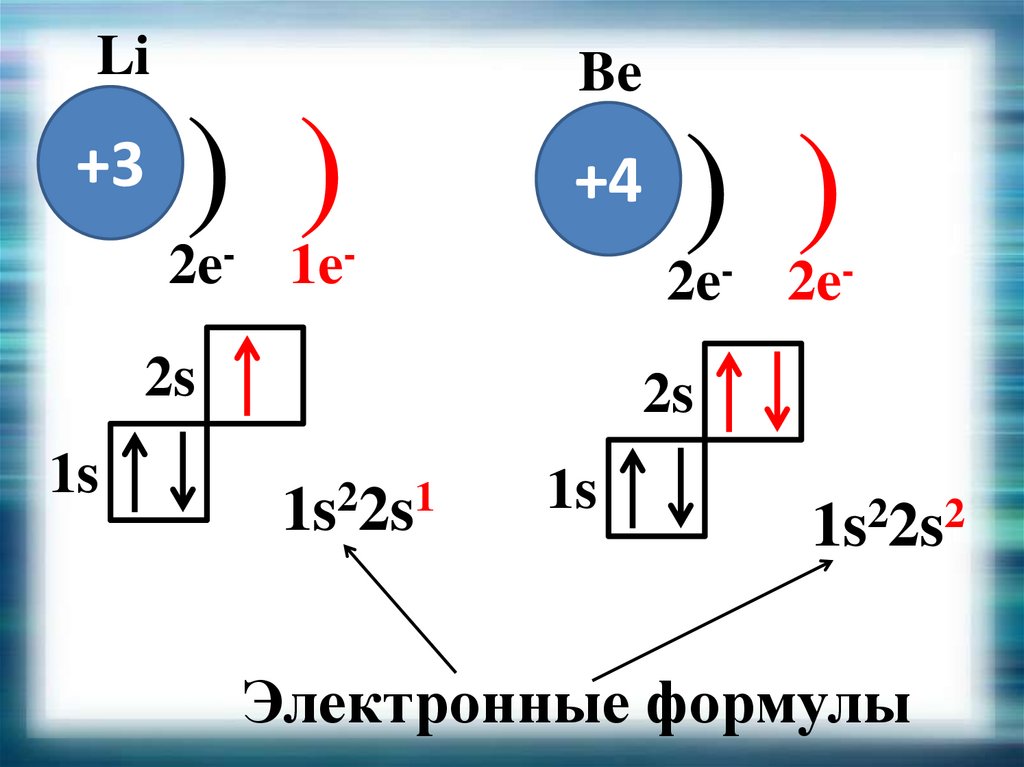
18. Распределение электронов по орбиталям
Li+3
1s
Be
) )
+4
) )
2e- 1e-
2e- 2e-
2s
2s
2
1
1s 2s
1s
1s22s2
Электронные формулы
19.
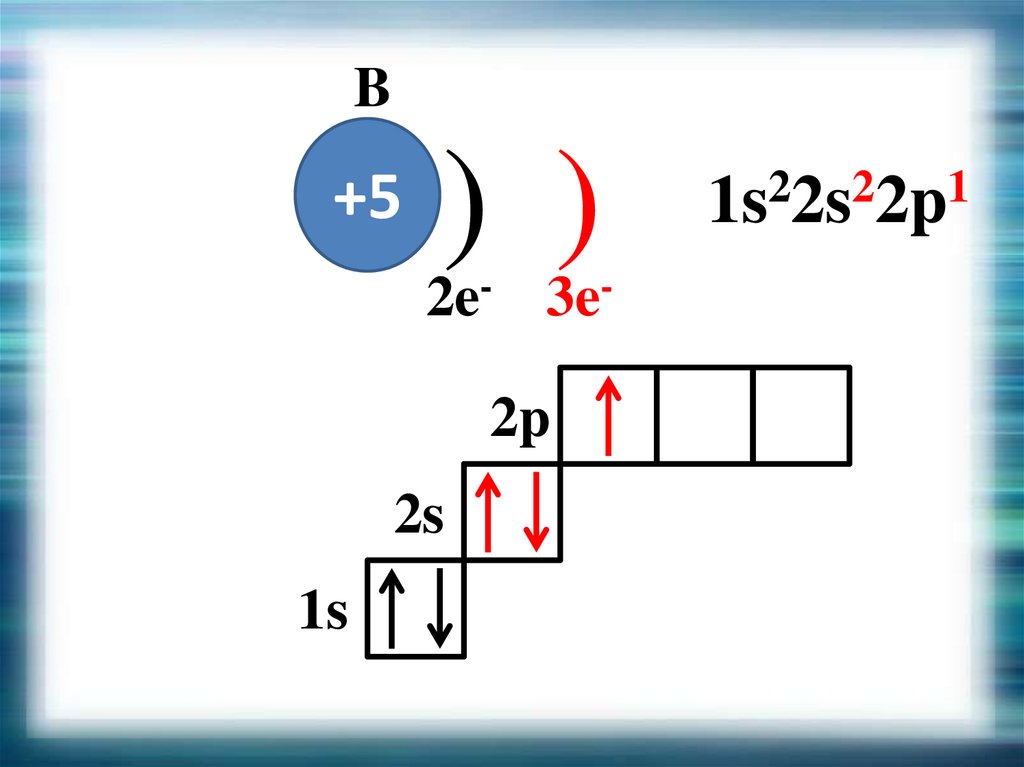
B+5
) )
2e- 3e2p
2s
1s
2
2
1
1s 2s 2p
20.
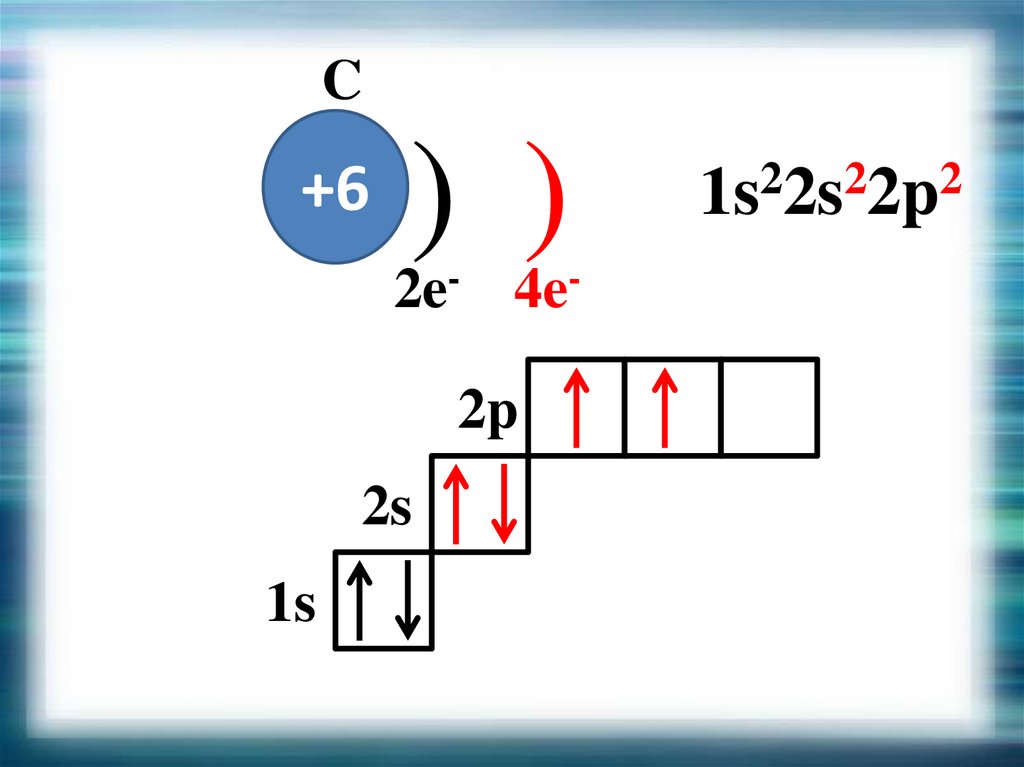
C+6
) )
2e- 4e2p
2s
1s
1s22s22p2
21.
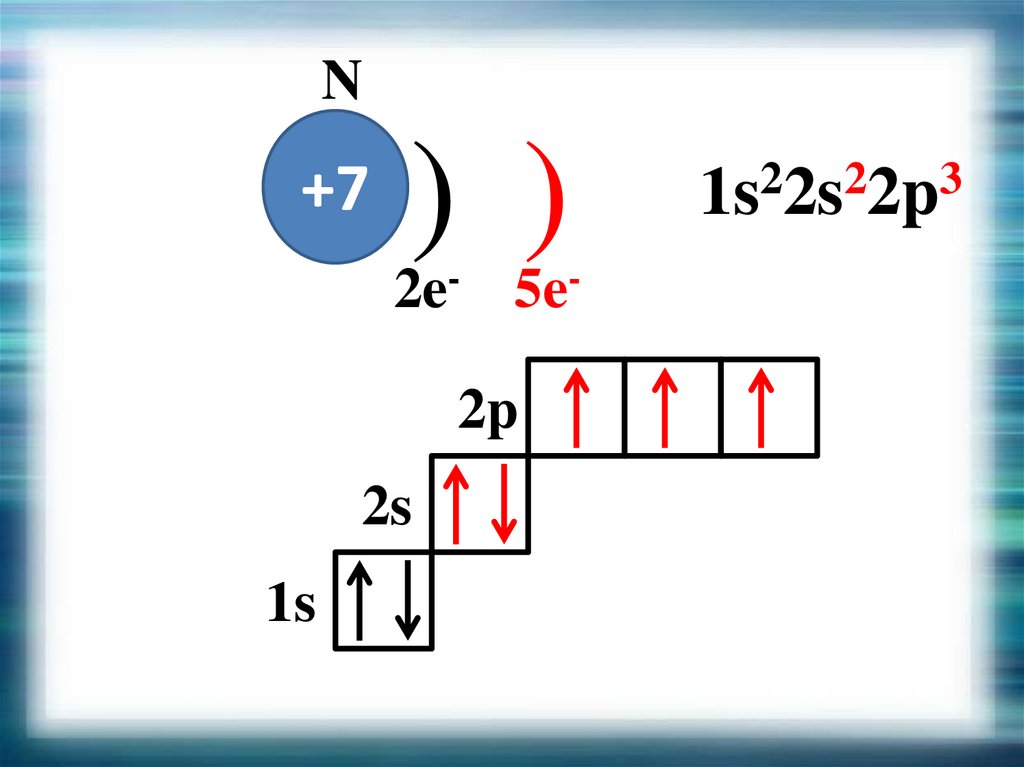
N+7
) )
2e- 5e2p
2s
1s
1s22s22p3
22.
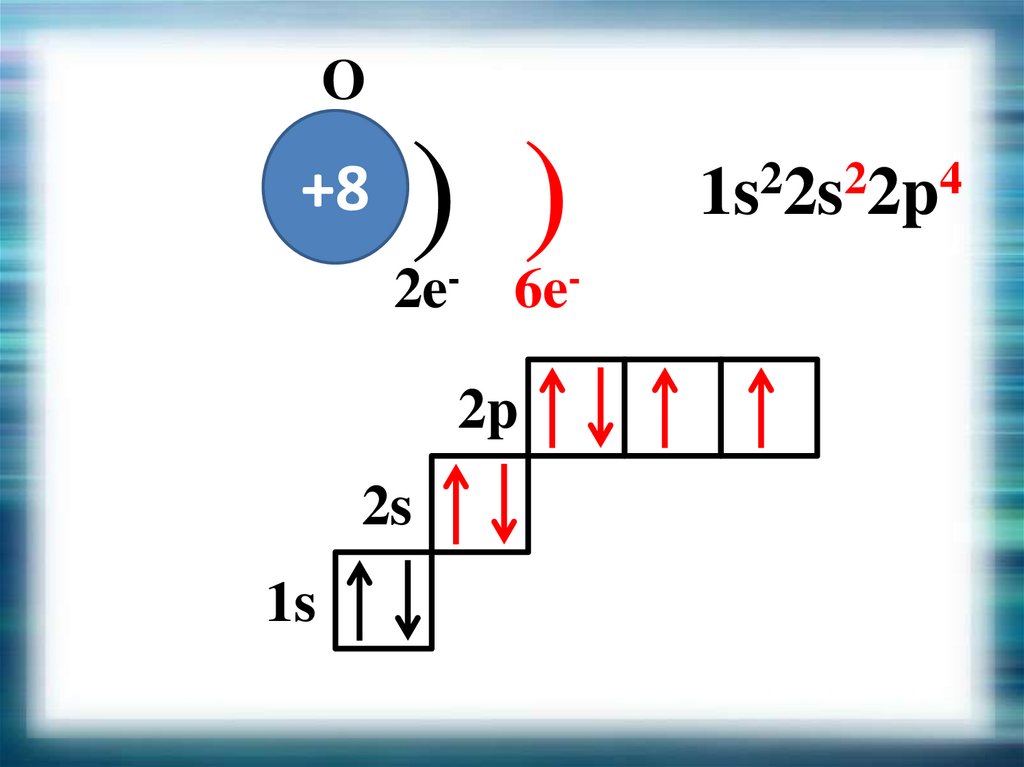
O+8
) )
2e- 6e2p
2s
1s
1s22s22p4
23.
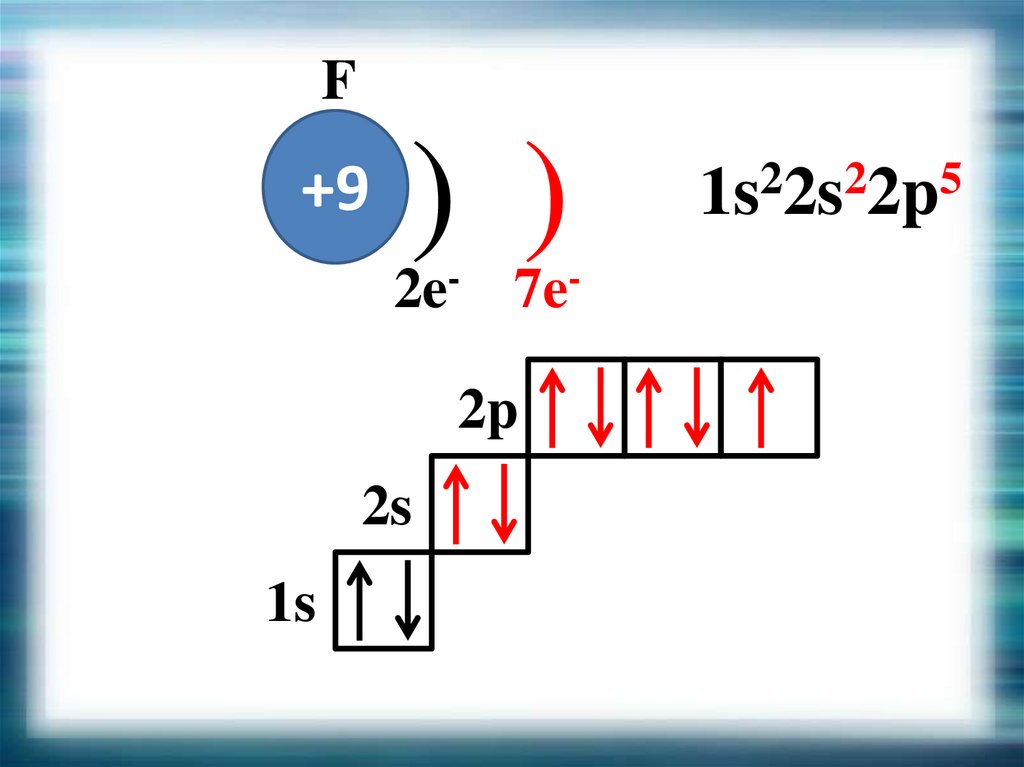
F+9
) )
2e- 7e2p
2s
1s
1s22s22p5
24.
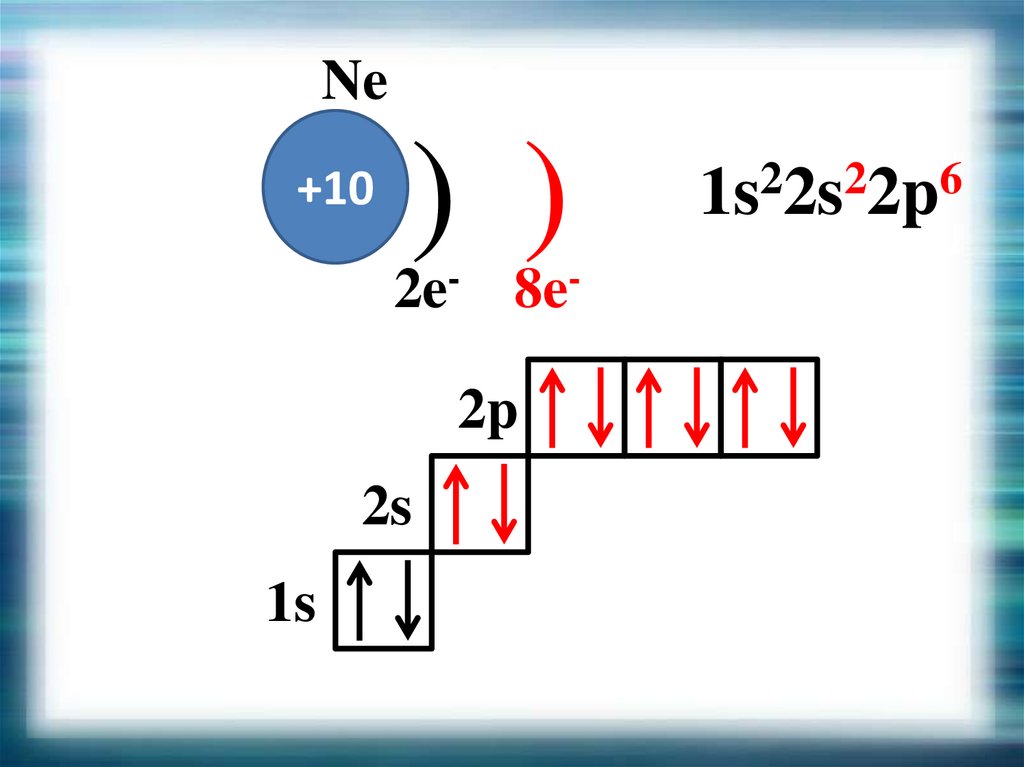
Ne+10
) )
2e- 8e2p
2s
1s
1s22s22p6
25.
Запомни:26.
Выводы:27. 1. вещество состоит из огромного количества частиц (атомов и молекул), между которыми есть промежутки; 2. молекула вещества
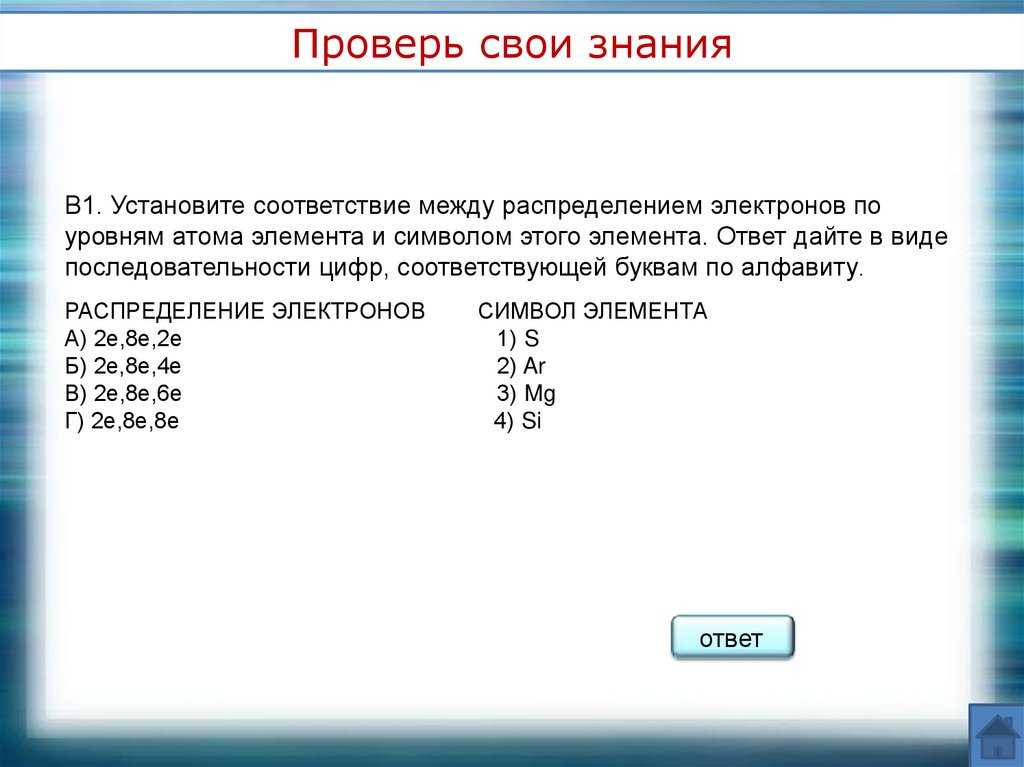
Проверь свои знанияВ1. Установите соответствие между распределением электронов по
уровням атома элемента и символом этого элемента. Ответ дайте в виде
последовательности цифр, соответствующей буквам по алфавиту.
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ
А) 2е,8е,2е
Б) 2е,8е,4е
В) 2е,8е,6е
Г) 2е,8е,8е
СИМВОЛ ЭЛЕМЕНТА
1) S
2) Ar
3) Mg
4) Si
ответ
3412












 Химия
Химия








