Похожие презентации:
Реакційна здатність вуглеводнів та їхніх похідних
1. 2021р. Лекція № 2 Реакційна здатність вуглеводнів та їхніх похідних
2.
1. Класифікація хімічних реакцій біоорганічних сполук та їхняхарактеристика
2. Реакції радикального заміщення (SR)
3. Реакції електрофільного приєднання (AE)
4. Реакції електрофільного заміщення в ароматичних
сполуках(SE)
Орієнтувальна дія замісників у монозаміщених бензенах
(ПСРС)
5. Медико-біологічне значення вуглеводнів
3.
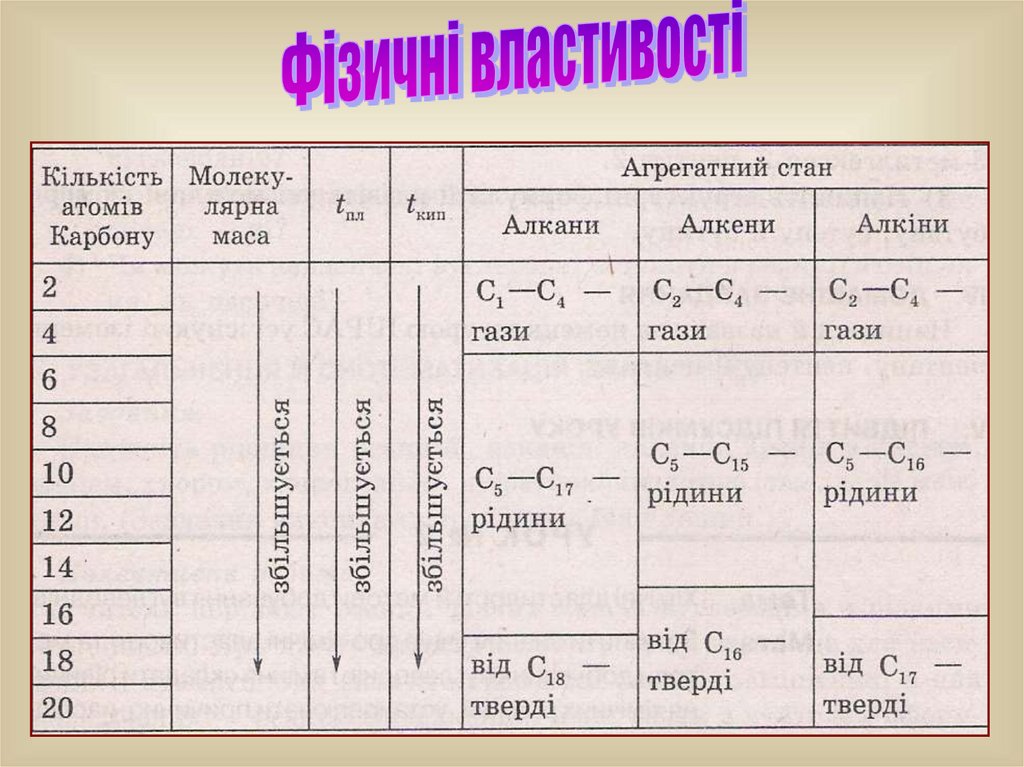
Порівняння гомологічних рядів вуглеводнівГомологічний
ряд
Зв'язки в
молекулі
Суфікс у назві
Загальна ф-ла
вуглеводню
Алкани
Всі ординарні
(одинарні), –
-ан-
CnH2n+2
Циклоалкани
Одинарні,
замкнені в цикл
-ан-
CnH2n
Алкени
Один подвійний
зв'язок, =
-ен-
CnH2n
Алкіни
Один потрійний
зв’язок, ≡
-ін-
CnH2n-2
Алкадієни
Спряжений
зв′язок, = – =
- дієн
CnH2n-2
-ен-
CnH2n-6
Арени
Ароматичний
зв’язок
4.
Біоорганічні реакції класифікують за:1.Напрямком перебігу;
5.
2.Способом розривання хімічного зв’язку.Гомолітичні-
Гетеролітичні –
реакції, в яких при розриванні
ковалентного зв’язку біля сусідніх
атомів залишається по одному
електрону
реакції, в яких при розриванні
ковалентного зв’язку пара
електронів, яка його утворює,
лишається біля одного з атомів
Х : Z→Х· + Z·
Х : Z→ Х+ + Z¯
Н : Н→Н∙ + Н∙
Н : Cl → Н+ + Cl -
Такі реакції називають
радикальними – R∙
Негативно заряджені частинки наз. нуклеофілами.
До них належать: ОН¯, Cl¯, Br¯, J¯ та інші аніони. Позитивно
заряджені частинки наз. електрофілами: Н+, NO2+ SO3H+ , інші
катіони.
6.
Якщо реагент в ході реакції утворює вільний радикал, тотакі реакції називають радикальними; якщо утворюється
нуклеофіл - нуклеофільними; якщо електрофіл –
електрофільними.
В біоорганічній хімії розрізняють реакції:
-радикального заміщення (SR)
-електрофільного заміщення ( SE )
-нуклеофільного заміщення ( SN )
-електрофільного приєднання
(AE )
-нуклеофільного приєднання ( AN )
-реакції відщеплення ( Е )
7.
8.
Реакції радикального заміщення SRДля алканів характерний тип реакцій
заміщення та окиснення.
При взаємодії з хлором під дією УФ
випромінювання проходить поступове заміщення
атомів Гідрогену на атоми Хлору.
Реакція йде за вільнорадикальним
механізмом і складається з таких стадій:
9.
1. ІніціюванняСl:Cl → Cl· + Cl·
2. Наростання ланцюга
CH4+ Cl· →CH3· + HCl
CH3· + Cl2 →CH3Cl + Cl·
3. Обрив ланцюга
Cl· + Cl· → Cl2
Cl· + CH3· →CH3Cl
CH3· + CH3· → CH3 - CH3
СН4+Cl2→ СН3Cl+НCl
СН3Cl+ Cl2→ СН2Cl2+НCl
СН2Cl2+ Cl2→ СНCl3+НCl
СНCl3+Cl2→ СCl4+НCl
Обриву ланцюга сприяє також наявність в системі додаткових хімічних
сполук-антиоксидантів, які взаємодіючи з вільними радикалами, ведуть до
утворення малоактивних молекулярних продуктів.
В організмі таку роль виконує вітамін Е (α-токоферол),
який є антиоксидантом.
Вітамін Е сповільнює процес аутоокиснення ліпідів в організмі.
Алкани не вступають в реакції приєднання, вони не
знебарвлюють розчини Br2 та KMnO4 .
10.
Однією з найважливіших реакцій за механізмом SRє взаємодія органічних сполук з киснем.
Окиснення сполук за відсутності зовнішніх джерел
ініціювання називають аутоокисненням.
Аутоокиснення веде до псування харчових
продуктів, багатих на ліпіди(“згірклість”).
В організмі відбувається пероксидне
окиснення ліпідів, що веде до руйнування
клітинних мембран.
Реакції горіння
СН4 + 2О2 → СО2 + 2Н2О
11.
Алкени практично нерозчинні в воді, але розчиняютьсяв органічних розчинниках.
Розчинність нижчих алкінів у воді трохи вища ніж алкенів та
алканів, однак вони погано розчиняються в воді, добре розчиняються в
органічних розчинниках.
Найважливіші з дієнових вуглеводнів- Бута-1,3-дієн( дивініл)газ, який легко зріджується, не розчиняється в воді, розчиняється в
ефірах, бензолі; поглинає уф випромінювання.
2-Метилбута- 1,3-дієн(ізопрен)-летка, легкокипляча рідина,
tкип.=34,070С, добре розчиняється в більшості вуглеводневих
розчинників, не розчиняється в воді.
12.
t, Pt,NiН2С=СН2 +Н2 -------→ - СН2 - СН2 - + Н2 →Н3С-СН3
Етен
Етан
НС≡СН+ Н2 → Н2С=СН2 +Н2 →Н3С-СН3
Етин
Етен
Етан
Н2С=СН-СН=СН2 +Н2 →Н3С-СН=СН –СН3+ Н2 →
Бута-1,3-дієн
Бут-2-ен
Н3С-СН2 –СН2 –СН3 →С4Н10
13.
Н2С=СН2 + Br2 → BrН2С-СН2Br1,2-дибромоетан
НС≡СН+Br2→BrНС=СНBr+Br2→Br2НС-СНBr2
1,2-дибромоетен
1,1,2,2-тетрабромоетан
Н2С=СН-СН=СН2 + Br2 → BrН2С-СН=СН-СН2Br+ Br2 →
1,4-Дибромобут-2-ен
BrН2С-СНBr -СНBr -СН2Br
1,2,3,4-тетрабромобутан
Спряжені дієни є фрагментами молекул
важливих біорегуляторів – вітамін А, вітамін Е.
14.
H2C=CH2 +HBr→ H3C- CH2BrСН≡СН+ НCl→H2C=CHCl -хлорвініл
Н2С=СН-СН=СН2 +HCl→ Н3С-СН=СН-СН2Cl
1-Хлоробут-2-ен
Якщо алкен несиметричний, то реакція відбувається за правилом
Марковникова: атом Гідрогену приєднується до найбільш
гідрогенізованого атома Карбону:
Пропен
2-бромпропан
Під дією групи СН3 - відбувається поляризація π-зв’язку .
В результаті на атомі С(1) виникає частковий негативний заряд , а на атомі
С(2)-позитивний.
15.
Процеси приєднання за місцем подвійного зв’язкушироко розповсюджені в біохімічних системах.
Це переважно реакції гідратації та відновлення
молекул α, β-ненасичених карбонових кислот і
високомолекулярних (жирних) кислот, що протікають за
участі біокаталізаторів -ферментів.
16.
Якісні реакції на кратний зв'язок:3 СН2=СН2 + 2KMnO4 + 4H2O→ 3СН2OH -СН2OH + 2KOH + 2MnO2↓
Н2С=СН2 + Br2 → BrН2С-СН2Br
Фізіологічна дія на організм
Тривале вдихання повітря, в якому є етилен, негативно
впливає на нервову систему, призводить до порушення
кровообігу.
Алкіни діють як наркотичні речовини, їх дія зростає зі
збільшенням числа атомів Карбону. Середні члени ряду
викликають судоми. Суміш ацетилену з повітрям викликає
задуху.
Дієнові вуглеводні в газо- і пароподібному стані мають
неприємний запах, подразнюють слизові оболонки. При
вдиханні проявляють наркотичну дію.
17.
Моноядерні арениУ складі бензену значний вміст Карбону, тому на повітрі сполука
горить кіптявим полум'ям, а в кисні згорає повністю:
2C6H6 + 15O2 → 12CO2 + 6H2O
Бензен вступає в реакції електрофільного заміщення SE –
галогенування, нітрування, сульфування:
Бензол та його гомологи у присутності каталізаторів –
безводних AlCl3, FeCl3, АlBr3 взаємодіють із хлором або бромом:
Толуол у такій реакції утворює суміш орто- і пара-ізомерів.
18.
Ізомери аренів19.
Бензен повільно реагує з конц. НNO3 навіть за сильного нагрівання.Однак, в присутності нітруючої суміші(суміш конц. НNO3 та H2SO4)
реакція нітрування проходить досить легко:
Нітробензен – сильна отрута, вражає ЦНС, негативно діє на обмін речовин.
Реакція легко проходить під дією сульфатної кислоти, що «димить» на
повітрі (олеум):
Бензенсульфокислота
20.
Толуен нітрується легше ніж бензен:2,4,6 – тринітротолуен (тол, тротил)
– вибухова речовина
21.
Алкілування аренівРеакція Фріделя-Крафтса
Бензен за н.у. не окиснюється. Гомологи його за рахунок
бокових ланцюгів окиснюються легко. Толуен знебарвлює розчин
КМnO4.
22.
23.
С6Н6Cl6 – Гексахлороциклогексан,інсектицид, 666
24.
C 6H 625.
Вазелін(суміш рідких і твердих насичених вуглеводнів, що містятьдо 25 атомів Карбону застосовують для приготування мазей, які
використовуються в медицині.
Вазелінове масло –суміш алканів до С15. Проносний засіб.
Парафін(суміш твердих вуглеводнів(С19–С35) має високу
теплоємність, тому застосовують для теплових процедур у
медицині(парафінотерапія).
Озокерит(гірський віск)-суміш вищих алканів, алкенів, смол та
мінеральних масел. Застосовують в медицині в тих самих випадках, що
і парафін.
Гомологи метану є сировиною для отримання важливих
органічних сполук.
26.
1.Метан→хлорметан→етан→етин→бензен→нітробензен→анілін
2. Задача.
Визначити молекулярну формулу вуглеводню, який містить 93,75%
Карбону. Відносна густина за повітрям складає 4,41.
27.
1. Л.М.Миронович Біоорганічна хімія с.23-61.2. В.П.Музиченко Медична хімія с.349-363.
Біологічно важливі оксигеновмісні
сполуки(спирти, альдегіди, кетони)



























 Химия
Химия








