Похожие презентации:
Реакційна здатність насичених вуглеводнів. Реакційна здатність ненасичених вуглеводнів (алкени, алкадієни, алкіни)
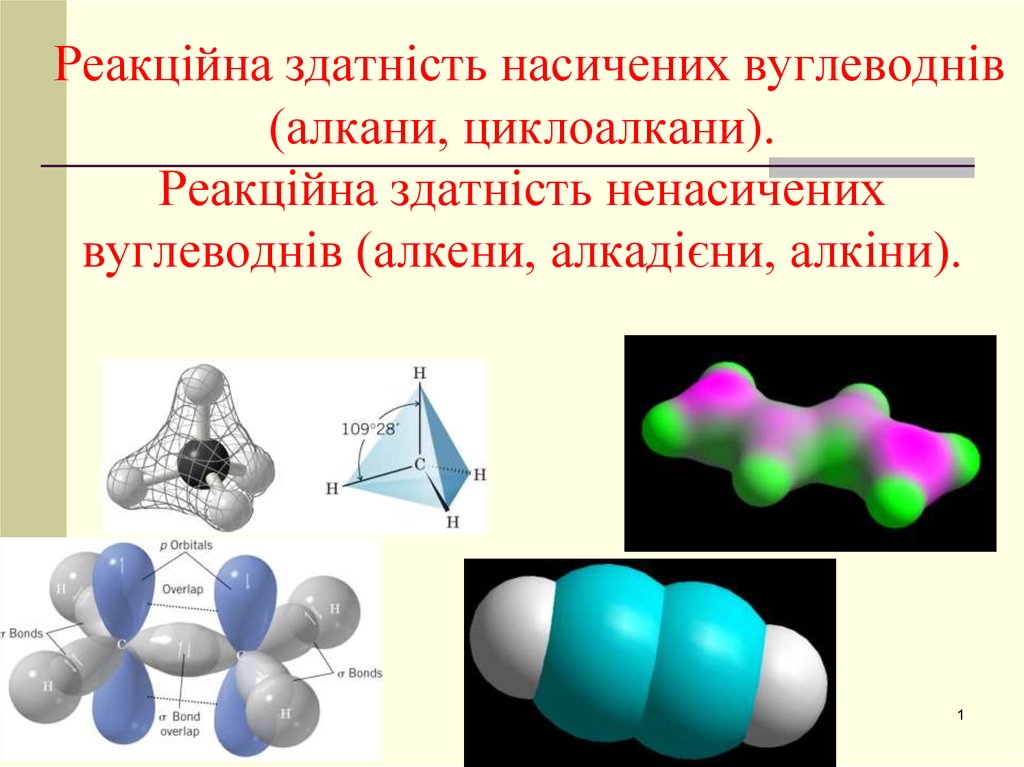
1. Реакційна здатність насичених вуглеводнів (алкани, циклоалкани). Реакційна здатність ненасичених вуглеводнів (алкени, алкадієни, алкіни).
Реакційна здатність насичених вуглеводнів(алкани, циклоалкани).
Реакційна здатність ненасичених
вуглеводнів (алкени, алкадієни, алкіни).
1
2.
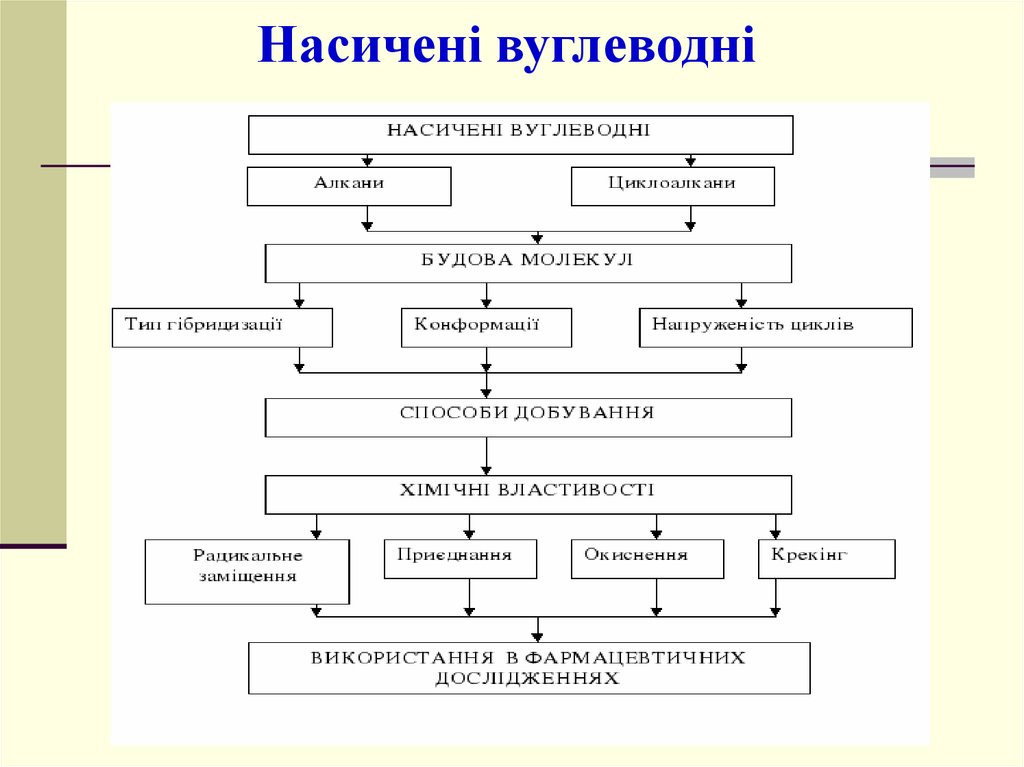
Вуглеводні: аліфатичні та аліциклічніНазва класу
вуглеводню
Загальна Тип гібридизації
формула атома Карбону
Алкани
СnН2n+2
Алкени
СnН2n
Циклоалкани
СnН2n
Алкадієни
Алкіни
СnН2n-2
СnН2n-2
sp3, тетраедр,
109028/
Особливості
будови, закінчення
в назві
Основний
тип реакції
S ; крекінг
R
Усі (С-С) ізомеризація,
- ан
окислення
A E;
1
С=С,
1 ,
2
sp , площинна, усі інші ; полімеризація,
окислення
1200
- ен
Атоми С
SR;
sp3, тетраедр, замкнуті
в
цикл,
приєднання
Цикло -ан
109028/
окислення
sp2, площинна,
1200
sp, лінійна,
1800
2 С=С, 2 , 1,2- та 1,4 AE;
усі інші ; полімеризація,
окислення
- дієн
A E;
1 С С, 2 , полімеризація,
усі інші ;СН-кислотні власт.
- ин (-ін)
окислення
3.
Насичені вуглеводні4.
АлканиСН4
Метан
СН3 -
Метил
С2Н6 Етан
С2Н5
С3Н8 Пропан
С3Н7 ¯
Пропіл
С4Н10 Бутан
С4Н9¯
Бутил
С5Н12 Пентан
С5Н11 ¯
Аміл
С6Н14 Гексан
С6Н13
Гексил
¯
¯
Етил
5.
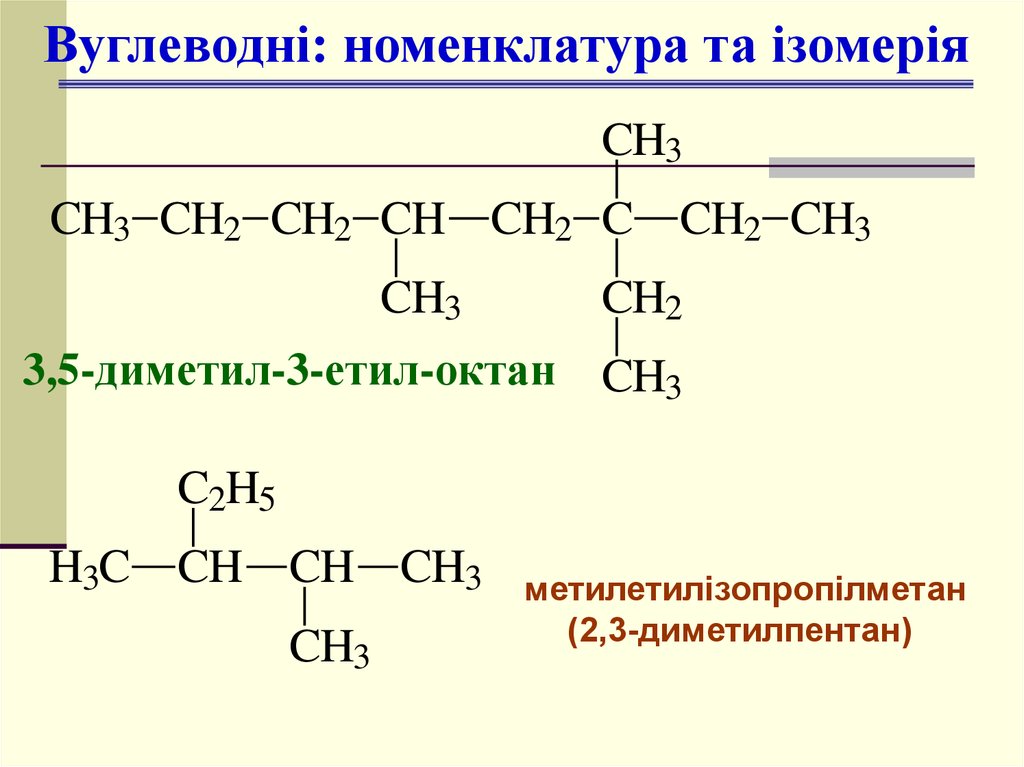
Вуглеводні: номенклатура та ізомеріяCH3
CH3 CH2 CH2 CH CH2 C CH2 CH3
CH3
CH2
3,5-диметил-3-етил-октан CH3
C2H5
H3C
CH CH CH3
CH3
метилетилізопропілметан
(2,3-диметилпентан)
6.
Вуглеводні: номенклатура та ізомеріяCH2 CH
2-етилпентен-1
етеніл
(вініл)
H2C
CH2
2
CH3 CH2 CH2 C
CH2 CH
1
3
4
5
1
CH2
3
2
CH
H2C
CH
C
2-пропеніл
(аліл)
4
CH
HC
CH3
CH2 CH3
5
CH3
пентадієн-1,3
CH2
2-метилбутадієн
(ізопрен)
7.
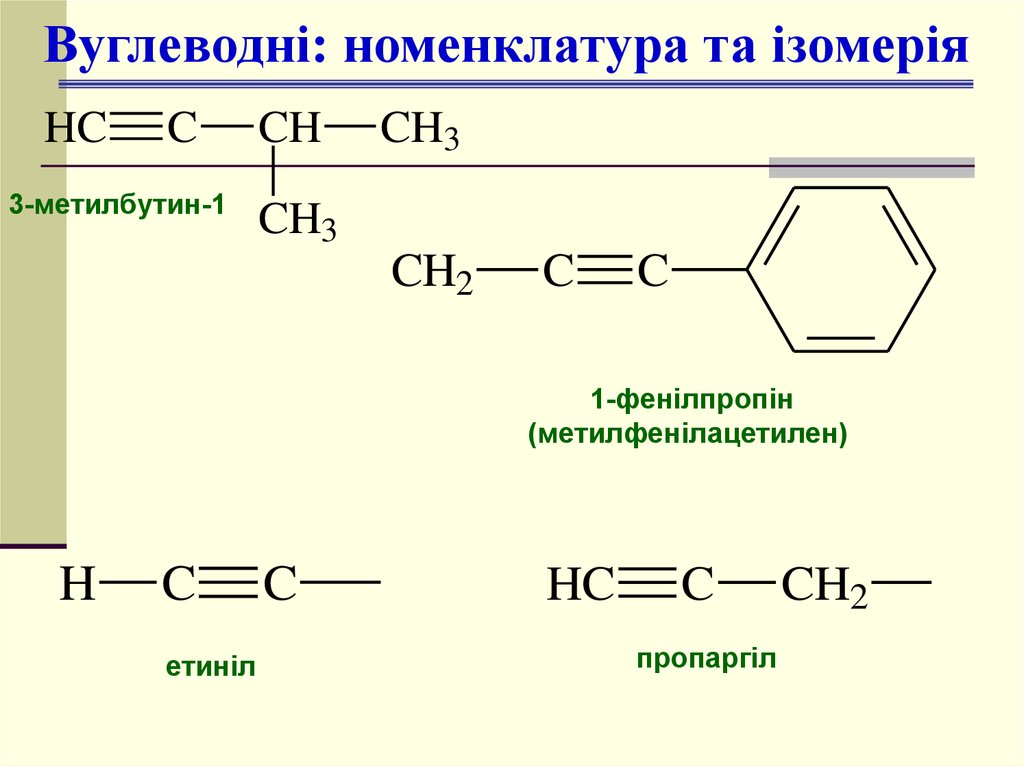
Вуглеводні: номенклатура та ізомеріяHC
C
3-метилбутин-1
CH
CH3
CH3
CH2
C
C
1-фенілпропін
(метилфенілацетилен)
H
C
етиніл
C
HC
C
пропаргіл
CH2
8.
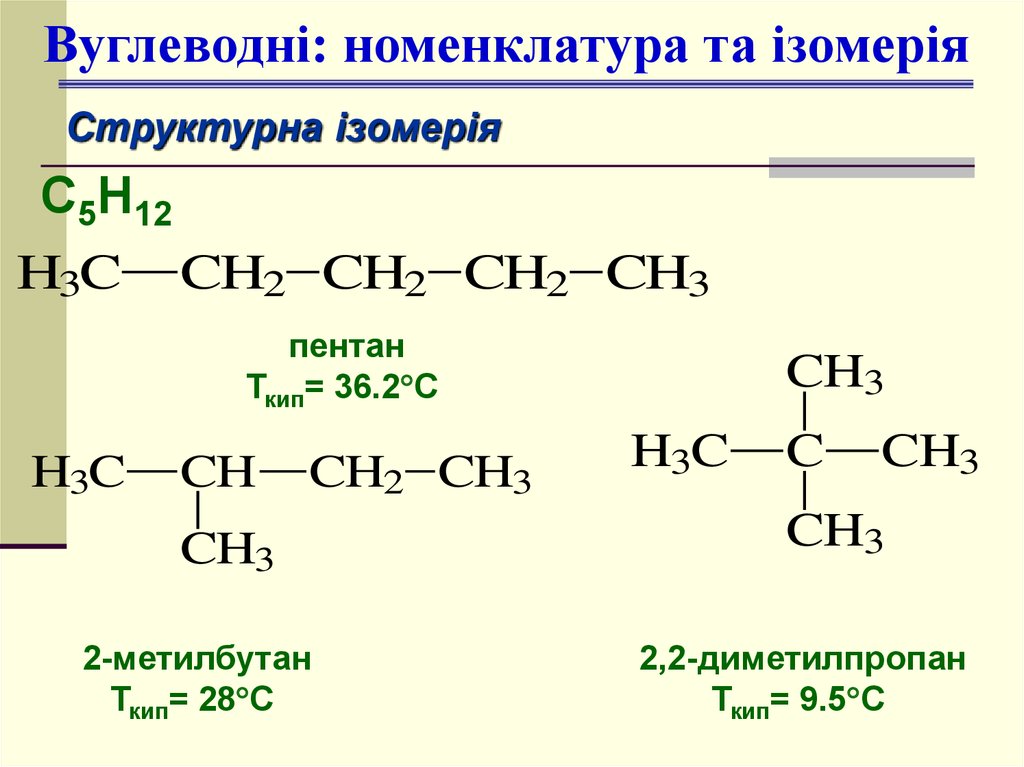
Вуглеводні: номенклатура та ізомеріяСтруктурна ізомерія
С5Н12
H3C CH2 CH2 CH2 CH3
пентан
Ткип= 36.2 С
H3C
CH
CH2 CH3
CH3
2-метилбутан
Ткип= 28 С
CH3
H3C
C
CH3
CH3
2,2-диметилпропан
Ткип= 9.5 С
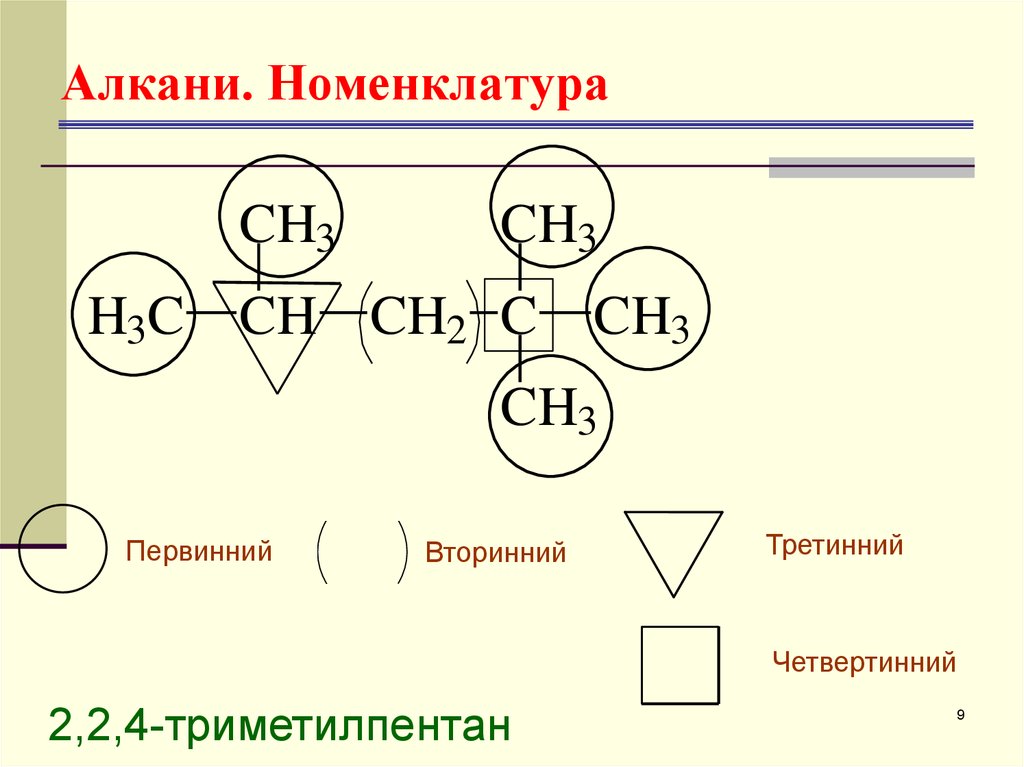
9. Алкани. Номенклатура
CH3CH3
H3C CH CH2 C
CH3
CH3
Первинний
Вторинний
Третинний
Четвертинний
2,2,4-триметилпентан
9
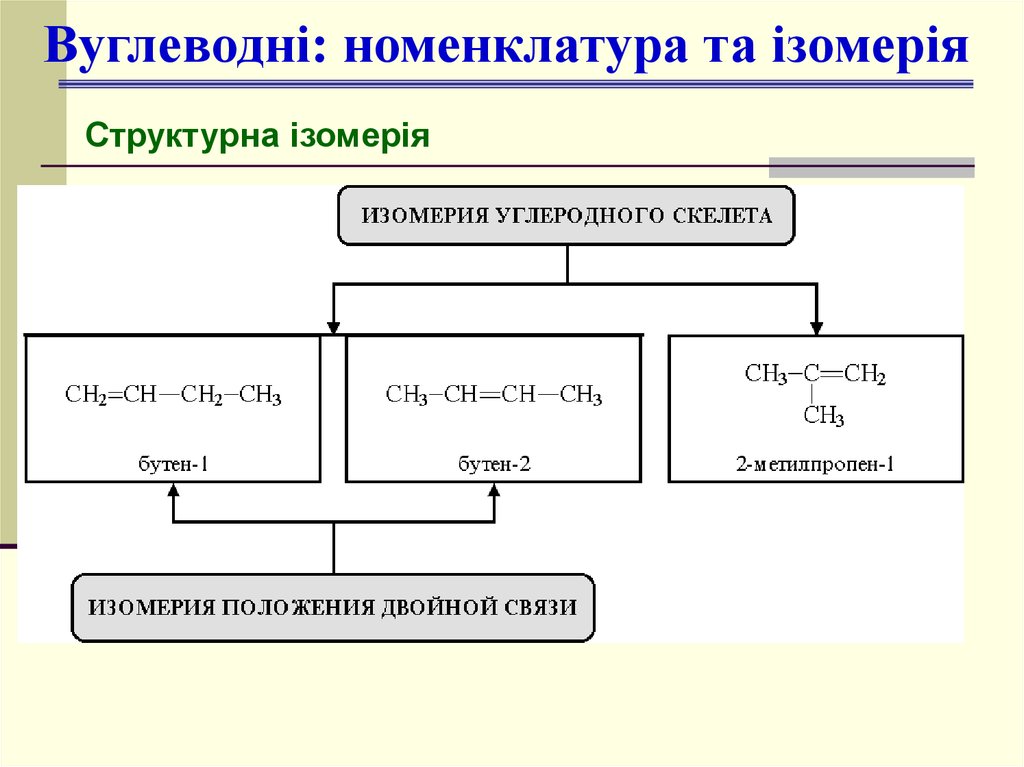
10.
Вуглеводні: номенклатура та ізомеріяСтруктурна ізомерія
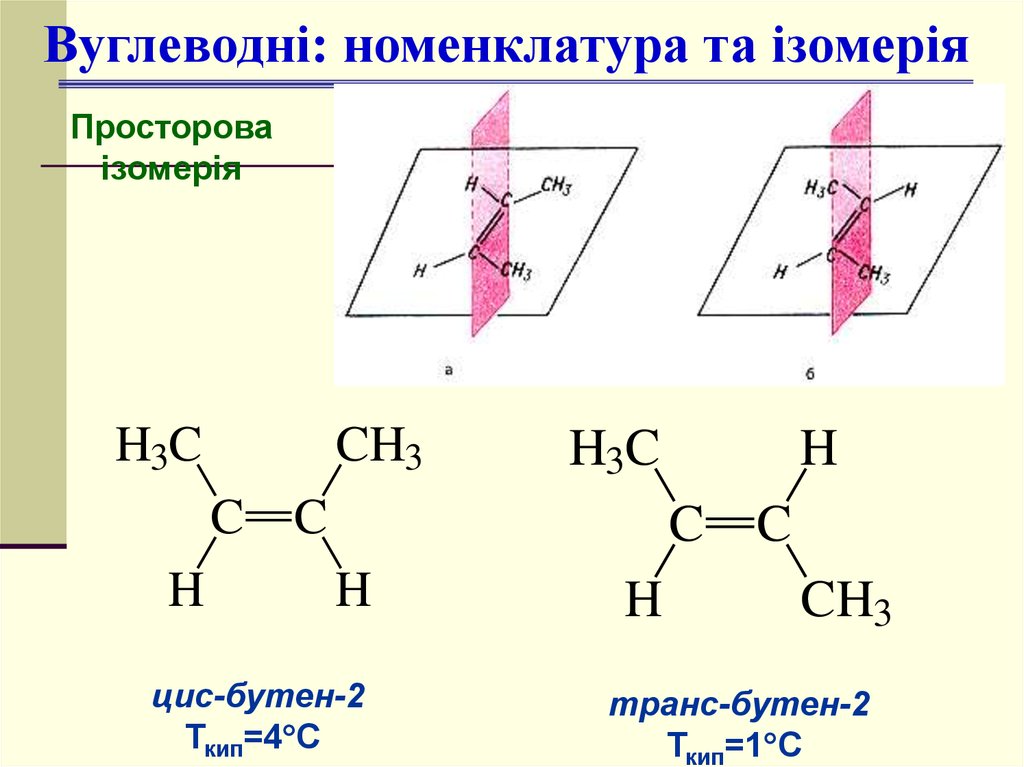
11.
Вуглеводні: номенклатура та ізомеріяПросторова
ізомерія
H3C
CH3
H3C
C C
H
H
C
H
цис-бутен-2
Ткип=4 С
H
C
CH3
транс-бутен-2
Ткип=1 С
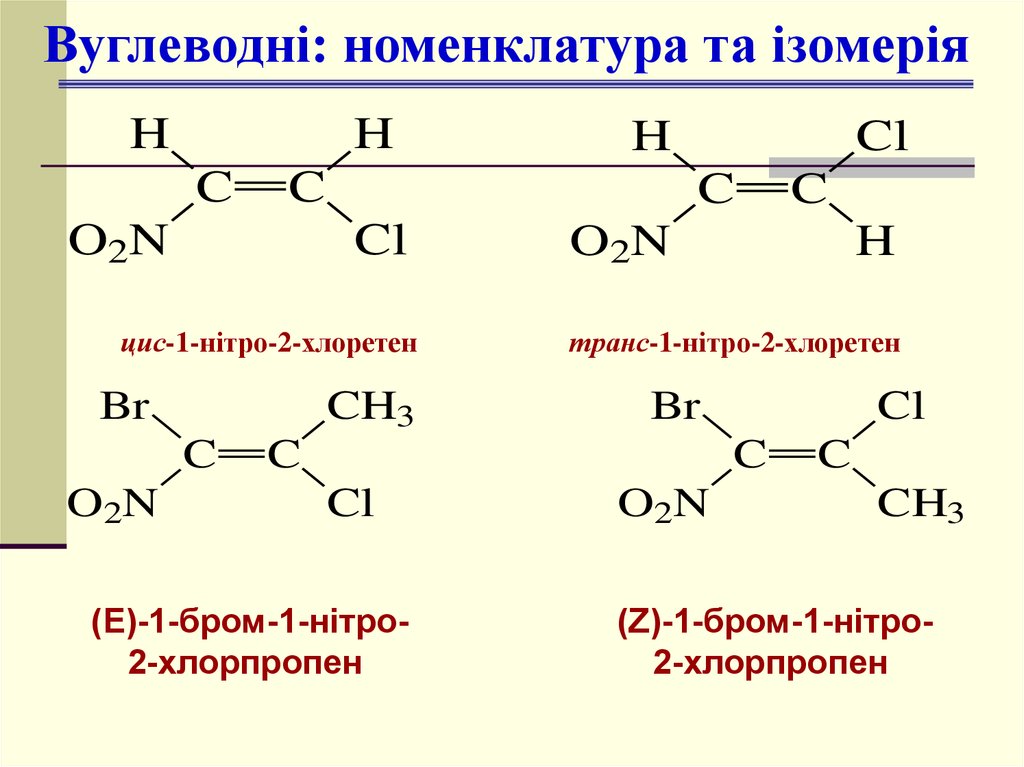
12.
Вуглеводні: номенклатура та ізомеріяH
H
C
C
O 2N
цис-1-нітро-2-хлоретен
Br
O2N
Cl
C
Cl
CH3
C
H
O 2N
H
транс-1-нітро-2-хлоретен
Br
C
Cl
C
Cl
(Е)-1-бром-1-нітро2-хлорпропен
C
O2N
C
CH3
(Z)-1-бром-1-нітро2-хлорпропен
13.
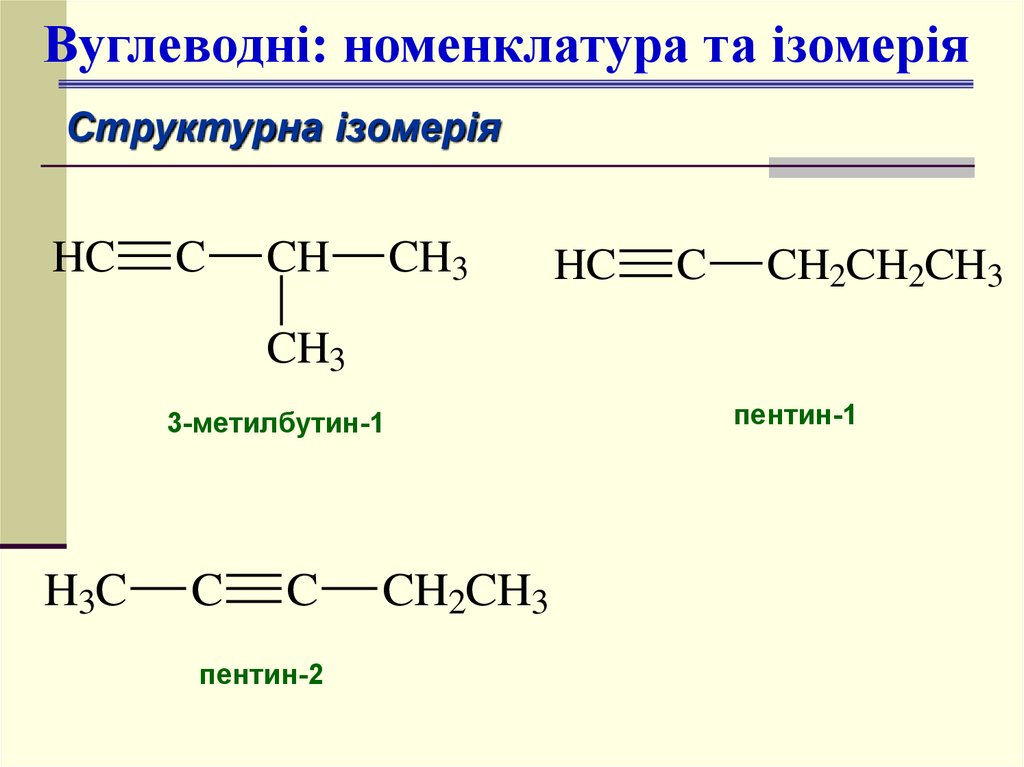
Вуглеводні: номенклатура та ізомеріяСтруктурна ізомерія
HC
C
CH
CH3
HC
C
CH2CH2CH3
CH3
3-метилбутин-1
H3C
C
C
пентин-2
CH2CH3
пентин-1
14.
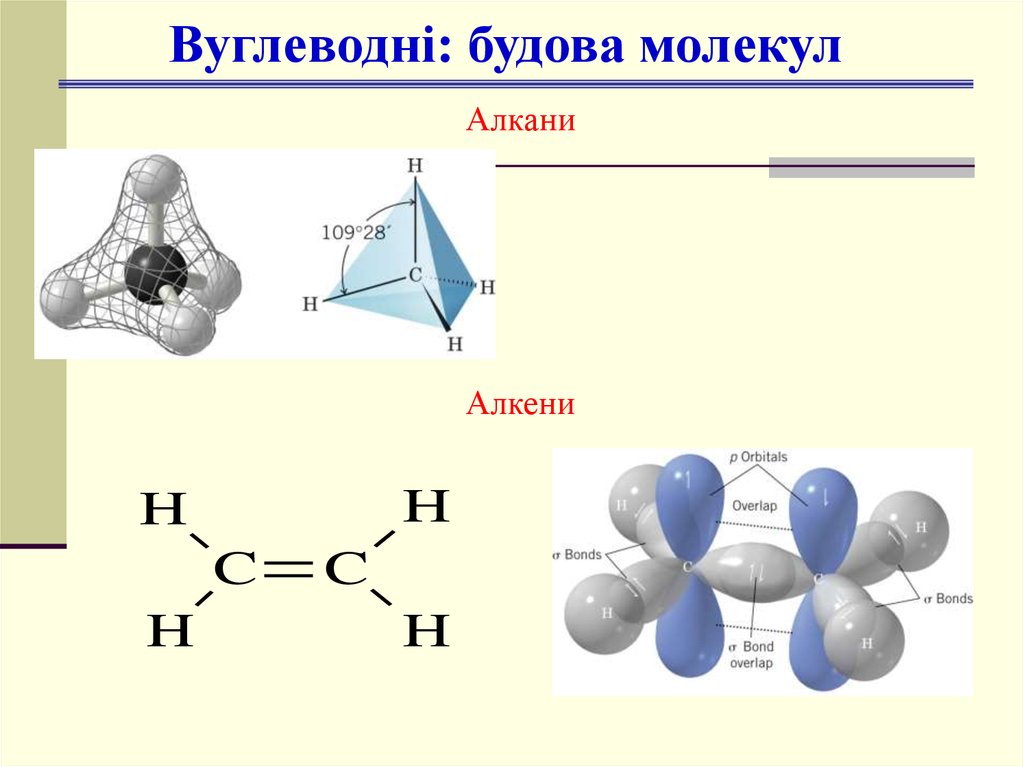
Вуглеводні: будова молекулАлкани
Алкени
H
H
C
H
C
H
15.
Вуглеводні: будова молекулH2C
C
CH2
H2C
Алкадієни
CH HC
H2C
CH2
CH CH2 HC
CH2
16.
Вуглеводні: будова молекулH C C H
Алкіни
17.
Алканами называют алифатические углеводороды, в молекулах которыхатомы углерода связаны простыми ковалентными σсвязями.
Методи одержання алканів
Лабораторні:
1. Лужне плавлення (синтез Дюма)
) R–H + Na CO
RCOONa + NaOH
Ca
(OH
2
3
Наприклад, для одержання бутану потрібно взяти:
(OH )2
СН3-СН2-СН2-СН2-СООNa + NaOH
сплавлення
Ca
2
СН3-СН2-СН2-СН2–H + Na2CO3
2. Гідроліз магнійорганічних сполук:
R-Mg-Hal + HOH → R–H + Mg(OH)Hal
Наприклад, для одержання бутану потрібно взяти:
СН3-СН2-СН2-СН2-Mg-Hal + HOH →
СН3-СН2-СН2-СН2–H + Mg(OH)Hal
18.
Методи одержання алканів4.
Реакція Кольбе (електроліз)
RCOONa RCOO– + Na+
RCOO– – 1е R + СО2
R + R R – R
Наприклад, для одержання гексану потрібно взяти:
СН3-СН2-СН2-COONa СН3-СН2-СН2-COO– + Na+
СН3- СН2-СН2-COO– – 1е СН3-СН2-СН2 + СО2
СН3- СН2-СН2 + СН3-СН2-СН2 СН3-СН2-СН2–СН2СН2-СН3
19.
Методи одержання алканів3.
Реакція В’юрца–Шоригіна:
R–Hal + 2Na + Hal–R 2NaHal + R–R
Механізм:
R–Hal + 2Na R–Na + NaHal
RNa + Hal–R NaHal + R–R
Наприклад, для одержання гексану потрібно взяти:
СН3-СН2-СН2–Сl + 2Na + Сl–СН2-СН2-СН3 2NaСl +
СН3-СН2-СН2–СН2-СН2-СН3
20.
Методи одержання алканів5.
Гідрування алкенів та алкінів:
Ni
Pt
СН3–С≡С–СН3 + Н2 СН3–СН=СН–СН3 + Н2
СН3–СН2–СН2–СН3
6. Крекінг алканів – одержання алкенів та алканів:
t
C20H42
C10H20 + C10H22
7. Одержання метану:
Al4C3 + 12HCl 4AlCl3 + 3CH4
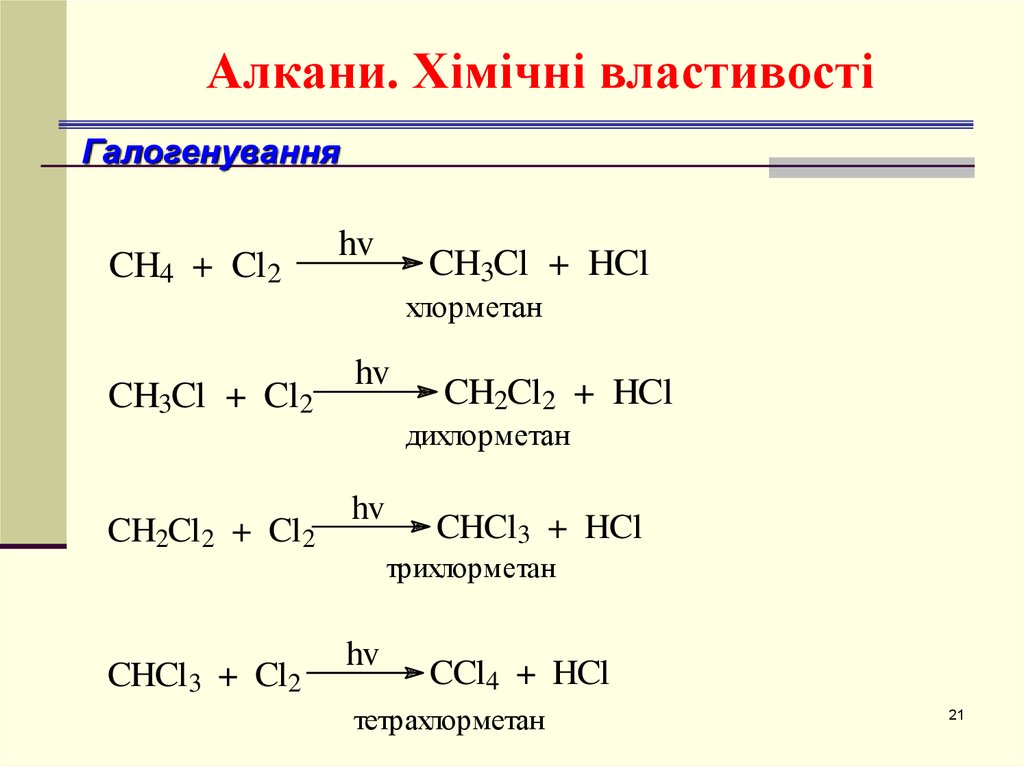
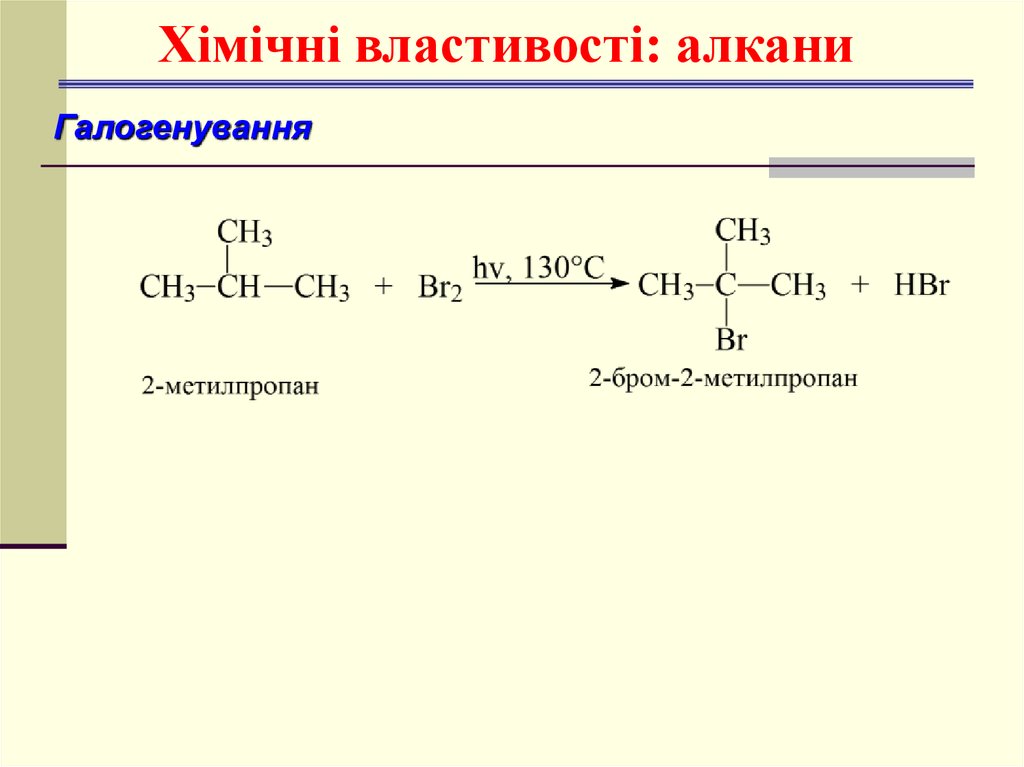
21. Алкани. Хімічні властивості
ГалогенуванняCH4 + Cl2
hv
CH3Cl + HCl
хлорметан
CH3Cl + Cl2
CH2Cl2 + Cl2
CHCl3 + Cl2
hv
CH2Cl2 + HCl
дихлорметан
hv
CHCl3 + HCl
трихлорметан
hv
CCl4 + HCl
тетрахлорметан
21
22.
Хімічні властивості: алканиГалогенування
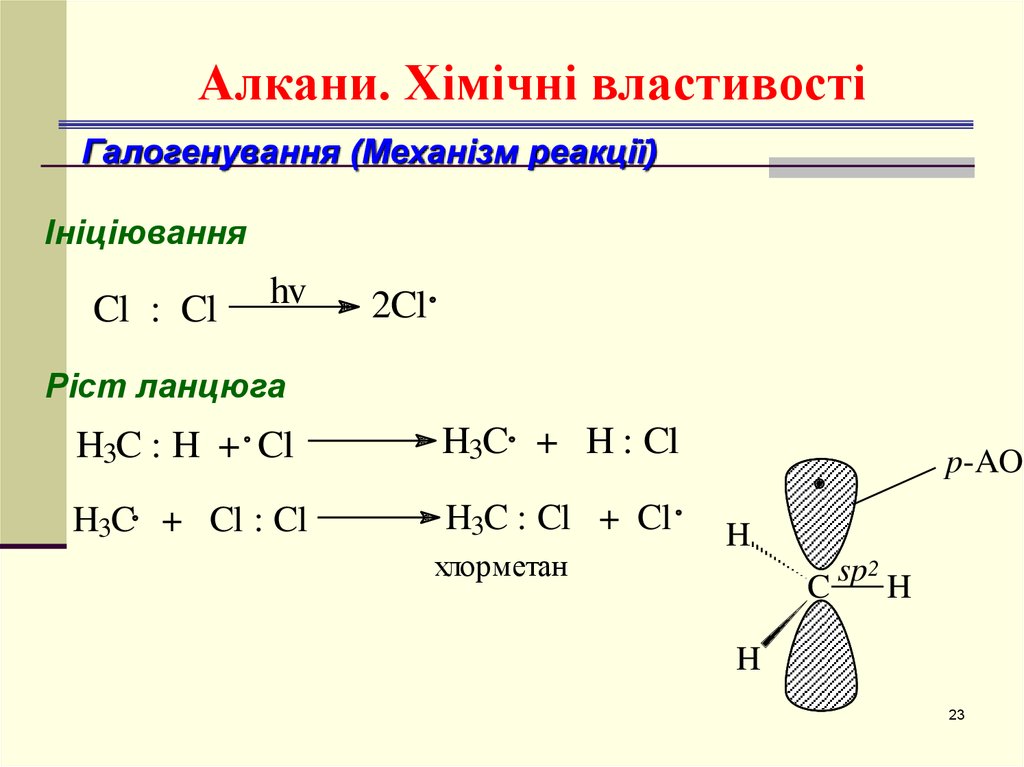
23. Алкани. Хімічні властивості
Галогенування (Механізм реакції)Ініціювання
Cl : Cl
hv
2Cl
Ріст ланцюга
H3C : H + Cl
H3C + H : Cl
H3C + Cl : Cl
H3C : Cl + Cl
хлорметан
p-AO
H
C sp H
2
H
23
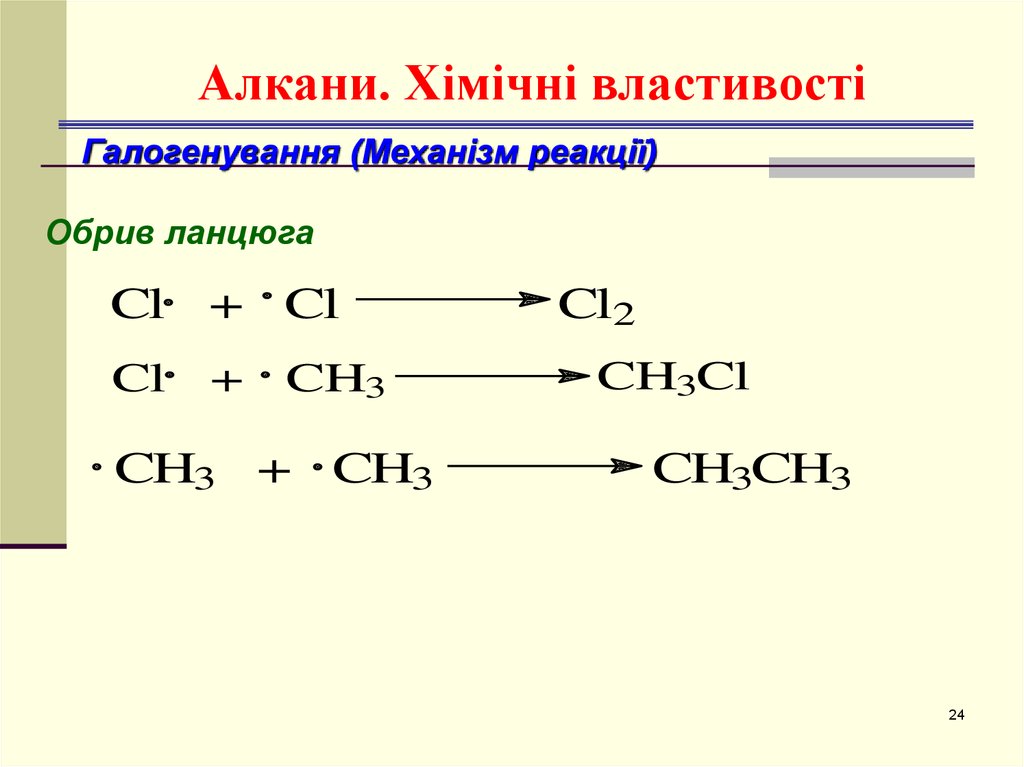
24. Алкани. Хімічні властивості
Галогенування (Механізм реакції)Обрив ланцюга
Cl + Cl
Cl
+
CH3
CH3 + CH3
Cl2
CH3Cl
CH3CH3
24
25. Алкани. Хімічні властивості
Галогенування (Механізм реакції)1.Галогенування розпочинається тільки під дією
ініціатора радикальних реакцій (УФ-світло, радикальні
реагенти, нагрівання).
2. Реакційна здатність галогенів зменшується в ряді:
F2 > Cl2 > Br2 > I2
3. Галогенування під дією фтору і хлору може вийти з
під контролю і набути взривного характеру.
25
26. Алкани. Хімічні властивості
Галогенування (Механізм реакції)4. Реакційна здатність Гідрогену у третинного атома
Карбону вища, ніж у вторинного, а вторинного вища, ніж
у первинного.
CH3
CH3 C
>
CH3 CH CH3
>
CH3CH2
>
CH3
CH3
376 кДж/моль
390 кДж/моль
415 кДж/моль
26
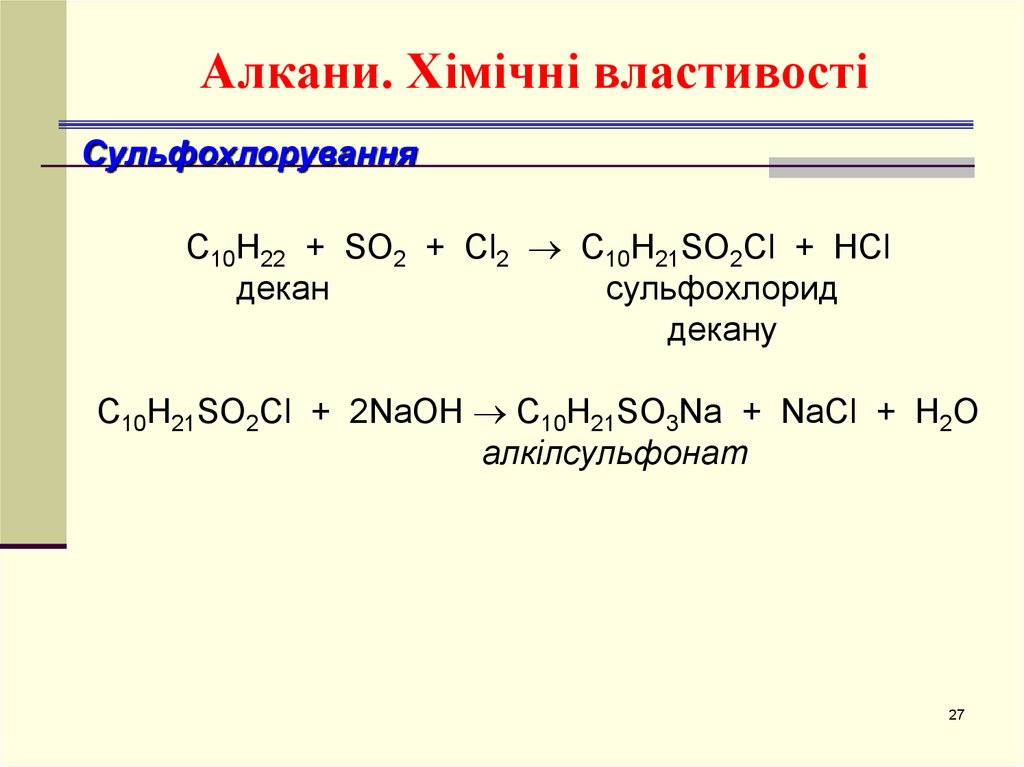
27. Алкани. Хімічні властивості
СульфохлоруванняС10H22 + SO2 + Cl2 C10H21SO2Cl + HCl
декан
сульфохлорид
декану
C10H21SO2Cl + 2NaOH C10H21SO3Na + NaCl + H2O
алкілсульфонат
27
28.
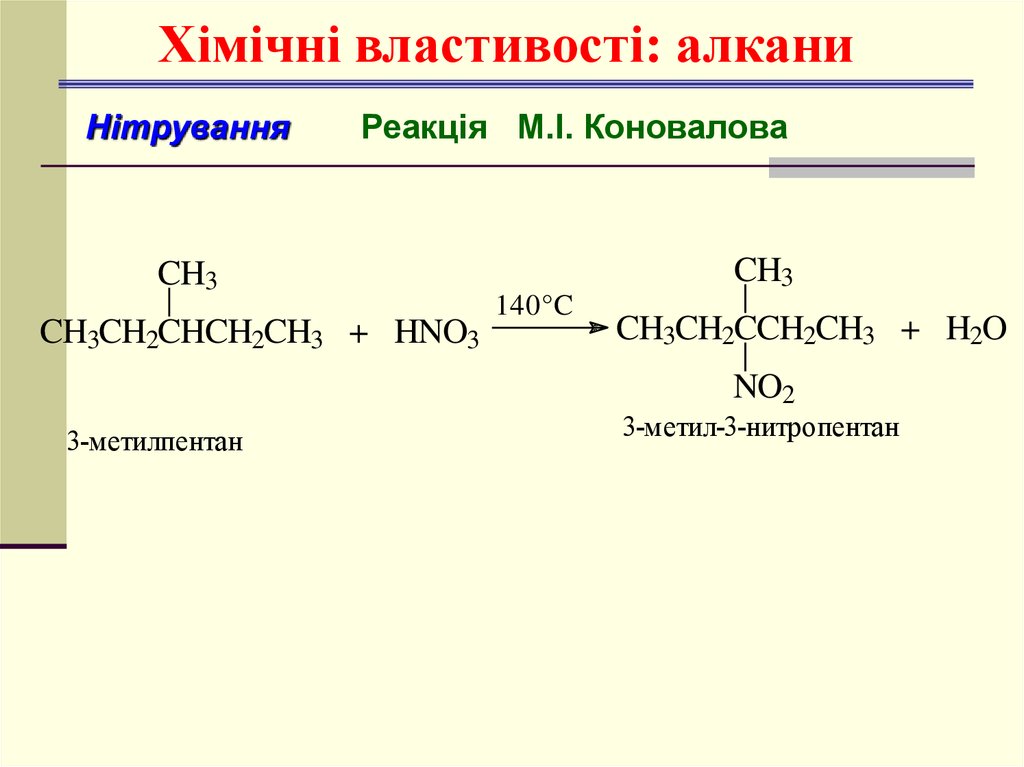
Хімічні властивості: алканиНітрування
Реакція М.І. Коновалова
CH3
CH3CH2CHCH2CH3 + HNO3
CH3
140°C
CH3CH2CCH2CH3 + H2O
NO2
3-метилпентан
3-метил-3-нитропентан
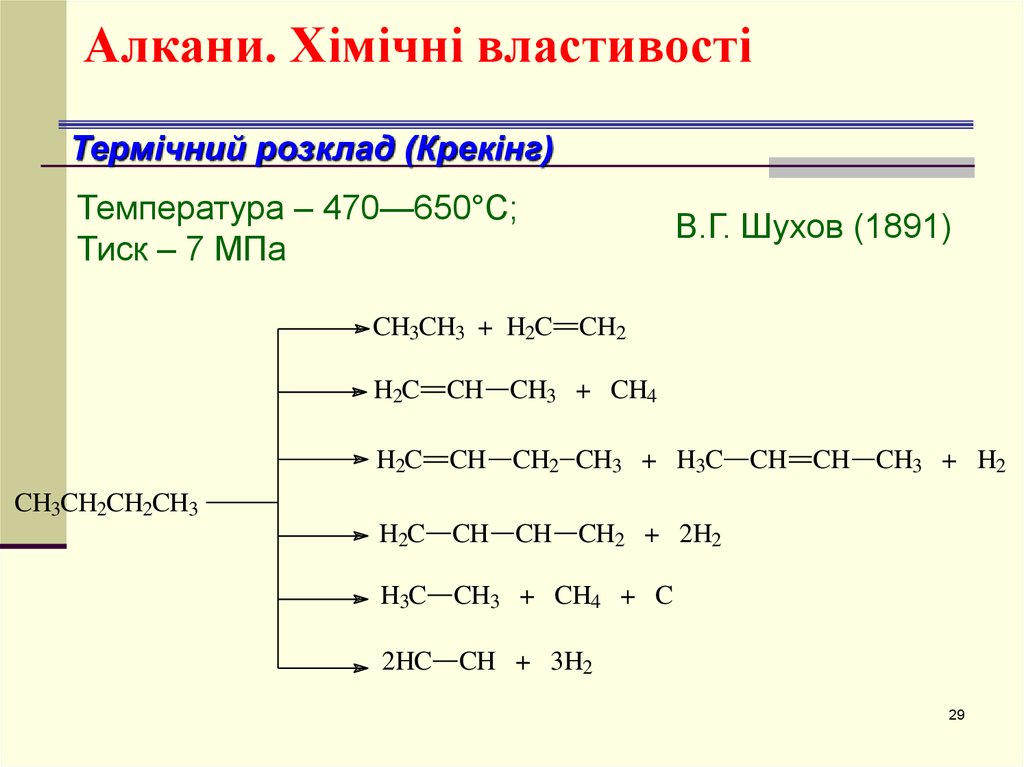
29. Алкани. Хімічні властивості
Термічний розклад (Крекінг)Температура – 470—650°С;
Тиск – 7 МПа
CH3CH3 + H2C
В.Г. Шухов (1891)
CH2
H2C
CH CH3 + CH4
H2C
CH CH2 CH3 + H3C
H2C
CH CH CH2 + 2H2
H3C
CH3 + CH4 + C
2HC
CH + 3H2
CH CH CH3 + H2
CH3CH2CH2CH3
29
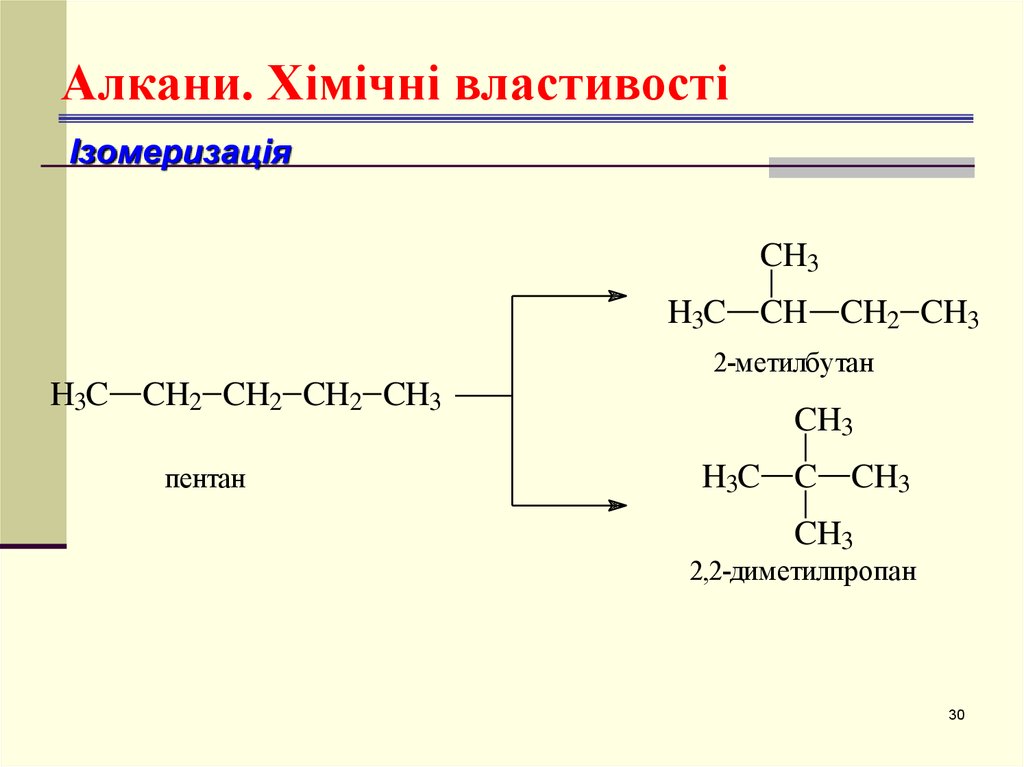
30. Алкани. Хімічні властивості
ІзомеризаціяCH3
H3C
CH CH2 CH3
2-метилбутан
H3C
CH2 CH2 CH2 CH3
пентан
CH3
H3C C
CH3
CH3
2,2-диметилпропан
30
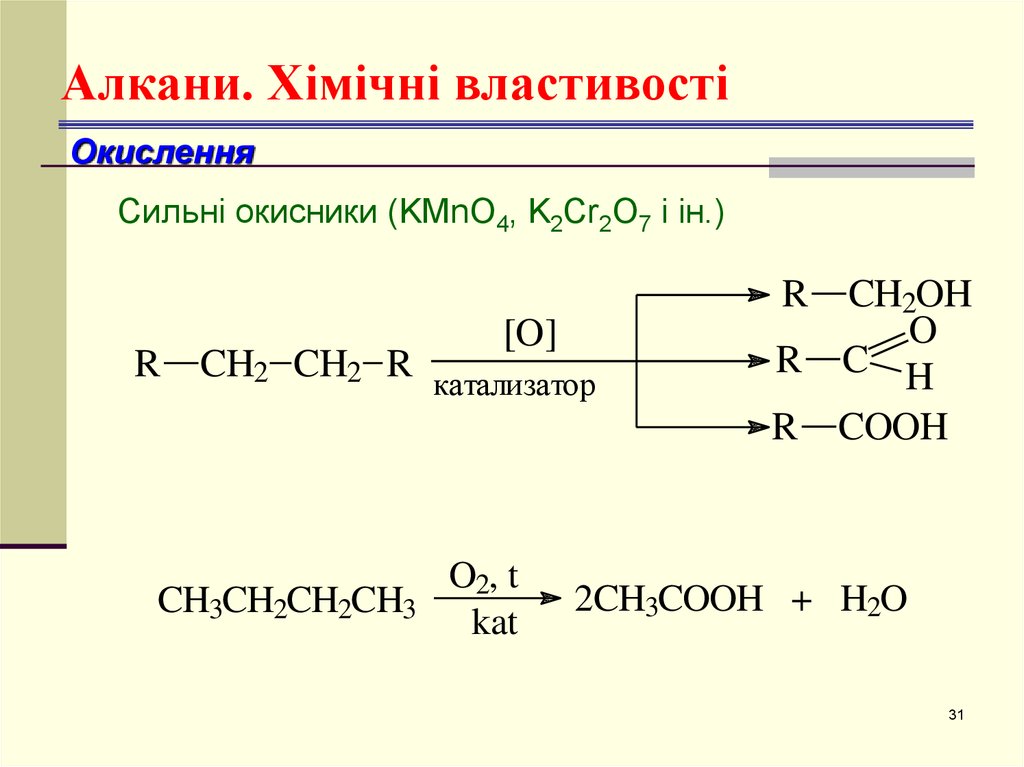
31. Алкани. Хімічні властивості
ОкисленняСильні окисники (KMnO4, K2Cr2O7 і ін.)
R
R
[O]
CH2 CH2 R катализатор
CH3CH2CH2CH3
O2, t
kat
CH2OH
O
R C H
R COOH
2CH3COOH + H2O
31
32.
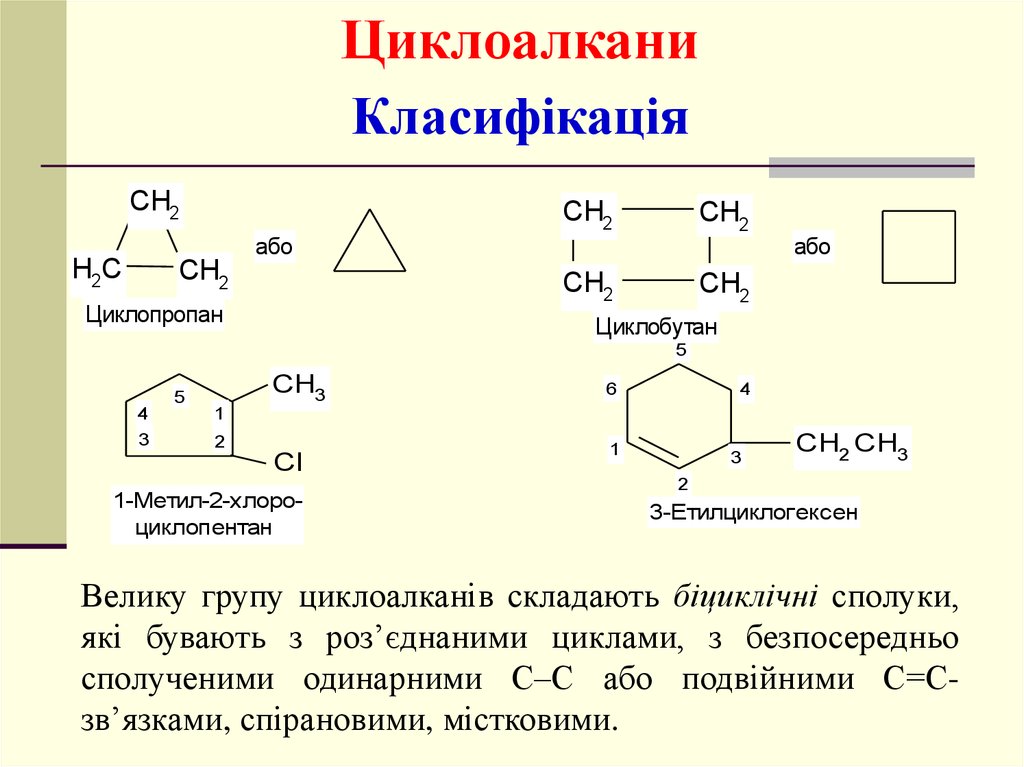
ЦиклоалканиКласифікація
CH2
CH2
CH2
або
H2C
CH2
CH2
Циклопропан
або
CH2
Циклобутан
5
CH3
5
4
3
6
4
1
2
Cl
1-Метил-2-хлороциклопентан
1
3
CH2 CH3
2
3-Етилциклогексен
Велику групу циклоалканів складають біциклічні сполуки,
які бувають з роз’єднаними циклами, з безпосередньо
сполученими одинарними С–С або подвійними С=Сзв’язками, спірановими, містковими.
33.
Класифікація: циклоалканиСпіранові сполуки містять спільний (вузловий) атом Карбону
для двох циклів. Їх назва починається з префікса спіро-, а далі
в квадратних дужках вказується кількість атомів Карбону
спочатку меншого циклу, а потім, після крапки – більшого
циклу (вузловий атом у дужках не позначається).
1
8
7
2
2
7
4
6
5
1
9
8
4
3
Спіро[3.4]октан
6
5
3
Спіро[3.5]нона-1,5,7-триєн
34.
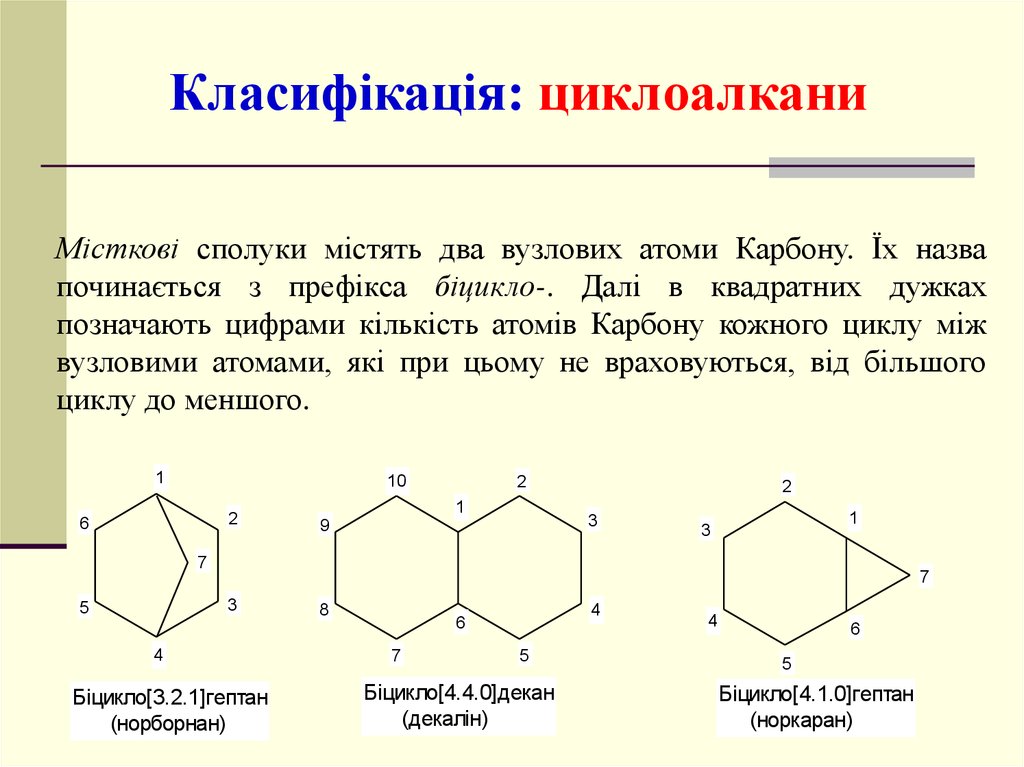
Класифікація: циклоалканиМісткові сполуки містять два вузлових атоми Карбону. Їх назва
починається з префікса біцикло-. Далі в квадратних дужках
позначають цифрами кількість атомів Карбону кожного циклу між
вузловими атомами, які при цьому не враховуються, від більшого
циклу до меншого.
1
10
2
6
2
1
2
3
9
1
3
7
7
3
5
4
Біцикло[3.2.1]гептан
(норборнан)
8
4
6
7
5
Біцикло[4.4.0]декан
(декалін)
4
6
5
Біцикло[4.1.0]гептан
(норкаран)
35.
Структурна ізомерія залежить від величинициклу, природи зімсника, їх взаємного розташування
і поділяється на такі види:
1. Ізомерія розміру циклу:
2. Ізомерія положення замісника:
3. Ізомерія бічних ланцюгів:
4. Ізомерія за кількістю атомів Карбону в бічних
замісниках:
Cl
Cl
2
H
2
1
H
3
H
цис-1,2-Дихлороциклопропан (Z-ізомер)
H
Cl
1
H
H
H
3
Cl
H
транс-1,2-Дихлороциклопропан (Z-ізомер)
36.
Енантіомерія аліциклічних сполук виникає при наявностіхірального атома Карбону і відсутності елементів симетрії, в
першу чергу площини симетрії. Так, циклопропан з двома
замісниками в транс-1,2-положенні або з двома різними як у
транс-1,2-положенні, та і в цис-1,2-положенні існує у вигляді
енантіомерів:
Д
з
H
е
р
H
Cl к
H
а
л
Енантіомери (не
о
суміщаються при
накладанні)
H
Cl
Cl
H
H
Cl
H
H
транс-1,2-Дихлороциклопропан (Z-ізомер)
Д
з
H
е
р
H3C
Cl к
H
а
л
Енантіомери (не
о
суміщаються при
накладанні)
H
H
CH3
H H3C
CH3 H
H
CH3
H
Cl
CH3
H
цис-1-Метил-2-хлороциклопропан
H3C
H
H
H
CH3 H
H
H
CH3
H
CH3
37.
Конформаційна ізомерія циклоалканів пов’язана зособливостями їх будови. Передумовою сучасного трактування
будови циклічних сполук була теорія напруження А. Байєра
(1885 р.), який виходив з їх плоскої будови і пояснював
стійкість циклів відхиленням їх валентних кутів від
тетраедричного кута 109 28 у метані, оскільки атоми Карбону в
насичених циклоалканах знаходяться в стані sp3-гібридизації.
Отже, відхилення від цього кута є мірою стійкості циклу, або
мірою його реакційної здатності:
900
1080
600
22044'
22044'
1200
9044'
n
3
4
5
6
7
22044'
9044'
0044'
-5016'
-9033'
38.
Конформаційна ізомерія циклоалканівПодальшим розвитком теоретичних уявлень будови
циклоалканів була теорія конформаційного аналізу К. Пітцера
(1947 р.), яка враховувала торсійні напруження, що приводило
до зміни конформацій циклу.
Так, циклопентан існує у вигляді фігури, що нагадує
конверт:
39.
HaHa
He
He
He
He
He
He
He
Ha
Ha
Ha
Ha
He
He
He
Ha
Ha
Ha
Ha
He
He
Ha
Ha
C3
C3
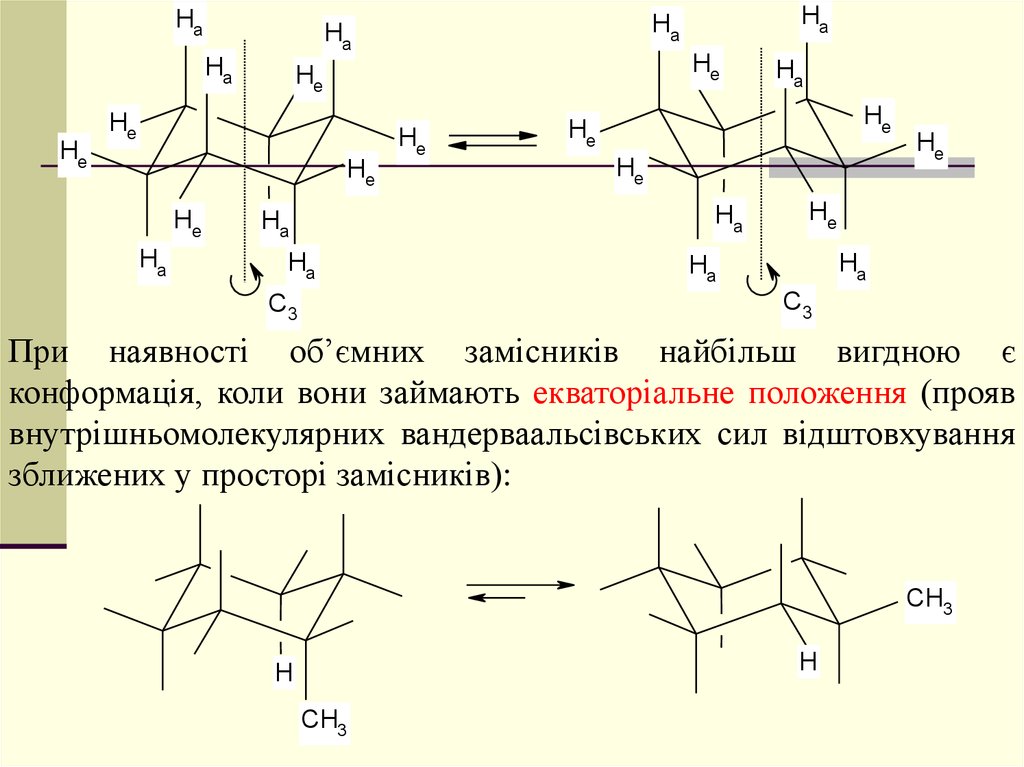
При наявності об’ємних замісників найбільш вигдною є
конформація, коли вони займають екваторіальне положення (прояв
внутрішньомолекулярних вандерваальсівських сил відштовхування
зближених у просторі замісників):
CH3
H
H
CH3
40.
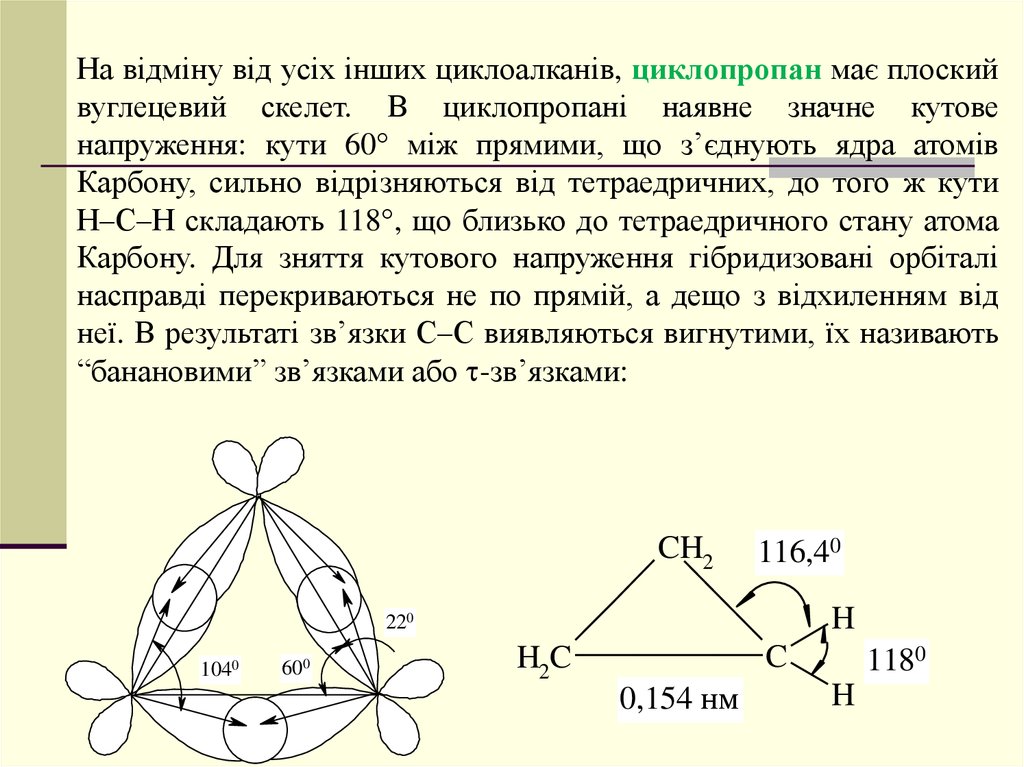
На відміну від усіх інших циклоалканів, циклопропан має плоскийвуглецевий скелет. В циклопропані наявне значне кутове
напруження: кути 60 між прямими, що з’єднують ядра атомів
Карбону, сильно відрізняються від тетраедричних, до того ж кути
Н–С–Н складають 118 , що близько до тетраедричного стану атома
Карбону. Для зняття кутового напруження гібридизовані орбіталі
насправді перекриваються не по прямій, а дещо з відхиленням від
неї. В результаті зв’язки С–С виявляються вигнутими, їх називають
“банановими” зв’язками або -зв’язками:
CH2
116,40
H
220
1040
600
H2C
C
0,154 нм
1180
H
41.
Хімічні властивості циклоалканів:реакції приєднання
800
+ H2
Pt, Ni
H3C
CH2 CH3
2000
+ H2
H3C
CH2 CH2 CH3
3000
+ H2
H3C
CH2 CH2 CH2 CH3
3000
Pt
t
+ X2
X
CH2 CH2 CH2 X (де Х - Br, I)
42.
Хімічні властивості: реакції приєднання+ HBr
CH3 CH2 CH2 Br
+ HI
CH3 CH2 CH2 CH2 I
Хімічні властивості: реакції окиснення
OH
O2
[O]
O
C
-H2O
Циклогексан
Циклогексанол
Циклогексанон
2O2
HOOC
(CH2)4
COOH
Адипінова кислота
43.
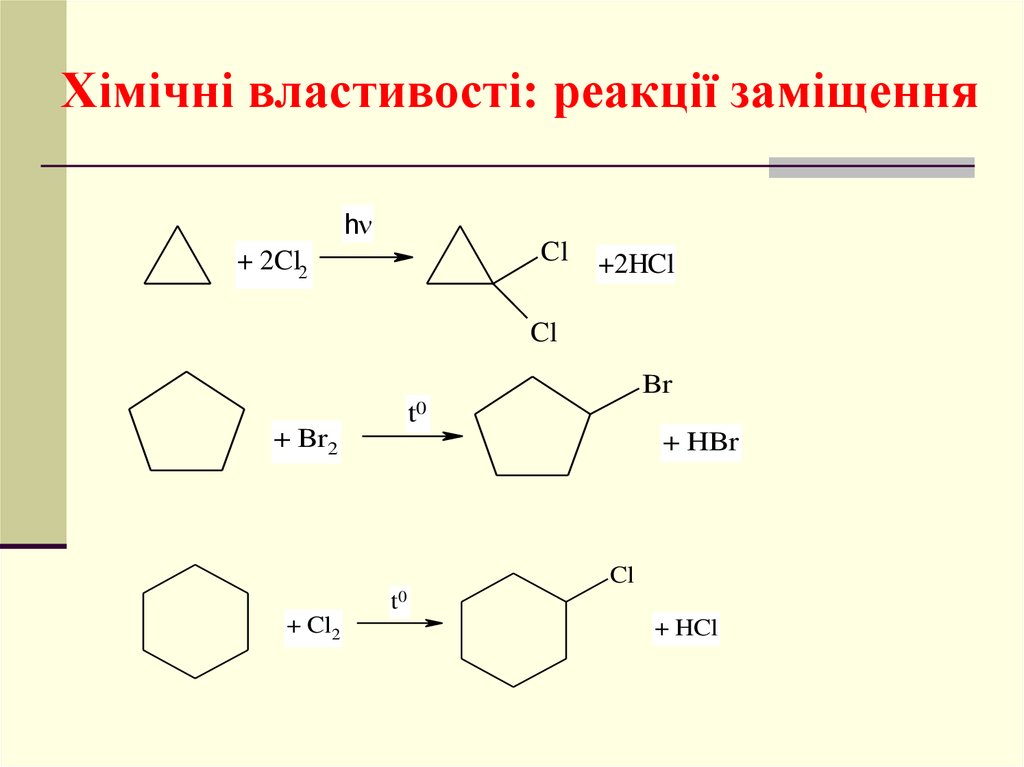
Хімічні властивості: реакції заміщенняh
Cl
+ 2Cl2
+2HCl
Cl
Br
t0
+ Br2
+ HBr
Cl
t0
+ Cl2
+ HCl
44.
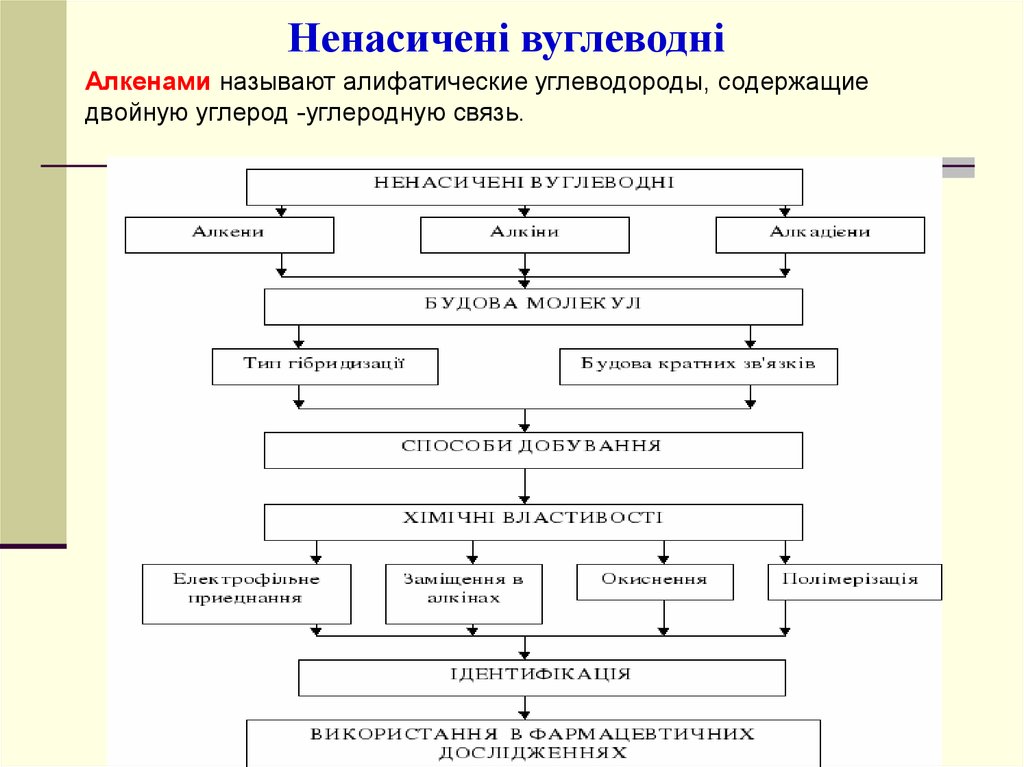
Ненасичені вуглеводніАлкенами называют алифатические углеводороды, содержащие
двойную углерод -углеродную связь.
45.
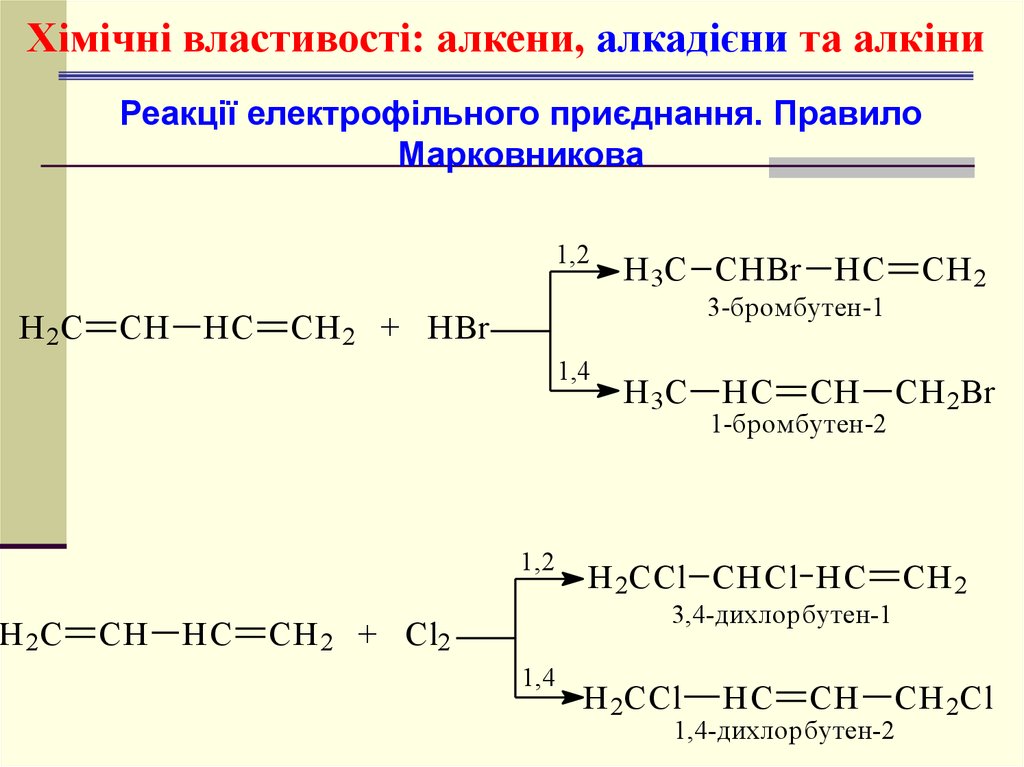
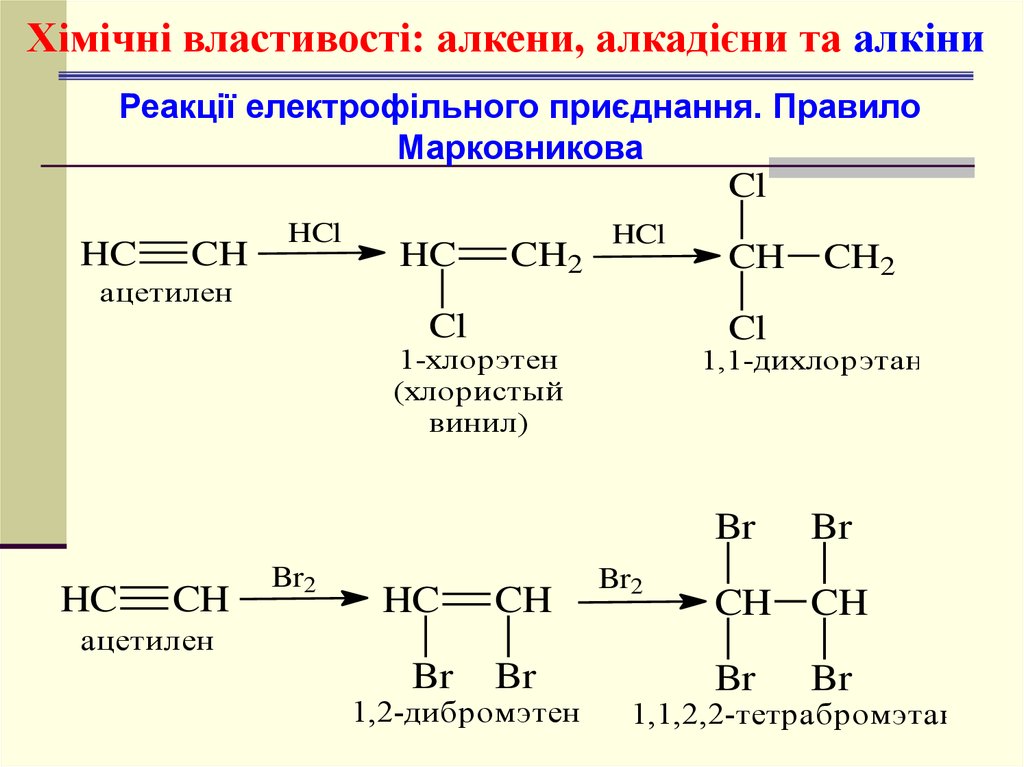
Хімічні властивості: алкени, алкадієни та алкіниРеакції електрофільного приєднання.
Правило Марковникова
CH3 CH CH2
Br
H
2-бромпропан
CH3 CH CH2 + HBr
пропен
CH3 CH CH2
H
Br
1-бромпропан
(не образуется)
CH3
-
CH CH2
+
H
CH3
+
CH
CH3
вторичный карбкатион
CH3
CH2
+
CH2
первичный карбкатион
46.
Хімічні властивості: алкени, алкадієни таалкіни
Реакції електрофільного приєднання. Правило
Марковникова
-
Br
C
C
+
Br
-комплекс
C
Br
+
C
Br
-комплекс
Br
C
C
+
Br
циклический
ион бромония
C
Br
C
47.
Хімічні властивості: алкени, алкадієни та алкіниРеакції електрофільного приєднання. Правило
Марковникова
1,2
H 2C
CH
HC
CH 2 + HBr
1,2
CH
HC
HC
CH 2
3-бромбутен-1
1,4
H 2C
H 3C CHBr
H 3C
HC
CH
CH 2Br
1-бромбутен-2
H 2CCl CHCl HC
CH 2
H 2CCl
CH 2Cl
3,4-дихлорбутен-1
CH 2 + Cl2
1,4
HC
CH
1,4-дихлорбутен-2
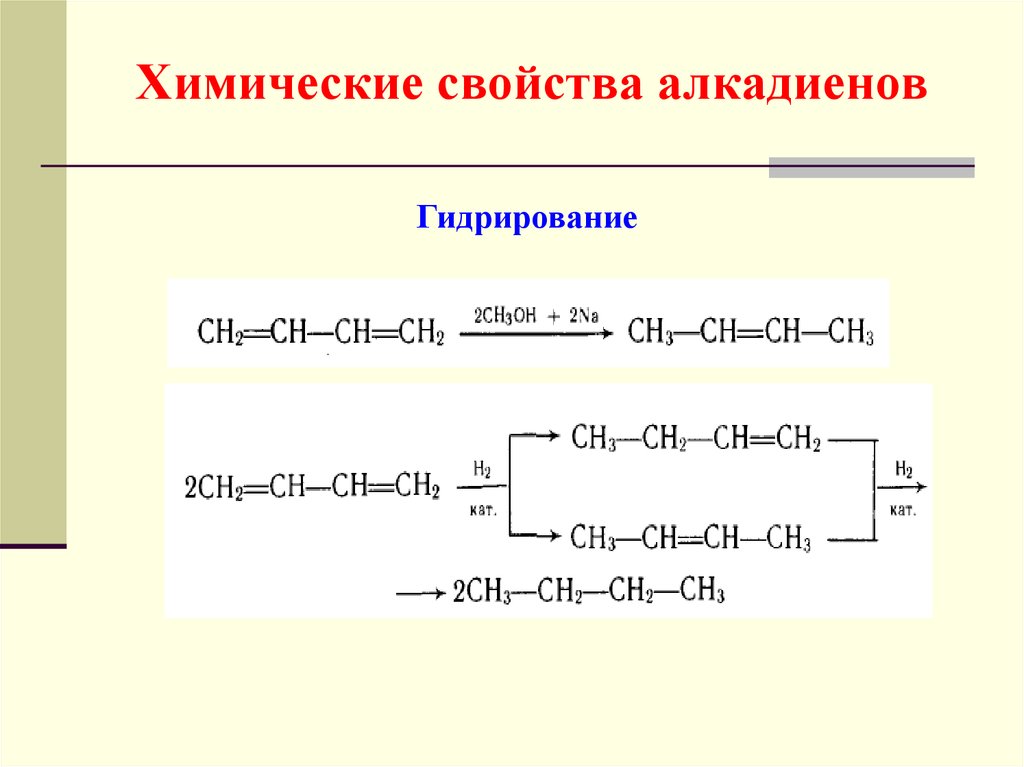
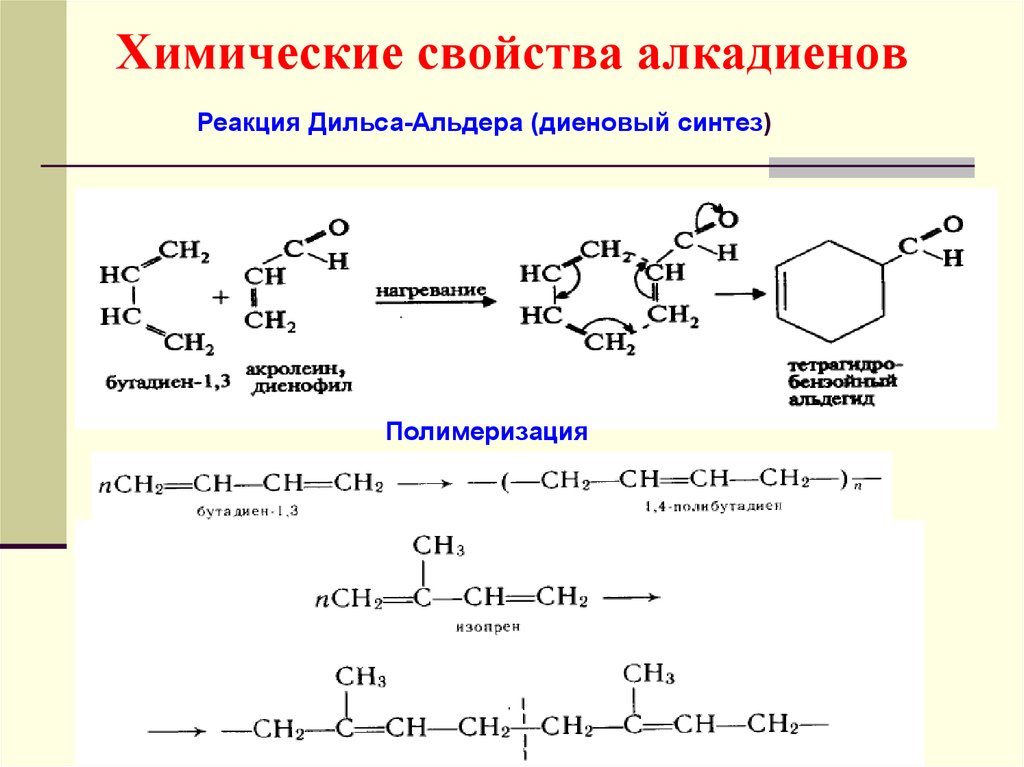
48. Химические свойства алкадиенов
Гидрирование49. Химические свойства алкадиенов
Реакция Дильса-Альдера (диеновый синтез)Полимеризация
50.
Хімічні властивості: алкени, алкадієни та алкіниРеакції електрофільного приєднання. Правило
Марковникова
Cl
HC
CH
HCl
HC
ацетилен
CH2
HCl
Cl
HC
CH
HC
CH
CH2
Cl
1-хлорэтен
(хлористый
винил)
Br2
CH
1,1-дихлорэтан
Br2
Br
Br
CH
CH
Br
Br
ацетилен
Br
Br
1,2-дибромэтен
1,1,2,2-тетрабромэтан
51.
Механізм реакції електрофільного приєднанняАЕ
-
Br
C
C
+
C
Br
Br
+
C
C
Br
Br
-комплекс
C
C
+
Br
Br
циклічний
йон
циклический
бромонію
ион
бромония
-комплекс
+
H
H
C
+
+ H
C
C
C
C
-комплекс
H
C
H
+
C
sp3 sp2
+ X
-
C
C
-орбиталь
рpz-zорбіталь
X
C
+
C
H
C
+C
sp3 sp3
sp3
sp2
52.
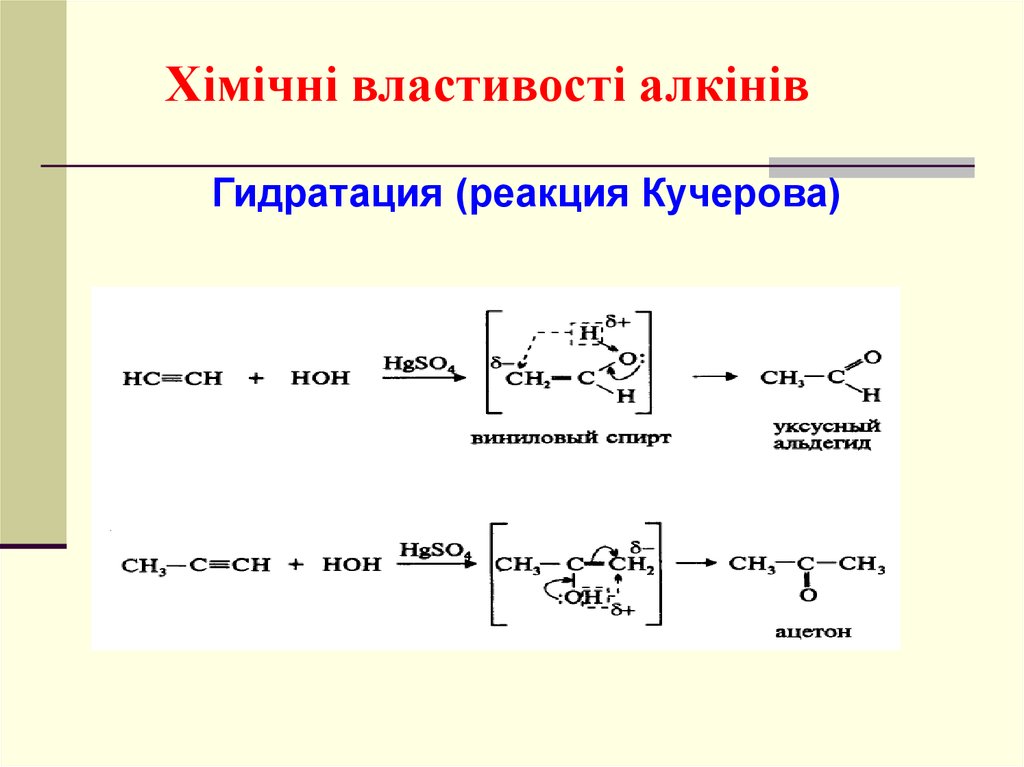
Хімічні властивості алкінівГидратация (реакция Кучерова)
53.
Реакции замещения алкиновОбразование ацетиленидов
54.
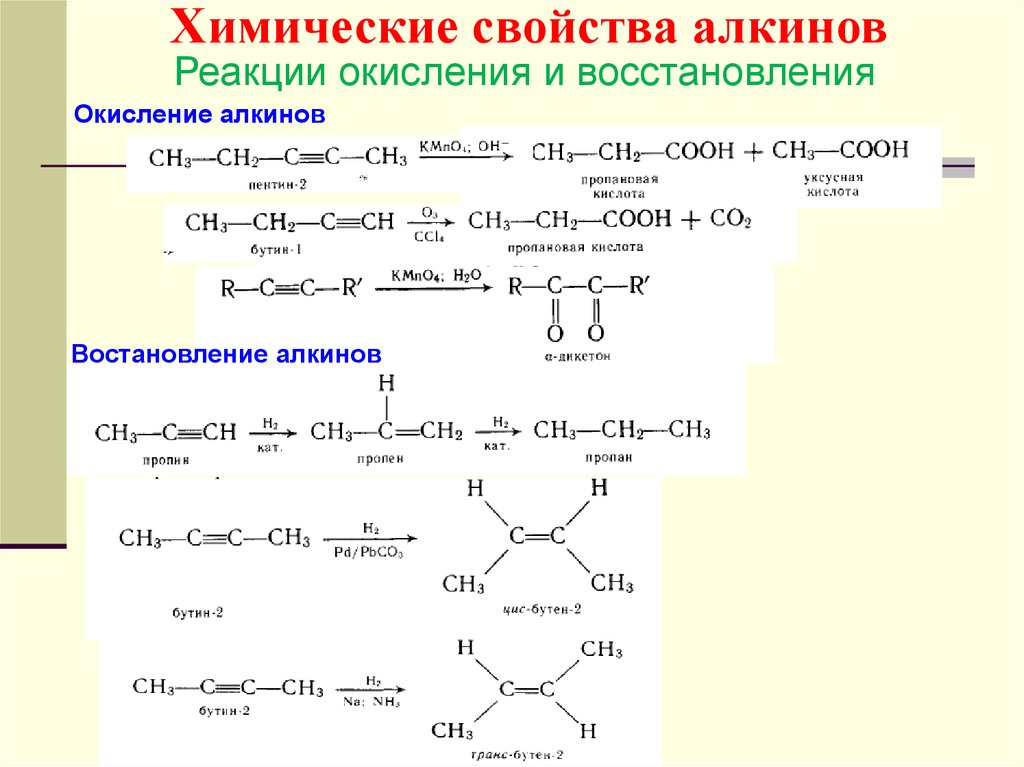
Химические свойства алкиновРеакции окисления и восстановления
Окисление алкинов
Востановление алкинов
55.
Химические свойства алкиновДимеризация, тримеризация и тетрамеризация
























 Химия
Химия








