Похожие презентации:
Окислительно-восстановительные реакции (ОВР)
1.
ПРЕПОДАВАТЕЛЬ: ЛЯСКЕВИЧ Л.Н.2.
Задание № 1Определите степени окисления атомов
химических элементов по формулам их
соединений:
H2S, O2, NH3, HNO3, Fe, K2Cr2O7
3.
Окислительно-восстановительныереакции (ОВР) – это реакции,
в процессе которых меняется степень
окисления двух элементов, один из
которых является окислителем, а
другой – восстановителем
4.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
5.
Отдает или принимает?Задание № 2
Определите число принятых или отданных
электронов
Установите окислитель, восстановитель и какой
процесс вследствие этого протекает(окисление
или восстановление)
S+6 + 6 e- S0
+ 8 e+6
S
Cu0
Cu+2
- 2 e-
- 4 e0
C
S-2
окислитель, процесс
восстановление
Окислитель, процесс
восстановление
Восстановитель,окисление
C+4 окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает е-
принимает е-
6.
- электроны0
+
*H2 - 2ē 2H
-2
0
*S - 2ē S
0
+3
*Al - 3ē Al
*Fe+2 - ē Fe+3
0
*2Br - 2ē Br2
7.
+электроны+4
+2
*Mn + 2ē Mn
*S0 + 2ē S-2
*Cr+6 +3ē Cr+3
0
*Cl2 +2ē 2Cl
*O20 + 4ē 2O-2
8.
Правила составления (алгоритм)окислительно –
восстановительных реакций
(ОВР)
9.
Составим уравнение окислительно-восстановительной реакции4
0
5
+1
+6
-2
4
+2 +6
Mg0 - 2e Mg+2 2
8
+6
+
8e
-2
S
S
8
-2
+1 -2
4
+1
-2
4 восстановитель,
1 окислитель, восстанавливается
10.
ДОМАШНЕЕ ЗАДАНИЕ1.Укажите ОВР:
а) PH₃
б) KOH
в) CO₂
г) P₂O₅
+ 2O₂ = H₃PO₄
+ HCl = KCl + H₂O
+ CaO = CaCO₃
+ H₂O = 2HPO₃
2.Укажите какие процессы происходят:
а) N⁰₂ - 4e→ 2N⁺²
б) S⁺⁶ + 2e→ S⁺⁴
в) Fe⁰ - 3e→ Fe⁺³
г) P⁺³ + 2e→ P⁺⁵
3.Cоставьте ОВР методом электронного баланса. Определите окислитель
и восстановитель.
а) S + N₂O→ SO₂ + N₂
б) Br₂ + Zn → ZnBr₂
в) HBr + O₂ → H₂O + Br₂
г) Fe₂O₃ + H₂→ H₂O + Fe
11.
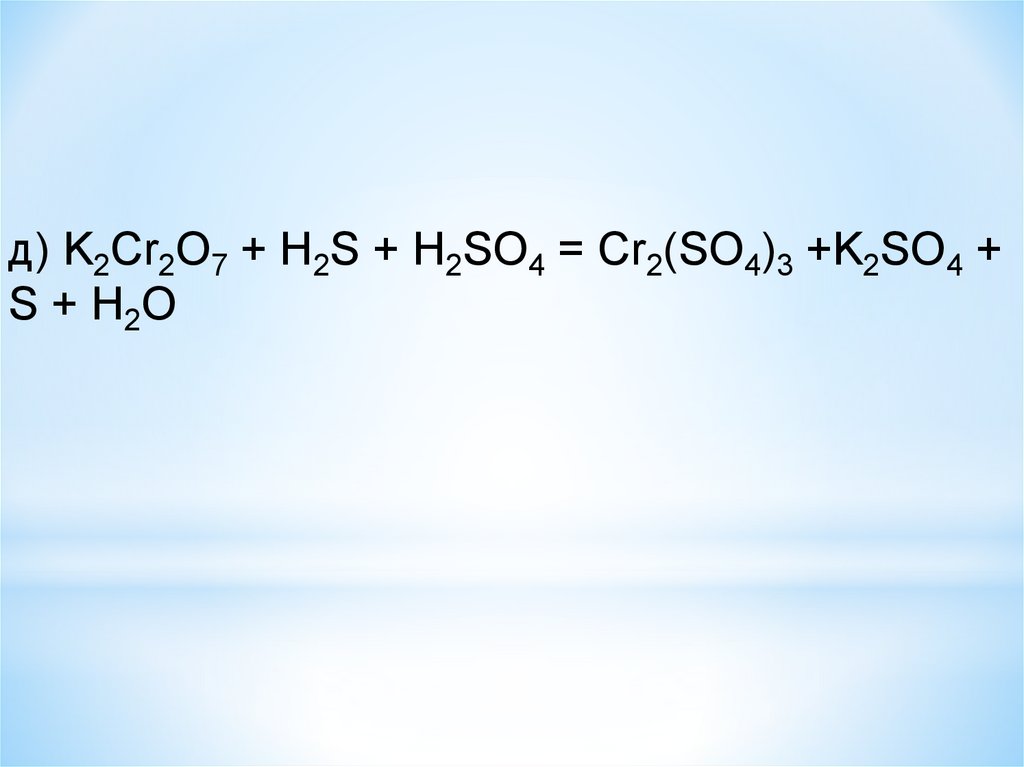
д) K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 +K2SO4 +S + H2O












 Химия
Химия








