Похожие презентации:
Условия протекания реакций обмена в растворах электролитов до конца
1. УСЛОВИЯ ПРОТЕКАНИЯ РЕАКЦИЙ ОБМЕНА В РАСТВОРАХ электролитов ДО КОНЦА
Цель урока:Изучить возможность протекания реакций
обмена в растворах электролитов
2. Проблема
Всели реакции обмена
между растворами
электролитов
возможны?
3. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически
осуществимы, если:
4. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически
осуществимы, если:
1. Выпадает осадок
5. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически
осуществимы, если:
1. Выпадает осадок
СuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
6. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически
осуществимы, если:
1. Выпадает осадок
СuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
2. Образуется вода
7. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически
осуществимы, если:
1. Выпадает осадок
СuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
2. Образуется вода
NaOH+HCl=NaCl+H2O
ф-фт
8.
Реакции обмена в растворах идут доконца, т.е. практически
осуществимы, если:
1. Выпадает осадок
СuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
2. Образуется вода
NaOH+HCl=NaCl+H2O
ф-фт
3. Выделяется газ
9. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически
осуществимы, если:
1. Выпадает осадок
СuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
2. Образуется вода
NaOH+HCl=NaCl+H2O
ф-фт
3. Выделяется газ
Na2CO3+2HCl=
10. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически осуществимы,
если:
1. Выпадает осадок
СuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
2. Образуется вода
NaOH+HCl=NaCl+H2O
ф-фт
3. Выделяется газ
Na2CO3+2HCl= 2NaCl+H2O+CO2↑
11. Определение возможности протекания реакций обмена в растворах до конца
Реакции обмена в растворах идут доконца, т.е. практически осуществимы,
если:
1. Выпадает осадок
2. Образуется вода
3. Выделяется газ
Если нет ↑, ↓, H2O – реакция
практически
неосуществима
12. Реакции обмена в быту
1.Выпечка блинчиков с применением питьевой соды
(гидрокарбоната натрия)
NaHCO3+CH3COOH=CH3COONa+H2O+CO2↑
уксусная
кислота
13. Реакции обмена в быту
Благодаря содержанию фосфатов в
средстве «Calgon» вода становится
более мягкой
2Na3PO4 + 3CaCl2 = Ca3(PO4)2 ↓ + 6 NaCl
14. Реакции обмена в быту
Удаление ржавчины
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
15. Реакции обмена в быту
Работа огнетушителей
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
16. Реакции обмена в быту
Удаление накипи
CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑
17. Реакции обмена в быту
В медицине, при изжоге, вызваннойизбытком в желудочном соке соляной
кислоты, применяют питьевую соду
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
18. Реакции обмена в быту
В сельском хозяйстве для уменьшениякислотности почвы применяют
известкование
CaCO3 + 2HNO3 = Ca(NO)2 + H2O + CO2 ↑
19. Реакции обмена в быту
Под воздействием кислотных дождей идётразрушение мраморных скульптур и
облицовочного камня из мрамора.
CaCO3 + H2SO3 = CaSO3 + H2O + CO2 ↑
В результате этой
реакции на поверхности
мрамора образуется
рыхлый тусклый
порошок сульфита
кальция
20.
Алгоритм составления ионного уравненияреакции
1. Записать молекулярное уравнение реакции:
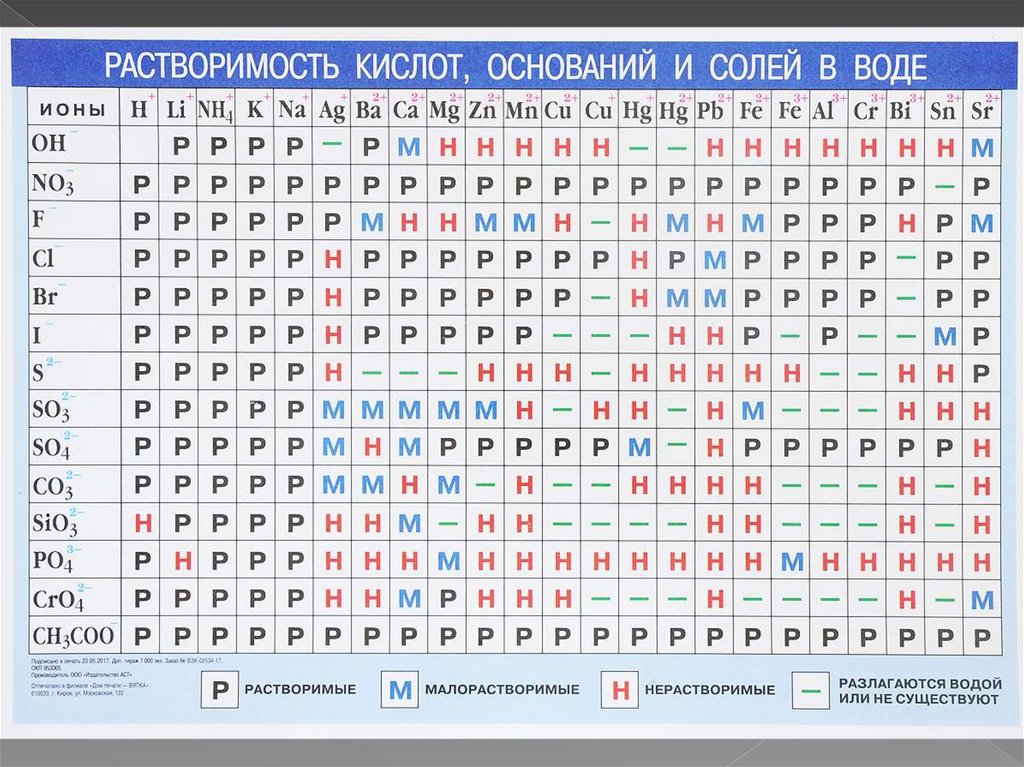
2. С помощью таблицы растворимости определить
растворимость каждого вещества:
3. Решить, уравнения диссоциации каких исходных
веществ и продуктов реакции нужно записывать:
4. Составить полное ионное уравнение (коэффициент пере
молекулой = коэффициенты перед ионами):
5.Найти одинаковые ионы и сократить их:
6. Записать сокращенное ионное уравнение
21.
22.
Молекулярное уравнение:Сa(OH)2 + 2HCl =СaCl2 + 2H2O;
р
р
р
Полное ионное уравнение:
Сa+ + 2OH– + 2H+ + 2Cl– = Сa2+ + 2Cl– + 2H2O,
Сокращенное ионное уравнение:
OH– + H+ = H2O;
23. Д/З- составить полные и сокращённые ионные уравнения (где возможно)
CaCO3+ H2SO3 = CaSO3 + H2O + CO2 ↑
2Na3PO4 + 3CaCl2 = Ca3(PO4)2 ↓ + 6 NaCl
2NaOH + H2S= Na2S +2H2O
2 KCL+Na2SO4=K2SO4+2NaCL
24.
1. Определите, в каком случае реакция протекает до конца:а) MgSO4 + Ba(NO3)2 →
б) MgCl2 + Ba(NO3)2 →
в) BaCl2 + Mg(NO3)2 →
г) BaSO4 + Mg(NO3)2 →
2. Определите в каком случае реакция обратима:
а) AgNO3 + NaCl →
б) MgCl2 + Na2SO4 →
в) K2CO3 + HCl →
г) H3PO4 + KOH →
25. Мой кластер
Реакцииионного
обмена
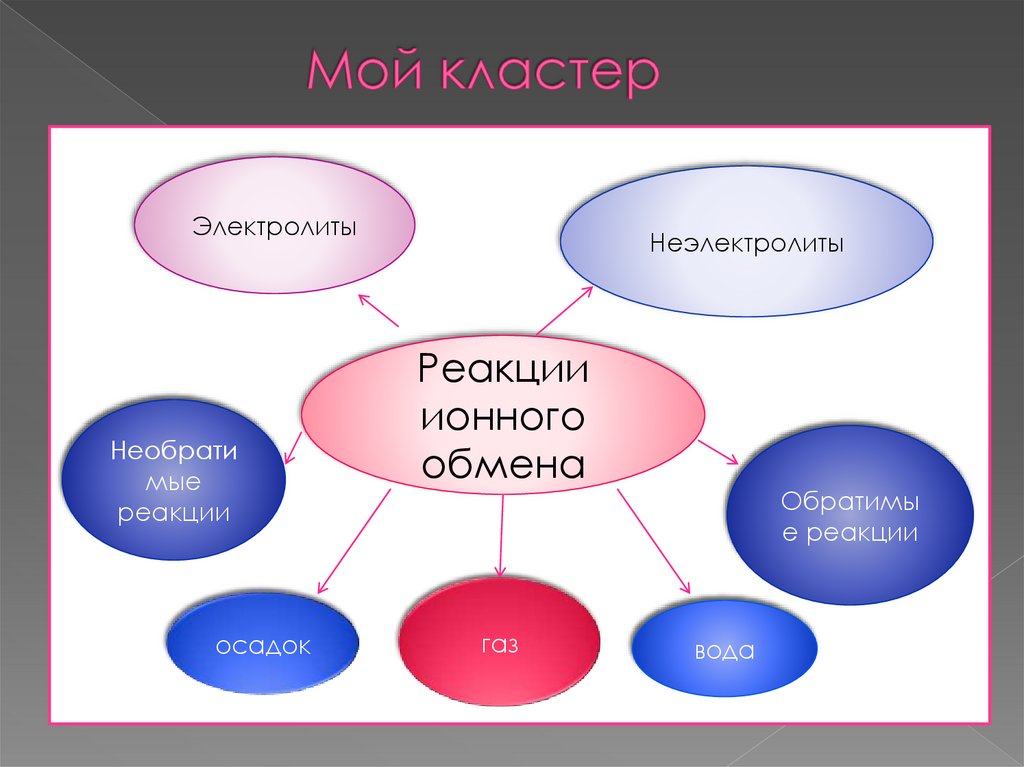
26. Мой кластер
ЭлектролитыНеобрати
мые
реакции
осадок
Неэлектролиты
Реакции
ионного
обмена
газ
Обратимы
е реакции
вода























 Химия
Химия








