Похожие презентации:
Реакции ионного обмена и условия их протекания
1. Тема урока:
Реакции ионного обмена иусловия их протекания.
2. Цель урока:
Изучение реакций ионного обмена иусловий их протекания.
https://youtu.be/8vHOrE4AAlU
3. Эпиграф
Три пути ведут к познанию: путьразмышления – самый благородный,
путь подражания – самый лёгкий, путь
опыта – самый горький!
4. Ответьте на вопросы
1.Какие вещества называютсяэлектролитами? Приведите примеры.
2. Какие вещества называются
неэлектролитами? Приведите примеры.
3. В каком году и кто разработал теорию
электролитической диссоциации?
5. Выполните задания
1.Перечисленные вещества разделитена 2 столбика: в один запишите
электролиты, в другой – неэлектролиты:
р-р КОН, тв.КОН, крист. сахара, Н2SO4,
спирт, дист.вода.
2. Запишите уравнение диссоциации
следующих веществ: КNO3, Ba(OH)2,
HCL, H2SO4
6.
7. Выберите выигрышный путь, как в игре «крестики – нолики, где три вещества являются: 1 вариант – электролитами, 2 вариант –
неэлектролитами.КОН
(раствор)
NaNO3
СО2
AgCl
HNO3
Na2SO4
С12Н22О11
(сахароза)
C2H5OH
(этиловый
спирт)
SiO2
8.
КОН(раствор)
СО2
С12Н22О11
(сахароза)
NaNO3
AgCl
C2H5OH
(этиловый
спирт)
HNO3
Na2SO4
SiO2
9.
10.
11. Реакции между ионами называются ионными реакциями, а уравнения таких реакций – ионными уравнениями.
12. Реакции ионного обмена (РИО) протекают до конца в случае
Выпаденияосадка
Выделения газа
Образования
малодиссоциирующего
вещества(М), например вода.
13. Правила составления ионных уравнений
Простые вещества, оксиды, а также нерастворимыекислоты, основания, соли не диссоциируют.
Для реакции берут растворы веществ, поэтому даже
малорастворимые вещества находятся в растворах в
виде ионов.
Если в результате реакции образовалось
малорастворимое вещество, то при записи ионного
уравнения его считают нерастворимым.
14. Алгоритм составления ионного уравнения
Записать молекулярное уравнение реакции.С помощью таблицы растворимости
определить растворимость каждого
вещества.
Составить полное ионное уравнение (найти
одинаковые ионы и сократить их слева и
справа)
Составить сокращенное ионное уравнение
15. Лабораторная работа Тема: Реакции ионного обмена
Взаимодействиерастворов NaOH и
CuSO4
Взаимодействие
растворов Na2CO3 и HCl
Взаимодействие
растворов NaOH и HCl
16. Взаимодействие растворов NaOH и CuSO4 вставьте ионы!!!!!!
2NaOH + CuSO4Na SO4 +Cu(OH)
2
2
Уравнение в молекулярном виде
2Na +2OH + Cu+SO4
2 Na + SO4 +Cu(OH)2
Уравнение в полном ионном виде
Cu + 2OH
Cu(OH)
2
голубой
Уравнение в сокращенном ионном виде
Время 1.04 -1.12
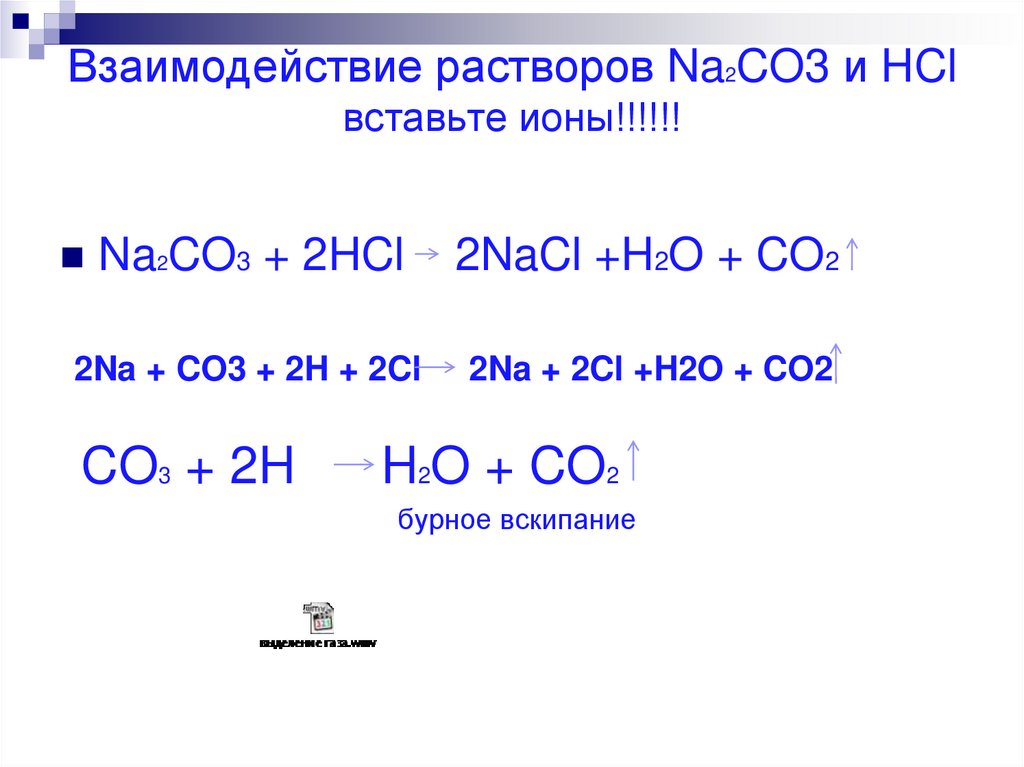
17. Взаимодействие растворов Na2CO3 и HCl вставьте ионы!!!!!!
Na2CO3 + 2HCl2NaCl +H2O + CO2
2Na + CO3 + 2H + 2Cl
2Na + 2Cl +H2O + CO2
CO3 + 2H
H2O + CO2
бурное вскипание
18. Взаимодействие растворов NaOH и HCl (реакция нейтрализации)
NaOH + HClNaCl + H2O
Фенолфт.
Na + OH + H + Cl
OH + H
H 2O
Na + Cl + H2O
исчезновение малиновой окраски
19.
20.
21.
22.
23. Оцените свою работу по направлениям
«Я» - как я себя чувствовал в процессеурока, доволен ли я своей работой;
«Мы» - насколько комфортно и
эффективно мне было работать в
группе;
«Дело» - достиг ли я цели обучения, в
чём испытал затруднения, как
преодолеть проблемы.
24. Домашнее задание
§ 4, упр.1https://youtu.be/0RCFox-oR_o
https://youtu.be/Sx0tldH9Grk
Соляная кислота + нитрат серебра HCl+ AgNO3 - HNO3 + AgCl
H +Cl +Ag + NO3 - H + NO3 + AgCl
Cl +Ag - AgCl
белые хлопья
K2 SO4 + Ba(NO3)2 =
CaCO3 + H2SO3 = CaSO3 + H2O + CO2 ↑
CaCO3 + 2HNO3 = Ca(NO)2 + H2O + CO2 ↑
NaHCO3 + HCl = NaCl + H2O + CO2 ↑
2Na3PO4 + 3CaCl2 = Ca3(PO4)2 ↓ + 6 NaCl
NaHCO3+CH3COOH=CH3COONa+H2O+ CO2↑
























 Химия
Химия








