Похожие презентации:
Амины. Азотсодержащие соединения
1. Амины
2. Азотсодержащие соединения
НитросоединенияR
NO2
Амины
R
..
NH2
..
R NH R'
2
3.
Амины – органические производныеаммиака NH3, в молекуле которого один,
два или три атома водорода замещены на
углеводородные радикалы:
RNH2,
R2NH,
R3N
Простейший представитель –
метиламин:
4. Амины
ПервичныеВторичные
Третичные
CH3 NH2 CH3 NH CH3 CH3
N
CH3
CH3
Метиламин
Диметиламин Триметиламин
4
5. По характеру углеводородного радикала
56. Номенклатура аминов
В большинстве случаев названия аминов образуютиз названий углеводородных радикалов и суффикса
амин:
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в
алфавитном порядке:
CH3-CH2-NH-CH3
Метилэтиламин
7. Номенклатура аминов
При наличии одинаковыхрадикалов используют
приставки ди и три:
(CH3)2NH диметиламин
(CH3)3N триметиламин
8. ПРИМЕРЫ
43
2
1
CH3-CH2-CH2-CH2-NH2
3
2
1
CH3-CH2-CH2-NH2
бутанамин-1
пропанамин-1
8
9. АРОМАТИЧЕСКИЕ АМИНЫ
910. АРОМАТИЧЕСКИЕ АМИНЫ
NH2NH2
H2N
NH2
1,3-Диаминобензол
(м-фенилендиамин)
1.4-Диаминобензол
(п-фенилендиамин)
10
11. АРОМАТИЧЕСКИЕ АМИНЫ
2-Нитроанилин(о-нитроанилин)
NH2
NH2
NO2
NH2
1,2-Диаминобензол
11
12. АРОМАТИЧЕСКИЕ АМИНЫ
NH2NHCH2CH3
C2H5
N
C2H5
CH2CH3
2-Этиланилин
N-Этиланилин
N,N-диэтиланилин
12
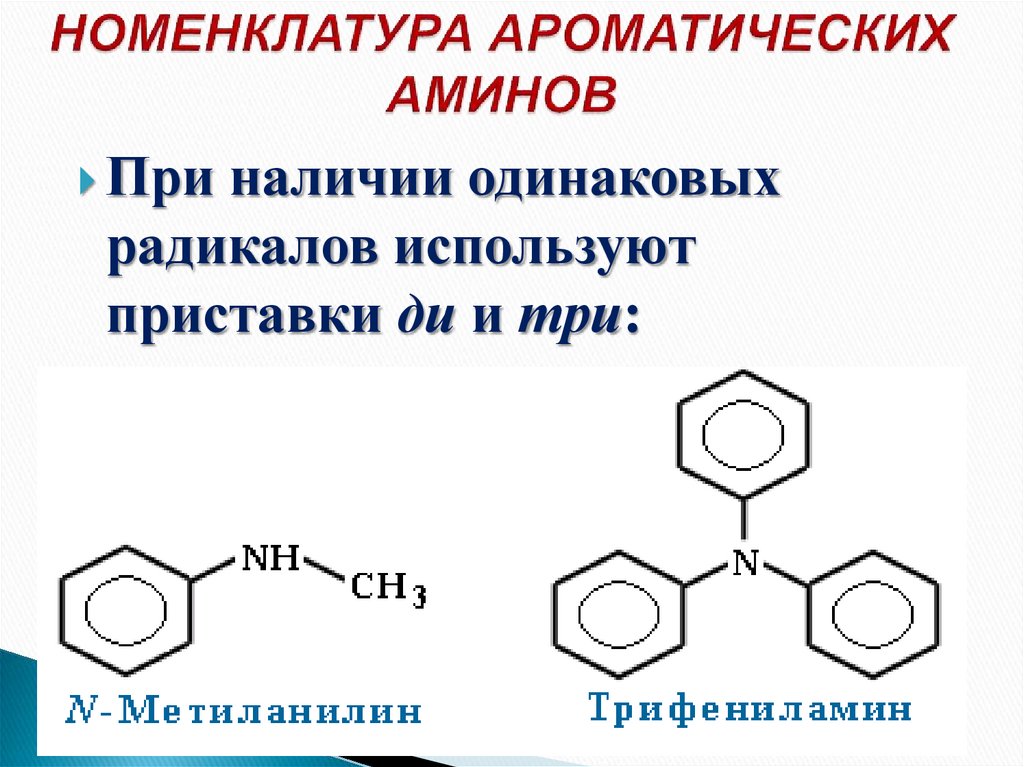
13. НОМЕНКЛАТУРА АРОМАТИЧЕСКИХ АМИНОВ
При наличии одинаковыхрадикалов используют
приставки ди и три:
14. Изомерия аминов
1.Структурная изомерия -
углеродного скелета, начиная с
С4H9NH2:
15. Изомерия аминов
Структурная изомерия - положенияаминогруппы, начиная с С3H7NH2:
16. Изомерия аминов
2. Пространственнаяизомерия - возможна
оптическая изомерия,
начиная с С4H9NH2:
17. Физические свойства аминов
Связь N–H является полярной,поэтому первичные и вторичные
амины образуют межмолекулярные
водородные связи:
18. Физические свойства аминов
Это объясняет относительновысокую температуру кипения
аминов по сравнению с
неполярными соединениями со
сходной молекулярной массой.
Например:
19. Физические свойства аминов
Третичные амины не образуютводородных связей (отсутствует
группа N–H).
Их температуры кипения ниже, чем у
изомерных первичных и вторичных
аминов
триэтиламин кипит при 89 °С, а
н-гексиламин – при 133 °С.
20. Физические свойства аминов
При обычной температуре низшиеалифатические амины CH3NH2, (CH3)2NH и
(CH3)3N – газы (с запахом аммиака),
средние гомологи –
жидкости (с резким
рыбным запахом),
высшие –
твердые вещества без запаха.
Ароматические амины – бесцветные
высококипящие жидкости или твердые
вещества.
21.
22. Химические свойства аминов
23. Химические свойства аминов
2. Взаимодействуя скислотами, амины образуют
соли:
24. 3. Алкилирование (реакция Гофмана, 1850)
нуклеофилCH3
..
+
NH2 + CH3
метиламин
CH3NH2
-[CH3NH3]+Iдиметиламмонийиодид
[CH3NH2CH3]I-
I
иодметан
..
+
CH3NHCH3 + CH3
[(CH3)3NH]I-
I
триметиламмонийиодид
диметиламин
..
+
(CH3)3N + CH3
I
CH3NHCH3
диметиламин
(CH3)2NH
(CH3)3N
-[(CH3)2NH2]+I-
(CH3)4N
триметиламин
+ -
I
тетраметиламмонийиодид
Гофман Фридрих
25. Химические свойства аминов
3. В отличие от аммиака, низшиегазообразные амины способны
воспламеняться от открытого пламени.
Реакция горения (полного окисления)
аминов на примере метиламина:
26. Анилин
(фениламин)С6H5NH2 – важнейший из
ароматических аминов:
27. Анилин
представляет собой бесцветнуюмаслянистую жидкость с характерным
запахом (т. кип. 184 °С, т. пл. – 6 °С). На
воздухе быстро окисляется и приобретает
красно-бурую окраску.
Ядовит!
28. Анилин
Для анилина характерны реакции как поаминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены
взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет
основные свойства аминогруппы по сравнению
алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы
бензольное кольцо становится более активным
в реакциях замещения, чем бензол.
29. Химические свойства анилина:
Например, анилин энергично реагируетс бромной водой с образованием 2,4,6триброманилина (белый осадок). Эта
реакция может использоваться для
качественного определения анилина:
30. Химические свойства аминов
2. Взаимодействуя с кислотами, анилинобразует соли:
Хлорид фениламмония
https://www.youtube.com/watch?v=VNUTpSaWQ0Q
31. Получение аминов
1. Наиболее общим методомполучения первичных аминов
является восстановление
нитросоединений:
32. Получение аминов
Важнейший ароматический амин анилин - образуется при восстановлениинитробензола (восстановители - водород в
присутствии металлических катализаторов,
Fe + HCl):
Эта реакция носит имя русского химика
Н.Н. Зинина, осуществившего ее впервые в
1842 г.
33.
ЗИНИННиколай Николаевич
(25.VIII.1812–18.II.1880)
академик, возглавлял кафедру общей
химии Медико-хирургической академии
в Петербурге, организатор и первый
президент Русского химического
общества. Известен своими работами в
области ароматических
нитросоединений.
NO2
Zn, HCl
нитробензол
нитрозобензол
N
O
NH2
[H]
анилин
(аминобензол)
33
34. Реакция горения анилина
C6H5NH2 + O2 -->CO2 + N2 + H2O
https://www.youtube.com/watch?v=cYtCWMczFFs
35.
36. Применение анилина
Широкое применение вкачестве полупродукта в
производстве витаминов и
лекарственных средств
(сульфаниламидные
препараты)
37.
38. СУЛЬФАНИЛАМИДЫ
39.
Пара-аминосалициловая кислота (ПАСК) была однимиз первых синтетических препаратов, предложенным
для специфического лечения туберкулеза.
Механизм действия парааминосалициловой кислоты
на туберкулезные бактерии
сходен с механизмом
действия сульфаниламида на
другие бактерии.







































 Химия
Химия








