Похожие презентации:
Амины. Азотсодержащие соединения
1. Амины
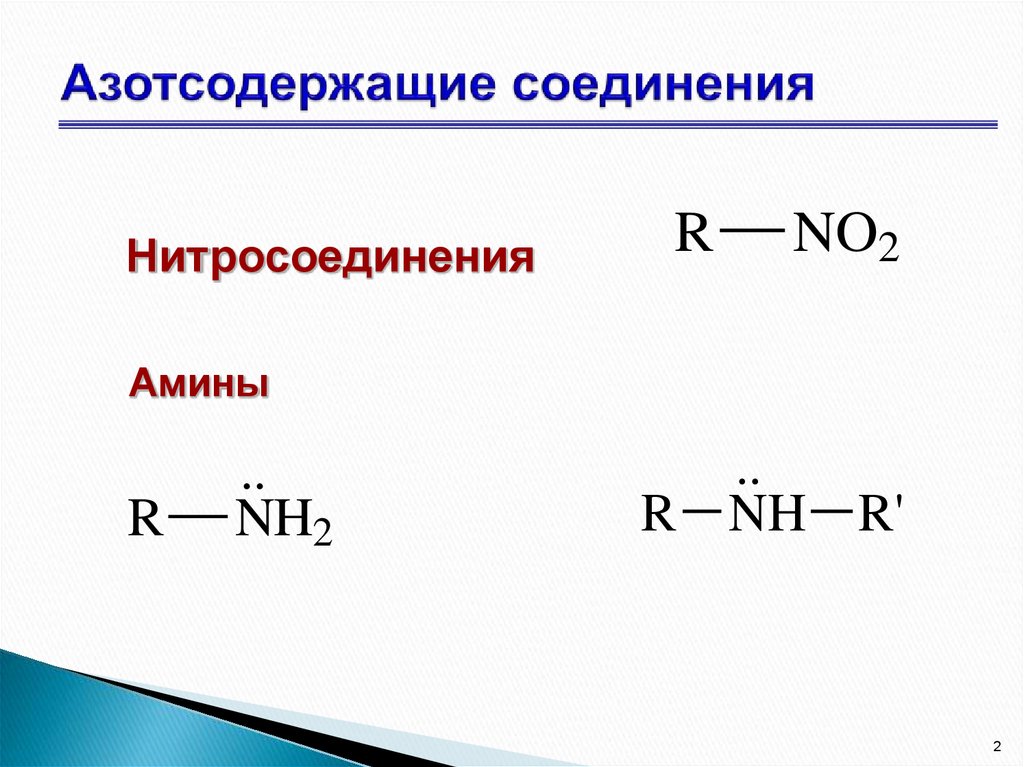
2. Азотсодержащие соединения
НитросоединенияR
NO2
Амины
R
..
NH2
..
R NH R'
2
3.
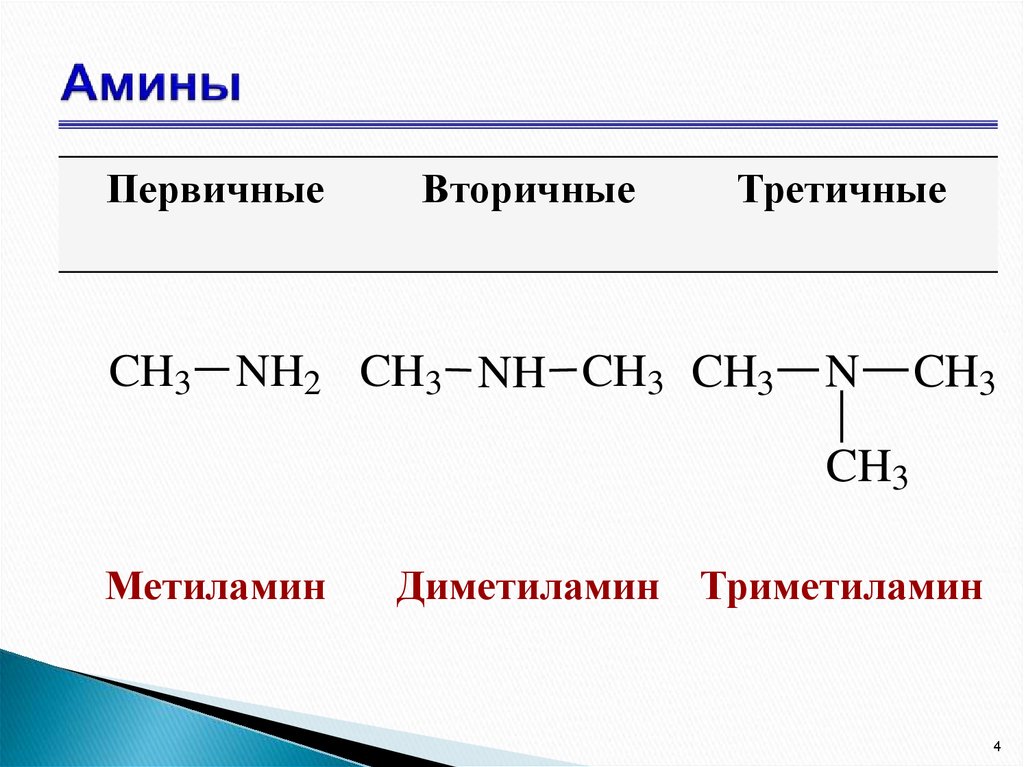
Амины – органические производныеаммиака NH3, в молекуле которого один,
два или три атома водорода замещены на
углеводородные радикалы:
RNH2,
R2NH,
R3N
Простейший представитель –
метиламин:
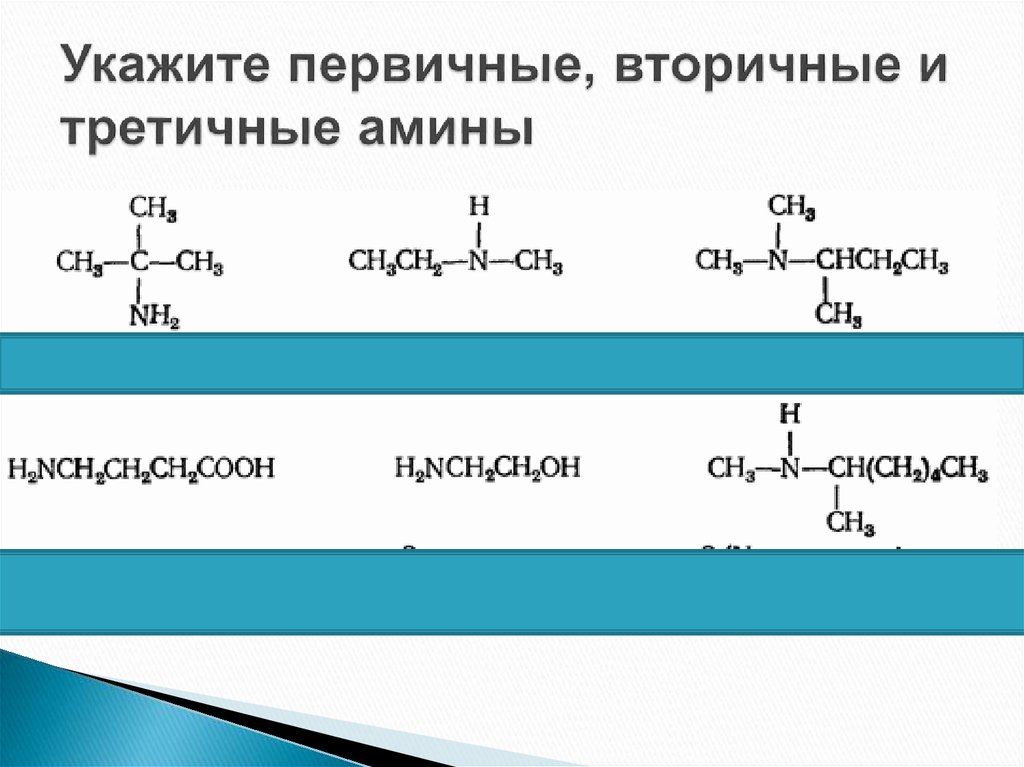
4. Амины
ПервичныеВторичные
Третичные
CH3 NH2 CH3 NH CH3 CH3
N
CH3
CH3
Метиламин
Диметиламин Триметиламин
4
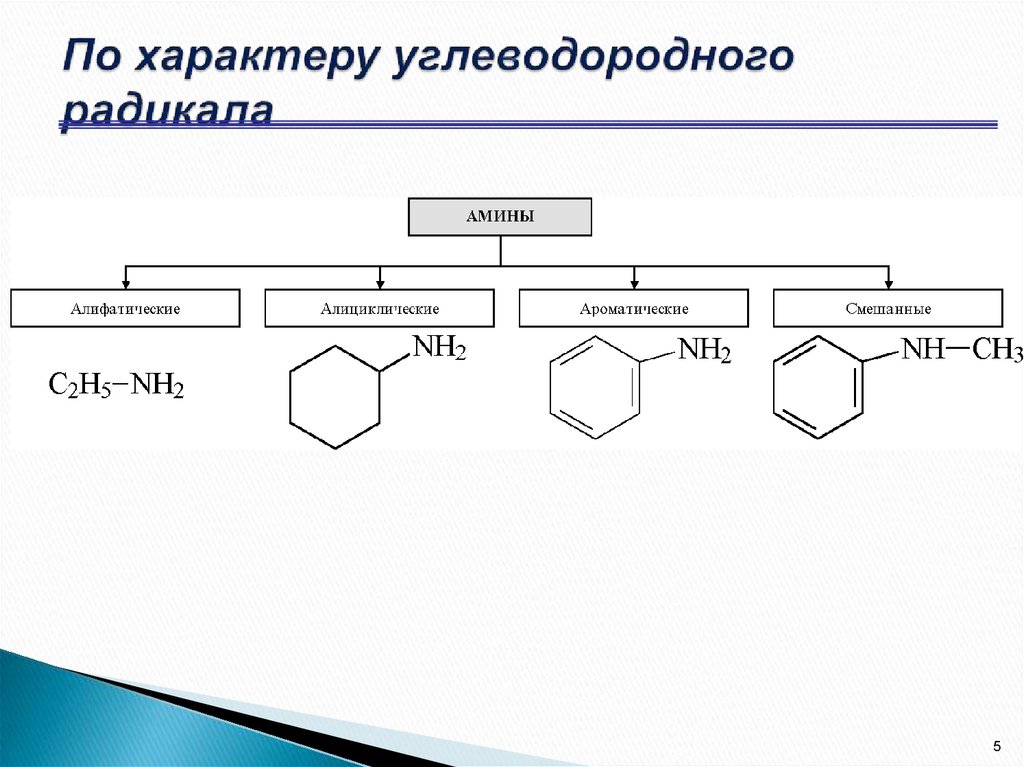
5. По характеру углеводородного радикала
56.
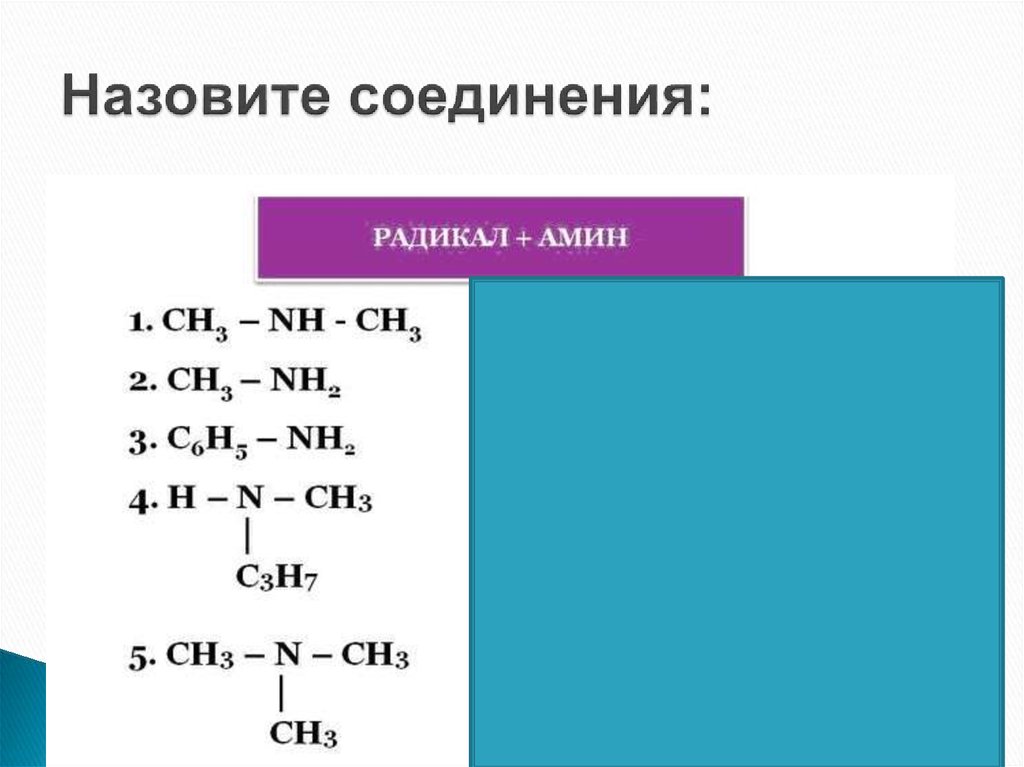
7. Номенклатура аминов
В большинстве случаев названия аминов образуютиз названий углеводородных радикалов и суффикса
амин:
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в
алфавитном порядке:
CH3-CH2-NH-CH3
Метилэтиламин
8. Амины
Номенклатура и изомерия(CH3)2CHCH2NH2
2-метилпропанамин
(изобутиламин)
8
9. Номенклатура аминов
Приналичии одинаковых
радикалов используют
приставки ди и три:
(CH3)2NH Диметиламин
(CH3)3N
(триметиламин)
10. Амины
Номенклатура и изомерияH2NCH2CH2CH2CH2NH2
H2NCH2CH2CH2CH2CH2NH2
бутандиамин-1,4
пентандиамин-1,5
10
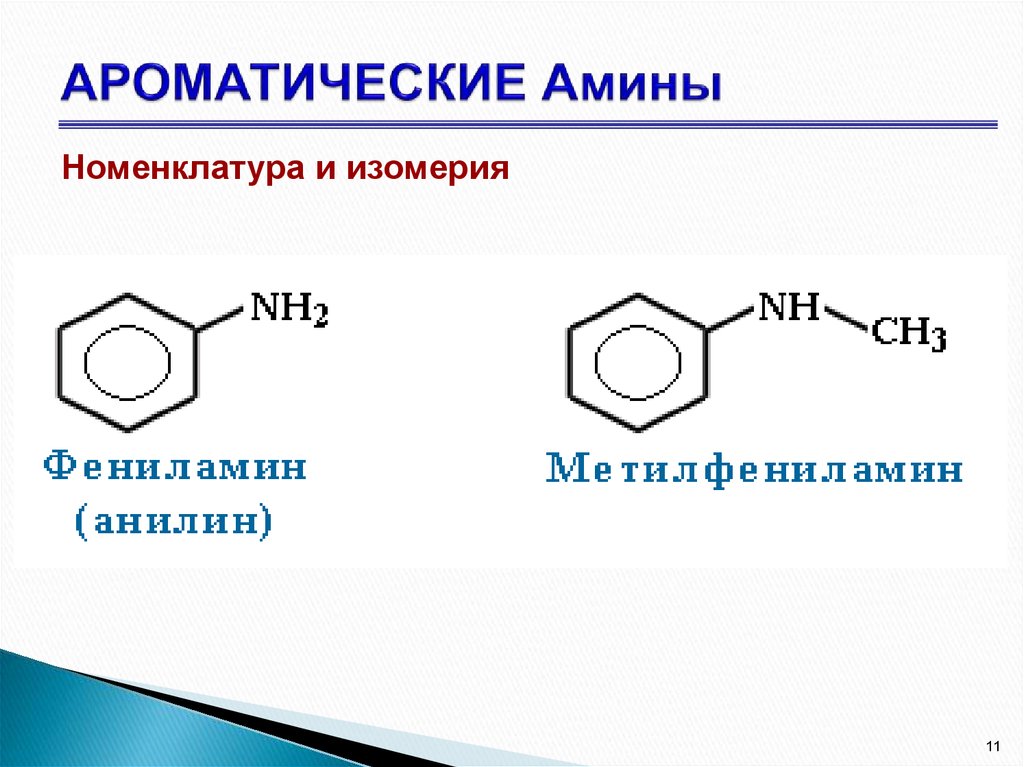
11. АРОМАТИЧЕСКИЕ Амины
Номенклатура и изомерия11
12. АРОМАТИЧЕСКИЕ Амины
Номенклатура и изомерия2-Нитроанилин
(о-нитроанилин)
NH2
NH2
NO2
NH2
1,2-Диаминобензол
12
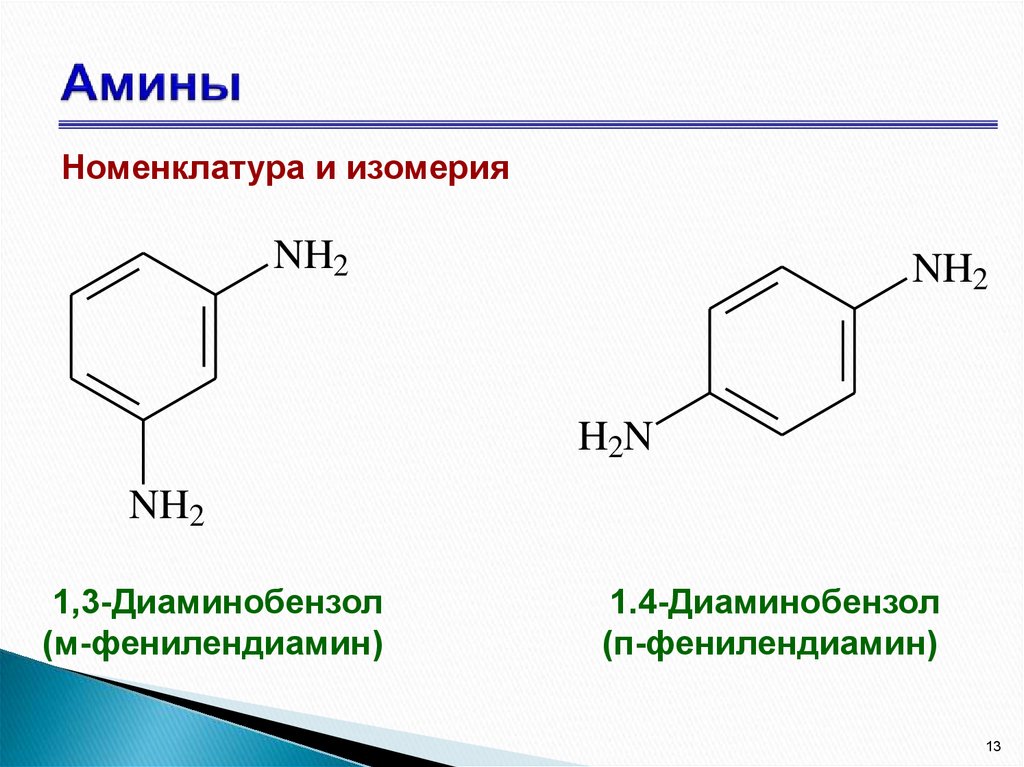
13. Амины
Номенклатура и изомерияNH2
NH2
H2N
NH2
1,3-Диаминобензол
(м-фенилендиамин)
1.4-Диаминобензол
(п-фенилендиамин)
13
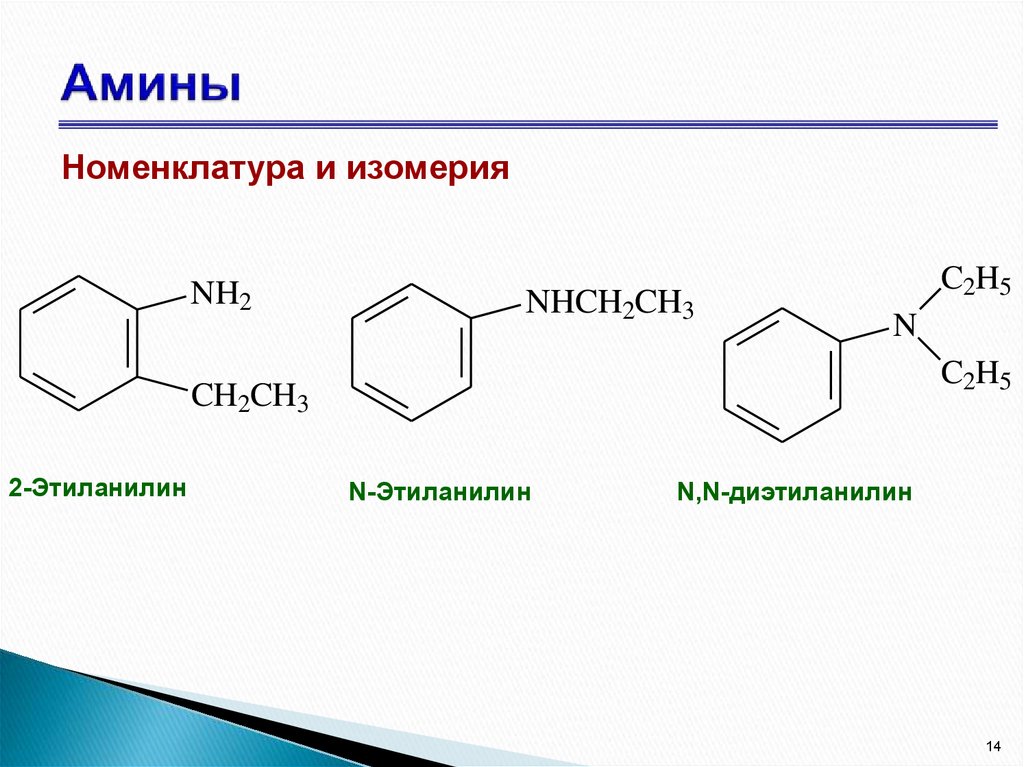
14. Амины
Номенклатура и изомерияNH2
NHCH2CH3
C2H5
N
C2H5
CH2CH3
2-Этиланилин
N-Этиланилин
N,N-диэтиланилин
14
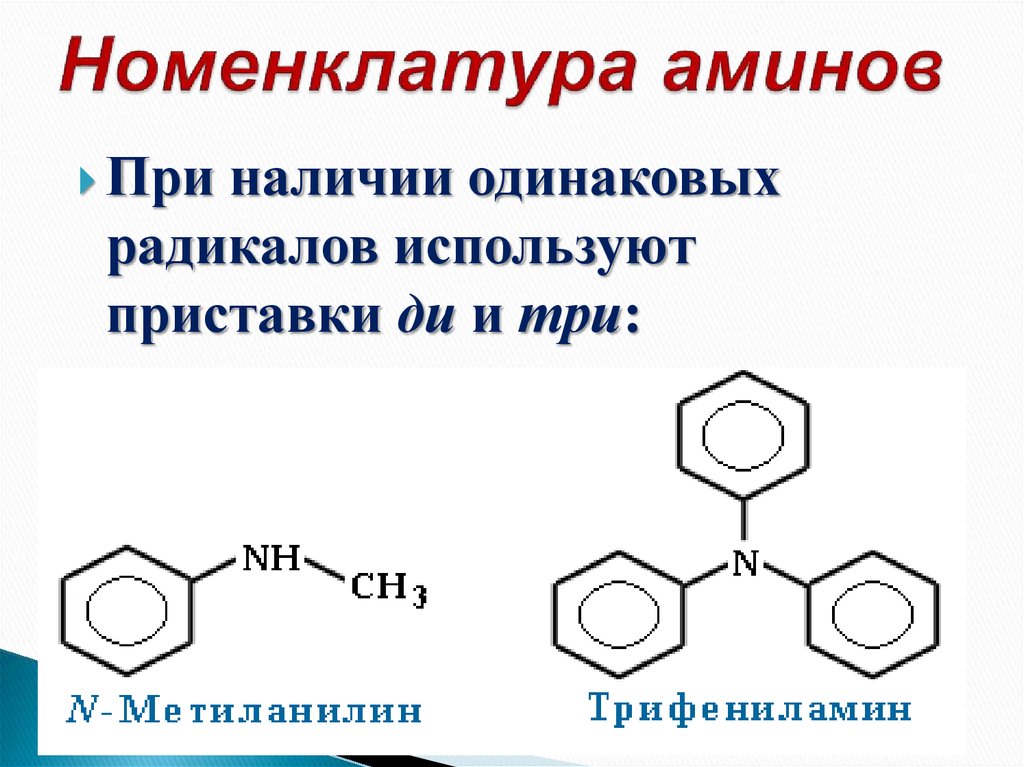
15. Номенклатура аминов
Приналичии одинаковых
радикалов используют
приставки ди и три:
16. Изомерия аминов
1.Структурная изомерия -
углеродного скелета, начиная с
С4H9NH2:
17. Изомерия аминов
Структурная изомерия - положенияаминогруппы, начиная с С3H7NH2:
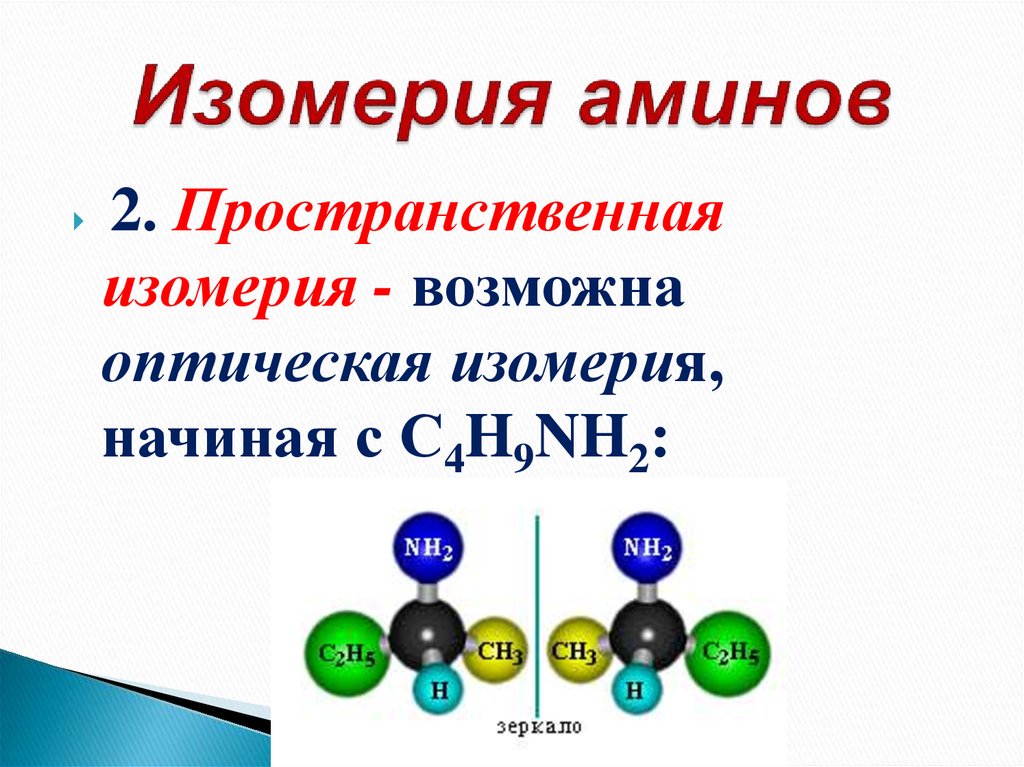
18. Изомерия аминов
2. Пространственнаяизомерия - возможна
оптическая изомерия,
начиная с С4H9NH2:
19. Физические свойства аминов
Связь N–H является полярной,поэтому первичные и вторичные
амины образуют межмолекулярные
водородные связи:
20. Физические свойства аминов
Это объясняет относительновысокую температуру кипения
аминов по сравнению с
неполярными соединениями со
сходной молекулярной массой.
Например:
21. Физические свойства аминов
Третичныеамины не образуют
ассоциирующих водородных связей
(отсутствует группа N–H). Поэтому
их температуры кипения ниже, чем
у изомерных первичных и
вторичных аминов (триэтиламин
кипит при 89 °С,
а н-гексиламин – при 133 °С).
22. Физические свойства аминов
При обычной температуре только низшиеалифатические амины CH3NH2, (CH3)2NH и
(CH3)3N – газы (с запахом аммиака),
средние гомологи – жидкости (с резким
рыбным запахом),
высшие – твердые вещества без запаха.
Ароматические амины – бесцветные
высококипящие жидкости или твердые
вещества.
23.
24.
25. Химические свойства аминов
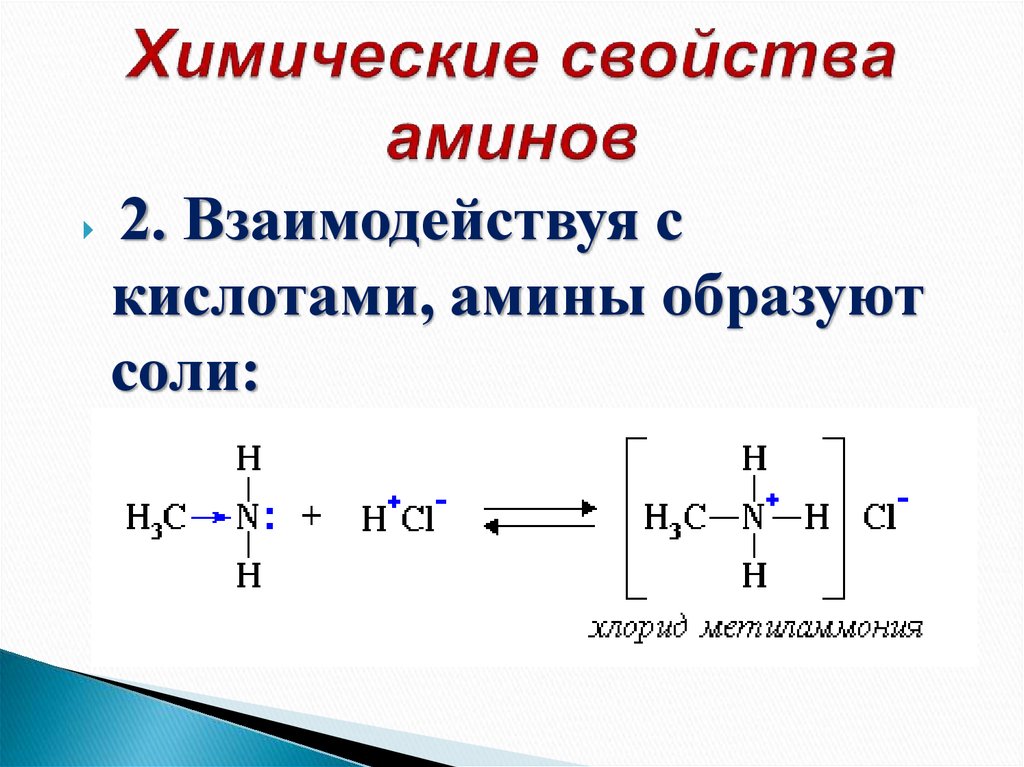
26. Химические свойства аминов
2. Взаимодействуя скислотами, амины образуют
соли:
27. Алкилирование (реакция Гофмана, 1850)
Гофман Фридрих19.02.1660 - 12.11.1742
нуклеофил
CH3
..
+
NH2 + CH3
метиламин
I
иодметан
CH3NH2
[CH3NH2CH3]I
-[CH3NH3]+Iдиметиламмонийиодид
-
CH3NHCH3
диметиламин
27
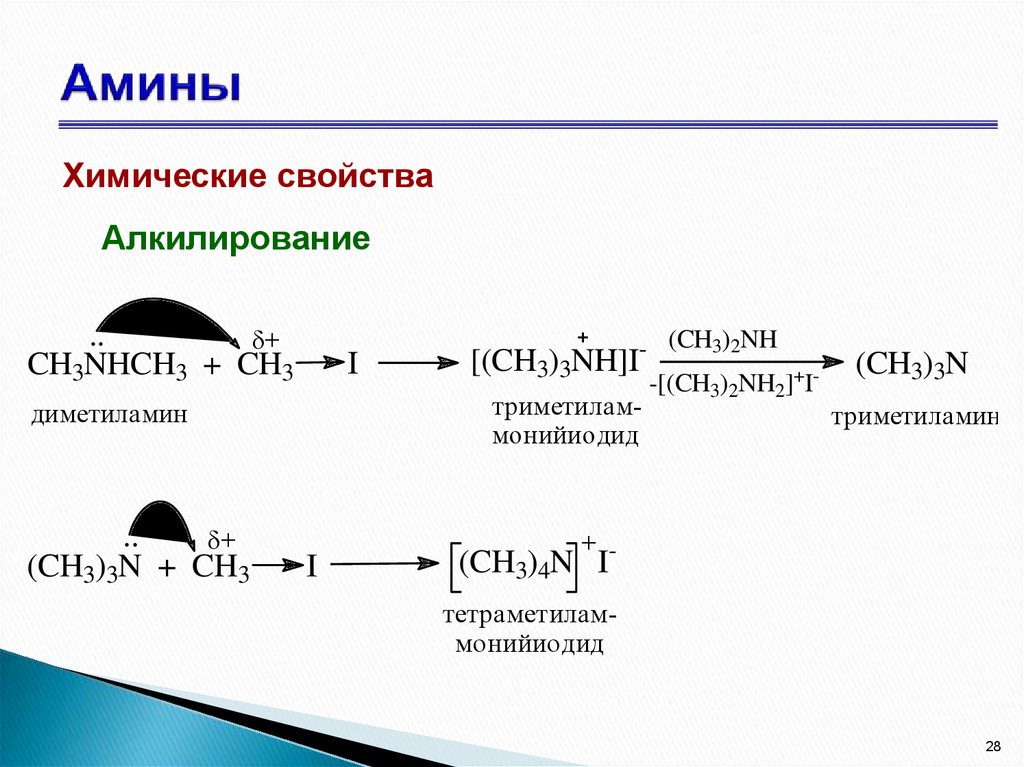
28. Амины
Химические свойстваАлкилирование
..
+
CH3NHCH3 + CH3
I
[(CH3)3NH]I
триметиламмонийиодид
диметиламин
..
+
(CH3)3N + CH3
- (CH3)2NH
I
-[(CH3)2NH2]+I-
(CH3)3N
триметиламин
+
(CH3)4N Iтетраметиламмонийиодид
28
29. Химические свойства аминов
3. В отличие от аммиака, низшиегазообразные амины способны
воспламеняться от открытого пламени.
Реакция горения (полного окисления)
аминов на примере метиламина:
30. Анилин
(фениламин)С6H5NH2 – важнейший из
ароматических аминов:
31. Анилин
представляет собой бесцветнуюмаслянистую жидкость с характерным
запахом (т. кип. 184 °С, т. пл. – 6 °С). На
воздухе быстро окисляется и приобретает
красно-бурую окраску.
Ядовит!
https://www.youtube.com/watch?v=2c6J-4sNGPc
32. Анилин
Для анилина характерны реакции как поаминогруппе, так и по бензольному кольцу.
Особенности этих реакций обусловлены
взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет
основные свойства аминогруппы по сравнению
алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы
бензольное кольцо становится более активным
в реакциях замещения, чем бензол.
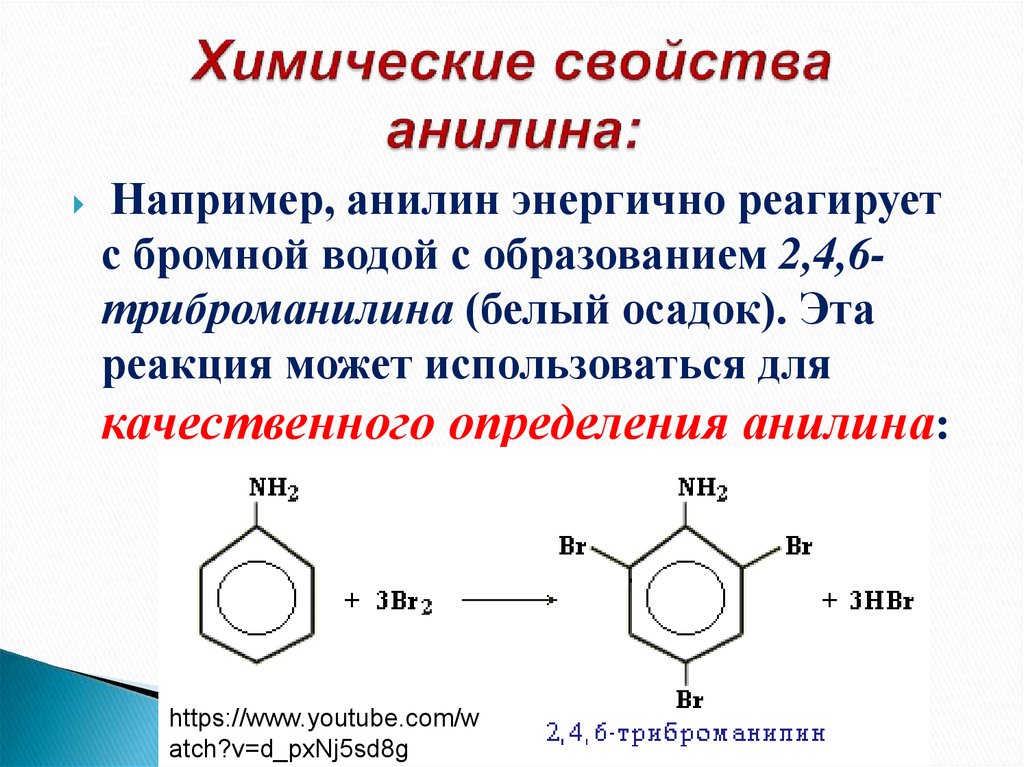
33. Химические свойства анилина:
Например, анилин энергично реагируетс бромной водой с образованием 2,4,6триброманилина (белый осадок). Эта
реакция может использоваться для
качественного определения анилина:
https://www.youtube.com/w
atch?v=d_pxNj5sd8g
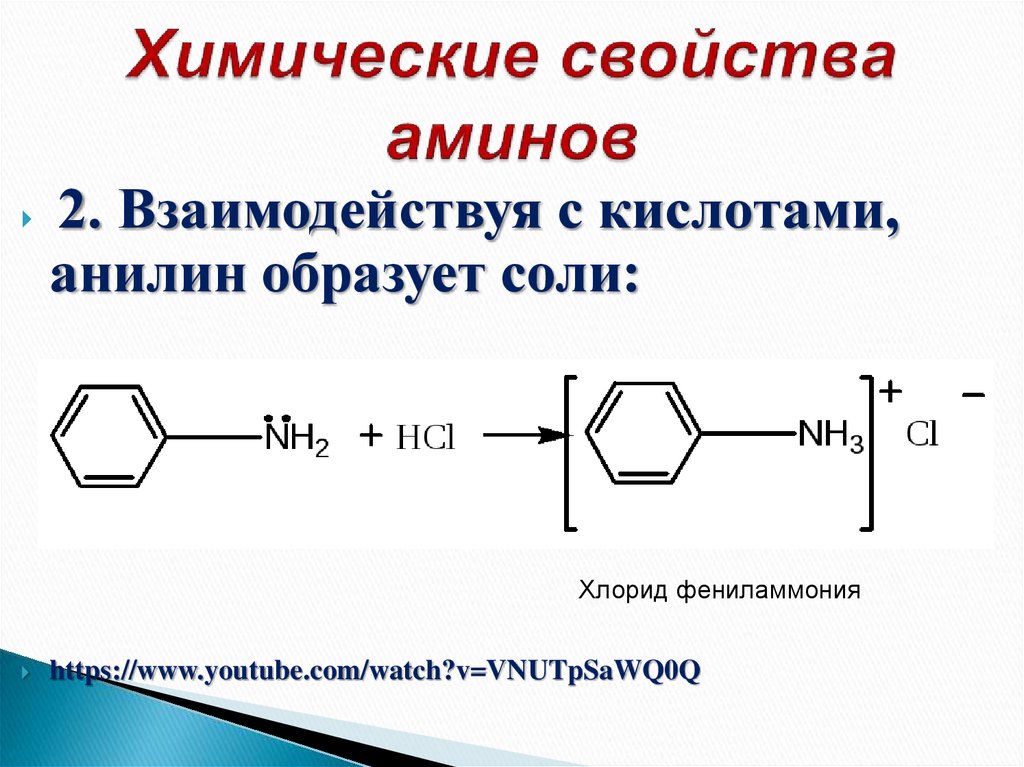
34. Химические свойства аминов
2. Взаимодействуя с кислотами,анилин образует соли:
Хлорид фениламмония
https://www.youtube.com/watch?v=VNUTpSaWQ0Q
35. Получение аминов
1. Наиболее общим методомполучения первичных аминов
является восстановление
нитросоединений:
36. Получение аминов
Важнейший ароматический амин анилин - образуется при восстановлениинитробензола (восстановители - водород в
присутствии металлических катализаторов,
Fe + HCl):
Эта реакция носит имя русского химика
Н.Н. Зинина, осуществившего ее впервые в
1842 г.
37.
ЗИНИННиколай Николаевич
(25.VIII.1812–18.II.1880)
академик, возглавлял кафедру общей
химии Медико-хирургической академии
в Петербурге, организатор и первый
президент Русского химического
общества. Известен своими работами в
области ароматических
нитросоединений.
NO2
Zn, HCl
нитробензол
нитрозобензол
N
O
NH2
[H]
анилин
(аминобензол)
37
38. Реакция горения анилина
C6H5NH2 + O2 --> CO2 + N2 + H2Ohttps://www.youtube.com/watch?v=cYtCWMczFFs
39.
40. Применение анилина
Широкоеприменение в
качестве полупродукта в
производстве витаминов и
лекарственных средств
(сульфаниламидные
препараты).
41.
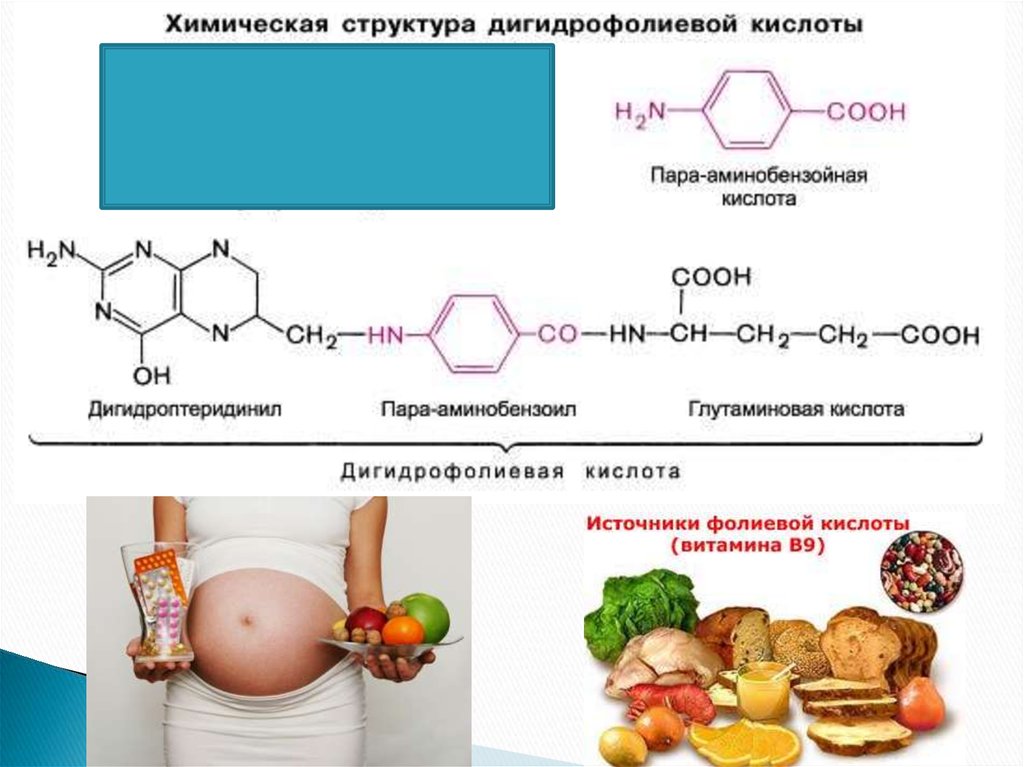
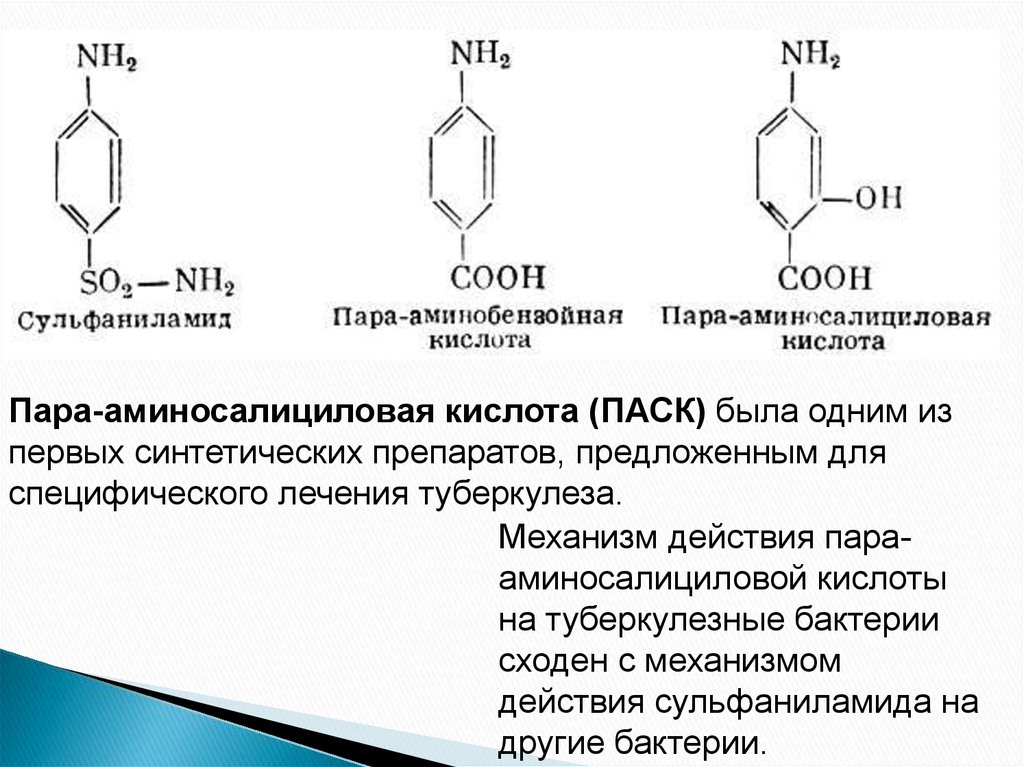
42. СУЛЬФАНИЛАМИДЫ
43.
Пара-аминосалициловая кислота (ПАСК) была одним изпервых синтетических препаратов, предложенным для
специфического лечения туберкулеза.
Механизм действия парааминосалициловой кислоты
на туберкулезные бактерии
сходен с механизмом
действия сульфаниламида на
другие бактерии.





























 Химия
Химия








