Похожие презентации:
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
1.
2. ПЛАН:
1. Общая характеристика,номенклатура, изомерия.
2. Получение.
3. Физико – химические свойства.
4. Отдельные представители.
3. АМИНЫ –
• Производные аммиака, в молекуле которогоатомы водорода (один, два или три)
замещены на углеводородные радикалы.
• В зависимости от числа углеводородных
радикалов амины делятся на первичные ,
вторичные и третичные.
4.
5.
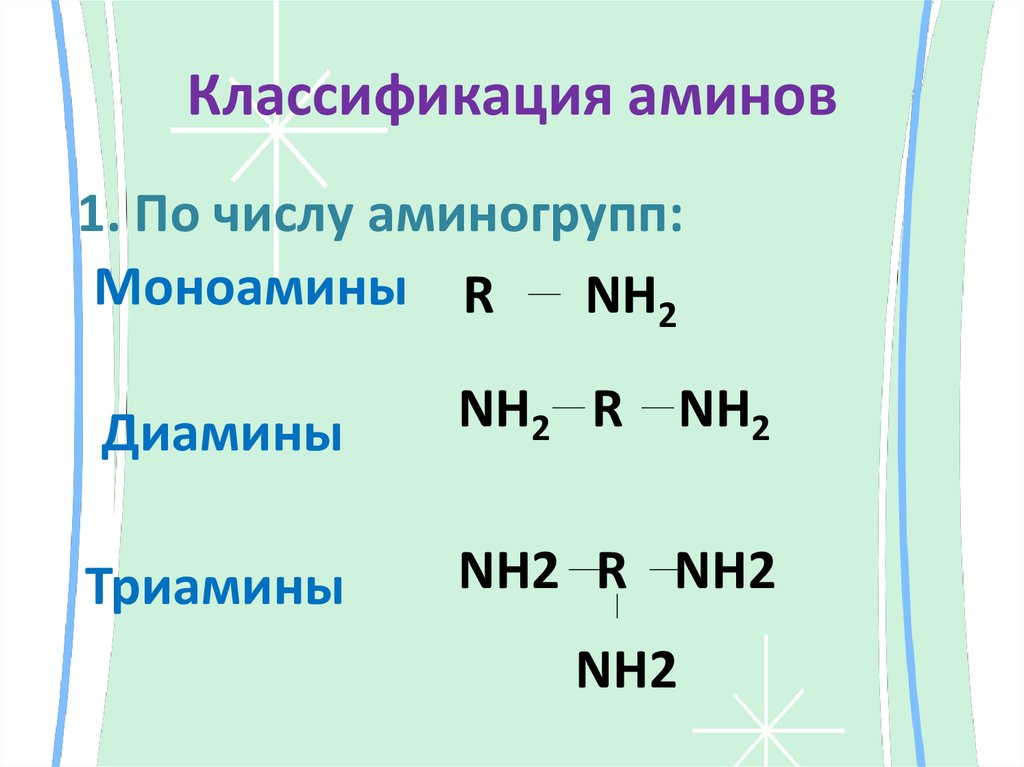
Классификация аминов1. По числу аминогрупп:
Моноамины R
NH2
Диамины
NH2 R NH2
Триамины
NH2 R NH2
NH2
6. 2. По характеру радикала:
• Предельные амины CnH2n+1NH2• Непредельные амины CnH2n-1NH2
• Ароматические амины CnH2n-7NH2
7. Номенклатура аминов (рациональная)
За основу берут названиеуглеводородного радикала
с прибавлением суффикса
-амин
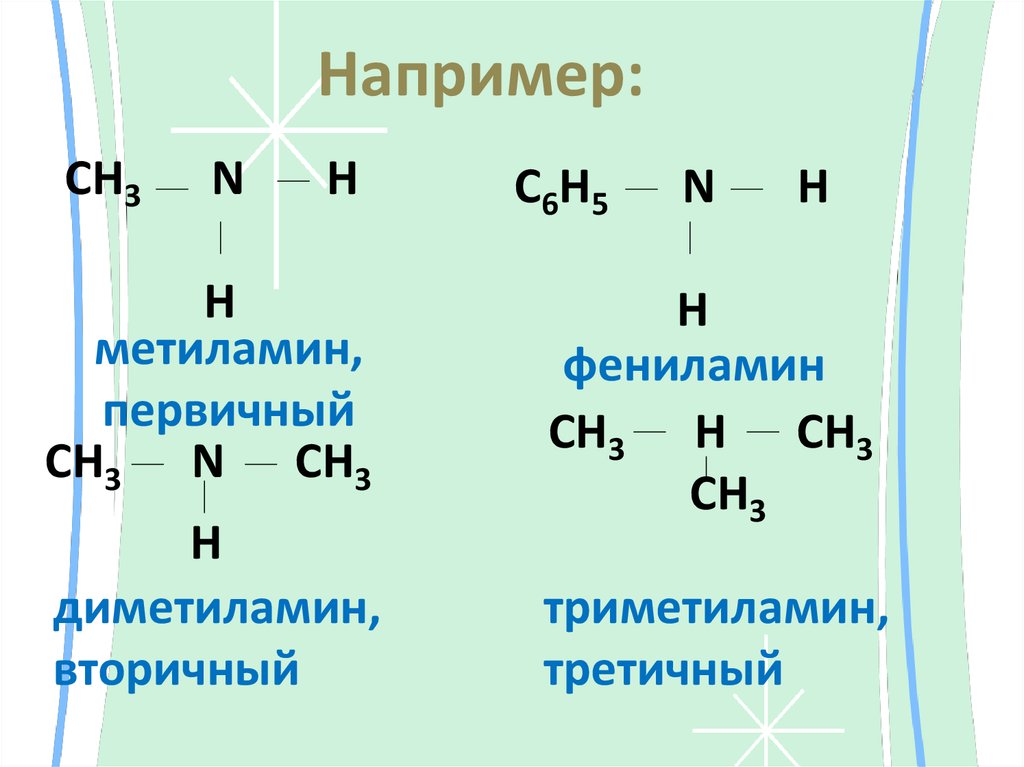
8. Например:
CH3N
H
H
метиламин,
первичный
CH3 N СН3
H
диметиламин,
вторичный
C6H5
N
H
H
фениламин
CH3 H CH3
СН3
триметиламин,
третичный
9. Номенклатура аминов (международная)
К названию углеводородадобавляют слово -амин и в
конце цифрой указывают
атом углерода, с которым
связана аминогруппа
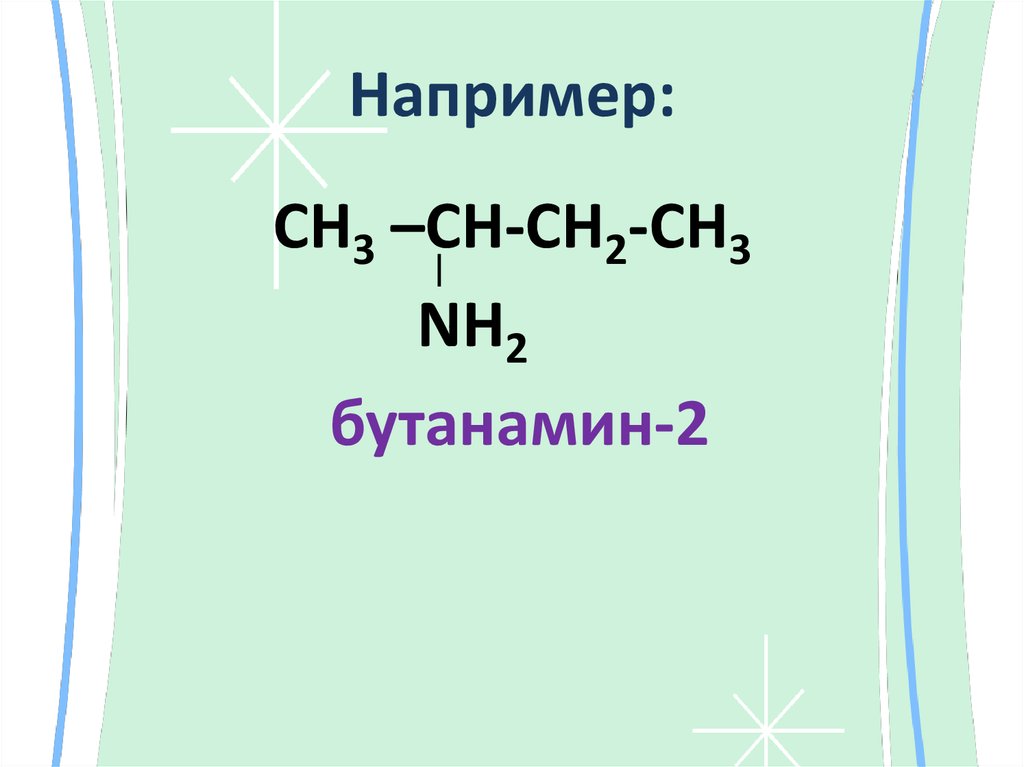
10. Например:
СН3 –СН-СН2-СН3NН2
бутанамин-2
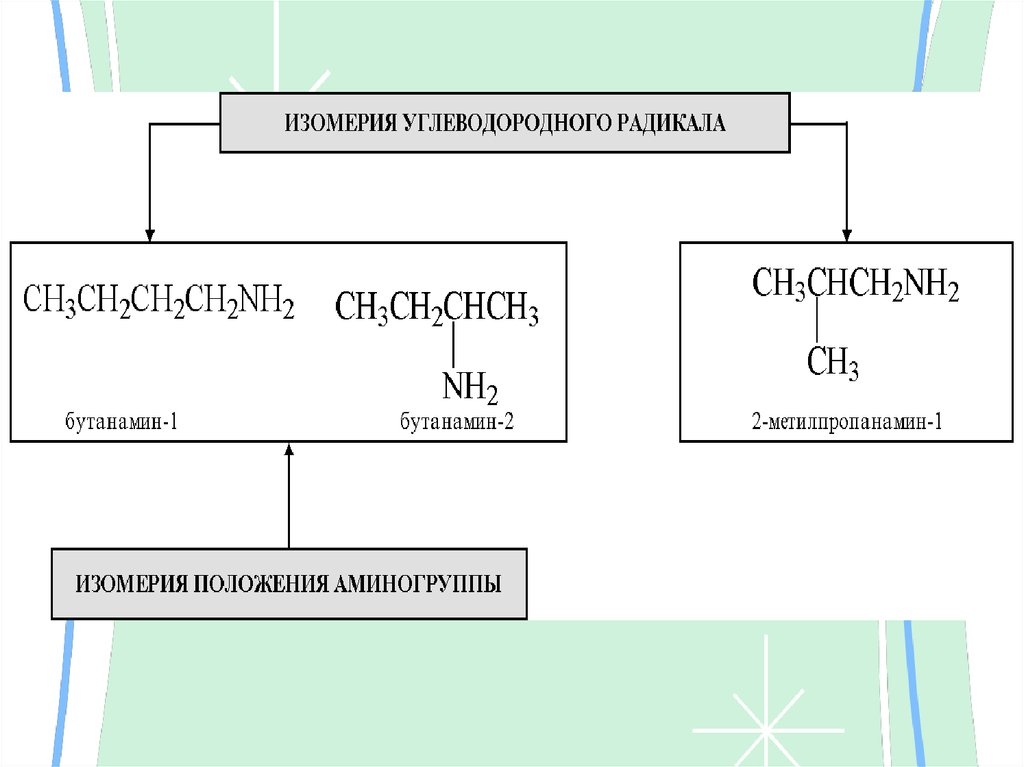
11. ИЗОМЕРИЯ:
1. Строения углеродногоскелета (радикала).
2. Положения аминогруппы
12.
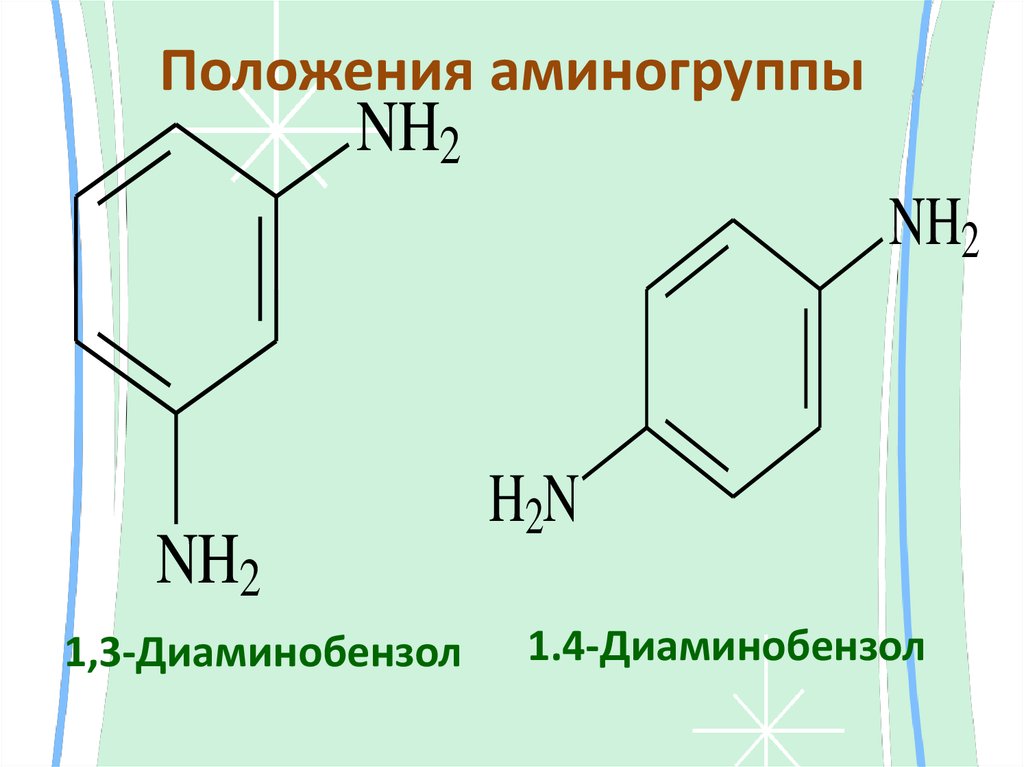
13. Положения аминогруппы
NH2NH2
NH2
1,3-Диаминобензол
H2N
1.4-Диаминобензол
14.
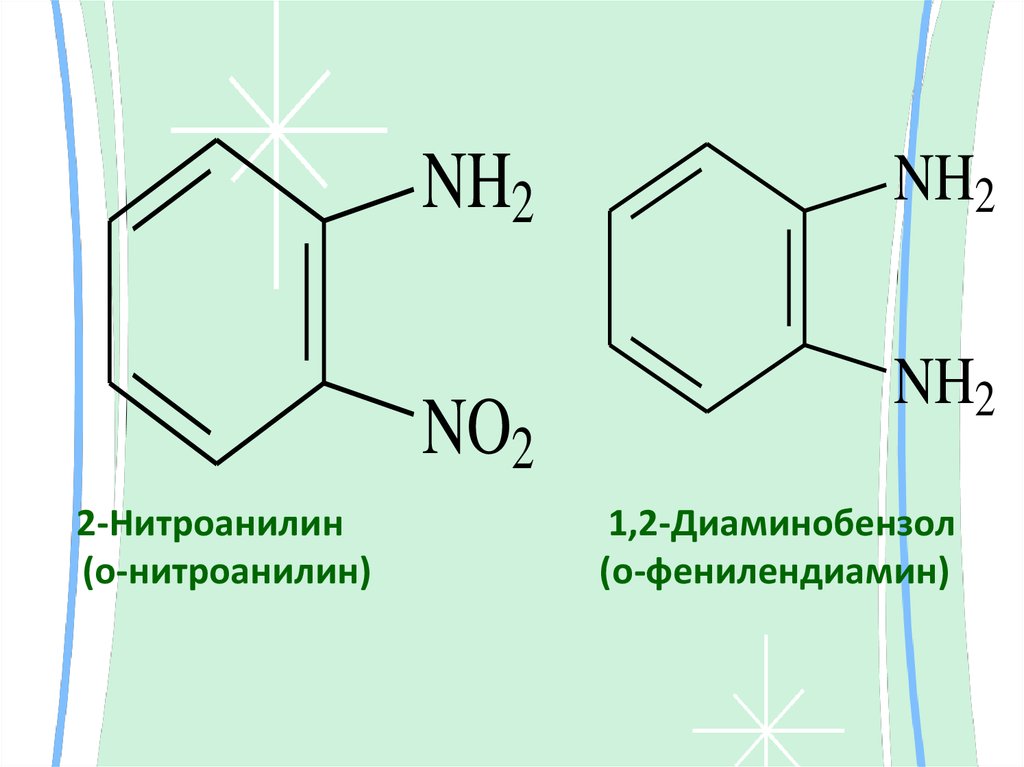
NH2NO2
2-Нитроанилин
(о-нитроанилин)
NH2
NH2
1,2-Диаминобензол
(о-фенилендиамин)
15.
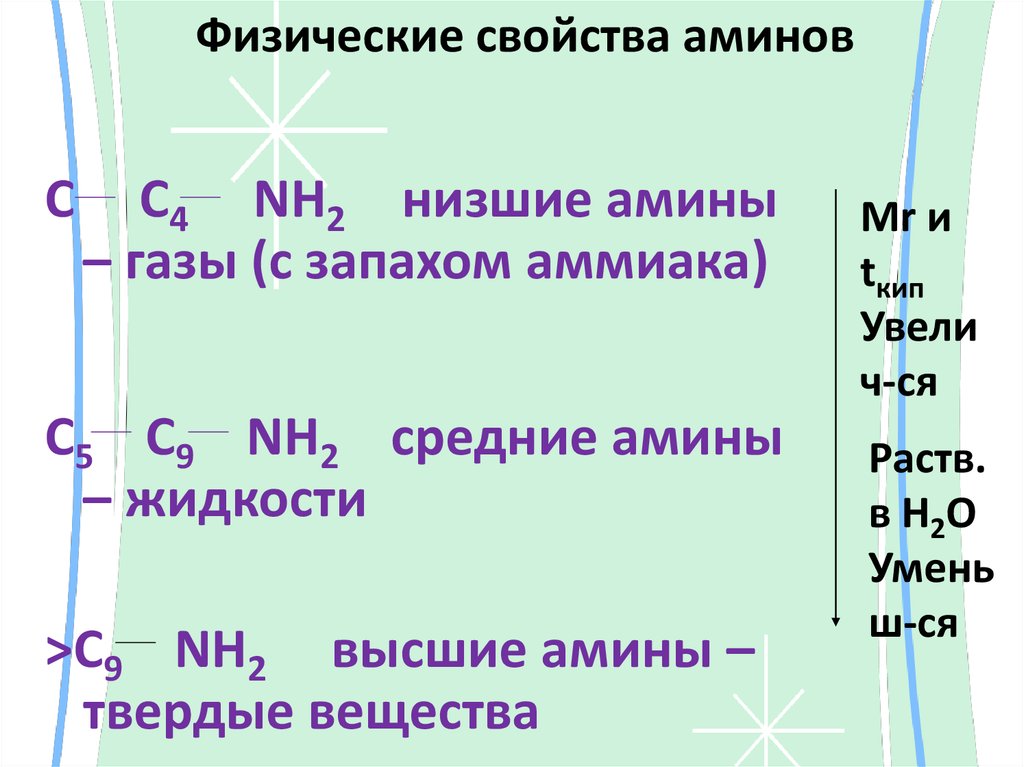
Физические свойства аминовC
C4 NH2 низшие амины
– газы (с запахом аммиака)
C5 C9 NH2 средние амины
– жидкости
>C9 NH2 высшие амины –
твердые вещества
Mr и
tкип
Увели
ч-ся
Раств.
в H2O
Умень
ш-ся
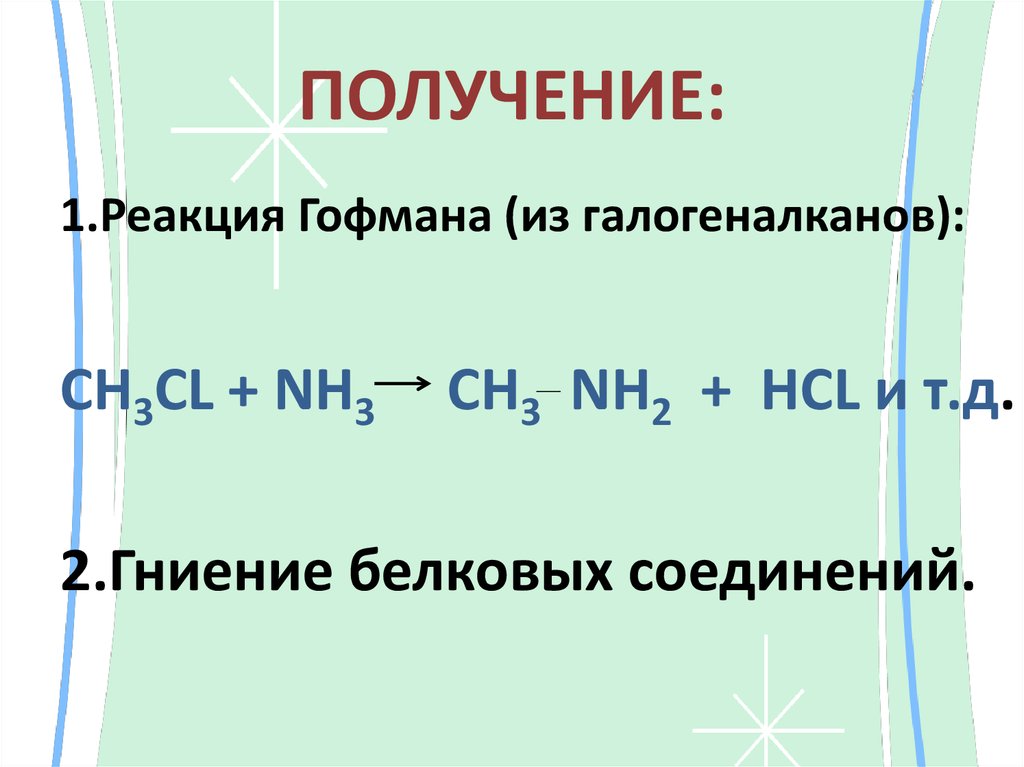
16. ПОЛУЧЕНИЕ:
1.Реакция Гофмана (из галогеналканов):CH3CL + NH3
CH3 NH2 + HCL и т.д.
2.Гниение белковых соединений.
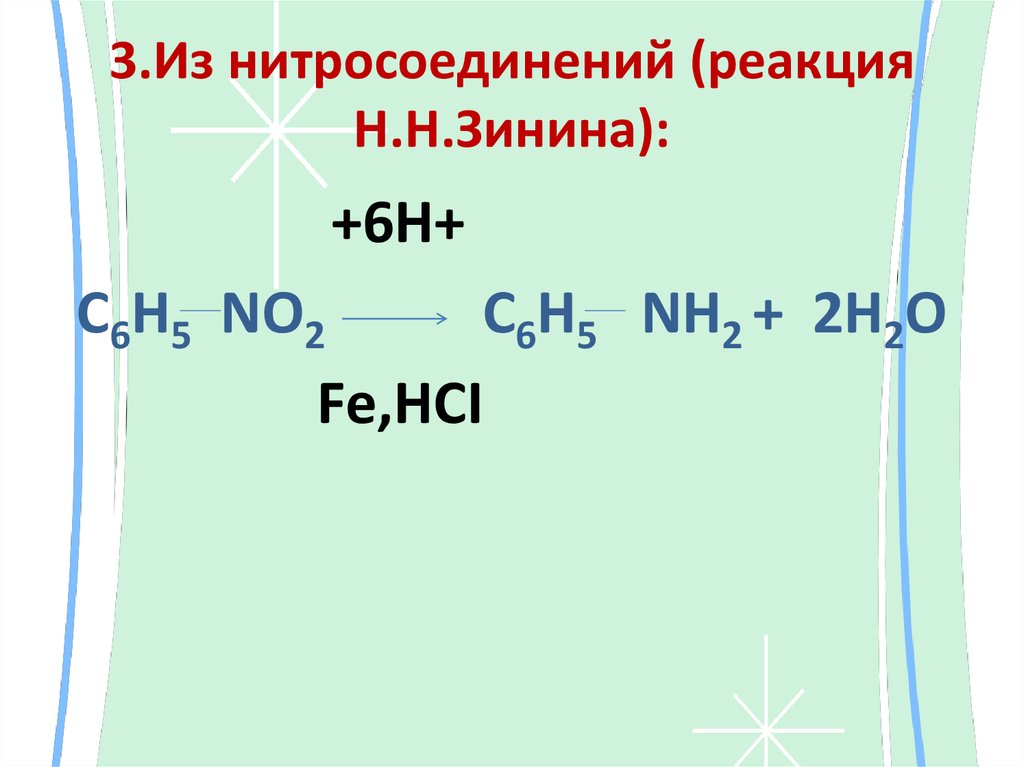
17. 3.Из нитросоединений (реакция Н.Н.Зинина):
+6Н+C6H5 NO2
C6H5 NH2 + 2Н2О
Fе,НСI
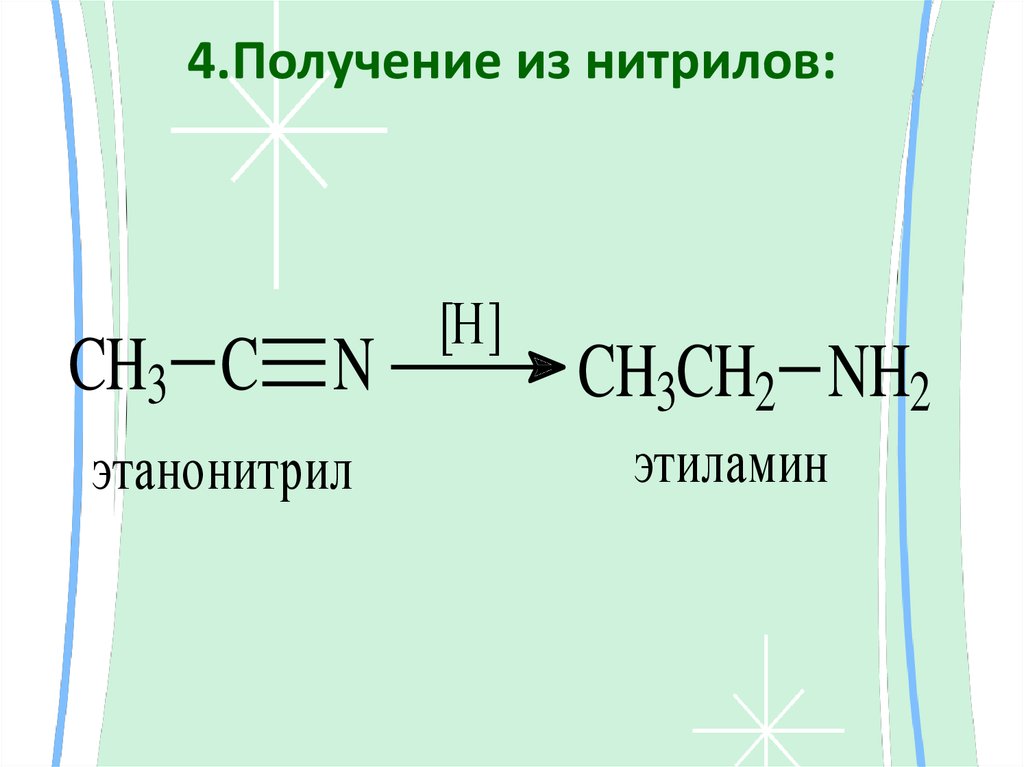
18. 4.Получение из нитрилов:
CH3 C Nэтанонитрил
[H]
CH3CH2 NH2
этиламин
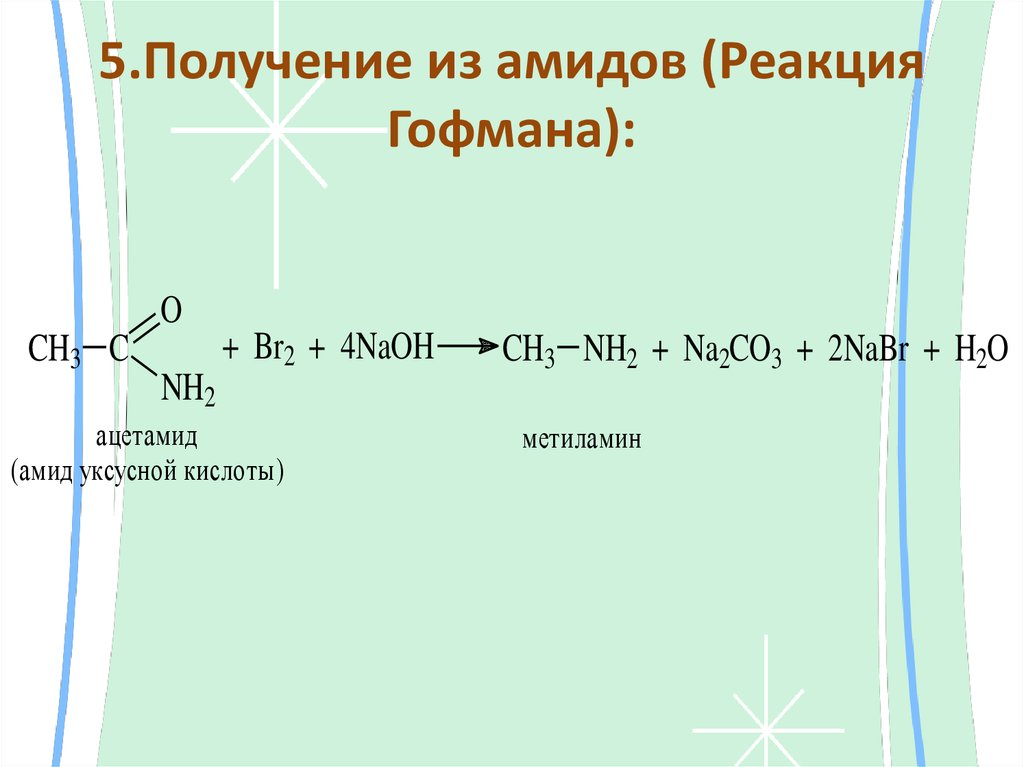
19. 5.Получение из амидов (Реакция Гофмана):
OCH3 C
+ Br2 + 4NaOH
NH2
ацетамид
(амид уксусной кислоты)
CH3 NH2 + Na2CO3 + 2NaBr + H2O
метиламин
20. Химические свойства:
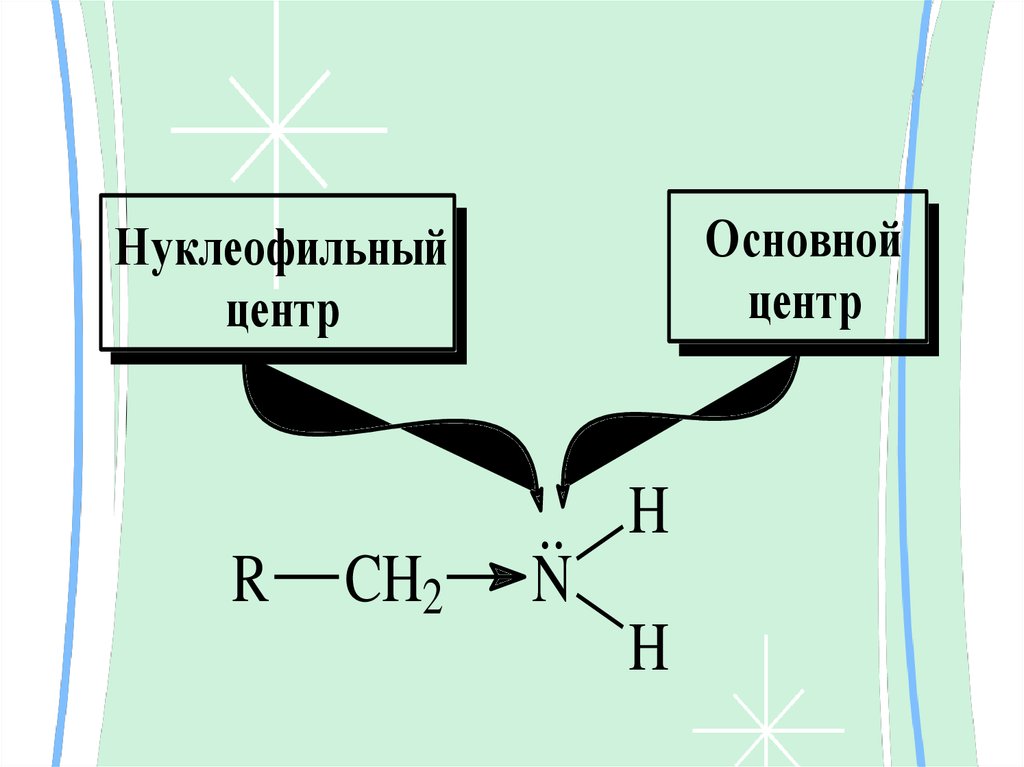
Амины – как и аммиак проявляют ярковыраженные свойства оснований, что
обусловлено наличием в молекуле
амина атома азота, имеющего
неподеленную пару электронов.
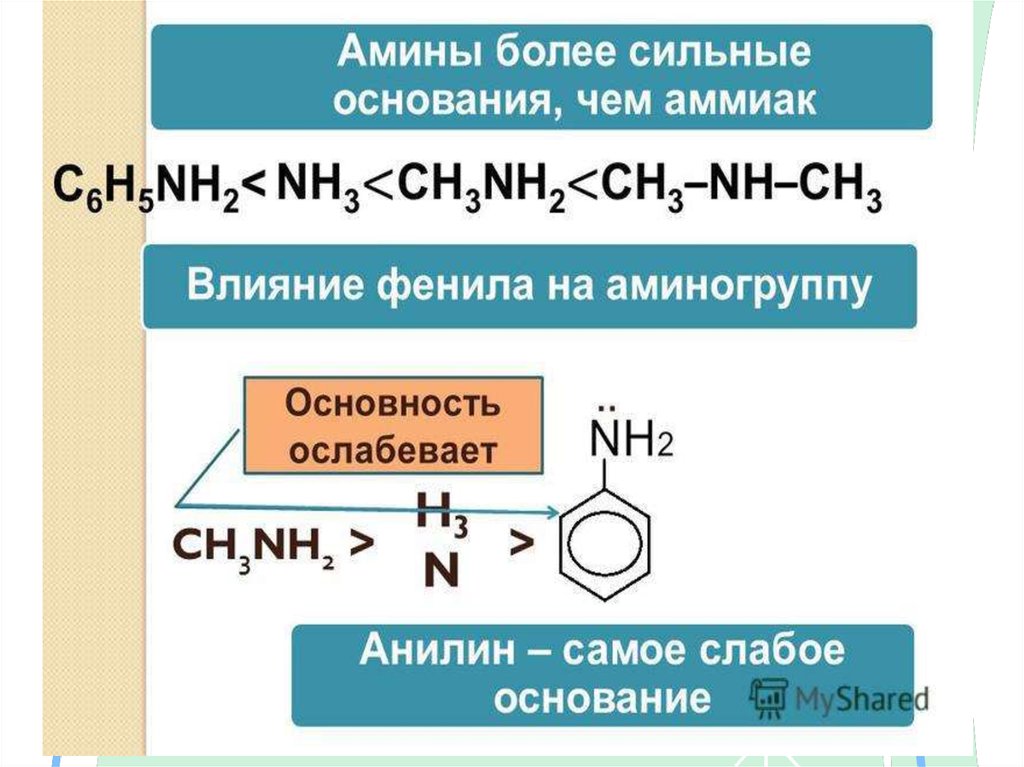
Алифатические амины более сильные
основания, чем ароматические.
Алифатические амины изменяют
окраску индикаторов, ароматические
– нет.
21.
22.
Основнойцентр
Нуклеофильный
центр
R
CH2
.. H
N
H
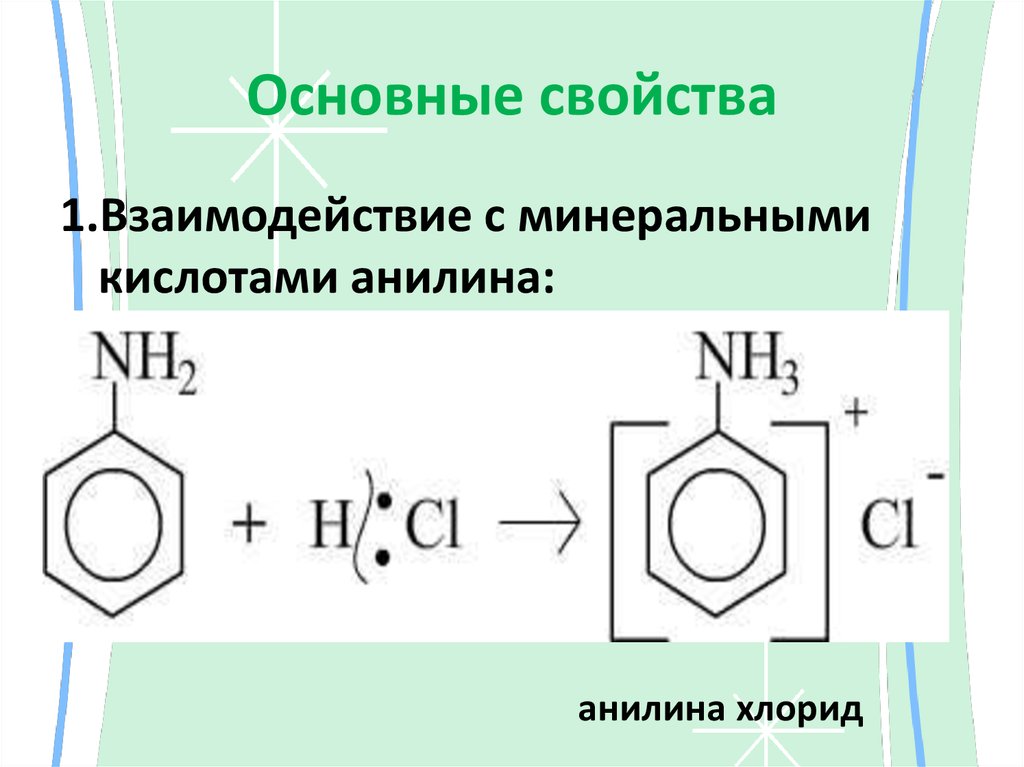
23. Основные свойства
1.Взаимодействие с минеральнымикислотами анилина:
анилина хлорид
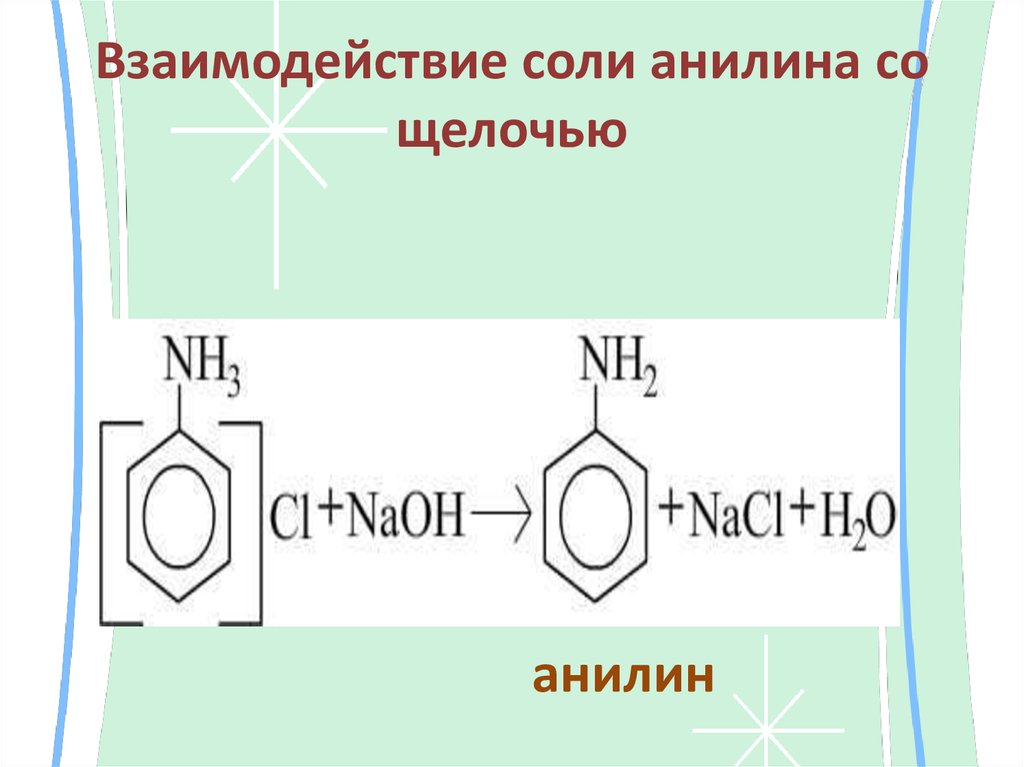
24. Взаимодействие соли анилина со щелочью
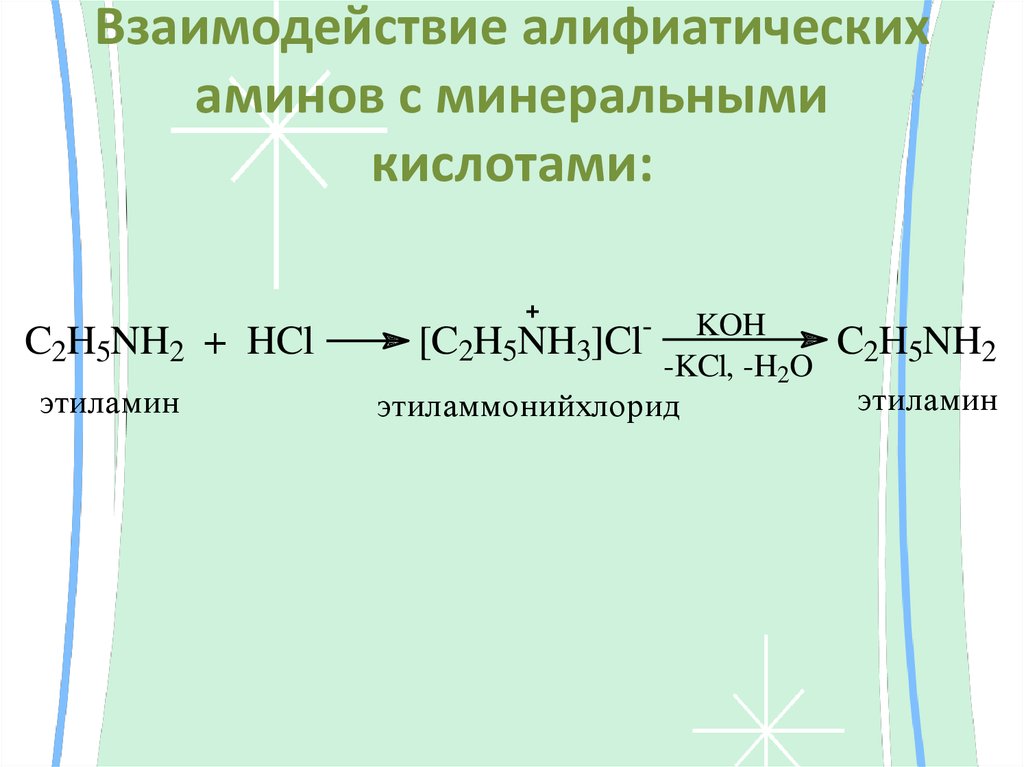
анилин25. Взаимодействие алифиатических аминов с минеральными кислотами:
C2H5NH2 + HClэтиламин
KOH
[C2H5NH3]Cl
-KCl, -H2O
этиламмонийхлорид
-
C2H5NH2
этиламин
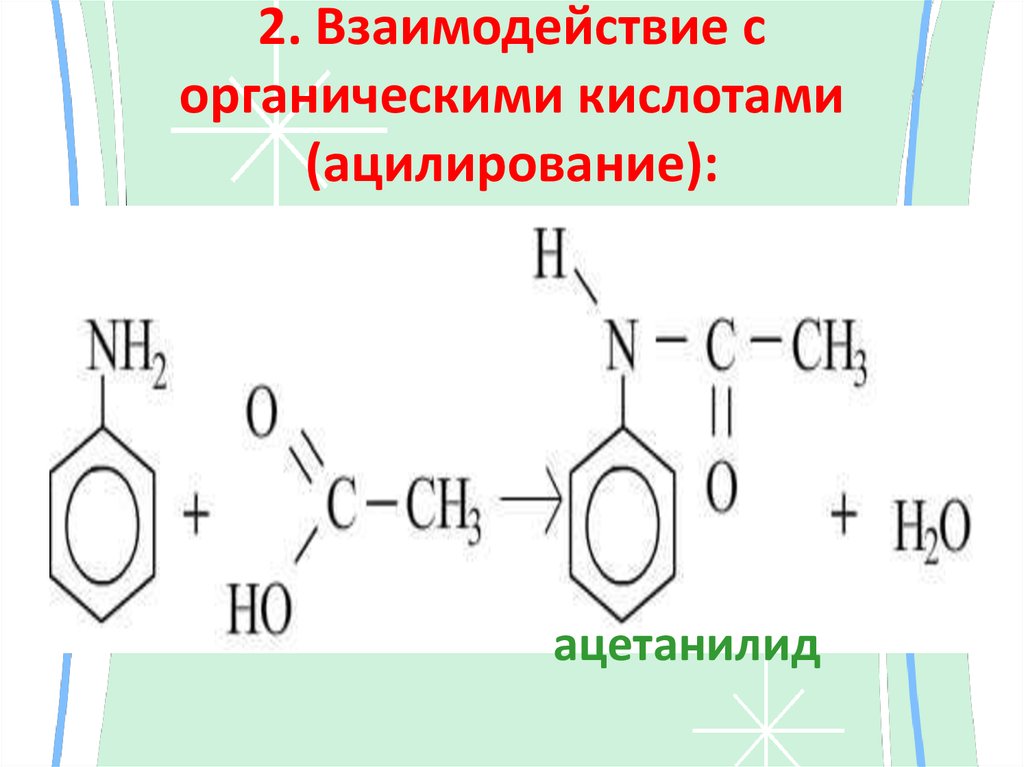
26. 2. Взаимодействие с органическими кислотами (ацилирование):
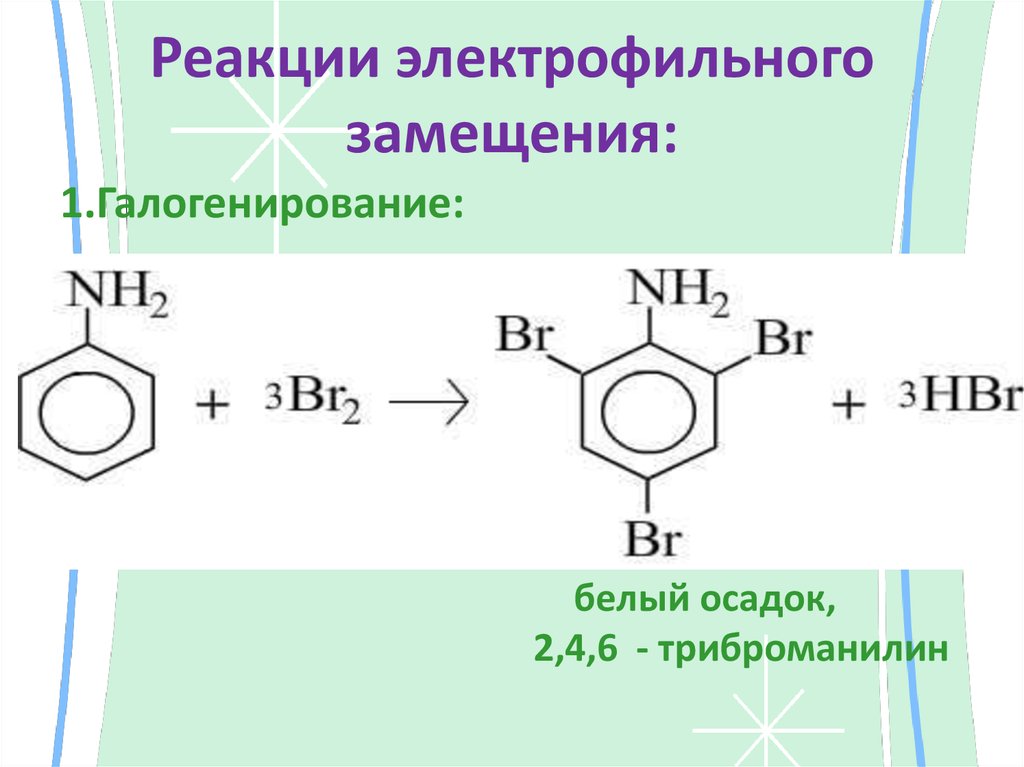
ацетанилид27. Реакции электрофильного замещения:
1.Галогенирование:белый осадок,
2,4,6 - триброманилин
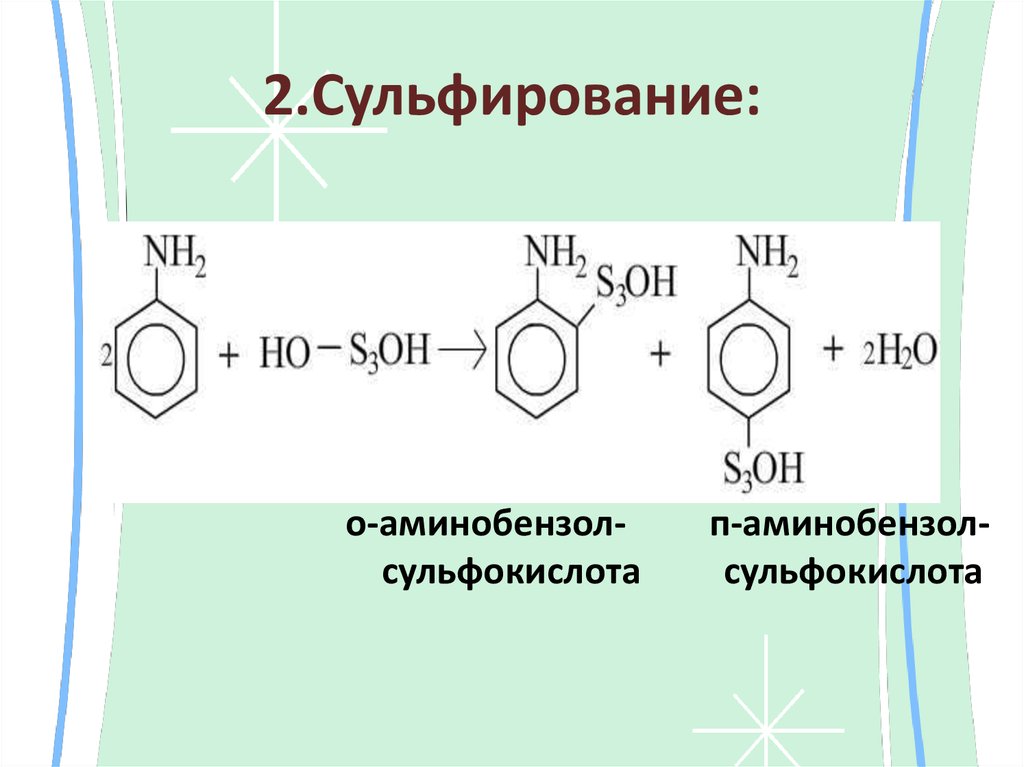
28. 2.Сульфирование:
о-аминобензолсульфокислотап-аминобензолсульфокислота
29. 3.Реакция диазотирования:
C6H5NH2+NaNO2+2HCl+
[C6H5-N N] Cl +NaCl + 2H2O
хлорид диазония
30. АНИЛИН (С6Н5NН2)-
АНИЛИН (С6Н5NН2)Бесцветная маслянистая жидкостьсо своеобразным запахом,
тяжелее воды, плохо в ней
растворяется. Ядовит.
Применяется для получения
красителей , пластмасс и
лекарственных средств.
31. Качественные реакции на анилин:
1. С бромной водой –выпадает осадокбелого цвета 2,4,6 триброманилин.
2. С лигнином в кислой среде – желтое
окрашивание.
3. С хлорной известью в кислой среде
– темно-фиолетовое окрашивание.
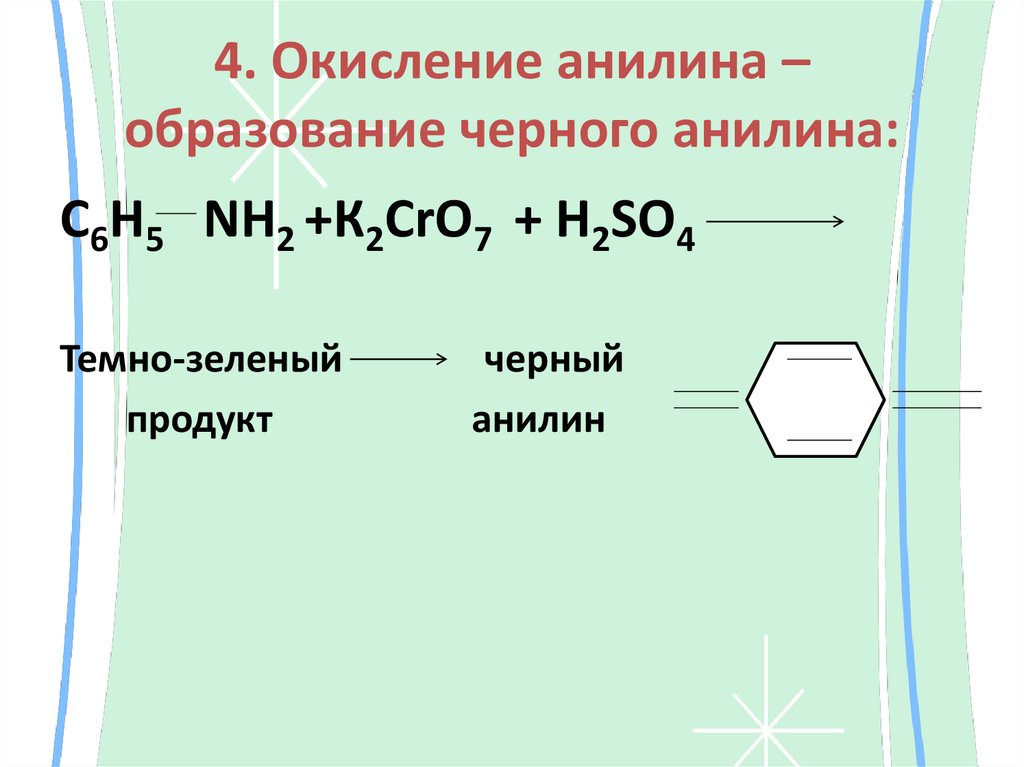
32. 4. Окисление анилина – образование черного анилина:
C6H5 NH2 +К2СrО7 + Н2SО4Темно-зеленый
продукт
черный
анилин
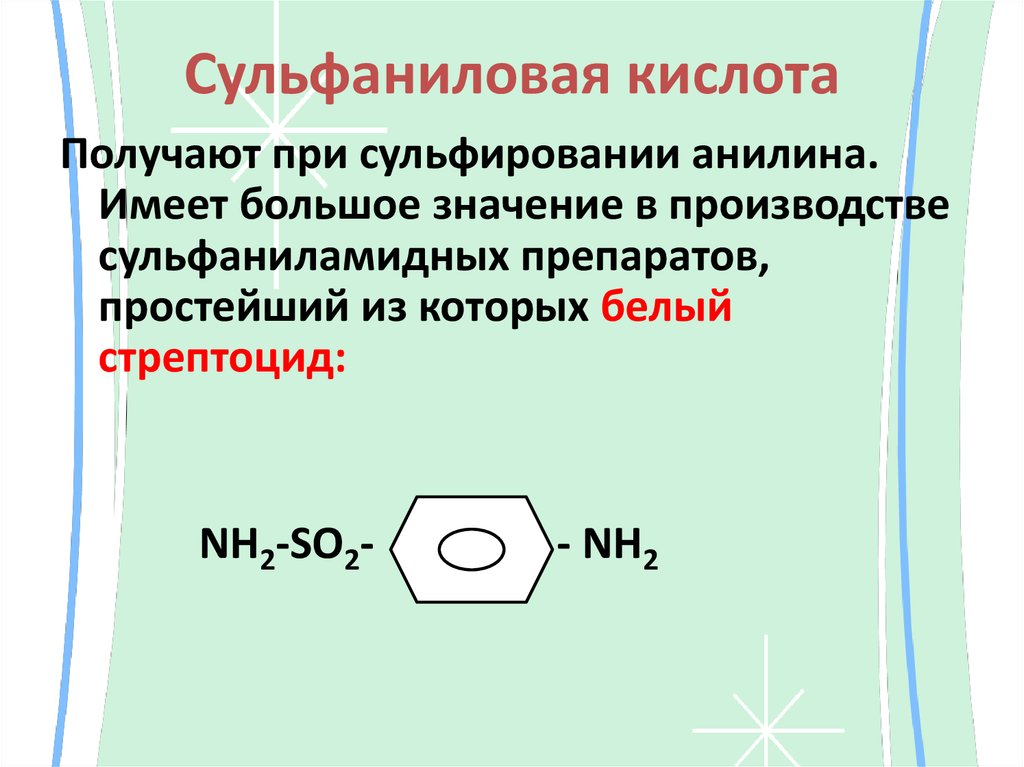
33. Сульфаниловая кислота
Получают при сульфировании анилина.Имеет большое значение в производстве
сульфаниламидных препаратов,
простейший из которых белый
стрептоцид:
NН2-SО2-
- NН2
34. Сульфаниламидные препараты – препараты антибактериального действия, применяются при лечении, заболеваний вызванных
стрептококками : ангина, рожистоевоспаление, минингит,
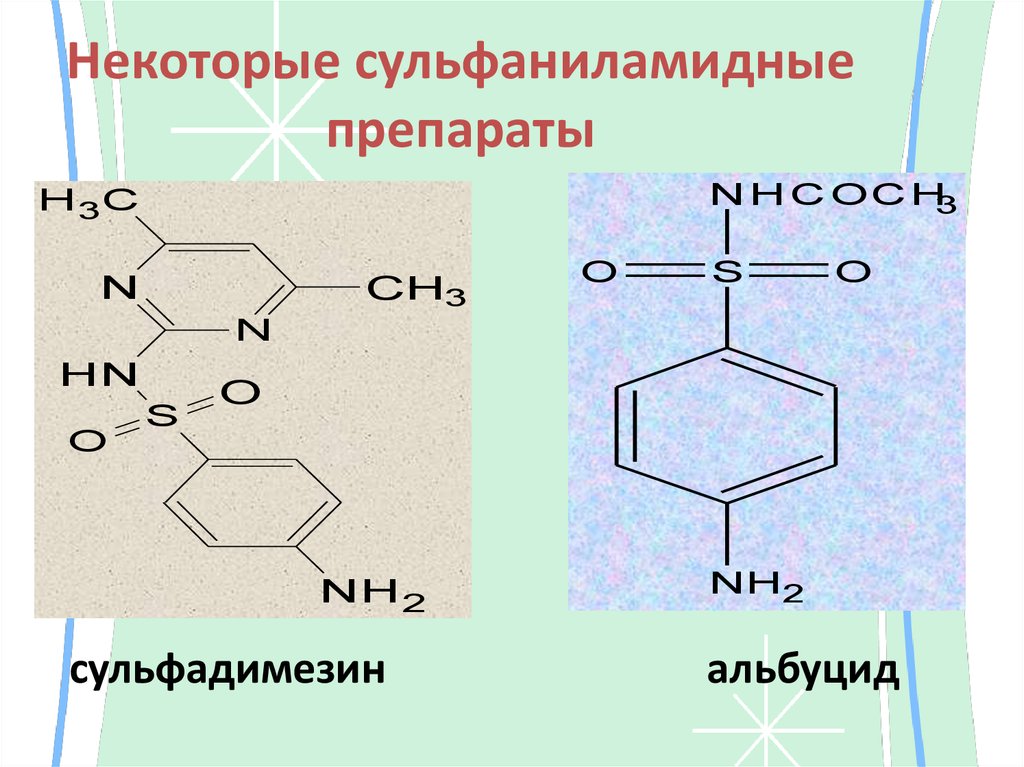
35. Некоторые сульфаниламидные препараты
N H C OC H3H 3C
N
CH3
O
S
O
N
HN
O
S
O
NH 2
сульфадимезин
NH2
альбуцид
36.
CH3N
S
N
S
N
HN
NH
O
S
O
O
S
O
NH2
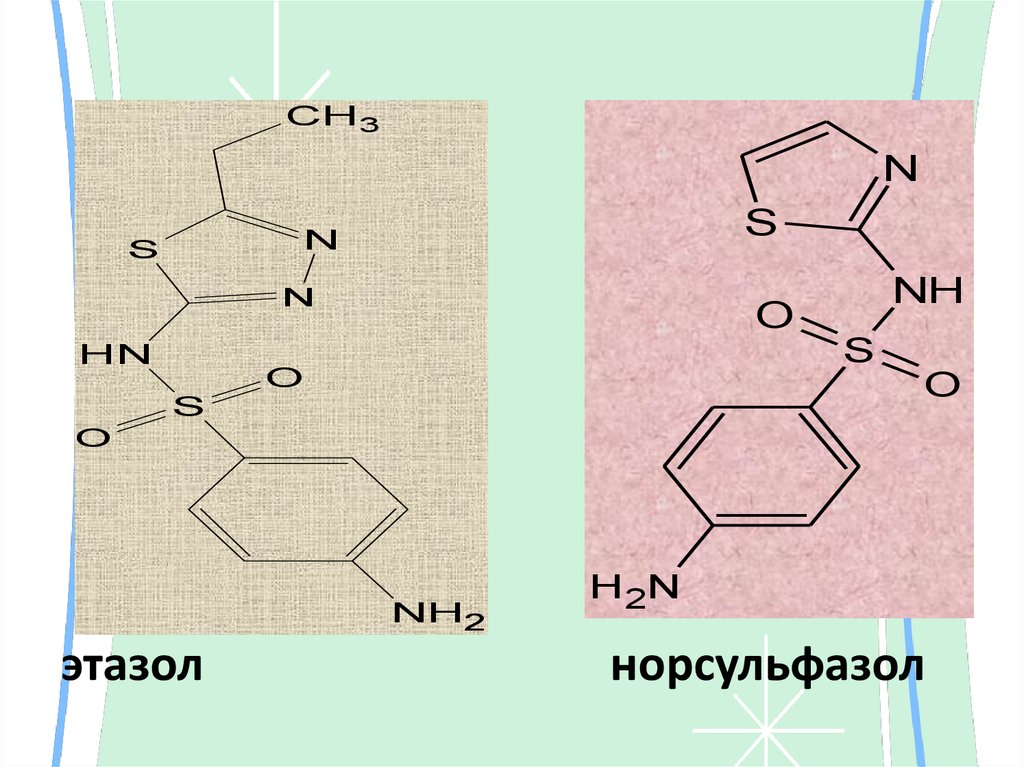
этазол
H2N
норсульфазол














 Химия
Химия








