Похожие презентации:
Путешествие в мир кислот
1. Путешествие в мир кислот
Г. Тула МБОУСОШ №31им. В.П.Храмченко
Желтова Юлия Владимировна
учитель химии
8класс
2.
Цель и задачи:• познакомиться с многообразием кислот;
• рассмотреть состав и классификацию
кислот;
• выявить общее в свойствах кислот.
продолжить формирование знаний по
составлению формул веществ на
основании степени окисления;
3. Напишите формулы веществ:
1. оксида серы (IV)2. хлорида алюминия
3. оксида серы (VI)
4. фосфида натрия
5. сульфида калия
6. нитрида кальция
4. Выберите формулы оснований, дайте им названия:
Н2О, КОН, Mg(OH)2FeS, Са(ОН)2, NO, K2S,
NaH, ZnO, AL(OH)3
5. Станция «Информационная»
6. Кислоты в продуктах
уксусная кислотаяблочная кислота
Лимонная кислота
аскорбиновая
кислота
молочная кислота
7. Кислоты в природе.
Муравьиная кислота8. Кислоты в природе.
дождеваявода
Откуда в атмосфере появляются
оксиды, служащие источником
кислот?
Ежегодно с дождями
на
землю выпадает 100
млн. тон азотной
кислоты.
9. Кислоты в природе, их роль.
разрушениегорных пород
создание
почвы
Кислоты в
природе, их роль.
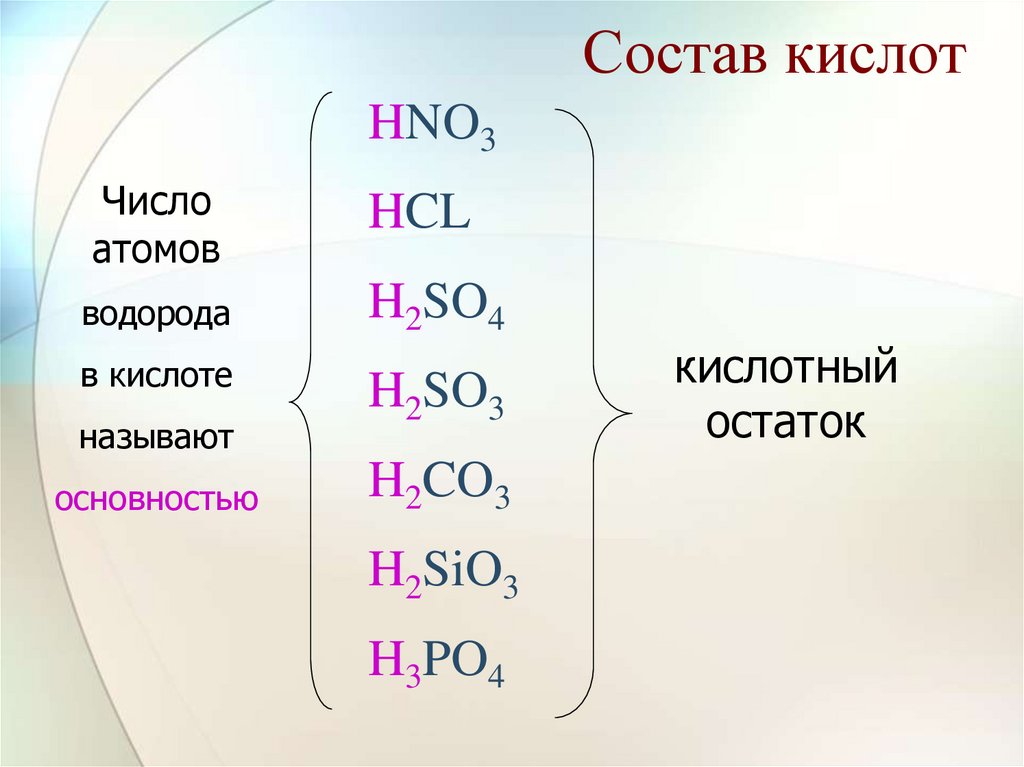
10. Состав кислот
HNO3Число
атомов
HCL
водорода
H2SO4
в кислоте
называют
основностью
H2SO3
H2CO3
H2SiO3
H3PO4
кислотный
остаток
11.
Молекуласерной кислоты
Это сложные
вещества,
состоящие из
атомов водорода и
кислотного остатка.
общая формула:
HR
R- обозначение
кислотного
остатка
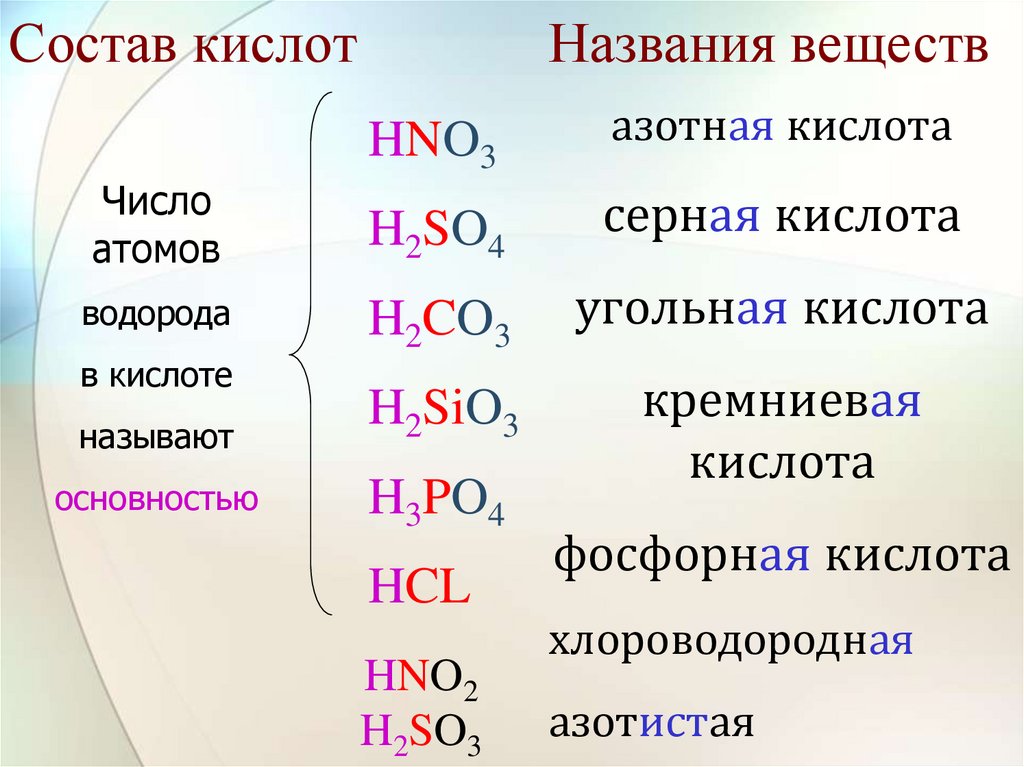
12. Состав кислот
Числоатомов
Названия веществ
HNO3
азотная кислота
H2SO4
серная кислота
H2CO3
угольная кислота
называют
H2SiO3
основностью
H3PO4
кремниевая
кислота
водорода
в кислоте
HCL
HNO2
H2SO3
фосфорная кислота
хлороводородная
азотистая
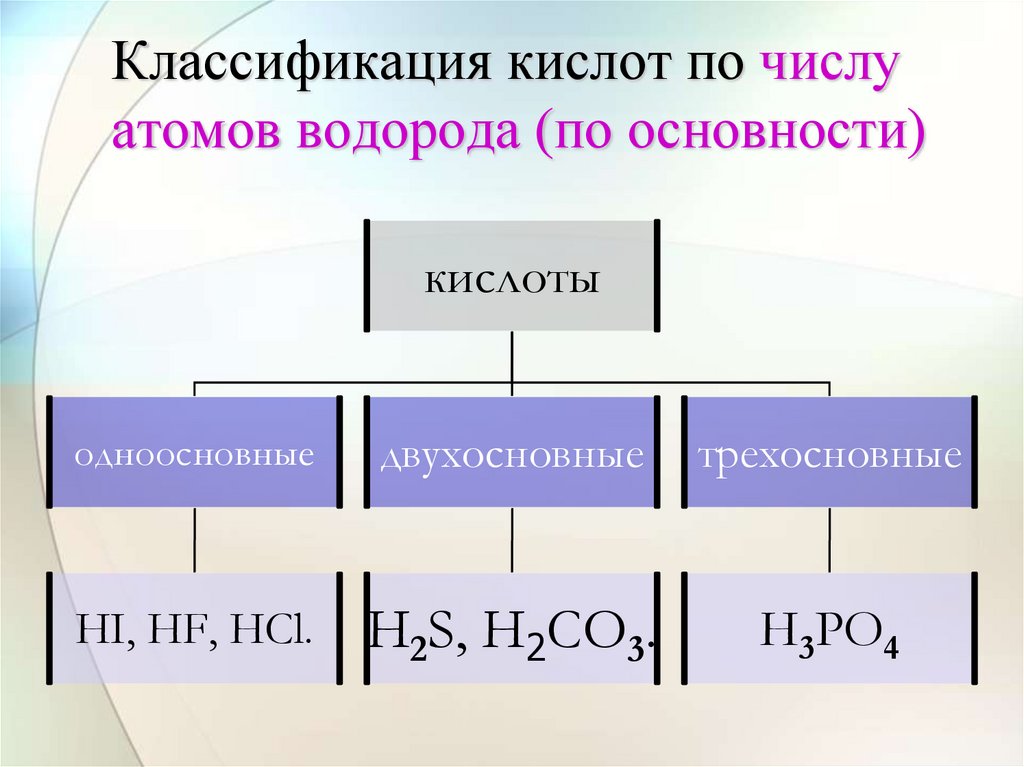
13. Классификация кислот по числу атомов водорода (по основности)
кислотыодноосновные
двухосновные
трехосновные
HI, HF, HCl.
H2S, H2CO3.
H3PO4
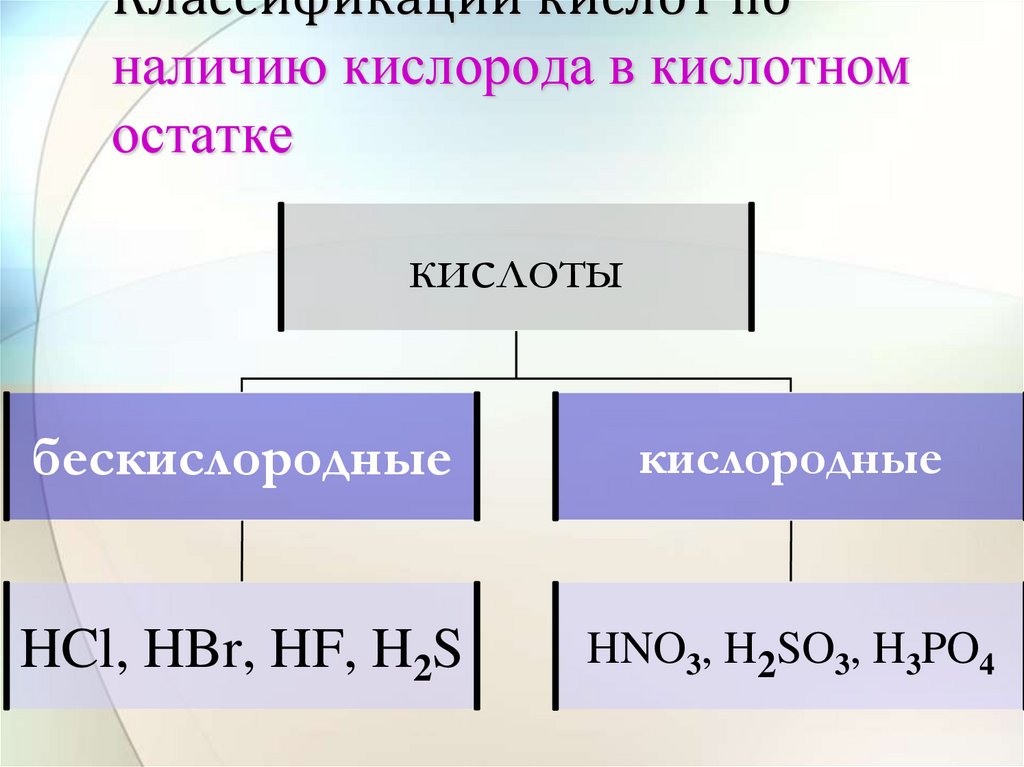
14. Классификации кислот по наличию кислорода в кислотном остатке
кислотыбескислородные
кислородные
HCl, HBr, HF, H2S
HNO3, H2SO3, H3PO4
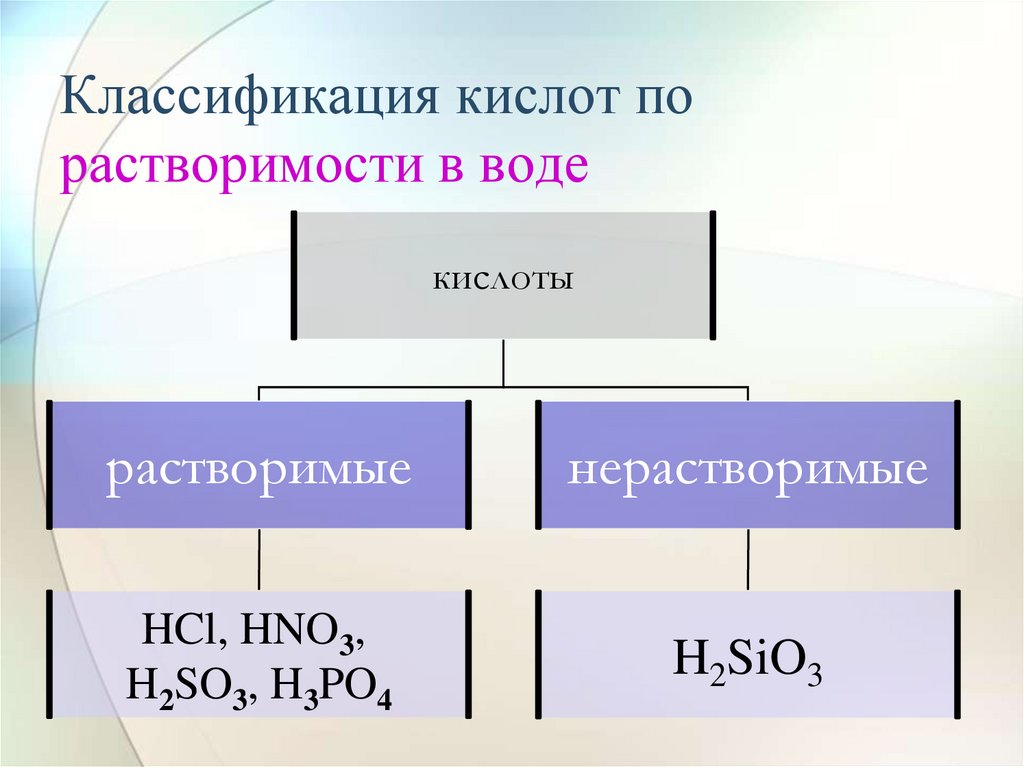
15. Классификация кислот по растворимости в воде
кислотырастворимые
нерастворимые
HCl, HNO3,
H2SO3, H3PO4
H2SiO3
16. Станция «Историческая»
17.
Абубекер аль РезиX век
Анджело Сала
XI век
Джозеф Пристли
XVIII век
К концу 18 века химики
уже знали более десятка
кислот
18. Внимание! Стоп!
Станция«Экспериментальная»
Задание: проведите сравнение
свойств серной и соляной кислот,
результаты запишите в таблицу.
Внимание! Стоп!
19.
хим.название агрегатное
формула вещества состояние
H2SO4
HCl
цвет запах индикатор
20. Станция «Индикаторная»
Задание: определите опытнымпутём, как индикатор изменяет
свой цвет в растворах кислот.
По результатам эксперимента
сделайте вывод о свойствах
кислот.
21.
1. Назовите кислоты, которыеможно встретить в природе.
2. Какая кислота была известна ещё
3 тысячи лет назад?
3. Какие вещества относятся к
классу кислот?
22.
1. Выберите формулы веществкоторые относятся к классу кислот:
КОН, NO, HNO3, HCl,
HBr, CaCO3, HF, H2S,
H2SO3, H3PO4
23.
HNO3, HCl,HBr, HF, H2S, H2SO3,
H3PO4
Проверим:
2.Определите кислоту:
а) трёхосновную, Р
б) двухосновную, кислородсодержащую
24. Установите соответствие
Название вещества1)угольная
Формула вещества
а) H3PO4
2)азотная
б) H2SO4
3)серная
в) HNO3
4)фосфорная
г) H2СO3
25.
Уважаемы пассажиры, нашепутешествие подошло к концу.
Спасибо Вам за то, что вы
помогли мне осуществить его.
Домашнее задание § 20, упражнение №1,2
26. ресурсы
• Настольная книга учителя «Химия 8 класс»О.С.Габриелян Москва «Дрофа» 2008г.
• Электронные уроки и тесты «Химия в школе»
«Просвещение-медиа»
• 1С:Школа «Химия 8 класс»





















 Химия
Химия








