Похожие презентации:
Himalaya. Новые подходы в лечении неоперабельного гепатоцеллюлярного рака
1.
Современные подходы в лечении онкологических заболеваний. Г.Томск,22.05.20024
HIMALAYA
Новые подходы в лечении неоперабельного
гепатоцеллюлярного рака.
Бритвина Мария Александровна
Врач-онколог, ТООД, г.Томск
Номер одобрения:
Дата одобрения:
Дата истечения:
Современные подходы в лечении онкологических заболеваний. Г.Томск, 22.05.20024
Номер одобрения: IMF--24 Дата одобрения: .2024. Дата истечения: .2026 г.
Презентация подготовлена с использованием материалов конференции «Перспектива. На шаг впереди. Город Санкт-Петербург, 01-03.03.2024»
Представлена только информация в рамках зарегистрированных в РФ показаний
Мнение лектора не всегда может совпадать с точкой зрения компании AstraZeneca
Мероприятие организовано компанией AstraZeneca
2024 г.
Материал предназначен для специалистов здравоохранения
2.
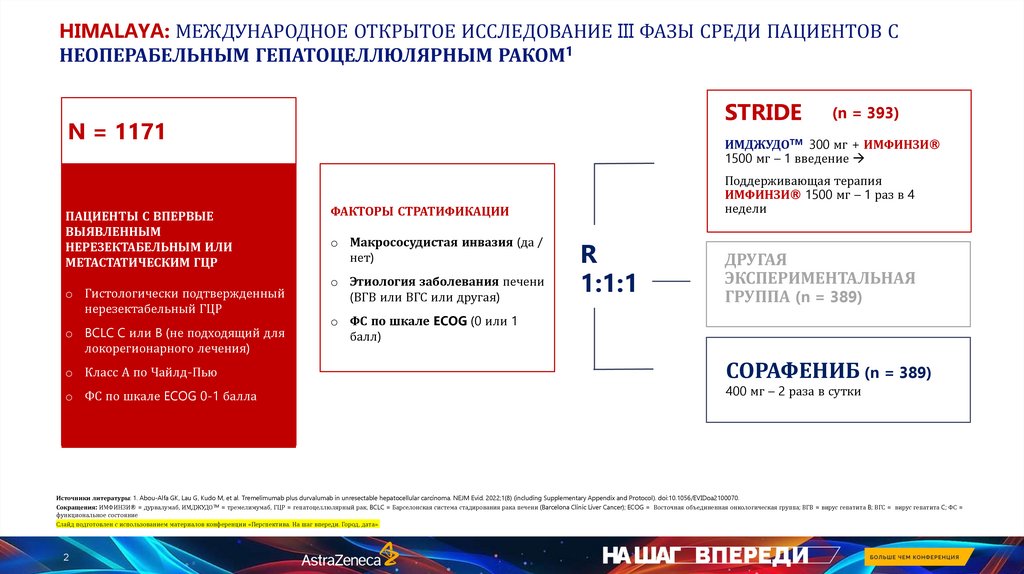
HIMALAYA: МЕЖДУНАРОДНОЕ ОТКРЫТОЕ ИССЛЕДОВАНИЕ III ФАЗЫ СРЕДИ ПАЦИЕНТОВ СНЕОПЕРАБЕЛЬНЫМ ГЕПАТОЦЕЛЛЮЛЯРНЫМ РАКОМ1
STRIDE
N = 1171
ПАЦИЕНТЫ С ВПЕРВЫЕ
ВЫЯВЛЕННЫМ
НЕРЕЗЕКТАБЕЛЬНЫМ ИЛИ
МЕТАСТАТИЧЕСКИМ ГЦР
o Гистологически подтвержденный
нерезектабельный ГЦР
o BCLC C или B (не подходящий для
локорегионарного лечения)
o Класс А по Чайлд-Пью
o ФС по шкале ECOG 0-1 балла
(n = 393)
ИМДЖУДОTM 300 мг + ИМФИНЗИ®
1500 мг – 1 введение
Поддерживающая терапия
ИМФИНЗИ® 1500 мг – 1 раз в 4
недели
ФАКТОРЫ СТРАТИФИКАЦИИ
o Макрососудистая инвазия (да /
нет)
o Этиология заболевания печени
(ВГВ или ВГС или другая)
o ФС по шкале ECOG (0 или 1
балл)
R
1:1:1
R
ДРУГАЯ
ЭКСПЕРИМЕНТАЛЬНАЯ
ГРУППА (n = 389)
СОРАФЕНИБ (n = 389)
400 мг – 2 раза в сутки
Источники литературы: 1. Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8) (including Supplementary Appendix and Protocol). doi:10.1056/EVIDoa2100070.
Сокращения: ИМФИНЗИ® = дурвалумаб, ИМДЖУДОTM = тремелимумаб, ГЦР = гепатоцеллюлярный рак, BCLC = Барселонская система стадирования рака печени (Barcelona Clinic Liver Cancer); ECOG = Восточная объединенная онкологическая группа; ВГВ = вирус гепатита B; ВГС = вирус гепатита C; ФС =
функциональное состояние
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
2
3.
STRIDE: 1-КРАТНОЕ ВВЕДЕНИЕ ИМДЖУДОTM В КОМБИНАЦИИ С ИМФИНЗИ® НА СТАРТЕЛЕЧЕНИЯ С ПОСЛЕДУЮЩЕЙ ПОДДЕРЖИВАЮЩЕЙ ТЕРАПИЕЙ ИМФИНЗИ® В МОНOРЕЖИМЕ1
STRIDE
1-кратная инициирующая доза
1
ВВЕДЕНИЕ
ИМДЖУДОTM
300 мг
Однократное введение
Фиксированная доза
Ингибитор CTLA-4
+
Поддерживающая терапия
ИМФИНЗИ®
ИМФИНЗИ®
1500 мг
Фиксированная доза
1500 мг
Фиксированная доза
1 раз * 4 недели
Ингибитор PD-L1
По материалам конференции Перспектива. ЖКТ. Г.Санкт-Петербург, 1-3 марта
2024г.
До утраты клинической пользы
или развития непереносимой
токсичности
Источники литературы:
Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8) (including Supplementary Appendix and Protocol). doi:10.1056/EVIDoa2100070.
Сокращения: ИМФИНЗИ® = дурвалумаб, ИМДЖУДОTM = тремелимумаб, STRIDE = схема с однократным введением тремелимумаба и дальнейшим введением дурвалумаба через равные интервалы; PD-L1 = лиганд белка программируемой клеточной гибели 1-го типа, CTLA4 — член суперсемейства
иммуноглобулинов, который представлен на поверхности Т-хелперов и передают ингибирующий сигнал на Т-лимфоциты
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
3
4.
HIMALAYA: ПЕРВИЧНОЙ КОНЕЧНОЙ ТОЧКОЙ ЯВЛЯЕТСЯ СТАТИСТИЧЕСКИ ЗНАЧИМОЕПРЕИМУЩЕСТВО РЕЖИМА STRIDE В ОТНОШЕНИИ ОВ1
Первичная конечная точка
• ОВ (режим STRIDE в сравнении с СОРАФЕНИБОМ)
Критерии исключения
Ко-инфекции ВГВ + ВГС
Печеночная энцефалопатия в течение последних 12 месяцев
или потребность в препаратах для профилактики или контроля
энцефалопатии
Клинически значимый асцит
Тромбоз в основном стволе портальной вены
Документально подтвержденное активное или
предшествующее желудочно-кишечное кровотечение,
включая кровотечение из язвы или варикозно расширенных вен
пищевода за предшествующие 12 месяцев
Ранее перенесенная операция по аллогенной трансплантации
внутренних органов (например, трансплантация печени)
Вторичные конечные точки
ОВ через 18, 24, 36 мес
ВБП
ЧОО
ПрО
Безопасность
Связанное со здоровьем качество жизни, сообщаемое
пациентами
Источник литературы:
1.
Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8) (including Supplementary Appendix and Protocol). doi:10.1056/EVIDoa2100070.
Сокращения:
ОВ = общая выживаемость, ВБП = выживаемость без прогрессирования, ЧОО = частота объективного ответа, ПрО = продолжительность ответа, ВГВ = вирус гепатита B, ВГС = вирус гепатита C, ВГД = вирус гепатита Д
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
4
5.
HIMALAYA: ВКЛЮЧАЛИСЬ РАЗЛИЧНЫЕ ПРОФИЛИ ПАЦИЕНТОВ, МАКСИМАЛЬНОСООТВЕТСТВУЮЩИЕ ПОПУЛЯЦИИ БОЛЬНЫХ С НЕОПЕРАБЕЛЬНЫМ ГЦР В РЕАЛЬНОЙ
КЛИНИЧЕСКОЙ ПРАКТИКЕ1
Основные исходные характеристики (ITT популяция)1
Характеристики
STRIDE
(n = 393)
СОРАФЕНИБ
(n = 389)
Медиана возраста (диапазон лет)
65 (22–86)
64 (18–88)
STRIDE
(n = 393)
СОРАФЕНИБ
(n = 389)
A/5
295 (75,1)
277 (71,2)
Характеристики
Класс по Чайлд - Пью, n (%)
Пол, n (%)
Мужской
327 (83,2)
337 (86,6)
A/6
92 (23,4)
102 (26,2)
Женский
66 (16,8)
52 (13,4)
B/7
4 (1,0)
10 (2,6)
Другое
2 (0,5)
0
B
77 (19,6)
66 (17,0)
C
316 (80,4)
323 (83,0)
Регион, n (%)
Азия (кроме Японии)
156 (39,7)
156 (40,1)
Остальные страны (включая
Японию)
237 (60,3)
233 (59,9)
Этиология, n (%)
Стадия по BCLC, n (%)
ВГВ
122 (31,0)
119 (30,6)
МСИ, n (%)
103 (26,2)
100 (25,7)
ВГС
110 (28,0)
104 (26,7)
ВнеПР, n (%)
209 (53,2)
203 (52,2)
Невирусная этиология
161 (41,0)
166 (42,7)
АФП ≥ 400 нг/мл, n (%)
145 (36,9)
124 (31,9)
Положительный
148 (37,7)
148 (38,0)
Отрицательный
189 (48,1)
181 (46,5)
Данные отсутствуют
52 (13,2)
45 (11,6)
ФС по шкале ECOG, n (%)
Статус PD-L1, n (%)
0
244 (62,1)
241 (62,0)
1
148 (37,7)
147 (37,8)
2
1 (0,3)
1 (0,3)
Источник литературы:
1.
Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8) (including Supplementary Appendix and Protocol). doi:10.1056/EVIDoa2100070.
Сокращения:
ВГВ = вирус гепатита B, ВГС = вирус гепатита C, ФС = функциональное состояние, ECOG = Восточная объединенная онкологическая группа, BCLC = Барселонская система стадирования рака печени (Barcelona Clinic Liver Cancer), МСИ = макрососудистая инвазия,
внеПР = внепеченочное распространение, АФП = альфа-фетопротеин, PD-L1 = лиганд белка программируемой клеточной гибели 1-го типа, ГЦР = гепатоцеллюлярный рак
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
5
5
6.
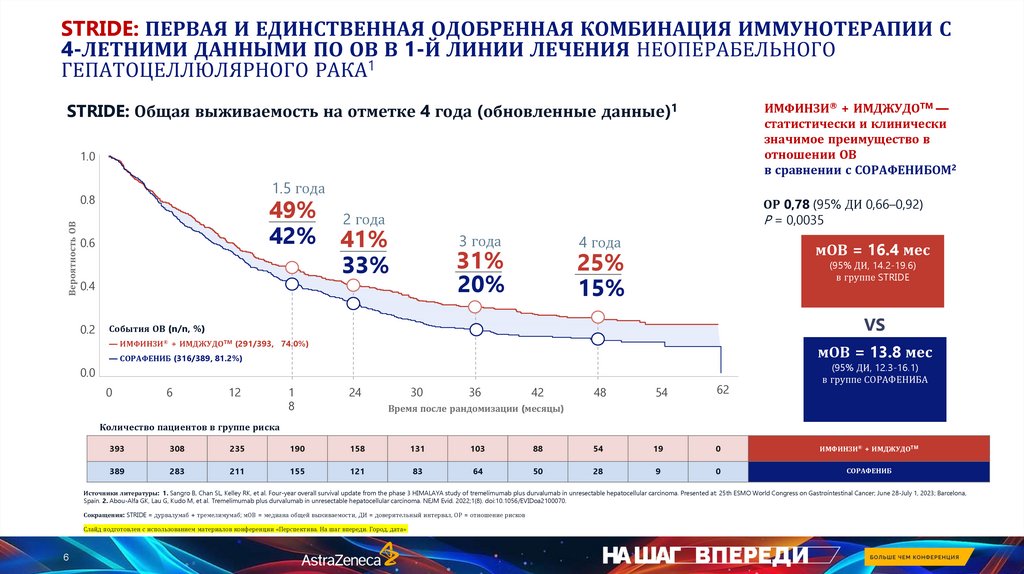
STRIDE: ПЕРВАЯ И ЕДИНСТВЕННАЯ ОДОБРЕННАЯ КОМБИНАЦИЯ ИММУНОТЕРАПИИ С4-ЛЕТНИМИ ДАННЫМИ ПО ОВ В 1-Й ЛИНИИ ЛЕЧЕНИЯ НЕОПЕРАБЕЛЬНОГО
ГЕПАТОЦЕЛЛЮЛЯРНОГО РАКА1
STRIDE: Общая выживаемость на отметке 4 года (обновленные данные)1
ИМФИНЗИ® + ИМДЖУДОTM —
статистически и клинически
значимое преимущество в
отношении ОВ
в сравнении с СОРАФЕНИБОМ2
1.0
1.5 года
Вероятность ОВ
0.8
49%
42%
0.6
0.4
0.2
ОР 0,78 (95% ДИ 0,66–0,92)
P = 0,0035
2 года
41%
33%
3 года
4 года
31%
20%
мОВ = 16.4 мес
25%
15%
(95% ДИ, 14.2-19.6)
в группе STRIDE
VS
События ОВ (n/n, %)
— ИМФИНЗИ® + ИМДЖУДОTM (291/393, 74.0%)
мОВ = 13.8 мес
— СОРАФЕНИБ (316/389, 81.2%)
0.0
0
6
12
1
8
24
30
36
42
48
54
62
(95% ДИ, 12.3-16.1)
в группе СОРАФЕНИБА
Время после рандомизации (месяцы)
Количество пациентов в группе риска
393
308
235
190
158
131
103
88
54
19
0
ИМФИНЗИ® + ИМДЖУДОTM
389
283
211
155
121
83
64
50
28
9
0
СОРАФЕНИБ
Источники литературы: 1. Sangro B, Chan SL, Kelley RK, et al. Four-year overall survival update from the phase 3 HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. Presented at: 25th ESMO World Congress on Gastrointestinal Cancer; June 28-July 1, 2023; Barcelona,
Spain. 2. Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8). doi:10.1056/EVIDoa2100070.
Сокращения: STRIDE = дурвалумаб + тремелимумаб; мОВ = медиана общей выживаемости, ДИ = доверительный интервал, ОР = отношение рисков
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
6
7.
ПРЕИМУЩЕСТВО В ОТНОШЕНИИ ОВ ОТМЕЧАЛОСЬ ПОЧТИ ВО ВСЕХ ЗАРАНЕЕ ОПРЕДЕЛЕННЫХ ПОДГРУППАХ.ПОЭТОМУ РЕЖИМ STRIDE МОЖЕТ БЫТЬ РЕКОМЕНДОВАН ВСЕМ ПАЦИЕНТАМ С НЕОПЕРАБЕЛЬНЫМ ГЦР1
В пользу
ИМФИНЗИ® +
ИМДЖУДО™
Пациенты (n)
ИМФИНЗИ® + ИМДЖУДО™
n/N (%)
СОРАФЕНИБ
n/N (%)
782
291/393 (74.0%)
316/389 (81.2%)
0.78 (0.67-0.92)
Мужской
664
239/327 (73.1%)
277/337 (82.2%)
0.73 (0.62-0.87)
Женский
118
52/66 (78.8%)
39/52 (75.0%)
1.02 (0.68-1.56)
<65 лет
390
147/195 (75.4%)
155/195 (79.5%)
0.83 (0.67-1.05)
≥65 лет
392
144/198 (72.7%)
161/194 (83.0%)
0.71 (0.57-0.89)
Позитивный
296
109/148 (73.6%)
121/148 (81.8%)
0.81 (0.62-1.05)
Негативный
370
146/189 (77.2%)
148/181 (81.8%)
0.84 (0.67-1.06)
ВГВ
241
93/122 (76.2%)
101/119 (84.9%)
0.68 (0.51-0.91)
ВГС
214
77/110 (70.0%)
75/104 (72.1%)
0.94 (0.68-1.29)
Невирусная
327
121/161 (75.2%)
140/166 (84.3%)
0.75 (0.59-0.96)
ФС по шкале
0
485
168/244 (68.9%)
185/241 (76.8%)
0.79 (0.64-0.98)
ECOG
1
295
122/148 (82.4%)
130/147 (88.4%)
0.73 (0.57-0.93)
МСИ = Да
203
81/103 (78.6%)
87/100 (87.0%)
0.75 (0.56-1.02)
МСИ = Нет
579
210/290 (72.4%)
229/289 (79.2%)
0.78 (0.64-0.94)
внеПР = Да
412
158/209 (75.6%)
166/203 (81.8%)
0.69 (0.55-0.86)
внеПР = Нет
367
131/182 (72.0%)
150/185 (81.1%)
0.84 (0.66-1.06)
МСИ = да/ или внеПР = нет
514
200/263 (76.0%)
204/251 (81.3%)
0.74 (0.61-0.90)
Азия (за исключением Япония)
312
117/156 (75.0%)
134/156 (85.9%)
0.71 (0.55-0.91)
Остальные страны (включая Японию)
470
174/237 (73.4%)
182/233 (78.1%)
0.82 (0.67-1.01)
<400 ng/mL
349
118/167 (70.7%)
138/182 (75.8%)
0.82 (0.64-1.05)
≥400 ng/mL
169
74/98 (75.5%)
62/71 (87.3%)
0.62 (0.44-0.88)
B
143
52/77 (67.5%)
52/66 (78.8%)
0.81 (0.55-1.19)
C
639
239/316 (75.6%)
264/323 (81.7%)
0.76 (0.64-0.91)
ОВ в заранее определенных подгруппах пациентов
(эксплораторный анализ)1
Все пациенты
Пол
Возраст
Статус PD-L1
Этиология
МСИ/внеПР
Регион
АФП
Стадия по BCLC
Подгрупповой анализ ОВ формально не тестировался на статистическую значимость
0.25
5
В пользу
СОРАФЕНИБА
1
2
ОР (95% ДИ)
4
Источник литературы: 1. Sangro B, Chan SL, Kelley RK, et al. Four-year overall survival update from the phase 3 HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. Presented at: 25th ESMO World Congress on Gastrointestinal Cancer; June 28-July 1, 2023; Barcelona, Spain. Сокращения: BCLC = Барселонская
система стадирования рака печени (Barcelona Clinic Liver Cancer); ECOG = Восточная объединенная онкологическая группа; ВГВ = вирус гепатита B; ГЦР = гепатоцеллюлярный рак, ВГС = вирус гепатита C, ФС = функциональное состояние, АФП = альфа-фетопротеин, МСИ = макрососудистая инвазия, внеПР = внепеченочное
распространение, PD-L1 = лиганд рецептора программируемой клеточной гибели 1 (PD-1), ОВ = общая выживаемость, ОР = отношение рисков, ДИ = доверительный интервал, МСИ = макрососудистая инвазия, внеПР = внепеченочное распространение
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
7
8.
HIMALAYA: ПАЦИЕНТЫ В ГРУППЕ ИМФИНЗИ® + ИМДЖУДОTM БЫСТРЕЕ ДОСТИГАЛИОТВЕТА И ДОЛЬШЕ СОХРАНЯЛИ ЕГО В СРАВНЕНИИ С ТЕМИ, КТО ПОЛУЧАЛ СОРАФЕНИБ1
Подтвержденная ЧОО в ITT популяции
(вторичная конечная точка)
Медиана длительности ответа
(вторичная конечная точка)
ИМФИНЗИ® + ИМДЖУДО™
(n=79) МКР 8,5 - НД
20,1%
В 4 РАЗА
ВЫШЕ ЧАСТОТА
ОТВЕТА
СОРАФЕНИБ
(n=20) МКР 6,5 – 26
22.3 МЕСЯЦА
18.4 МЕСЯЦА
Время от первого задокументированного ответа до даты прогрессирования, смерти или последней
доступной оценки ответа по критериям RECIST 1.1.1
Медиана времени до наступления ответа
(вторичная конечная точка)
5,1%
2.2 МЕСЯЦА
ИМФИНЗИ® + ИМДЖУДОTM
(95 % ДИ, 1,8–4)
ИМФИНЗИ® + ИМДЖУДО™
(79/393)
СОРАФЕНИБ
(20/389)
8
СОРАФЕНИБ
(95 % ДИ 1,9–8,4)
Время от рандомизации до первого подтвержденного ответа по критериям RECIST 1.1.1
Источники литературы: 1. Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8). doi:10.1056/EVIDoa2100070
•Сокращения: ЧОО = частота объективного ответа, ITT популяция = пациенты, получившие лечение, МКР = межквартальный размах, НД = не достигнута, ДИ = доверительный интервал
•Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
3.8 МЕСЯЦА
9.
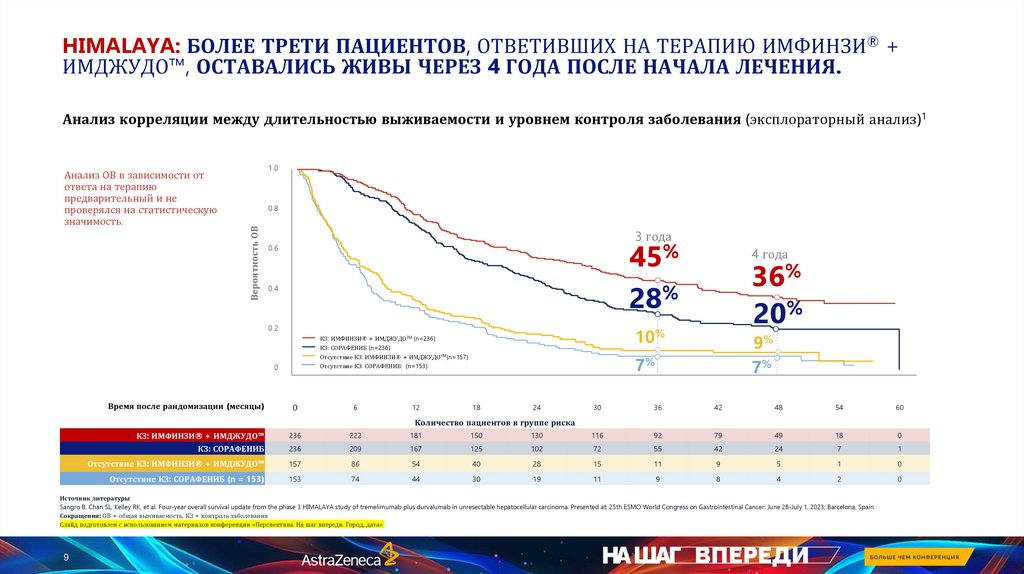
HIMALAYA: БОЛЕЕ ТРЕТИ ПАЦИЕНТОВ, ОТВЕТИВШИХ НА ТЕРАПИЮ ИМФИНЗИ® +ИМДЖУДО™, ОСТАВАЛИСЬ ЖИВЫ ЧЕРЕЗ 4 ГОДА ПОСЛЕ НАЧАЛА ЛЕЧЕНИЯ.
Анализ корреляции между длительностью выживаемости и уровнем контроля заболевания (эксплораторный анализ)1
0.8
Вероятность ОВ
Анализ ОВ в зависимости от
ответа на терапию
предварительный и не
проверялся на статистическую
значимость.
1.0
3 года
%
45
0.6
%
36
%
28
0.4
0.2
0
6
12
%
20
10%
КЗ: ИМФИНЗИ® + ИМДЖУДОTM (n=236)
КЗ: СОРАФЕНИБ (n=236)
Отсутствие КЗ: ИМФИНЗИ® + ИМДЖУДОTM(n=157)
Отсутствие КЗ: СОРАФЕНИБ: (n=153)
0
Время после рандомизации (месяцы)
4 года
9%
7%
7%
18
24
30
36
42
48
54
60
Количество пациентов в группе риска
КЗ: ИМФИНЗИ® + ИМДЖУДО™
236
222
181
150
130
116
92
79
49
18
0
КЗ: СОРАФЕНИБ
236
209
167
125
102
72
55
42
24
7
1
Отсутствие КЗ: ИМФИНЗИ® + ИМДЖУДО™
157
86
54
40
28
15
11
9
5
1
0
Отсутствие КЗ: СОРАФЕНИБ (n = 153)
153
74
44
30
19
11
9
8
4
2
0
Источник литературы:
Sangro B, Chan SL, Kelley RK, et al. Four-year overall survival update from the phase 3 HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. Presented at: 25th ESMO World Congress on Gastrointestinal Cancer; June 28-July 1, 2023; Barcelona, Spain.
Сокращения: ОВ = общая выживаемость, КЗ = контроль заболевания
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
9
10.
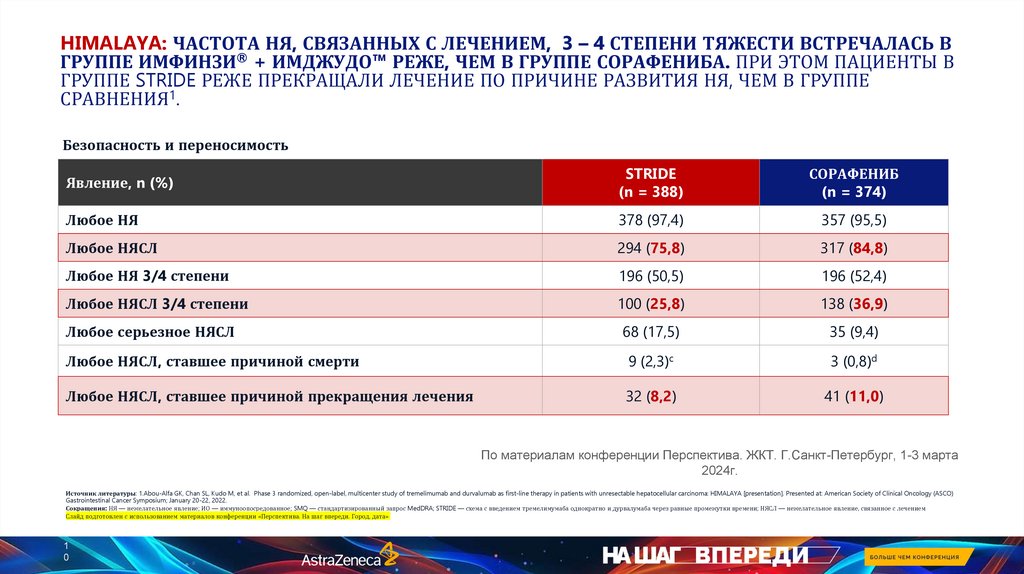
HIMALAYA: ЧАСТОТА НЯ, СВЯЗАННЫХ С ЛЕЧЕНИЕМ, 3 – 4 СТЕПЕНИ ТЯЖЕСТИ ВСТРЕЧАЛАСЬ ВГРУППЕ ИМФИНЗИ® + ИМДЖУДО™ РЕЖЕ, ЧЕМ В ГРУППЕ СОРАФЕНИБА. ПРИ ЭТОМ ПАЦИЕНТЫ В
ГРУППЕ STRIDE РЕЖЕ ПРЕКРАЩАЛИ ЛЕЧЕНИЕ ПО ПРИЧИНЕ РАЗВИТИЯ НЯ, ЧЕМ В ГРУППЕ
СРАВНЕНИЯ1.
Безопасность и переносимость
Явление, n (%)
STRIDE
(n = 388)
СОРАФЕНИБ
(n = 374)
Любое НЯ
378 (97,4)
357 (95,5)
Любое НЯСЛ
294 (75,8)
317 (84,8)
Любое НЯ 3/4 степени
196 (50,5)
196 (52,4)
Любое НЯСЛ 3/4 степени
100 (25,8)
138 (36,9)
Любое серьезное НЯСЛ
68 (17,5)
35 (9,4)
Любое НЯСЛ, ставшее причиной смерти
9 (2,3)c
3 (0,8)d
Любое НЯСЛ, ставшее причиной прекращения лечения
32 (8,2)
41 (11,0)
По материалам конференции Перспектива. ЖКТ. Г.Санкт-Петербург, 1-3 марта
2024г.
Источник литературы: 1.Abou-Alfa GK, Chan SL, Kudo M, et al. Phase 3 randomized, open-label, multicenter study of tremelimumab and durvalumab as first-line therapy in patients with unresectable hepatocellular carcinoma: HIMALAYA [presentation]. Presented at: American Society of Clinical Oncology (ASCO)
Gastrointestinal Cancer Symposium; January 20-22, 2022.
Сокращения: НЯ — нежелательное явление; ИО — иммуноопосредованное; SMQ — стандартизированный запрос MedDRA; STRIDE — схема с введением тремелимумаба однократно и дурвалумаба через равные промежутки времени; НЯСЛ — нежелательное явление, связанное с лечением
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
0
11.
НЯ, связанные с лечением, n (%)ИМФИНЗИ® + ИМДЖУДOTM
(n = 388)
СОРАФЕНИБ
(n = 374)
Любое НЯ со стороны печени (по SMQ)
66 (17)
46 (12,3)
НЯ со стороны печени (по SMQ) 3-й или 4й степени
23 (5,9)
17 (4,5)
HIMALAYA: В ГРУППЕ ИМФИНЗИ® +
ИМДЖУДОTM
НЕ НАБЛЮДАЛОСЬ ВЫЗВАННЫХ
ЛЕЧЕНИЕМ СЛУЧАЕВ
КРОВОТЕЧЕНИЙ ИЗ ВАРИКОЗНО
РАСШИРЕННЫХ ВЕН ЖЕЛУДКА
ИЛИ ПИЩЕВОДА1
Нежелательное явление
НЯ, связанные с лечением
со стороны печени или геморрагические
явления (в соответствии с SMQ)1
Печеночная недостаточность, фиброз и цирроз / другие состояния, связанные с поражением печени
Любые
3 (0,8)
6 (1,6)
Печеночная недостаточность
1 (0,3)
2 (0,5)
Цирроз печени
0
0
Печеночная энцефалопатия
0
2 (0,5)
Кровотечение из варикозно расширенных вен
желудка
0
0
Варикозное расширение вен пищевода
0
0
Кровотечение из варикозно расширенных вен
пищевода
0
0
18 (4,6)
0
4 (1)
0
Любое геморрагическое НЯ (по SMQ)
7 (1,8)
18 (4,8)
Любое геморрагическое НЯ (по SMQ) 3-й или
4-й степени
2 (0,5)
4 (1,1)
Повышение МНО
4 (1)
0
Пурпура
2 (0,5)
1 (0,3)
Увеличение активированного частичного
тромбопластинового времени
1 (0,3)
0
Кровотечение из опухоли
1 (0,3)
0
Желудочно-кишечное кровотечение
0
3 (0,8)
Носовое кровотечение
0
4 (1,1)
Кровоточивость десен
0
2 (0,5)
Кровохарканье
0
1 (0,3)
Гематурия
0
2 (0,5)
Снижение уровня гемоглобина в крови
0
1 (0,3)
Гепатит не вирусной этиологии
Любые
Иммуноопосредованный гепатит
Кровотечение
Источники литературы: Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable
hepatocellular carcinoma. NEJM Evid. 2022;1(8) (including Supplementary Appendix and Protocol).
doi:10.1056/EVIDoa2100070.
Сокращения: НЯ = нежелательное явление, АЛТ = аланинаминотрансфераза; АСТ = аспартатаминотрансфераза,
SMQ — стандартизированный запрос MedDRA; МНО = международное нормализованное отношение
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
1
12.
HIMALAYA: БОЛЬШИНСТВО иоНЯ В ГРУППЕ STRIDE БЫЛИ НИЗКОЙ СТЕПЕНИТЯЖЕСТИ (СТЕПЕНИ 1 ИЛИ 2) И, КАК ПРАВИЛО, ПОДДАВАЛИСЬ ЛЕЧЕНИЮ В
СООТВЕТСТВИИ С РЕКОМЕНДАЦИЯМИ ПО ВЕДЕНИЮ НЯ
Общая частота любых иоНЯ по времени возникновения у
пациентов с иоНЯ в группе STRIDE (поисковый анализ)
Иммуноопосредованные явления
Любой степени,
%
Степени тяжести
3–4, %
Любые
35,8
12,6
Явления со стороны печени
7,5
4,1
Диарея/колит
5,9
3,6
Дерматит/сыпь
4,9
1,8
Явления со стороны поджелудочной
железы
2,3
1,8
Явления со стороны почек
1,0
0,5
Надпочечниковая недостаточность
1,5
0,3
Гипертиреоз
4,6
0,3
Гипотиреоз
10,8
0
Пневмонит
1,3
0
Пациенты с явлениями (%)
иоНЯ
ИМФИНЗИ® + ИМДЖУДО™
(n = 388)
Большинство иоНЯ при применении
ИМФИНЗИ® + ИМДЖУДО™ развивались в
течение первых 3 месяцев лечения и
разрешались в течение 60 дней после начала
соответствующей медикаментозной терапии и/или
модификации лечения
Время (месяцы)
Источник литературы: 1. Lau G, Sangro B, Crysler OV, et al. Temporal patterns of immune-mediated adverse events with tremelimumab plus durvalumab in the phase 3 HIMALAYA study in unresectable hepatocellular carcinoma. Poster presented at: American Society of Clinical Oncology Annual Meeting; June 2-6, 2023; Chicago,
IL.
Сокращения: НЯ –нежелательное явление; иоНЯ – иммуно-опосредованное нежелательное явление
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
2
13.
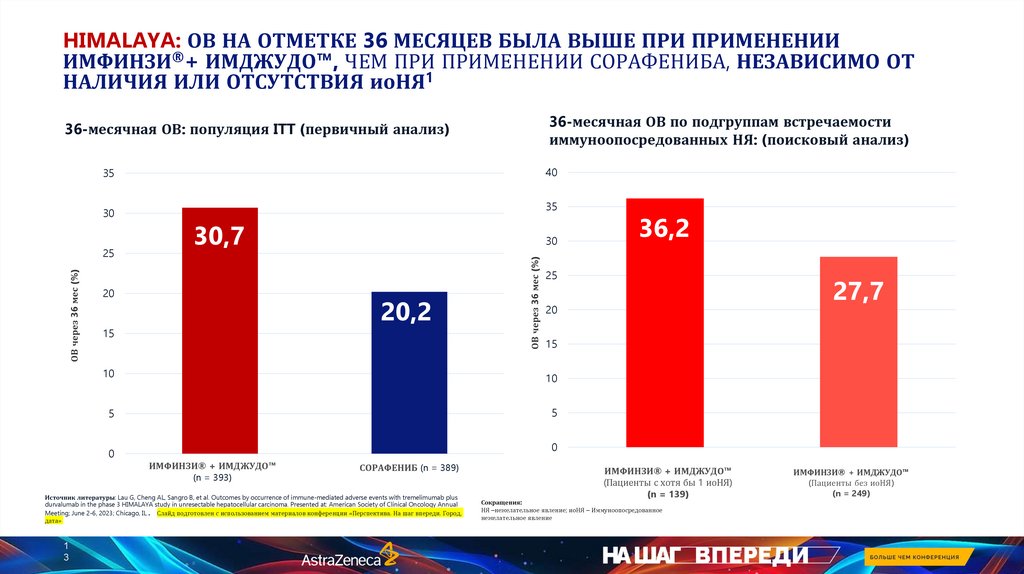
HIMALAYA: ОВ НА ОТМЕТКЕ 36 МЕСЯЦЕВ БЫЛА ВЫШЕ ПРИ ПРИМЕНЕНИИИМФИНЗИ®+ ИМДЖУДО™, ЧЕМ ПРИ ПРИМЕНЕНИИ СОРАФЕНИБА, НЕЗАВИСИМО ОТ
НАЛИЧИЯ ИЛИ ОТСУТСТВИЯ иоНЯ1
36-месячная ОВ по подгруппам встречаемости
иммуноопосредованных НЯ: (поисковый анализ)
36-месячная ОВ: популяция ITT (первичный анализ)
40
35
ОВ через 36 мес (%)
25
35
30,7
30
30,7
20
20,2
20,2
15
36,2
36,2
27,7
25
27,7
20
15
10
10
5
5
0
0
ИМФИНЗИ® + ИМДЖУДО™
(n = 393)
СОРАФЕНИБ (n = 389)
Источник литературы: Lau G, Cheng AL, Sangro B, et al. Outcomes by occurrence of immune-mediated adverse events with tremelimumab plus
durvalumab in the phase 3 HIMALAYA study in unresectable hepatocellular carcinoma. Presented at: American Society of Clinical Oncology Annual
Meeting; June 2-6, 2023; Chicago, IL. Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город,
дата»
1
3
ОВ через 36 мес (%)
30
ИМФИНЗИ® + ИМДЖУДО™
(Пациенты с хотя бы 1 иоНЯ)
(n = 139)
Сокращения:
НЯ –нежелательное явление; иоНЯ – Иммуноопосредованное
нежелательное явление
ИМФИНЗИ® + ИМДЖУДО™
(Пациенты без иоНЯ)
(n = 249)
14.
ТЕРАПИЯ STRIDE В ИССЛЕДОВАНИИ HIMALАYA ПОЛУЧИЛА ОЦЕНКУ 5 БАЛЛОВ ПО ШКАЛЕКЛИНИЧЕСКОЙ ПОЛЬЗЫ ЕВРОПЕЙСКОГО ОБЩЕСТВА МЕДИЦИНСКОЙ ОНКОЛОГИИ (ESMOMCBS)1
Шкала ESMO-MCBS была разработана в 2015 г. с
целью улучшить выбор противоопухолевой
терапии с учетом клинических и
экономических аспектов
Оценка по шкале ESMO-MCBS позволяет:
Снизить вероятность систематических ошибок в ходе
анализа и интерпретации данных
Провести надежную валидацию в соответствии со
строгими критериями «целесообразности» терапии
Объективно оценить преимущества терапии и
принимать обоснованные решения по ее назначению
HIMALAYA: Терапия дурвалумабом с тремелимумабом по сравнению
с сорафенибом в качестве терапии 1-й линии нерезектабельного ГЦР
получил оценку 5 (из 5 возможных)
Если мОВ стандарта лечения > 12 - ≤ 24 мес
Уровень 4
ОР ≤ 0.70 и увеличение на 5 ≥ мес
Либо только увеличение 3л ОВ ≥ 10%
Уровень 3
ОР ≤ 0.70 и увеличение на ≥ 3 - < 5 мес
Уровень 2
ОР ≤ 0.70 и увеличение на ≥1.5 - < 3 мес
ОР > 0.70 – 0.75 и увеличение на ≥ 1.5 мес
Уровень 1
ОР > 0.75 или увеличение на < 1.5 мес
Оценки 5 из 5 по шкале ESMO-MCBS означают, что данная
терапия представляет «значимую пользу» и должна быть
По материалам конференции Перспектива. ЖКТ. Г.Санкт-Петербург, 1-3 марта
рассмотрена для включения в программу финансирования.
2024г.
Сокращения: ГЦР = Гепатоцеллюлярный рак, мОВ = медиана обзей выживаемость, ОР – отношение рисков
Источники литературы: https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-scorecards/scorecard-358-1 доступно на 29.02.2024
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
4
15.
NCCN 2022 v4 ПРИНЦИПЫ СИСТЕМНОЙ ТЕРАПИИ: STRIDE РЕКОМЕНДОВАН В КАЧЕСТВЕ 1-ЙЛИНИИ ЛЕЧЕНИЯ НЕОПЕРАБЕЛЬНОГО ГЦР. КОМБИНАЦИЯ ИМФИНЗИ® + ИМДЖУДО™ НЕ
ИМЕЕТ ОГРАНИЧЕНИЙ В ОТНОШЕНИИ КЛАССА ПО ЧАЙЛД-ПЬЮ1
Системная терапия первой линии
Предпочтительные схемы
терапии
a.
b.
c.
Другие рекомендуемые схемы
Сорафениб (класс A по Чайлд — Пью)
([категория 1] или B7)d,e
Атезолизумаб + бевацизумаб
(только класс A по Чайлд — Пью)
(категория 1)a,b,c,
Ленватиниб (только класс A по Чайлд
— Пью) (категория 1)
Тремелимумаб + дурвалумаб
(категория 1)b
Дурвалумабb
Пембролизумабb (категория 2В)
Целесообразны в некоторых
обстоятельствах
Ниволумабb (при невозможности
применения ингибиторов
тирозинкиназы [ИТК] или других
антиангиогенных средств)
(класс A или B по Чайлд — Пью)
(категория 2B)
Одобренный FDA биосимиляр это адекватная замена для бевацизумаба.
См. Рекомендации NCCN по ведению пациентов с проявлениям токсичности на фоне иммунотерапии.
Пациенты, получающие атезолизумаб + бевацизумаб, должны находиться под наблюдением с эндоскопической оценкой состояния вен пищевода в течение минимум 6 месяцев до начала терапии или в соответствии с практикой, принятой в учреждении, а также с учетом оценки риска
кровотечения.
Примечание: все рекомендации относятся к категории 2А, если не указано иное. Клинические исследования: по мнению NCCN, любой пациент со злокачественным новообразованием получает наилучшее лечение при участии в клиническом исследовании. Следует стимулировать пациентов к
участию в клинических исследованиях.
CD — кластер дифференцировки; CTLA-4 — связанный с цитотоксическими Т-клетками антиген-4; PD-1 — белок запрограммированной гибели клеток 1 типа; PD-L1 — лиганд белка запрограммированной гибели клеток 1 типа; МОО — микроокружение опухоли.
NCCN Hepatobiliary cancers 2022 v.4 - December 9, 2022 https://www.nccn.org/professionals/physician_gls/pdf/hepatobiliary.pdf доступно на 26.12.2022
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
5
16.
BCLC 2022: STRIDE РЕКОМЕНДОВАН В КАЧЕСТВЕ 1-Й ЛИНИИ ТЕРАПИИНЕОПЕРАБЕЛЬНОГО ГЕПАТОЦЕЛЛЮЛЯРНОГО РАКА1
Оценка характеристик пациентов
Прогноз
ГЦР
На основании опухолевой нагрузки, функции
печени и физического состояния
Уточняется по уровню АПФ, показателю ALBI,
оценке по шкале Чайлд – Пью и по шкале
MELD
Самая ранняя стадия (0)
Ранняя стадия (A)
1 опухоль ≤ 2 см
Сохраненная функция печени, ФС 0 баллов
1 опухоль или ≤ 3 узла, ≤ 3 см каждый;
Сохраненная функция печени1, ФС 0 баллов
1 опухоль
Потенциальные кандидаты
на трансплантацию печени
Промежуточная стадия (B)
≤ 3 узла, ≤ 3 см
каждый
Нет
Множественные узлы
Сохраненная функция печени1, ФС 0 баллов
Расширенные критерии
трансплантации печени
(размер АФП)
Давление в воротной
вене, уровень
билирубина
Для выбора индивидуальной тактики лечения
Узлы четко определены,
портальный поток сохранен,
селективный доступ
Терминальная стадия (D)
Поздняя стадия (C)
портальная инвазия и / или внепеченочное распространение;
Сохраненная функция печени, ФС 1–2 балла
Любая опухолевая нагрузка
Выраженная печеночная недостаточность, ФС 3–
4 балла
Диффузное,
инфильтративное
двудолевое печени
Да
Противопоказания к ТП
Нормальный
Повышенный2
Да2
1-й вариант лечения
Абляция
Резекция
Абляция
> 5 лет
Ожидаемая продолжительность жизни
Нет
Трансплантация
ТАХЭ
Системная терапия
ОПТ
> 2,5 лет
> 2 лет
3 месяца
1-я линия
2.
Кроме пациентов с допустимой при трансплантации опухолевой
нагрузкой.
Резекция может быть рассмотрена в случае одиночной
периферальной ГЦР с приемлемым объемом остающейся части
печени.
- После атезолизумаба-бевацизумаба
- После дурвалумаба-тремелимумаба
- После ленватиниба или дурвалумаба
3-я линия
Кабозантиниб
Невозможность применения
1.
Неосуществима или
неудачная
Клинические исследования
ТАХЭ
Радиоэмболизация (только для одиночного очага ≤ 8 см)
Регорафениб
(при переносимости сорафениба)
Кабозантиниб
Рамуцирумаб
(АФП ≥ 400 нг/мл)
Невозможность
применения
Переход в этапах лечения Подготовка
низкоприоритетных методов при клинической
характеристике с отсутствием проблем,
связанных с печенью (возраст, сопутствующие
заболевания, предпочтения
2-я линия
- После сорафениба
Невозможность
применения
Принятие клинического решения
Неосуществима или неудачная
Атезолизумаб-бевацизумаб / ДУРВАЛУМАБ-ТРЕМЕЛИМУМАБ
При невозможности — сорафениб или ленватиниб или дурвалумаб
Понижение стадии
опухоли
Могут быть рассмотрены
альтернативные
последовательности, но их
эффективность не
подтверждена
Сокращения: ГЦР — гепатоцеллюлярный рак; ОС — общее состояние; АФП — α-фетопротеин; МКСЗП — модель конечной стадии заболевания печени; ТП — трансплантация печени; ТАХЭ — трансартериальная химиоэмболизация; ОПТ — оптимальная поддерживающая терапия; CPS — классификация Чайлд – Пью (Child – Pugh Score); BCLC —
Барселонская система стадирования рака печени (Barcelona Clinic Liver Cancer). Источник литературы: Journal of Hepatology 2022 vol. 76, 681-693 Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
6
16
17.
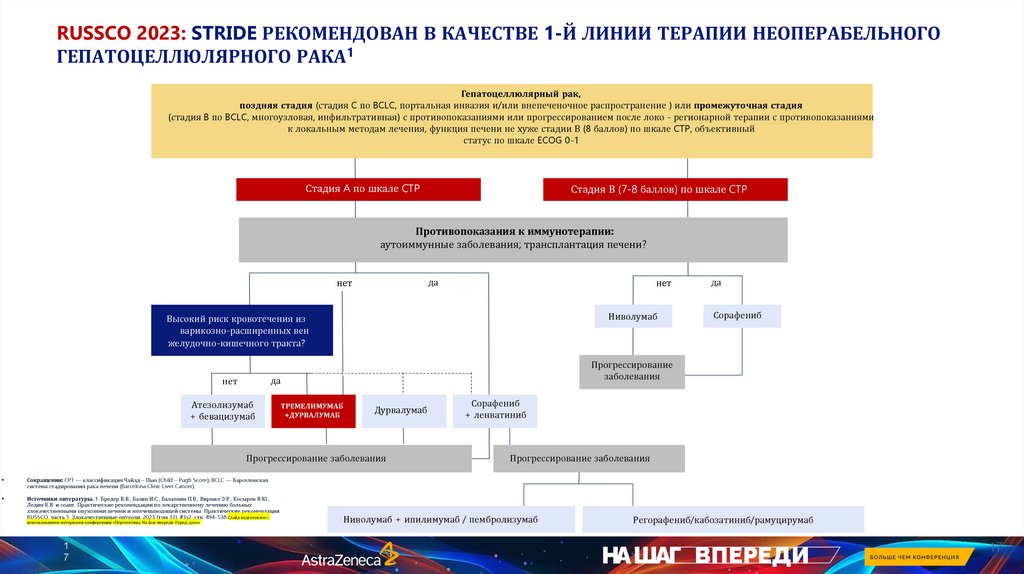
RUSSCO 2023: STRIDE РЕКОМЕНДОВАН В КАЧЕСТВЕ 1-Й ЛИНИИ ТЕРАПИИ НЕОПЕРАБЕЛЬНОГОГЕПАТОЦЕЛЛЮЛЯРНОГО РАКА1
Гепатоцеллюлярный рак,
поздняя стадия (стадия C по BCLC, портальная инвазия и/или внепеченочное распространение ) или промежуточная стадия
(стадия B по BCLC, многоузловая, инфильтративная) с противопоказаниями или прогрессированием после локо - регионарной терапии с противопоказаниями
к локальным методам лечения, функция печени не хуже стадии В (8 баллов) по шкале CTP, объективный
статус по шкале ECOG 0-1
Стадия A по шкале CTP
Стадия В (7-8 баллов) по шкале CTP
Противопоказания к иммунотерапии:
аутоиммунные заболевания; трансплантация печени?
да
нет
нет
Ниволумаб
Высокий риск кровотечения из
варикозно-расширенных вен
желудочно-кишечного тракта?
Атезолизумаб
+ бевацизумаб
ТРЕМЕЛИМУМАБ
+ДУРВАЛУМАБ
Дурвалумаб
Прогрессирование заболевания
Сокращения: CPT — классификация Чайлд – Пью (Child – Pugh Score); BCLC — Барселонская
система стадирования рака печени (Barcelona Clinic Liver Cancer).
Источники литературы. 1. Бредер В.В., Базин И.С., Балахнин П.В., Виршке Э.Р., Косырев В.Ю.,
Ледин Е.В. и соавт. Практические рекомендации по лекарственному лечению больных
злокачественными опухолями печени и желчевыводящей системы. Практические рекомендации
RUSSCO, часть 1. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 494–538.Слайд подготовлен с
использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
7
Сорафениб
Прогрессирование
заболевания
да
нет
да
Сорафениб
+ ленватиниб
Прогрессирование заболевания
Ниволумаб + ипилимумаб / пембролизумаб
Регорафениб/кабозатиниб/рамуцирумаб
17
18.
RUSSCO 2023: STRIDE РЕКОМЕНДОВАН В КАЧЕСТВЕ 1-Й ЛИНИИ ТЕРАПИИ НЕОПЕРАБЕЛЬНОГОГЕПАТОЦЕЛЛЮЛЯРНОГО РАКА1
АТЕЗОЛИЗУМАБ + БЕВАЦИЗУМАБ
ИМФИНЗИ® + ИМДЖУДО™
В качестве предпочтительной I линии системной терапии у
пациентов:
Методом выбора терапии I линии.
!
o В регистрационное исследование HIMALAYA не
включались пациенты с распространенным
тромбозом (тип 3–4, долевые вены и ствол) воротной
вены.
o c низким риском кровотечения из варикозно-расширенных вен
пищевода / желудка (не было эпизода кровотечения в последние
6 мес., расширение вен пищевода 1–2 степени на эффективной
профилактике неселективными β-блокаторами, > 2 недель после
лигирования варикозно расширенных вен пищевода 3 степени),
?
ECOG 0–1 баллов и
!
!
o функцией печени CТP 5–6 баллов ГЦР независимо от факторов
риска развития ГЦР.
При наличии в анамнезе пациента аутоиммунных заболеваний или трансплантации органа иммунотерапия не применяется.
Сокращения: CPT — классификация Чайлд – Пью (Child – Pugh Score); BCLC — Барселонская система стадирования рака печени (Barcelona Clinic Liver Cance); ГЦР – гепатоцеллюлярный рак; ECOG – Восточноевропейская система оценки общего состояния
онкологического пациента. Источники литературы. 1. Бредер В.В., Базин И.С., Балахнин П.В., Виршке Э.Р., Косырев В.Ю., Ледин Е.В. и соавт. Практические рекомендации по лекарственному лечению больных злокачественными опухолями печени и желчевыводящей
системы. Практические рекомендации RUSSCO, часть 1. Злокачественные опухоли, 2023 (том 13), #3s2, стр. 494–538.
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
8
18
19.
HIMALAYA: РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ1,2ОВ на отметке 4 года
25% vs 15%
STRIDE
СОРАФЕНИБ
медиана ОВ (мес)
16.4 vs 13.8
STRIDE
Устойчивое преимущество по ОВ
почти во всех подгруппах
пациентов
СОРАФЕНИБ
ОР = 0.78 (95% ДИ 0.66– 0.92)
р = 0,0035
ЧОО
Частота НЯСЛ 3 – 4 ст.
20% vs 5%
26% vs 37%
STRIDE
СОРАФЕНИБ
STRIDE
Частота кровотечений из
варикозно расширенных вен
пищевода и желудка
СОРАФЕНИБ
0%
STRIDE
Источники литературы:
1.
Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8) (including Supplementary Appendix and Protocol). doi:10.1056/EVIDoa2100070.
2.
Sangro B, Chan SL, Kelley RK, et al. Four-year overall survival update from the phase 3 HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. Presented at: 25th ESMO World Congress on Gastrointestinal
Cancer; June 28-July 1, 2023; Barcelona, Spain. 2. Abou-Alfa GK, Lau G, Kudo M, et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid. 2022;1(8). doi:10.1056/EVIDoa2100070.
Сокращения:
ОВ = общая выживаемость, ЧОО = частота объективного ответа, НЯСЛ = нежелательные явления, связанные с лечением
Слайд подготовлен с использованием материалов конференции «Перспектива. На шаг впереди. Город, дата»
1
9
19













 Медицина
Медицина