Похожие презентации:
Новые возможности в лечении колоректального рака таргентными препаратами
1. Новые возможности в лечении колоректального рака таргентными препаратами докладчик: Мишина Ю.А. врач ХТО№2 ОБУЗ КОКОД
14.04.2017Материал подготовлен при научной поддержке АО «БАЙЕР»
L.RU.COM.SM.03.2016.0284
2. Эпидемиология колоректального рака
Колоректальный рак (КРР) - злокачественные новообразованиятолстого кишечника и прямой кишки
Колоректальный рак – третий по распространенности вид рака во всем
мире у мужчин и второй у женщин
рак легкого
рак предстательной железы
колоректальный рак
рак молочной железы
колоректальный рак
рак легкого
GLOBOCAN 2012 (IARC) , Section of Cancer Surveillance (10/11/2014) http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx.
L.RU.COM.SM.03.2016.0284
3. Эпидемиология колоректального рака в мире
Заболеваемость и смертность КРРВ мире
(2012)
Заболеваемость
1 360 000
Смертность
694 000
В Европе 345 000
(2012)
152 000
Заболеваемость
Смертность
57 648
В России
(2014)
38 263
0
Заболеваемость
Смертность
300
Пациенты (мил)
500
1.5
GLOBOCAN Cancer fact sheets: colorectal cancer. 2008.; WHO. Available at:
http://www.euro.who.int/en/what-we-do/health-topics/noncommunicable-diseases/cancer/news/news/2012/2/early-detection-of-common-cancers/colorectal-cancer;
Злокачественные новообразования в России в 2014 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. — М.: ФГБУ
«МНИОИ им. П.А. Герцена» Минздрава России. — 2016.
L.RU.COM.SM.03.2016.0284
4. Рекомендации по лечению колоректального рака
Лекарственная терапия при неоперабельномколоректальном раке в настоящее время не
вызывает сомнений
Терапия
КРР
Гетерогенность течения заболевания: даже в
случае значительного распространения процесса
болезнь может протекать по-разному.
Необходимы все активные препараты, при этом не
имеет значения, за сколько линий терапии это
будет сделано
Непрерывный лечебный комплекс, в котором
определение цели лечения является важной
составляющей
Руководство по химиотерапии опухолевых заболеваний / Под ред. Н.И. Переводчиковой, В.А. Горбуновой. 2015. – 688 с.; Рациональная фармакотерапия в
онкологии: руководство для практикующих врачей/ под ред. М.И. Давыдова, В.А. Горбуновой. 2015. – 844с.; Schmoll HJ, Van Cutsem E, Stein A, et al. ESMO
consensus guidelines Ann Oncol. 2012;23:2479‐2516; E. Van Cutsem, A. Cervantes, B. Nordlingerб et al. Metastatic Colorectal Cancer: ESMO Clinical Practice
Guidelines. Ann Oncol (2014) 25 (suppl 3): iii1-iii9.
L.RU.COM.SM.03.2016.0284
5. Регистрация препаратов для лечения мКРР в России
Таргетные препаратыРегистрация препаратов для лечения
мКРР в России
Химиотерапия
До 2000
Цетуксимаб (2007)
Регорафениб
(2016)
Бевацизумаб (2009)
Панитумумаб (2009)
2002
2003
2004
2005
2006
2007
2008
Афлиберцепт (2014)
2009
2010
2011
2012
2013
2014
2015
2016
2017
2018
Капецитабин (2009)
Оксалиплатин (2002)
Иринотекан (2006)
5-ФУ/лейковорин
Государственный реестр лекарственных средств http://grls.rosminzdrav.ru/default.aspx
L.RU.COM.SM.03.2016.0284
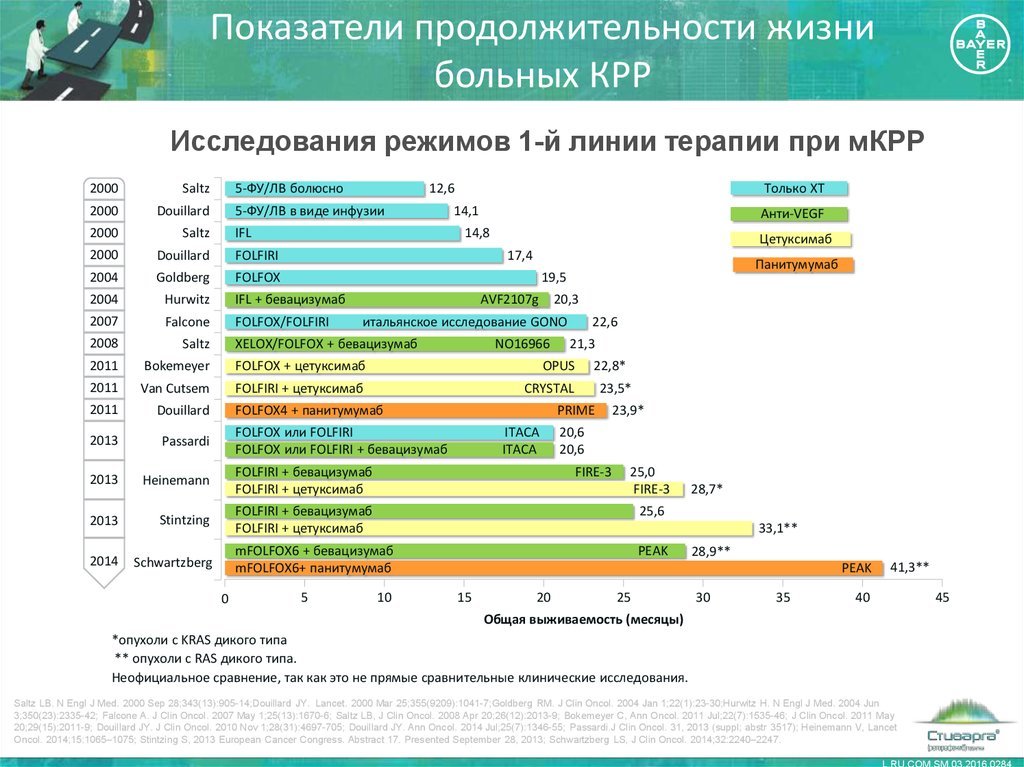
6. Показатели продолжительности жизни больных КРР
Исследования режимов 1-й линии терапии при мКРР5-ФУ/ЛВ болюсно
Только ХТ
2000
Saltz
12,6
2000
Douillard
2000
Saltz
2000
Douillard
FOLFIRI
2004
Goldberg
FOLFOX
2004
Hurwitz
IFL + бевацизумаб
2007
Falcone
FOLFOX/FOLFIRI
2008
Saltz
2011
Bokemeyer
FOLFOX + цетуксимаб
OPUS
2011
Van Cutsem
FOLFIRI + цетуксимаб
CRYSTAL
2011
Douillard
2013
Passardi
2013
Heinemann
FOLFIRI + бевацизумаб
FOLFIRI + цетуксимаб
2013
Stintzing
FOLFIRI + бевацизумаб
FOLFIRI + цетуксимаб
25,6
2014
Schwartzberg
mFOLFOX6 + бевацизумаб
mFOLFOX6+ панитумумаб
PEAK
5-ФУ/ЛВ в виде инфузии
IFL
14,1
Анти-VEGF
14,8
Цетуксимаб
17,4
AVF2107g
20,3
итальянское исследование GONO
XELOX/FOLFOX + бевацизумаб
NO16966
FOLFOX4 + панитумумаб
5
22,6
21,3
22,8*
23,5*
PRIME
FOLFOX или FOLFIRI
FOLFOX или FOLFIRI + бевацизумаб
0
Панитумумаб
19,5
ITACA
ITACA
23,9*
20,6
20,6
FIRE-3
25,0
FIRE-3
28,7*
33,1**
10
28,9**
PEAK
15
20
25
30
35
41,3**
40
45
Общая выживаемость (месяцы)
*опухоли с KRAS дикого типа
** опухоли с RAS дикого типа.
Неофициальное сравнение, так как это не прямые сравнительные клинические исследования.
Saltz LB. N Engl J Med. 2000 Sep 28;343(13):905-14;Douillard JY. Lancet. 2000 Mar 25;355(9209):1041-7;Goldberg RM. J Clin Oncol. 2004 Jan 1;22(1):23-30;Hurwitz H. N Engl J Med. 2004 Jun
3;350(23):2335-42; Falcone A. J Clin Oncol. 2007 May 1;25(13):1670-6; Saltz LB, J Clin Oncol. 2008 Apr 20;26(12):2013-9; Bokemeyer C, Ann Oncol. 2011 Jul;22(7):1535-46; J Clin Oncol. 2011 May
20;29(15):2011-9; Douillard JY. J Clin Oncol. 2010 Nov 1;28(31):4697-705; Douillard JY. Ann Oncol. 2014 Jul;25(7):1346-55; Passardi.J Clin Oncol. 31, 2013 (suppl; abstr 3517); Heinemann V, Lancet
Oncol. 2014;15:1065–1075; Stintzing S, 2013 European Cancer Congress. Abstract 17. Presented September 28, 2013; Schwartzberg LS, J Clin Oncol. 2014;32:2240–2247.
L.RU.COM.SM.03.2016.0284
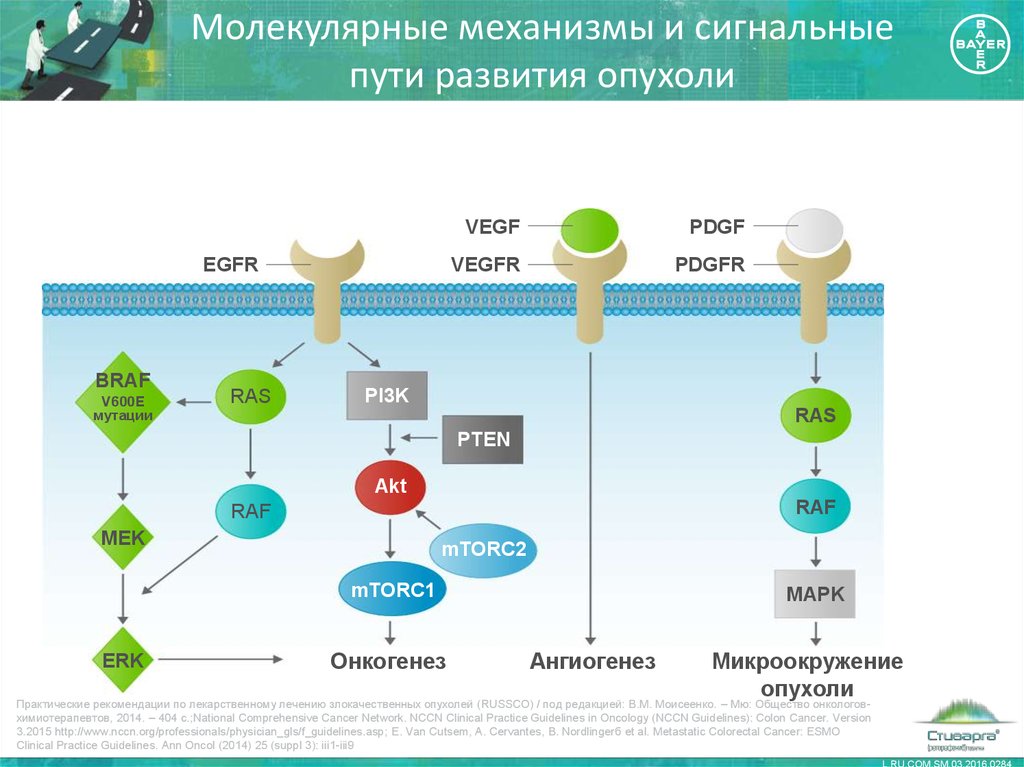
7. Молекулярные механизмы и сигнальные пути развития опухоли
EGFRBRAF
V600E
мутации
RAS
VEGF
PDGF
VEGFR
PDGFR
PI3K
RAS
PTEN
Akt
RAF
RAF
MEK
mTORC2
mTORC1
ERK
Онкогенез
MAPK
Ангиогенез
Микроокружение
опухоли
Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO) / под редакцией: В.М. Моисеенко. – Мю: Общество онкологовхимиотерапевтов, 2014. – 404 с.;National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines): Colon Cancer. Version
3.2015 http://www.nccn.org/professionals/physician_gls/f_guidelines.asp; E. Van Cutsem, A. Cervantes, B. Nordlingerб et al. Metastatic Colorectal Cancer: ESMO
Clinical Practice Guidelines. Ann Oncol (2014) 25 (suppl 3): iii1-iii9
L.RU.COM.SM.03.2016.0284
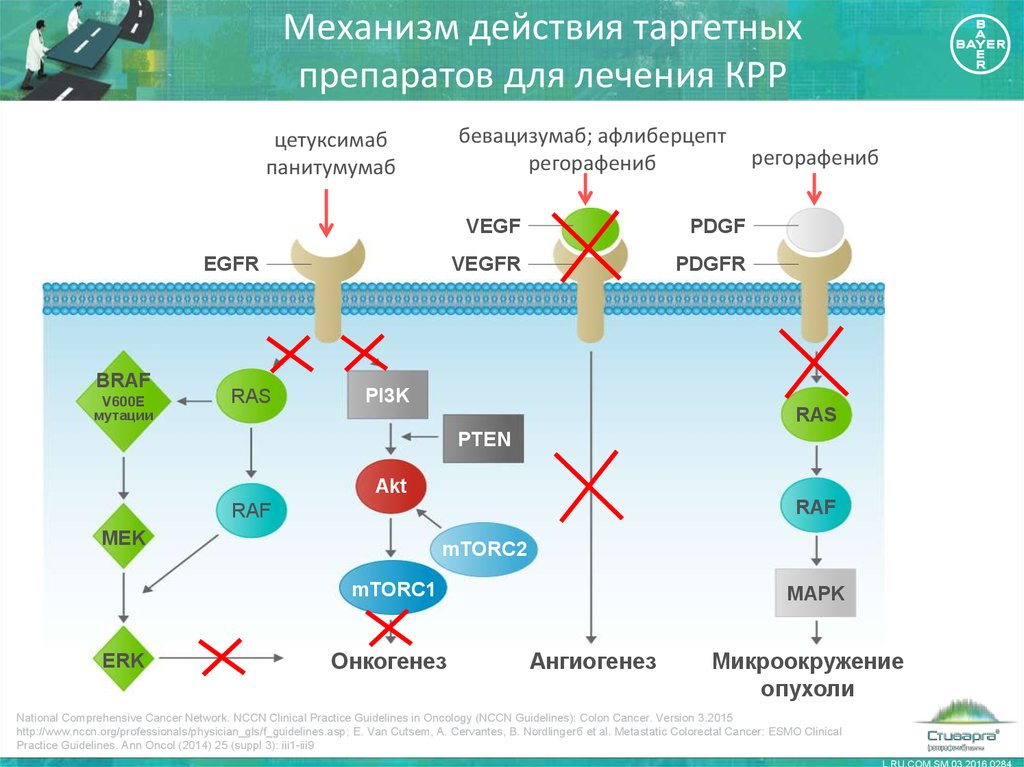
8. Механизм действия таргетных препаратов для лечения КРР
бевацизумаб; афлиберцептрегорафениб
цетуксимаб
панитумумаб
EGFR
BRAF
V600E
мутации
RAS
VEGF
PDGF
VEGFR
PDGFR
регорафениб
PI3K
RAS
PTEN
Akt
RAF
RAF
MEK
mTORC2
mTORC1
ERK
Онкогенез
MAPK
Ангиогенез
Микроокружение
опухоли
National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines): Colon Cancer. Version 3.2015
http://www.nccn.org/professionals/physician_gls/f_guidelines.asp; E. Van Cutsem, A. Cervantes, B. Nordlingerб et al. Metastatic Colorectal Cancer: ESMO Clinical
Practice Guidelines. Ann Oncol (2014) 25 (suppl 3): iii1-iii9
L.RU.COM.SM.03.2016.0284
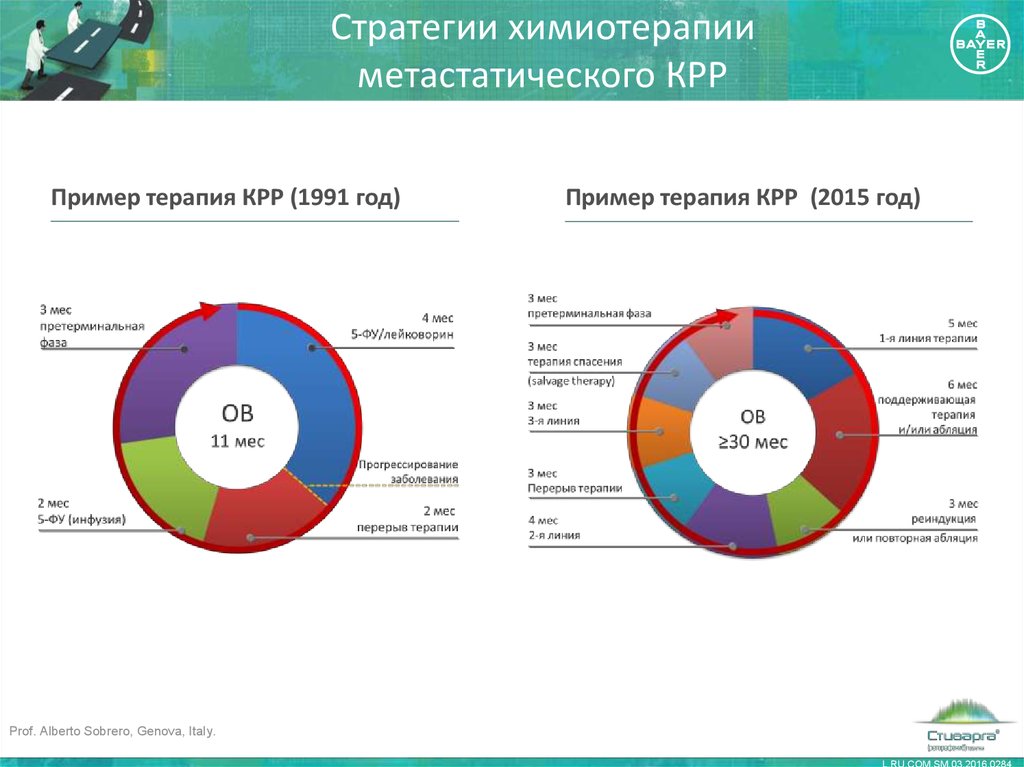
9. Стратегии химиотерапии метастатического КРР
Пример терапия КРР (1991 год)Пример терапия КРР (2015 год)
Prof. Alberto Sobrero, Genova, Italy.
L.RU.COM.SM.03.2016.0284
10. Рекомендации ESMO по лечению распространенного ККР
Группа0
Описание группы
Интенсивность терапии
Выздоровление, снижение
риска рецидива
-
Выполнение операции
-
Потенциально резектабельные
метастазы в печень или легкие в случае
эффекта химиотерапии. Пациент
подходит для интенсивной ХТ
-
Максимальное уменьшение
опухоли и выполнение R0/1резекции
-
Возможно проведение ХТ
по схеме FOLFOX
Наиболее эффективные
режимы ХТ
2
Нерезектабельные метастазы; быстрое прогрессирование, симптоматическое
течение; может перенести интенсивное
лечение
Максимальное уменьшение
размеров опухоли, контроль
прогрессии заболевания
3
Нерезектабельные метастазы, нет
значимых симптомов, или имеется
сопутствующая патология,
препятствующая интенсивному
лечению
Контроль прогрессии
заболевания, сохранение
качества жизни (минимальная токсичность)
1
Изолированные резектабельные (R0)
метастазы в печень и/или легкие
Цель терапии
-
-
Выздоровление
-
Комбинированные
режимы ХТ (двойные или
тройные комбинации)
Наименее токсичные
схемы лечения
Возможно начало с
монотерапии или с
двойных комбинаций с
низкой токсичностью
ESMO - Европейское общество медицинской онкологии
Schmoll HJ et al. Ann Oncol. 2012;23:2479–516.
L.RU.COM.SM.03.2016.0284
11. Схема выбора терапии 1 и 2-й линии согласно клинической группе по рекомендациям ESMO
1-я линия терапииГруппа 0
Изолированные резектабельные (R0)
метастазы в печень и/или легкие
Группа 1
Потенциально резектабельные
Наиболее эффективные режимы ХТ
Группа 2
Симптоматическое течение
Режимы ХТ средней интенсивности
Группа 3
Множественные метастазы, нет
значимых симптомов, нет риска
быстрого ухудшения состояния
Щадящие режимы ХТ
2-я линия терапии
Согласно рекомендациям – отсутствие системной ХТ или ХТ по схеме FOLFOX
KRAS дикий тип
двойная комбинация ХТ ±
цетуксимаб/панитумумаб
двойная комбинация ХТ ±
бевацизумаб
тройная комбинация ХТ
KRAS мутации
двойная комбинация ХТ ±
бевацизумаб
тройная комбинация ХТ
5-ФУ
капецитабин± бевацизумаб
• Режимы на основе иринотекана ±
бевацизумаб при резистентности к
оксалиплантину
• Режимы на основе оксалиплатина±
бевацизумаб при резистентности к
иринотекану
Рефрактерные к ХТ пациенты с
KRAS дикого типа:
• Режимы на основе иринотекана ±
цетуксимаб или панитумумаб при
резистентности к оксалиплантину
• Режимы на основе оксалиплатина±
цетуксимаб или панитумумаб при
резистентности к иринотекану
ХТ – химиотерапия; двойная комбинация ХТ – схемы FOLFOX, FOLFIRI, XELOX, XELIRI
R0 = in sano (полное удаление очага), R1 = возможная микроскопическая остаточная опухоль, R2 = макро/микроскопическая остаточная опухоль.
ESMO - Европейское общество медицинской онкологии
Schmoll HJ et al. Ann Oncol. 2012;23:2479–516.
L.RU.COM.SM.03.2016.0284
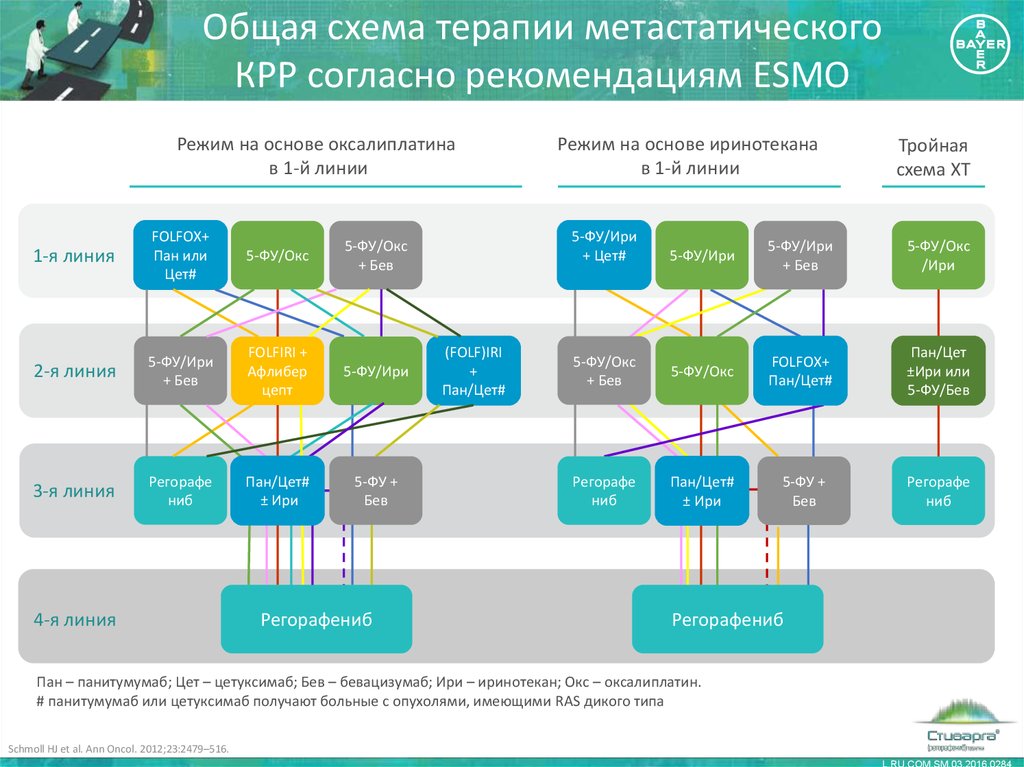
12. Общая схема терапии метастатического КРР согласно рекомендациям ESMO
Режим на основе оксалиплатинав 1-й линии
1-я линия
FOLFOX+
Пан или
Цет#
5-ФУ/Окс
2-я линия
5-ФУ/Ири
+ Бев
FOLFIRI +
Афлибер
цепт
5-ФУ/Ири
3-я линия
Регорафе
ниб
Пан/Цет#
± Ири
5-ФУ +
Бев
4-я линия
5-ФУ/Ири
+ Цет#
5-ФУ/Окс
+ Бев
Регорафениб
Режим на основе иринотекана
в 1-й линии
(FOLF)IRI
+
Пан/Цет#
Тройная
схема ХТ
5-ФУ/Ири
5-ФУ/Ири
+ Бев
5-ФУ/Окс
/Ири
5-ФУ/Окс
+ Бев
5-ФУ/Окс
FOLFOX+
Пан/Цет#
Пан/Цет
±Ири или
5-ФУ/Бев
Регорафе
ниб
Пан/Цет#
± Ири
5-ФУ +
Бев
Регорафе
ниб
Регорафениб
Пан – панитумумаб; Цет – цетуксимаб; Бев – бевацизумаб; Ири – иринотекан; Окс – оксалиплатин.
# панитумумаб или цетуксимаб получают больные с опухолями, имеющими RAS дикого типа
Schmoll HJ et al. Ann Oncol. 2012;23:2479–516.
L.RU.COM.SM.03.2016.0284
13. Рекомендации Национальной онкологической сети (NCCN)
Режим на основе оксалиплатина в 1-й линии#1-я линия
FOLFOX ± Бев
или
XELOX ± Бев
FOLFOX ± Панa
FOLFIRI или Иринотекан
± Афлиб или Бев
2-я линия
3-я линия
Регорафениб
4-я линия
или
Цет или Панa
+ Иринотекан
или
или
FOLFIRI или Иринотекан +
Цет или Панa
Цет или Панa
Регорафениб или клин
исследование или ОПТ
Регорафениб или клин
исследование или ОПТ
aKRAS дикий тип
ОПТ – оптимальная поддерживающая терапия; Афлиб – афлиберцепт; Цет – цетуксимаб; Пан – панитумумаб; Бев - бевацизумаб
#Режим на основе иринотекана и режим с тройной схемой терапии в 1-й линии схожи с рекомендациями ESMO
NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines ®): Colon Cancer, version 2, 2013.
Available at http://www.nccn.org/professionals/physician_gls/pdf/colon.pdf (accessed March 2013).
L.RU.COM.SM.03.2016.0284
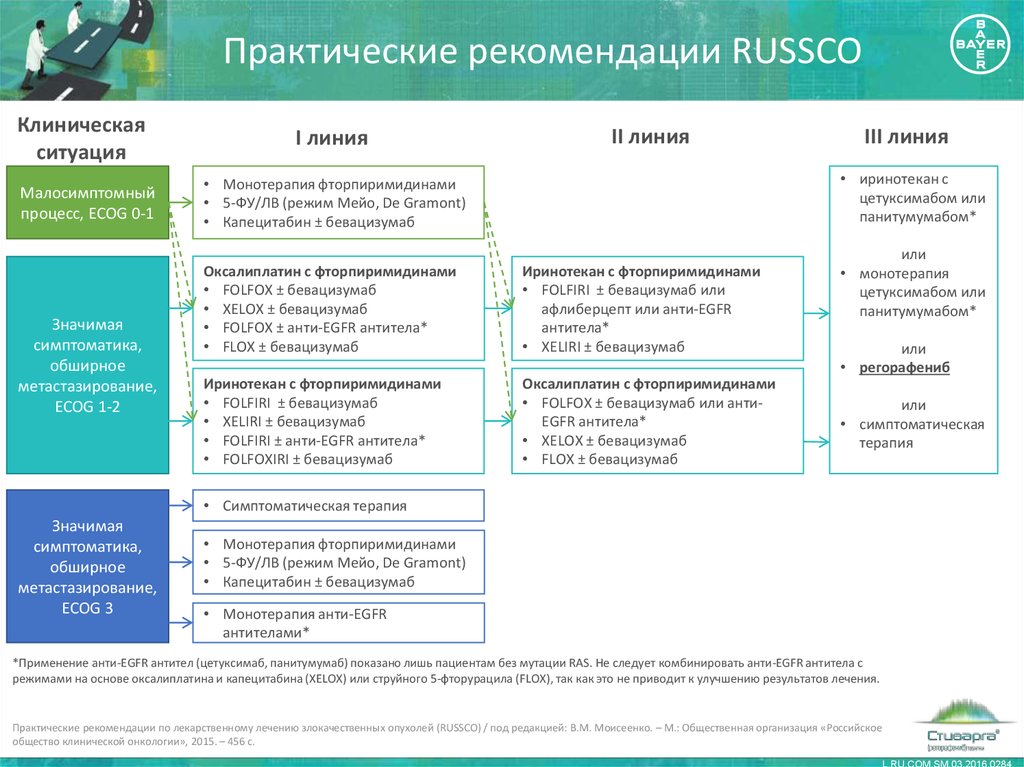
14. Практические рекомендации RUSSCO
Клиническаяситуация
Малосимптомный
процесс, ECOG 0-1
Значимая
симптоматика,
обширное
метастазирование,
ECOG 1-2
I линия
II линия
III линия
• иринотекан с
цетуксимабом или
панитумумабом*
• Монотерапия фторпиримидинами
• 5-ФУ/ЛВ (режим Мейо, De Gramont)
• Капецитабин ± бевацизумаб
Оксалиплатин с фторпиримидинами
• FOLFOX ± бевацизумаб
• XELOX ± бевацизумаб
• FOLFOX ± анти-EGFR антитела*
• FLOX ± бевацизумаб
Иринотекан с фторпиримидинами
• FOLFIRI ± бевацизумаб или
афлиберцепт или анти-EGFR
антитела*
• XELIRI ± бевацизумаб
Иринотекан с фторпиримидинами
• FOLFIRI ± бевацизумаб
• XELIRI ± бевацизумаб
• FOLFIRI ± анти-EGFR антитела*
• FOLFOXIRI ± бевацизумаб
Оксалиплатин с фторпиримидинами
• FOLFOX ± бевацизумаб или антиEGFR антитела*
• XELOX ± бевацизумаб
• FLOX ± бевацизумаб
или
• монотерапия
цетуксимабом или
панитумумабом*
или
• регорафениб
или
• симптоматическая
терапия
• Симптоматическая терапия
Значимая
симптоматика,
обширное
метастазирование,
ECOG 3
• Монотерапия фторпиримидинами
• 5-ФУ/ЛВ (режим Мейо, De Gramont)
• Капецитабин ± бевацизумаб
• Монотерапия анти-EGFR
антителами*
*Применение анти-EGFR антител (цетуксимаб, панитумумаб) показано лишь пациентам без мутации RAS. Не следует комбинировать анти-EGFR антитела с
режимами на основе оксалиплатина и капецитабина (XELOX) или струйного 5-фторурацила (FLOX), так как это не приводит к улучшению результатов лечения.
Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO) / под редакцией: В.М. Моисеенко. – М.: Общественная организация «Российское
общество клинической онкологии», 2015. – 456 с.
L.RU.COM.SM.03.2016.0284
15. Обоснование рекомендаций терапии препаратом регорафениб
Торговое наименование препарата: Стиварга®/Stivarga®Международное непатентованное наименование: регорафениб/ regorafenib
Противоопухолевой препарат, ингибитор протеинкиназы
Лекарственная форма и описание: овальные таблетки, покрытые пленочной оболочкой,
светло-розового цвета, на одной стороне методом выдавливания нанесено «40», на
другой стороне – «BAYER»
Препарат Стиварга®(регорафениб) зарегистрирован для пациентов с метастатическим
колоректальным раком, которым уже проводилась или не показана
химиотерапия фторпиримидиновыми препаратами,
терапия, направленная против сосудистого эндотелиального фактора роста (VEGF)
и терапия, направленная против рецепторов эпидермального фактора роста (EGFR)
при диком типе KRAS
Инструкция по применению лекарственного препарата для медицинского применения Стиварга® № ЛП-003405 от 12.01.2016;
L.RU.COM.SM.03.2016.0284
16. Обоснование рекомендаций терапии препаратом регорафениб
Эффективность препарата регорафениб при мКРР была подтверждена в двухклинических исследованиях III фазы CORRECT и CONCUR
Применение препарата регорафениб достоверно увеличивает общую выживаемость у
пациентов с метастатическим колоректальным раком и функциональным статусом по
ECOG 0–1 после прогрессирования на фоне стандартной терапии независимо от статуса
KRAS
• в клиническом исследовании CORRECT риск смерти в группе пациентов, получавших
препарат регорафениб, снизился на 23%
• в клиническом исследовании CONCUR риск смерти в группе пациентов, получавших
препарат регорафениб, снизился на 45%
Препарат регорафениб имеет предсказуемый и контролируемый профиль безопасности
Grothey A., Van Cutsem E., Sobrero A. et al; for the CORRECT Study Group. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an
international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013; 381: 303–312.; Li J., Qin S., Xu R., Yau T.C. et al. Regorafenib plus best supportive care versus placebo plus
best supportive care in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2015 Jun;
16(6): 619–29.
L.RU.COM.SM.03.2016.0284
17. Дизайн исследования CORRECT
Международное, рандомизированное, многоцентровое, двойное слепое,плацебо-контролируемое исследование фазы III
ОС по ECOG= 0 или 1
Стиварга®
160 мг перорально 1 р/д + ОПТ
РАНДОМИЗАЦИЯ 2:1
Пациенты с мКРР (N=760), с
зафиксированным
прогрессированием
опухоли, либо при
непереносимости
стандартной терапии
3 недели прием препарата,
1 неделя перерыв (n=505)
Продолжение лечения до
прогрессирования заболевания
или до появления
неприемлемого токсического
действия
Плацебо + ОПТ
3 недели прием препарата,
1 неделя перерыв (n=255)
Оценка опухоли каждые 8 недель
по критериям
RECIST 1.1
Первичная конечная точка: общая выживаемость (ОВ)
Вторичные конечные точки: выживаемость без прогрессирования заболевания (ВБП),
показатель объективного ответа опухоли, показатель контроля заболевания
Критерии включения: во время или в течение 3 месяцев после последнего приема зарегистрированных стандартных методов
лечения, или они должны были прекратить стандартное лечение из-за развития неприемлемой токсичности. В настоящем
исследовании к стандартной терапии мКРР относились препараты: фторпиримидин, оксалиплатин, иринотекан, бевацизумаб
и цетуксимаб или панитумумаб (при наличии опухоли с KRAS дикого типа).
ОПТ - оптимальная поддерживающая терапия; ОС по ECOG - общее состояние по шкале Восточной объединенной группы онкологов; RECIST - критерии оценки ответа солидных
опухолей
Grothey A et al. Lancet. 2013;381:303-312.
L.RU.COM.SM.03.2016.0284
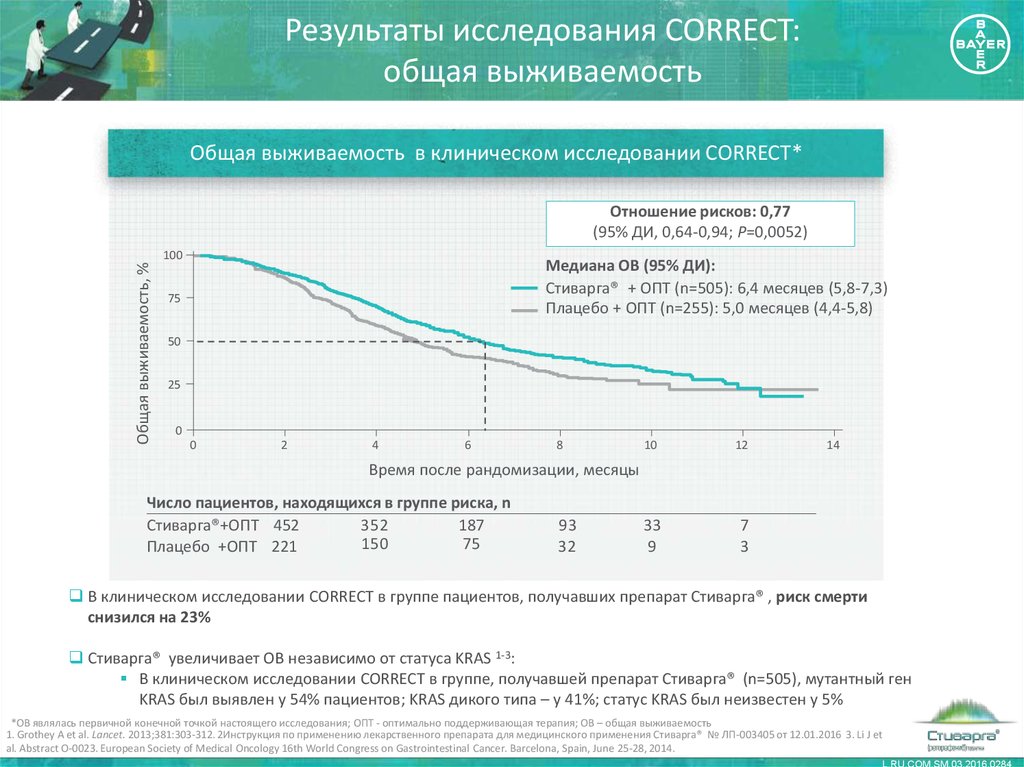
18. Результаты исследования CORRECT: общая выживаемость
Общая выживаемость в клиническом исследовании CORRECT*Общая выживаемость, %
Отношение рисков: 0,77
(95% ДИ, 0,64-0,94; P=0,0052)
100
Медиана OВ (95% ДИ):
Стиварга® + ОПТ (n=505): 6,4 месяцев (5,8-7,3)
Плацебо + ОПТ (n=255): 5,0 месяцев (4,4-5,8)
75
50
25
0
0
2
4
6
8
10
12
33
9
7
3
14
Время после рандомизации, месяцы
Число пациентов, находящихся в группе риска, n
Стиварга®+ОПТ 452
352
187
150
75
Плацебо +ОПТ 221
93
32
В клиническом исследовании CORRECT в группе пациентов, получавших препарат Стиварга® , риск смерти
снизился на 23%
Стиварга® увеличивает ОВ независимо от статуса KRAS 1-3:
В клиническом исследовании CORRECT в группе, получавшей препарат Стиварга® (n=505), мутантный ген
KRAS был выявлен у 54% пациентов; KRAS дикого типа – у 41%; статус KRAS был неизвестен у 5%
*OВ являлась первичной конечной точкой настоящего исследования; ОПТ - оптимально поддерживающая терапия; ОВ – общая выживаемость
1. Grothey A et al. Lancet. 2013;381:303-312. 2Инструкция по применению лекарственного препарата для медицинского применения Стиварга® № ЛП-003405 от 12.01.2016 3. Li J et
al. Abstract O-0023. European Society of Medical Oncology 16th World Congress on Gastrointestinal Cancer. Barcelona, Spain, June 25-28, 2014.
L.RU.COM.SM.03.2016.0284
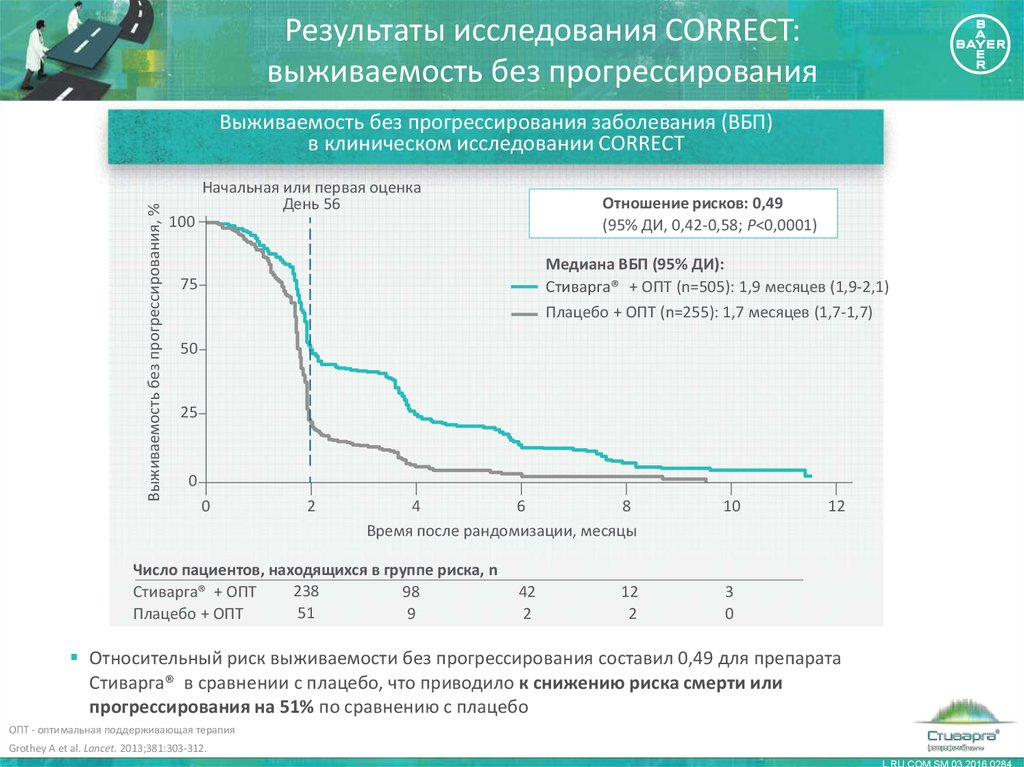
19. Результаты исследования CORRECT: выживаемость без прогрессирования
Выживаемость без прогрессирования, %Выживаемость без прогрессирования заболевания (ВБП)
в клиническом исследовании CORRECT
Начальная или первая оценка
День 56
Отношение рисков: 0,49
(95% ДИ, 0,42-0,58; P<0,0001)
100
Медиана ВБП (95% ДИ):
Стиварга® + ОПТ (n=505): 1,9 месяцев (1,9-2,1)
Плацебо + ОПТ (n=255): 1,7 месяцев (1,7-1,7)
75
50
25
0
0
2
4
6
8
Время после рандомизации, месяцы
Число пациентов, находящихся в группе риска, n
238
Стиварга® + ОПТ
98
51
Плацебо + ОПТ
9
42
2
12
2
10
12
3
0
Относительный риск выживаемости без прогрессирования составил 0,49 для препарата
Стиварга® в сравнении с плацебо, что приводило к снижению риска смерти или
прогрессирования на 51% по сравнению с плацебо
ОПТ - оптимальная поддерживающая терапия
Grothey A et al. Lancet. 2013;381:303-312.
L.RU.COM.SM.03.2016.0284
20. Результаты исследования CORRECT: показатель контроля заболевания
Показатель контроля заболевания в клиническом исследовании CORRECT41%
Стиварга® + ОПТ
15%
Плацебо + ОПТ
Улучшение в
2,7x
раза
Показатель контроля заболевания (полный или частичный ответ + стабилизация
заболевания в течении не менее 6 недель после рандомизации) составил 41%
для пациентов, получавших препарат Стиварга® , и 15% для пациентов,
получавших плацебо
В клиническом исследовании CORRECT показатель контроля заболевания в
группе пациентов, получавших препарат Стиварга® почти в 3 раза выше чем в
группе плацебо
ОПТ - оптимальная поддерживающая терапия
Grothey A et al. Lancet. 2013;381:303-312.
L.RU.COM.SM.03.2016.0284
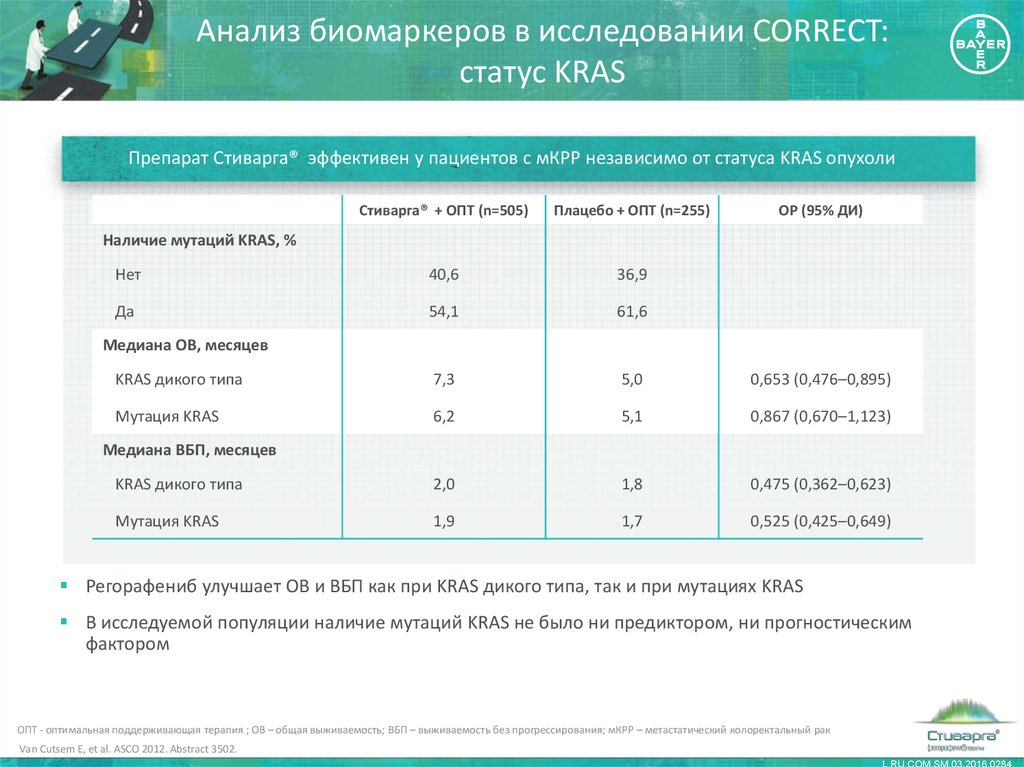
21. Анализ биомаркеров в исследовании CORRECT: статус KRAS
Препарат Стиварга® эффективен у пациентов с мКРР независимо от статуса KRAS опухолиСтиварга® + ОПТ (n=505)
Плацебо + ОПТ (n=255)
ОР (95% ДИ)
Нет
40,6
36,9
Да
54,1
61,6
KRAS дикого типа
7,3
5,0
0,653 (0,476–0,895)
Мутация KRAS
6,2
5,1
0,867 (0,670–1,123)
KRAS дикого типа
2,0
1,8
0,475 (0,362–0,623)
Мутация KRAS
1,9
1,7
0,525 (0,425–0,649)
Наличие мутаций KRAS, %
Медиана ОВ, месяцев
Медиана ВБП, месяцев
Регорафениб улучшает ОВ и ВБП как при KRAS дикого типа, так и при мутациях KRAS
В исследуемой популяции наличие мутаций KRAS не было ни предиктором, ни прогностическим
фактором
ОПТ - оптимальная поддерживающая терапия ; ОВ – общая выживаемость; ВБП – выживаемость без прогрессирования; мКРР – метастатический колоректальный рак
Van Cutsem E, et al. ASCO 2012. Abstract 3502.
L.RU.COM.SM.03.2016.0284
22. Результаты исследования CORRECT: профиль безопасности препарата Стиварга®
Нежелательные явления, связанные с приемом препарата изарегистрированные у ≥10% пациентов в исследовании CORRECT 1
Стиварга® (160 мг) + ОПТ
(n=500)
Плацебо + ОПТ
(n=253)
Все степени
тяжести
3
степень
4
степень
Все степени
тяжести
3
степень
4
степень
Слабость
47%
9%
<1%
28%
5%
<1%
Ладонно-подошвенный
синдром
47%
17%
0
8%
<1%
0
Диарея
34%
7%
<1%
8%
1%
0
Aнорексия
30%
3%
0
15%
3%
0
Изменения голоса
29%
<1%
0
6%
0
0
Повышение артериального
давления
28%
7%
0
6%
1%
0
Воспаление слизистых
полости рта
27%
3%
0
4%
0
0
Сыпь или шелушение
26%
6%
0
4%
0
0
Тошнота
14%
<1%
0
11%
0%
0
Снижение веса
14%
0
0
2%
0
0
Лихорадка
10%
1%
0
3%
0
0
Нежелательное явление (НЯ)
Наиболее частым НЯ 3 степени тяжести был ладонно-подошвенный синдром, зарегистрированный у 17% пациентов
Снижение дозы потребовалось у 38% пациентов, получавших регорафениб, и у 3% пациентов, получавших плацебо
НЯ – нежелательное явление; ОПТ - оптимальная поддерживающая терапия;
Grothey A et al. Lancet. 2013;381:303-312.
L.RU.COM.SM.03.2016.0284
23. Результаты исследования CORRECT: профиль безопасности препарата Стиварга®
Частота НЯ любой степени тяжести снижается с течением времени15
10
5
Диарея
15
10
5
1
2
3
4
5
6
7
1
8
2
n 500 417 229 193 119 91
55
3
4
5
6
20
Частота НЯ (%)
15
10
5
0
7
1
8
55
3
4
5
6
7
8
15
10
5
1
2
3
4
5
6
7
8
55
43
Цикл лечения
55
43
3
4
5
6
7
8
55
43
Повышение артериального
давления
Цикл лечения
n 500 417 229 193 119 91
2
n 500 417 229 193 119 91
43
0
2
5
Цикл лечения
n 500 417 229 193 119 91
43
Сыпь/ шелушение
1
10
Цикл лечения
Цикл лечения
20
Слабость
15
0
0
0
Частота НЯ (%)
Частота НЯ (%)
Ладонно-подошвенный
синдром
Частота НЯ (%)
Частота НЯ (%)
20
20
20
n 500 417 229 193 119 91
НЯ – нежелательное явление;
━ 1 степени
тяжести
━ 2 степени
тяжести
━ 3 степени
тяжести
━ 4 степени
тяжести
Grothey A, et al. Lancet. 2013;381:303-312; Grothey A, et al. J Clin Oncol. 2013;31(suppl):abstr 3637
L.RU.COM.SM.03.2016.0284
24. Результаты исследования CORRECT: профиль безопасности препарата Стиварга®
Дни, медианаВ данном анализе изучается
время между началом лечения и
первым развитием НЯ и
максимальной степенью
тяжести этих нежелательных
явлений
Представляющие интерес
нежелательные явления
развивались в начале лечения
Медиана времени составляла
14,0–23,5 дней
Диарея (n=214)
31,5
23,5
Утомляемость (n=317a)
20,0
15,0
Ладонно-подошвенный 22,0
синдром (n=234) 15,0
Повышение 15,0
артериального 14,0
давления(n=151)
Сыпь/шелушение (n=145)
15,0
15,0
Максимальная степень НЯ
Первый случай НЯ
НЯ – нежелательное явление;
ЛПС – ладонно-подошвенный синдром
a. n=316 для максимальной степени тяжести
Grothey A, et al. Lancet. 2013;381:303-312; Grothey A, et al. J Clin Oncol. 2013;31(suppl):abstr 3637
L.RU.COM.SM.03.2016.0284
25. Выводы исследования CORRECT
ЭффективностьПервичная конечная точка исследования CORRECT была достигнута на момент второго
запланированного промежуточного анализа общей выживаемости, и составила 6,4 месяцев в группе
препарата Стиварга® и 5,0 месяцев в группе плацебо
В клиническом исследовании CORRECT в группе пациентов, получавших препарат Стиварга® , риск
смерти снизился на 23%
Эффективность препарата Стиварга® не зависит от статуса KRAS опухоли
Безопасность
Основными нежелательными явлениями в группе регорафениба были ладонно-подошвенный
синдром, слабость, диарея, анорексия, изменения голоса, повышение артериального давления,
воспаления слизистой оболочки полости рта и сыпь/шелушение
Большинство нежелательных явлений произошли в начале курса лечения и контролировались за счет
снижения дозы или временного прекращения приема препарата
Качество жизни
Качество жизни у пациентов в исследовании CORRECT было сопоставимым в группах регорафениба и
плацебо
L.RU.COM.SM.03.2016.0284
26. Профили пациентов, которым рекомендовано лечение препаратом регорафениб
L.RU.COM.SM.03.2016.028427. Профили пациентов, которым рекомендовано лечение препаратом регорафениб
Пациент АМетастатический колоректальный рак (мКРР)
Дикий тип KRAS
ECOG 0 или 1
Прогрессирование после терапии предыдущих линий
химиотерапия фторпиримидиновыми препаратами
5-ФУ/Окс /Ири
терапия, направленная против сосудистого эндотелиального
фактора роста (VEGF)
бевацизумаб
терапия, направленная против рецепторов эпидермального
фактора роста (EGFR) при диком типе KRAS
панитумумаб или цетуксимаб
Рекомендации: назначение препарата Стиварга®(регорафениб) после
прогрессирования на фоне стандартной терапии мКРР при диком типе KRAS
*Изображенные на фото лица не являются реальными пациентами; ОС по ECOG - общее состояние по шкале Восточной объединенной группы онкологов
Инструкция по применению лекарственного препарата для медицинского применения Стиварга® № ЛП-003405 от 12.01.2016; Практические рекомендации по лекарственному
лечению злокачественных опухолей (RUSSCO) / Под ред. В.М. Моисеенко. – М.: Общественная организация «Российское общество клинической онкологии», 2015. – 456 с.; National
Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Colon Cancer. Version 1.2015. www.nccn.org/professionals/physician_gls/pdf/colon.pdf.;Van Cutsem E.,
Cervantes A., Nordlinger B. et al. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014; 00: iii1–iii9.
L.RU.COM.SM.03.2016.0284
28. Профили пациентов, которым рекомендовано лечение препаратом регорафениб
Пациент БМетастатический колоректальный рак (мКРР)
Мутации KRAS
ECOG 0 или 1
Прогрессирование после терапии предыдущих линий
химиотерапия фторпиримидиновыми препаратами
5-ФУ/Окс /Ири
терапия, направленная против сосудистого эндотелиального
фактора роста (VEGF)
бевацизумаб
Рекомендации: назначение препарата Стиварга®(регорафениб) после
прогрессирования на фоне стандартной терапии мКРР при мутациях KRAS
*Изображенные на фото лица не являются реальными пациентами; ОС по ECOG - общее состояние по шкале Восточной объединенной группы онкологов
Инструкция по применению лекарственного препарата для медицинского применения Стиварга® № ЛП-003405 от 12.01.2016; Практические рекомендации по лекарственному
лечению злокачественных опухолей (RUSSCO) / Под ред. В.М. Моисеенко. – М.: Общественная организация «Российское общество клинической онкологии», 2015. – 456 с.; National
Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Colon Cancer. Version 1.2015. www.nccn.org/professionals/physician_gls/pdf/colon.pdf.;Van Cutsem E.,
Cervantes A., Nordlinger B. et al. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014; 00: iii1–iii9.
L.RU.COM.SM.03.2016.0284
29. Рекомендации по применению препарата регорафениб для терапии мКРР
Рекомендации, которые могут помочь получить максимальное возможноепреимущество от терапии препаратом регорафениб:
Подбор пациентов с хорошим общим состоянием (0 или 1 по шкале ECOG) после
прогрессирования на фоне стандартной терапии
Проведение регулярного мониторинга нежелательных явлений с целью контроля
пациентов во время приема препарата до первой оценки результатов лечения
мониторинг НЯ в течение первой недели, а затем каждые 2 недели, или чаще, по
необходимости
При развитии нежелательных явлений своевременное изменение дозы препарата
подбор дозы индивидуально для контроля переносимости препарата
коррекция дозы на каждом этапе снижения дозы составляет 40 мг (1 таблетка)
повышение дозы препарата после купирования нежелательных явлений производят
по рекомендации врача
ОС по ECOG - общее состояние по шкале Восточной объединенной группы онкологов
1. Grothey A et al. Lancet. 2013;381:303-312. 2.Инструкция по применению лекарственного препарата для медицинского применения Стиварга® № ЛП-003405 от 12.01.2016
L.RU.COM.SM.03.2016.0284
30. Спасибо за внимание!
АО «БАЙЕР». 107113, Москва, 3-я Рыбинская ул., д. 18, стр. 2.Тел.: +7 (495) 231 1200, факс: +7 (495) 231 1202. www.bayer.ru
L.RU.COM.SM.03.2016.0284





















 Медицина
Медицина