Похожие презентации:
Аминокислоты. Белки
1.
Аминокислоты.Белки
Преподаватель Юридического колледжа
Валентина Владимировна Киреева
2.
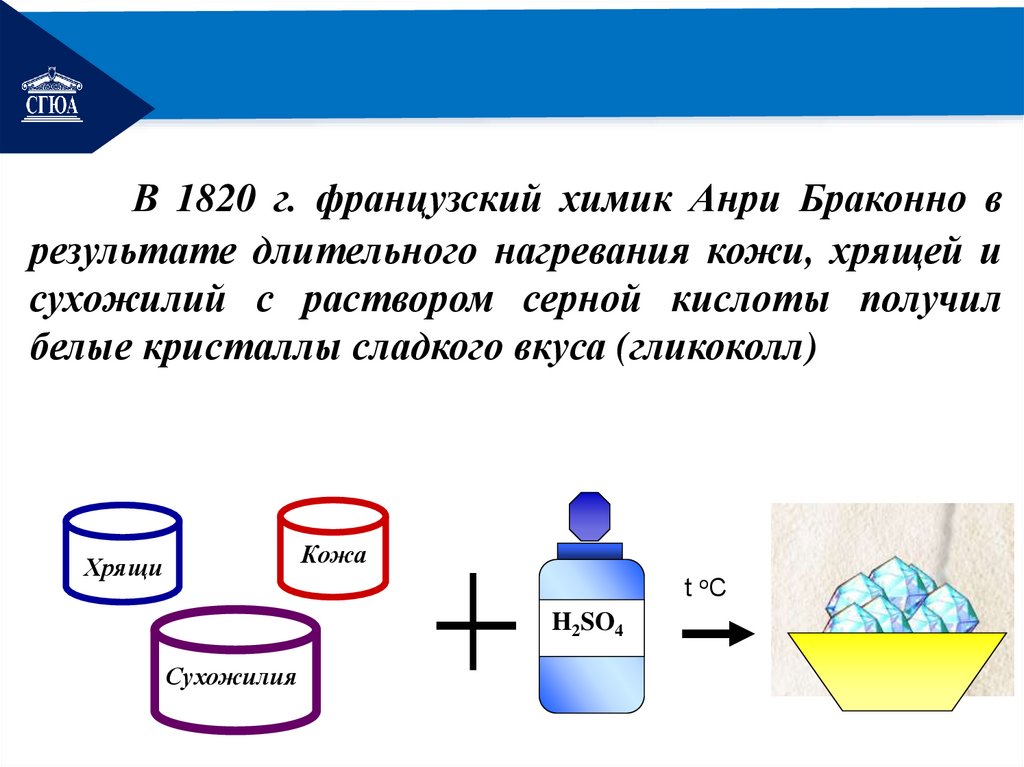
РЕМОНТВ 1820 г. французский химик Анри Браконно в
результате длительного нагревания кожи, хрящей и
сухожилий с раствором серной кислоты получил
белые кристаллы сладкого вкуса (гликоколл)
Кожа
Хрящи
t оC
H2SO4
Сухожилия
3.
РЕМОНТВ 1838 г. голландский химик
Г. Мульдер обнаружил в его составе
азот.
В 1844 г. Э. Хорсфорд установил
формулу вещества O
CH3 – CH - C
NH2
OH
4.
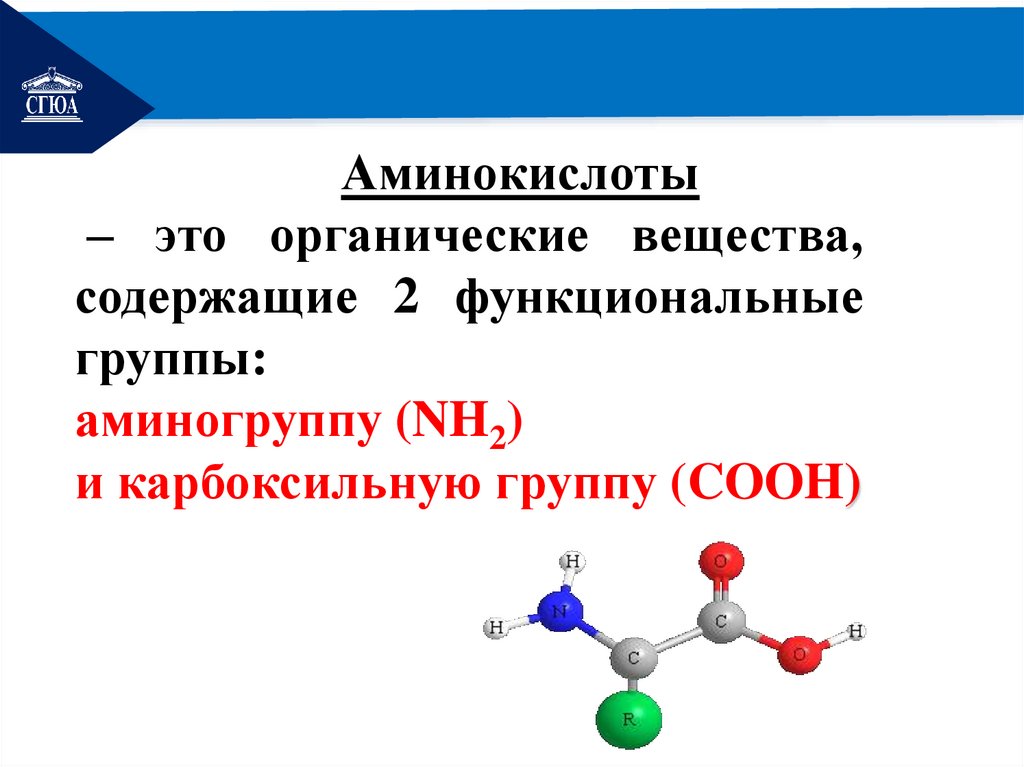
РЕМОНТАминокислоты
– это органические вещества,
содержащие 2 функциональные
группы:
аминогруппу (NH2)
и карбоксильную группу (COOH)
5.
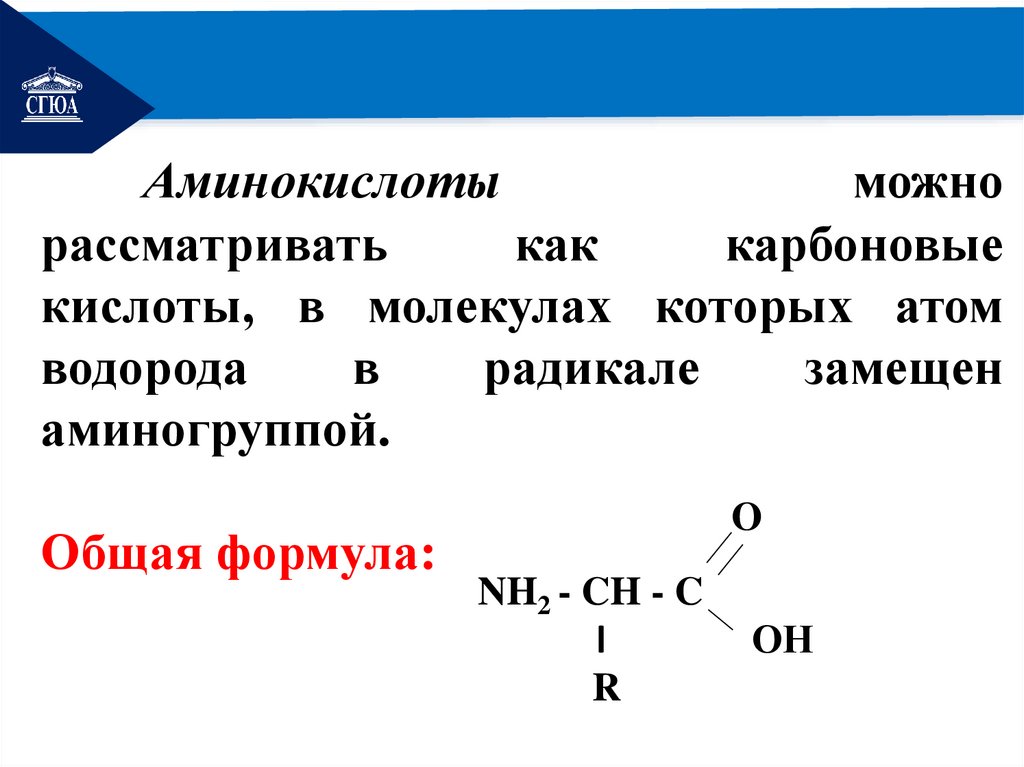
РЕМОНТАминокислоты
можно
рассматривать
как
карбоновые
кислоты, в молекулах которых атом
водорода
в
радикале
замещен
аминогруппой.
Общая формула:
O
NH2 - CH - C
l
R
ОН
6.
РЕМОНТИзвестно более 200 природных
аминокислот.
Аминокислоты
являются
элементами пептидов и белков.
В
состав
белков
входят
20
аминокислот.
Такие
аминокислоты
называются стандартными
7.
РЕМОНТИз 20 стандартных аминокислот, 10
(валин, изолейцин, лейцин, лизин, метионин,
треонин, триптофан, гистидин,
аргинин и фенилаланин) называют
незаменимыми потому, что они не могут
синтезироваться самостоятельно из других
соединений, их можно получить только с
пищей.
Другие аминокислоты – заменимые,
могут синтезироваться из незаменимых.
8.
РЕМОНТНоменклатура аминокислот
1. ИЮИПАК: атомы углерода нумеруют,
начиная
с
карбоксильной
группы,
положение
аминогруппы
указывается
цифрой перед названием соответствующей
кислоты с добавленным словом аминоO
CH3 – CH - C
OH
NH2
2-аминопропионовая кислота
9.
РЕМОНТ2.
Атомы
С
обозначаются
греческими буквами (α,β,γ), нумерация
начинается
от
ближайшего
к
карбоксильной группе атома C (но не с
самого карбоксила!)
β
α
CH3 – CH - C
O
OH
NH2
α-аминопропионовая кислота
10.
РЕМОНТ• Каждая аминокислота имеет тривиальное
название, иногда оно связано с источником
выделения. Например, аспарагин впервые
обнаружили в аспарагусе (спарже),
глутаминовую кислоту - в клейковине (от
англ. gluten - глютен) пшеницы, тирозин – в
казеине сыра (от греч. tyros – «сыр»).
• глицин был назван так за его сладкий вкус
(от греч. glykys - сладкий),
11.
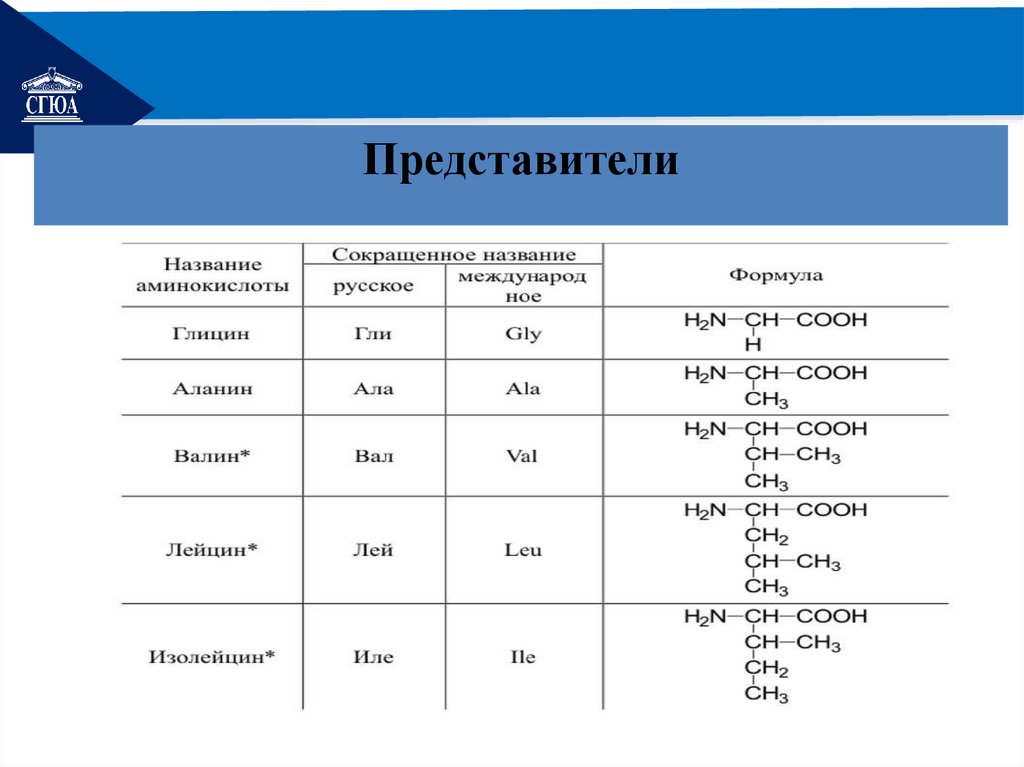
РЕМОНТПредставители
1.NH2-CH2-COOH -аминоуксусная
кислота (глицин)
2. NH2-CH-COOH - 2-аминопропионовая
I
кислота (аланин)
CH3
12.
РЕМОНТПредставители
13.
РЕМОНТИЗОМЕРИЯ
1.Изомерия углеродного скелета
2.Изомерия положения функциональных групп
3.Оптическая изомерия
В состав белков, синтезируемых на рибосомах включаются только Lаминокислоты.
14.
РЕМОНТФизические свойства
•твердые кристаллические вещества,
•хорошо растворимые в воде
•многие имеют сладкий вкус
•плавятся при высоких температурах и
при этом разлагаются
15.
РЕМОНТХимические свойства
Аминокислоты
являются
амфотерными соединениями.
16.
РЕМОНТ• Как основания реагируют с кислотами
NH2 - CH2 - COOH + HCl →
NH3 Cl - CH2 - COOH
(хлороводородная соль глицина)
• Как кислоты реагируют с основаниями
NH2-CH2-COOH + NaOH →
NH2-CH2-COONa + H2O
(натриевая соль глицина)
17.
РЕМОНТ• Вступают в реакции
этерификации:
NH2 - CH2 - COOH + CH3OH
→ H2O + NH2 - CH2 - COOCH3
(метиловый эфир глицина)
18.
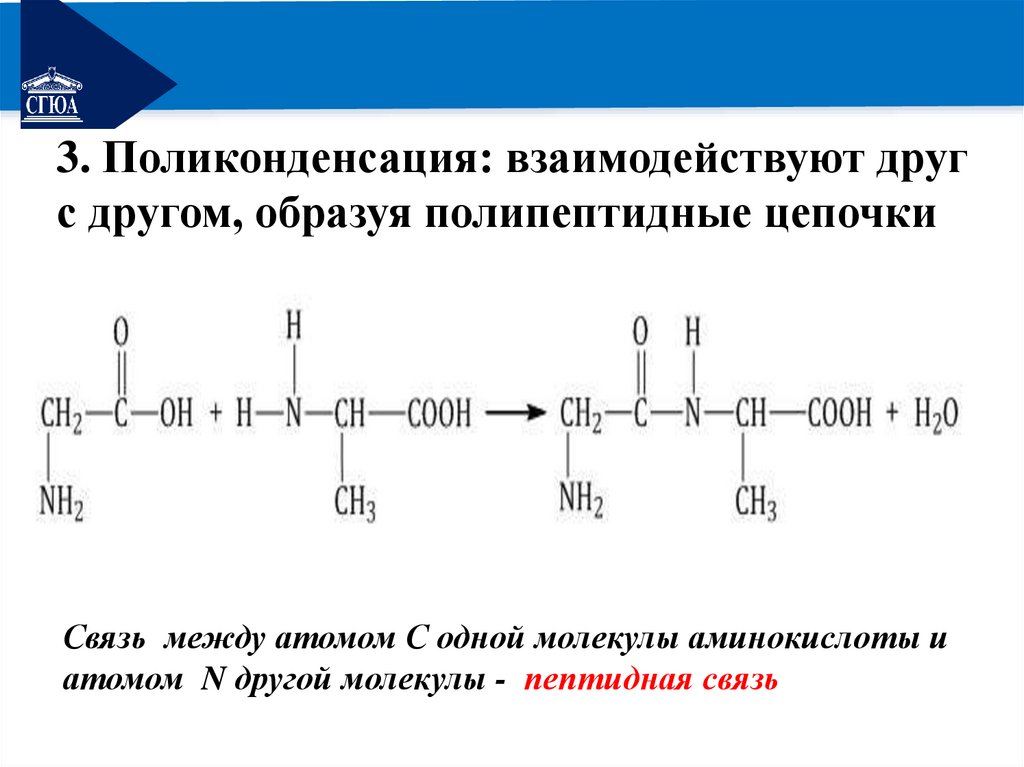
РЕМОНТ3. Поликонденсация: взаимодействуют друг
с другом, образуя полипептидные цепочки
Связь между атомом С одной молекулы аминокислоты и
атомом N другой молекулы - пептидная связь
19.
РЕМОНТПолучение
Замещение галогена на аминогруппу в
соответствующих галогензамещенных
кислотах:
20.
РЕМОНТПрименение
1. В медицине (глутаминовая кислота используется
при нервных заболеваниях, гистидин – при язве
желудка глицин - для улучшения мозгового
кровообращения);
3. В сельском хозяйстве для подкормки животных;
4. Вкусовые добавки: глутамат -усилитель вкуса,
аспартам -низкокалорийный подсластитель.
5. Синтез синтетических волокон – капрона и
энанта.
21.
РЕМОНТПептиды.
Белки
22.
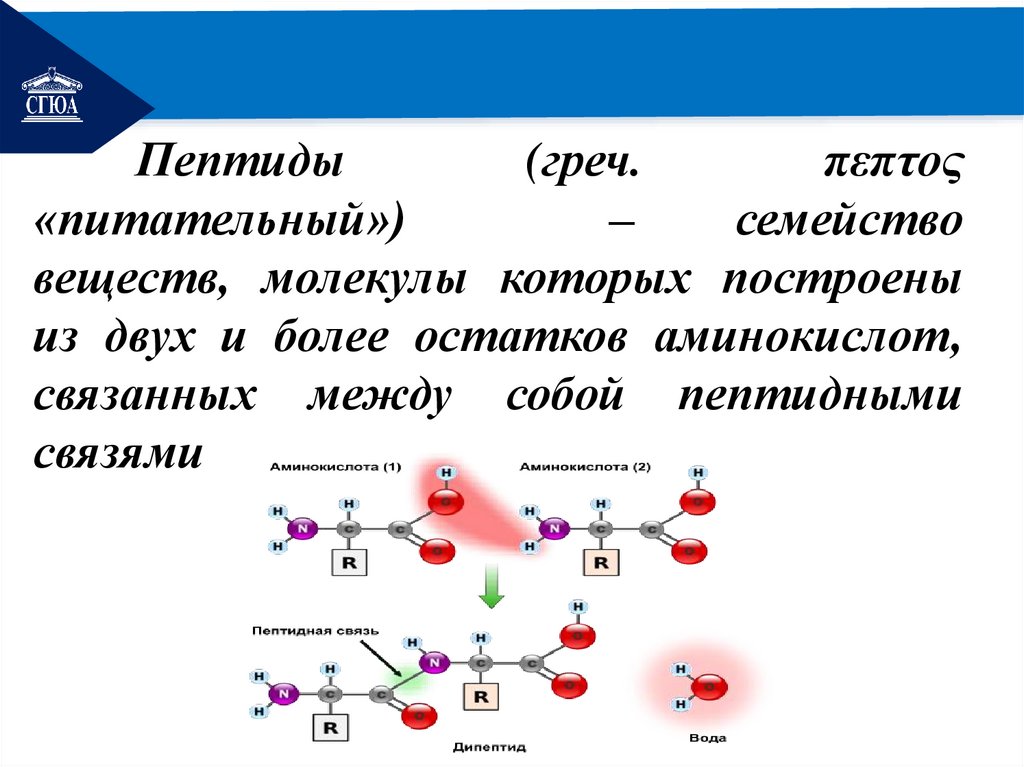
РЕМОНТПептиды
(греч.
πεπτος
«питательный»)
–
семейство
веществ, молекулы которых построены
из двух и более остатков аминокислот,
связанных между собой пептидными
связями
23.
РЕМОНТОлигопептиды – это полимеры,
содержащие до 10 аминокислотных остатков;
Полипептиды – до 50 аминокислотных
остатков.
Пептиды постоянно синтезируются во всех
организмах для регулирования физиологических
процессов, в том числе процессов регенерации
клеток. Пептиды иммунологического действия
защищают организм от попавших в него токсинов.
Дефицит пептидов ускоряет износ тканей, что
приводит к старению всего организма
24.
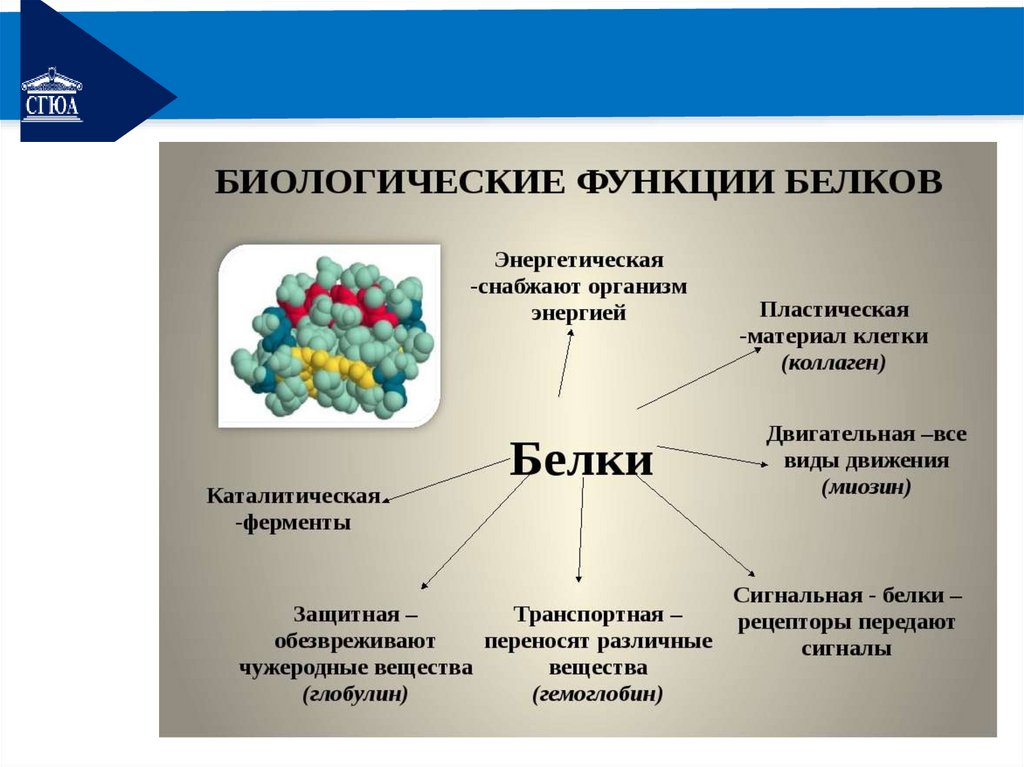
РЕМОНТБелки – биополимеры, в составе
молекул
которых
более
50
остатков аминокислот, связанных между
собой пептидными связями
Кристаллы различных белков,
выращенные на космической станции
«Мир» и во время
полётов шаттлов НАСА.
25.
РЕМОНТИстория изучения белков
Яконо Бартоломео Беккари
в 1728 году впервые
выделил белок (в виде
клейковины) из
пшеничной муки.
В начале XIX века было
известно, что при гидролизе
белков образуются
аминокислоты.
26.
РЕМОНТК концу XIX века было
исследовано большинство
аминокислот, которые входят
в состав белков.
В 1888 году А. Я.
Данилевский указал на то,
что в молекулах белков
содержатся повторяющиеся
пептидные группы атомов
27.
РЕМОНТВ 1903 году Э. Фишер:
Белки представляют
собой полимеры из
остатков аминокислот,
соединенных пептидной
связью NH – CO
В 1926 г. Д. Самнер
показал, что
фермент уреаза является
белком.
28.
РЕМОНТВ 1958 году впервые
Фредериком
Сенгером была
определена
аминокислотная
последовательность
молекулы бычьего
инсулина, за что он
получил Нобелевскую
премию
29.
РЕМОНТСостав белков
1. Углерод 50-55%
2. Кислород 19 – 24 %
3. Азот 15 – 19 %
4. Водород 6,5 –7,3%
5. Сера 0,2 – 2,4 %
6. В состав некоторых белков входит фосфор,
и металлы
30.
РЕМОНТБелки,
как
высокомолекулярные
соединениями, характеризуются большими
величинами
молекулярной
массы.
Молекулярная масса измеряется в Дальтонах
(1Да=1,66 10-24 г.)
Например, белок инсулин обладает молекулярной
массой 6000 Да, миоглобин — 17000 Да, миозин – 500000 Да.
31.
РЕМОНТВ состав всех белков входит
только 20 определенных аминокислот,
являющихся α-L-аминокислотами, в
результате
комбинаций
которых
образуются разнообразные молекулы
белков.
Белковая
молекула
имеет
определенную структуру.
32.
РЕМОНТСтруктура белковой
молекулы
33.
РЕМОНТК. Линдстрём-Ланг предложил
выделять 4 уровня структурной
организации белков:
• первичную
• вторичную
• третичную
• четвертичную
34.
РЕМОНТПервичная структура
Аминокислоты соединяясь друг с другом
пептидной связью образуют длинные
неразветвленные цепи – полипептиды
35.
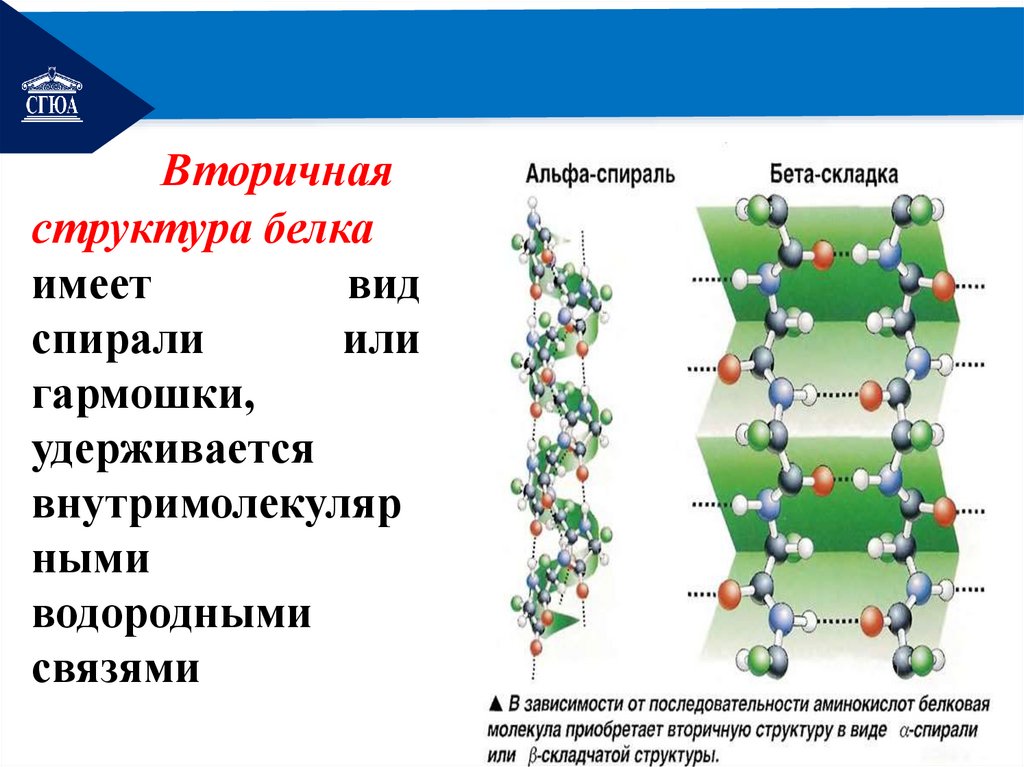
РЕМОНТВторичная
структура белка
имеет
вид
спирали
или
гармошки,
удерживается
внутримолекуляр
ными
водородными
связями
36.
РЕМОНТТретичная структура белка глобулярная
В ее формировании
участвуют водородные,
ионные и гидрофобные
связи
37.
РЕМОНТЧетвертичная
структура белка комплекс из
нескольких молекул
с третичной
структурой
(гемоглобин)
38.
РЕМОНТ39.
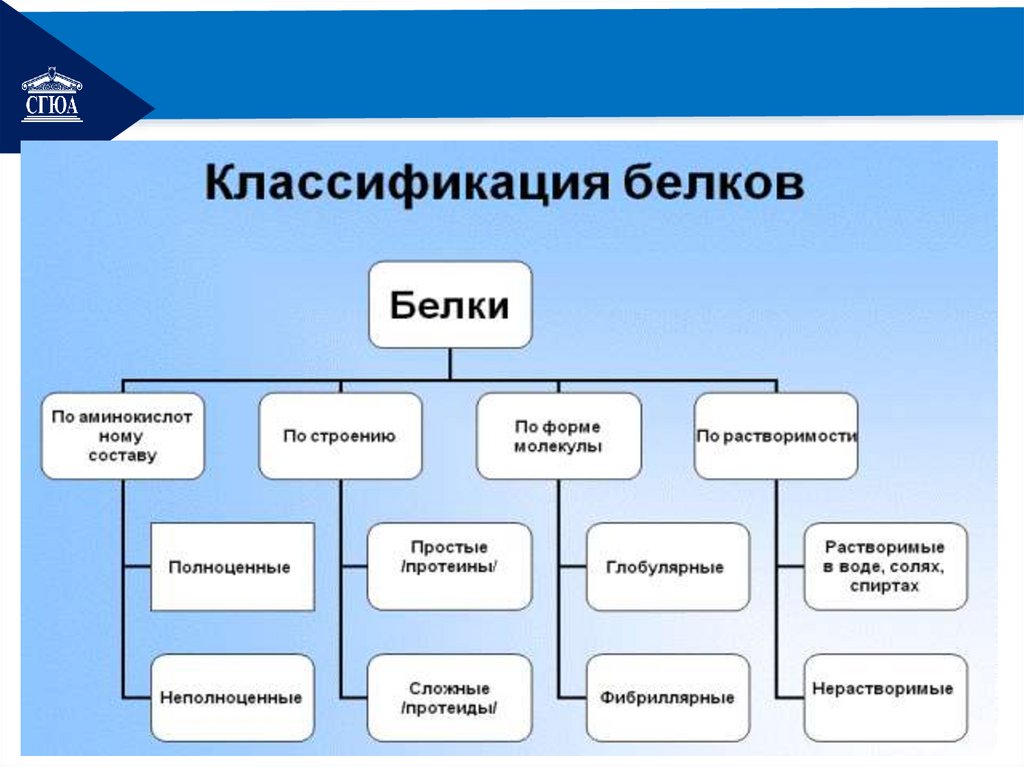
РЕМОНТВ зависимости от строения
различают простые и сложные белки:
1. Простые белки - протеины - состоят
только из аминокислот: альбумины
яичного белка, кровяной сыворотки,
молока, фибриноген, клейковина,
эластин, белки костей, хрящевой ткани
40.
РЕМОНТ2. Сложные - протеиды имеют
небелковую часть.
Нуклеопротеиды – протеин + нуклеиновые
кислоты (хроматин).
Хромопротеиды – протеин + окрашенные
соединения (хлорофилл).
Фосфопротеиды – протеин + сложный эфир
фосфорной кислоты (казеин молока).
Гликопротеины – протеин + углеводы.
Липопротеиды – протеин + липиды.
Металлопротеиды – протеин + металлы
(ферритин).
41.
РЕМОНТНа основе пространственной
формы белки делятся на:
Глобулярные белки - в воде
растворимые, молекулы имеют
шаровидную форму (альбумины и
глобулины крови).
Фибриллярные белки - в воде
нерастворимые, молекулы имеют вид
волокна (белки мышц, волос, ногтей)
42.
РЕМОНТХимические свойства
1. Белки - амфотерные соединения.
Гидролиз - разрушение первичной
структуры белка до аминокислот:
а)кислотный
б)ферментативный.
43.
РЕМОНТ3. Денатурация белка - любые
изменения в его биологической
активности и физико-химических
свойствах, связанные
с потерей четвертичной,
третичной или
вторичной структуры.
44.
РЕМОНТВыделяют
• механическую (сильное
перемешивание или встряхивание),
• физическую (нагревание,
охлаждение, облучение,
ультразвук)
• химическую денатурацию.
Денатурация белка может быть
обратимой или необратимой
45.
РЕМОНТ46.
РЕМОНТ47.
РЕМОНТСинтез белков
1. Биосинтез
Белки синтезируются живыми
организмами из аминокислот на основе
информации, закодированной в генах.
2. Химический синтез
Неэффективен при синтезе молекул
из более 300 аминокислотных остатков:
искусственные белки могут иметь
неправильную третичную структуру.
48.
РЕМОНТ49.
СПАСИБО ЗАВНИМАНИЕ!








































 Химия
Химия