Похожие презентации:
Аминокислоты. Белки
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ ПРОФЕССОРА В.Ф. ВОЙНО-ЯСЕНЕЦКОГО»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ
ТЕМА: «АМИНОКИСЛОТЫ.
БЕЛКИ»
Преподаватель: Агафонова Н.В.
2.
План лекции:Аминокислоты: строение, классификация,
номенклатура, изомерия.
2. Физические и химические свойства
аминокислот.
3. Получение аминокислот.
4. Белки – как биополимеры. Строение белковых
молекул.
5. Физические и химические свойства белков.
Цветные реакции белков.
6. Превращение и функции белков в организме.
1.
3.
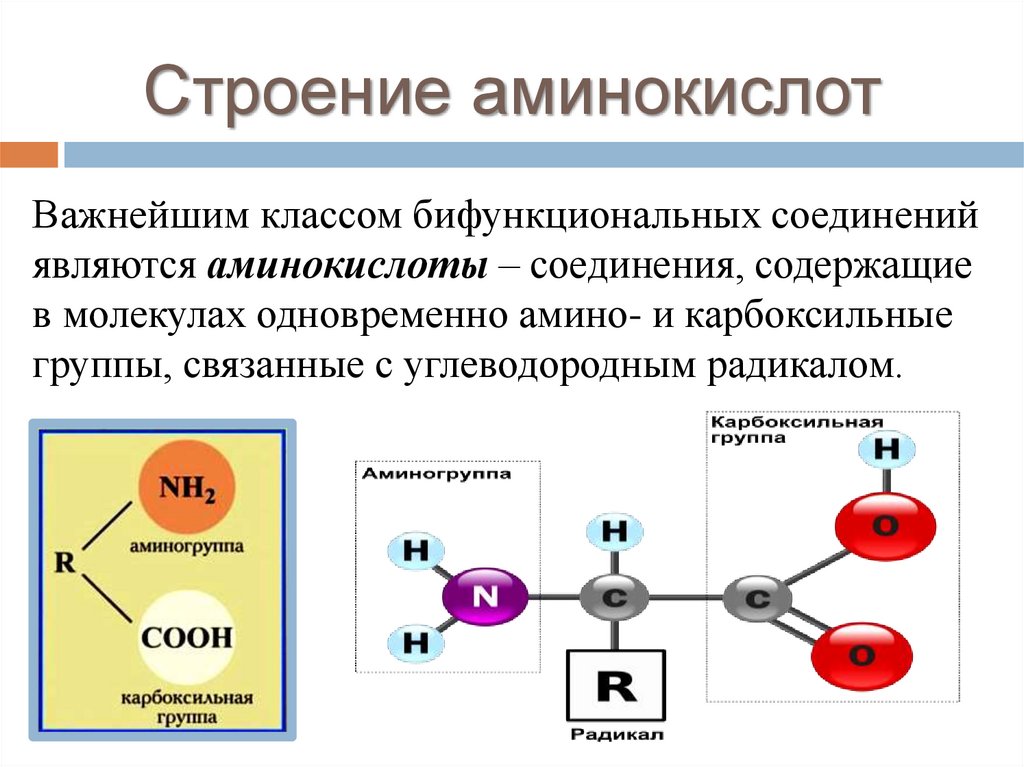
Строение аминокислотВажнейшим классом бифункциональных соединений
являются аминокислоты – соединения, содержащие
в молекулах одновременно амино- и карбоксильные
группы, связанные с углеводородным радикалом.
4.
Аминокислоты можно рассматривать какпроизводные карбоновых кислот, в молекулах
которых атом водорода радикала замещен на
аминогруппу.
Общая формула аминокислот:
(H2N)m─ R─ (COOH)n
где m и n – чаще всего равны 1 или 2
5.
Историческая справкаВ 1806 г. французские химики Луи Николя
Воклен и Пьер Жан Робике из сока спаржи
выделили белое кристаллическое вещество,
названное ими аспарагином. Это была первая
аминокислота, выделенная химиками из
природных объектов.
В 1848 г. итальянец Р. Пириа гидролизом
аспарагина получил аспарагиновую кислоту.
Из белка содержащегося в зернах пшеницы
была выделена кислота, названная
глутаминовой.
6.
Классификация аминокислотАминокислоты
Природные
Заменимые
Синтетические
Незаменимые
7.
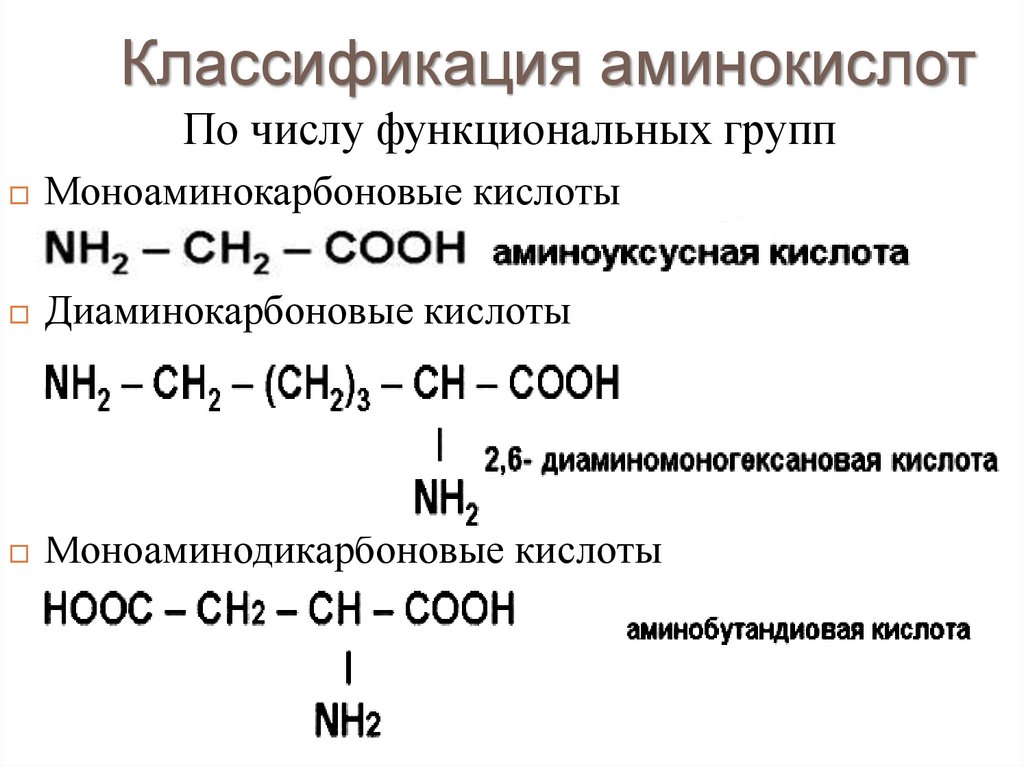
Классификация аминокислотПо числу функциональных групп
Моноаминокарбоновые кислоты
Диаминокарбоновые кислоты
Моноаминодикарбоновые кислоты
8.
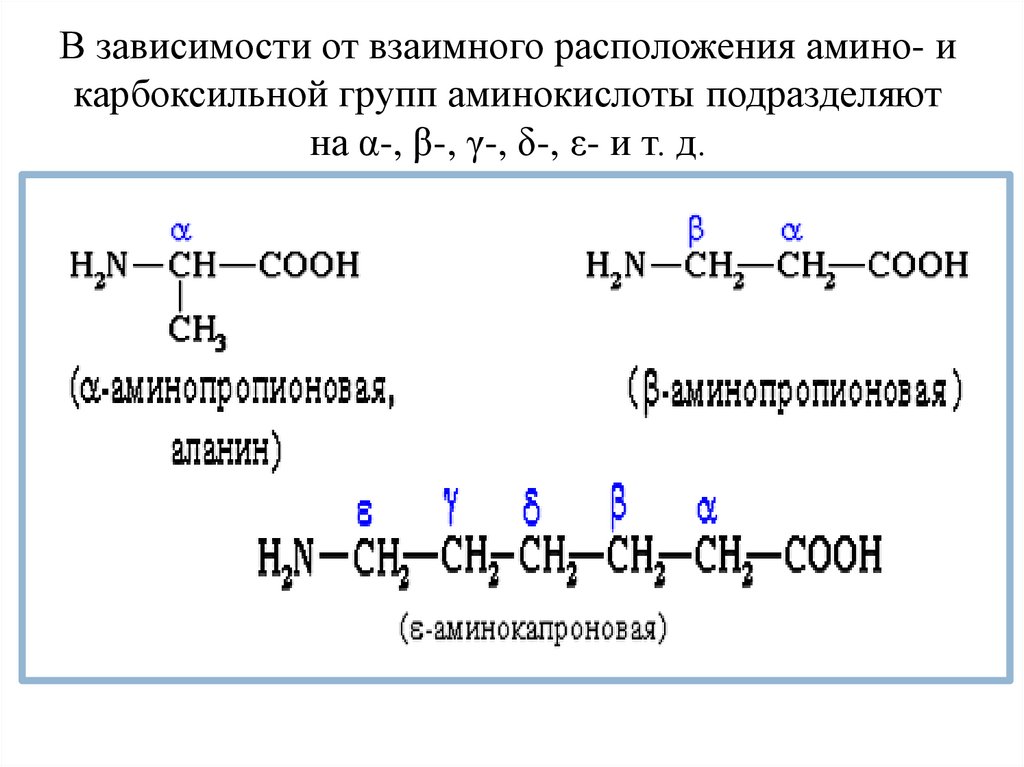
В зависимости от взаимного расположения амино- икарбоксильной групп аминокислоты подразделяют
на α-, β-, γ-, δ-, ε- и т. д.
9.
Номенклатура аминокислотПо систематической номенклатуре
аминокислоты называют по соответствующей
карбоновой кислоте с добавлением приставки
амино-. Положение аминогруппы указывают
соответствующей цифрой.
3
2
1
СН3─СН─СООН
│
NH2
3
2
2-аминопропановая кислота
1
NH2─СН2─СН2─СООН
3-аминопропановая кислота
10.
Номенклатура аминокислотПо рациональной номенклатуре положение
аминогруппы -NH2 указывается буквами
греческого алфавита, начиная со второго
атома углерода: α, β, γ, δ, ε и т.д. Название
кислоты используется тривиальное.
11.
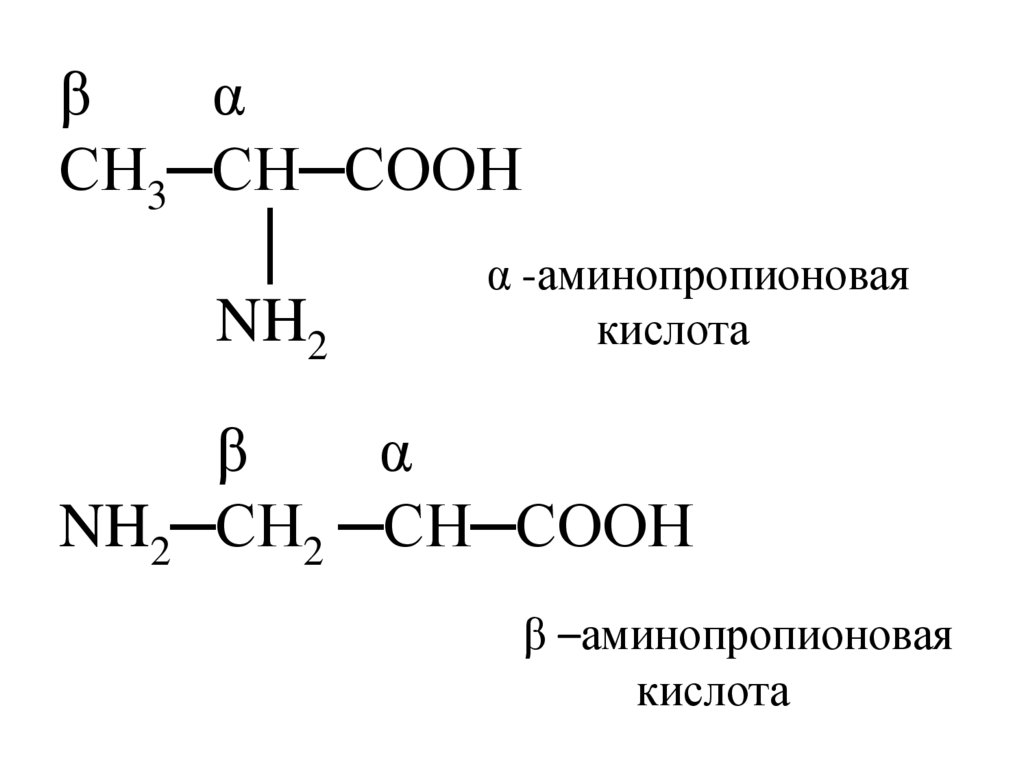
βα
СН3─СН─СООН
│
α -аминопропионовая
NH2
кислота
β
α
NH2─СН2 ─СН─СООН
β –аминопропионовая
кислота
12.
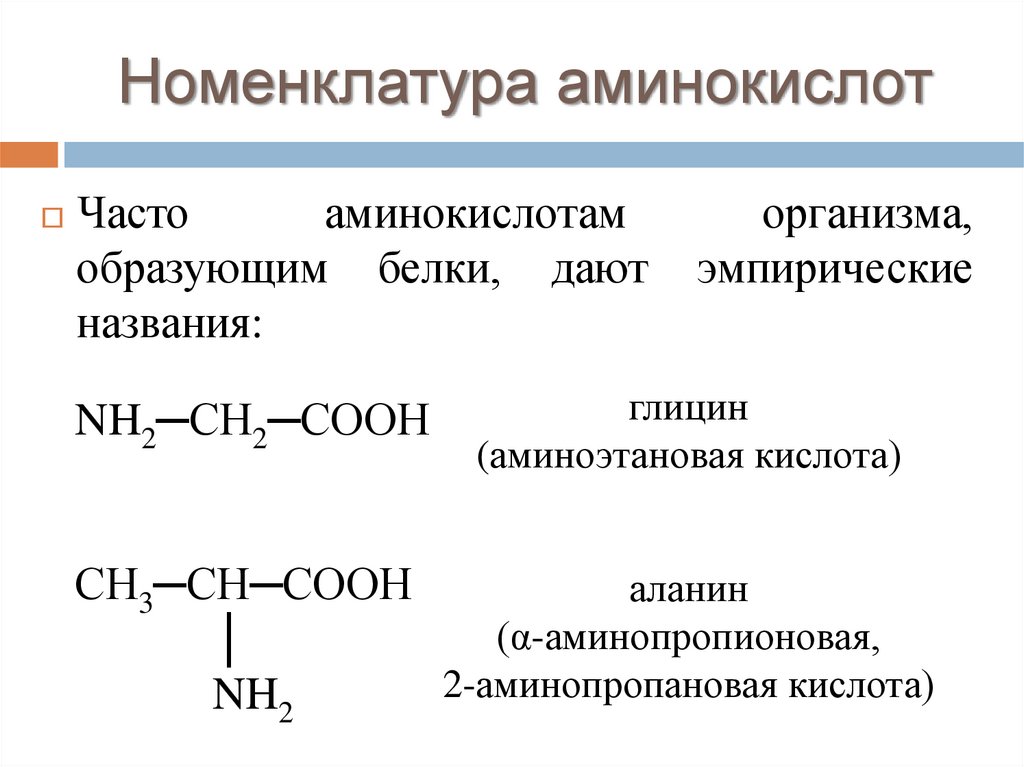
Номенклатура аминокислотЧасто
аминокислотам
образующим белки, дают
названия:
NH2─СН2─СООН
организма,
эмпирические
глицин
(аминоэтановая кислота)
СН3─СН─СООН
аланин
(α-аминопропионовая,
│
2-аминопропановая кислота)
NH2
13.
Номенклатура аминокислотЕсли в молекуле аминокислоты содержится
две аминогруппы, то в ее названии
используется приставка диамино-, три группы
NH2 – триамино- и т.д.
14.
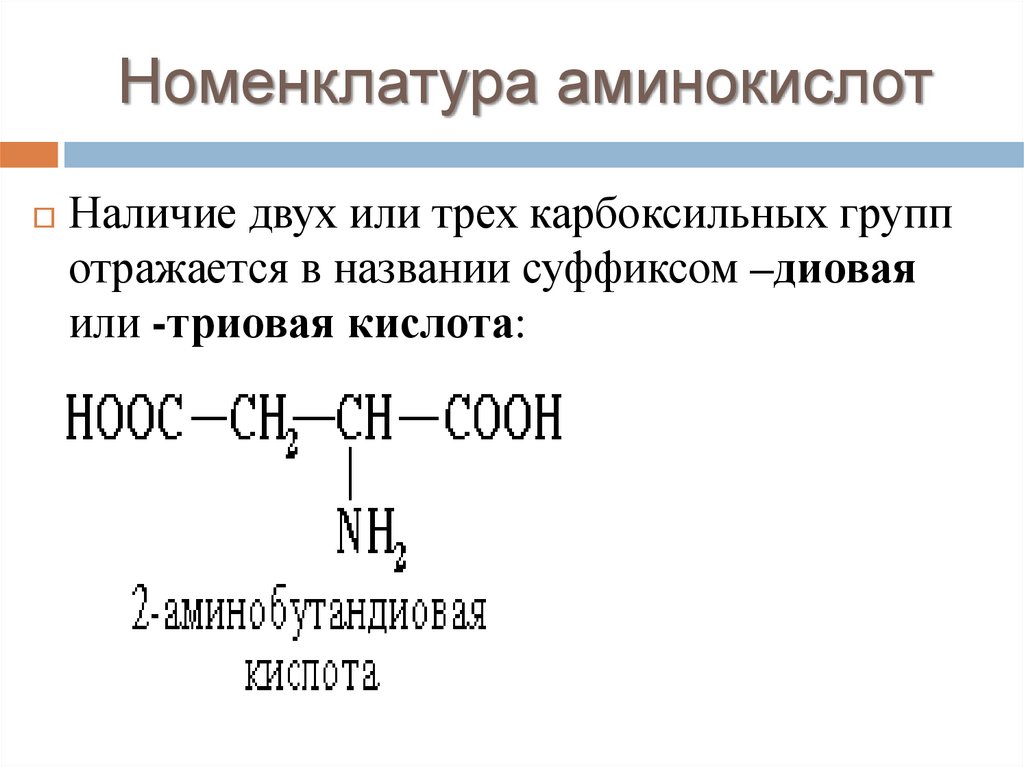
Номенклатура аминокислотНаличие двух или трех карбоксильных групп
отражается в названии суффиксом –диовая
или -триовая кислота:
15.
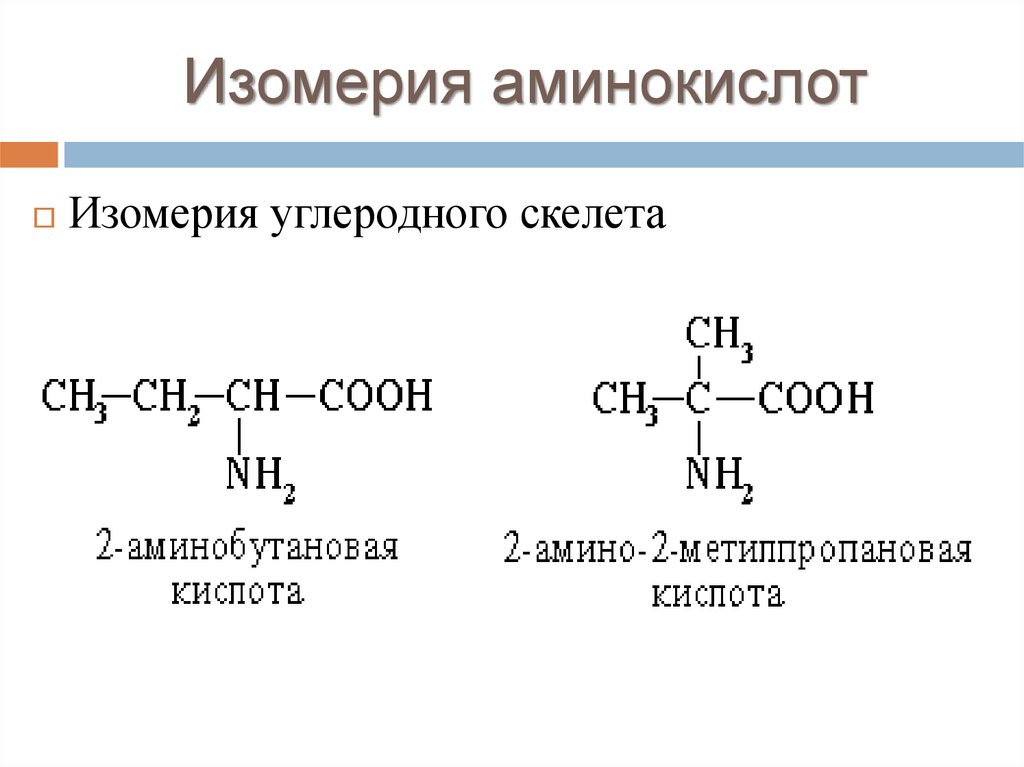
Изомерия аминокислотИзомерия углеродного скелета
16.
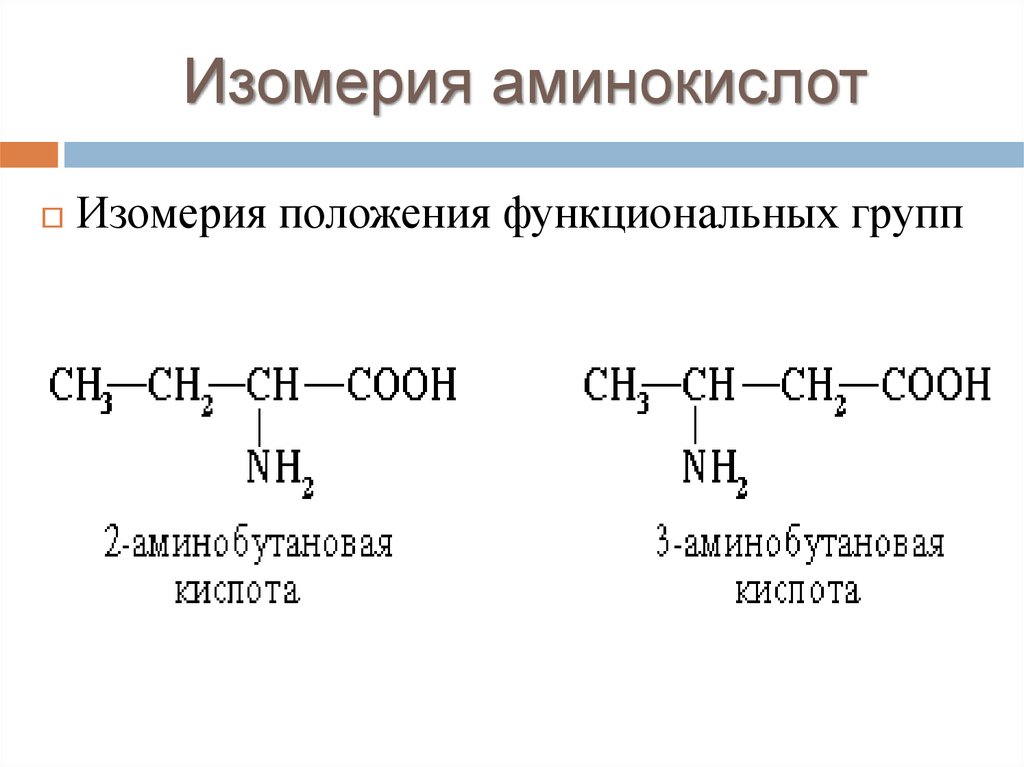
Изомерия аминокислотИзомерия положения функциональных групп
17.
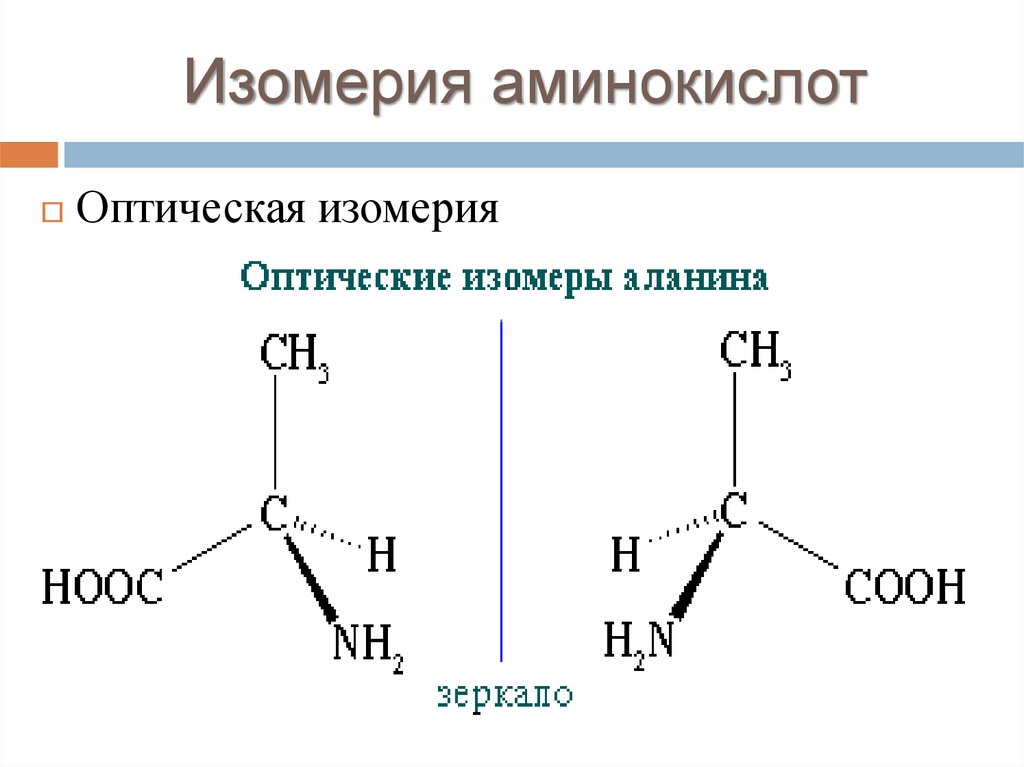
Изомерия аминокислотОптическая изомерия
18.
Изомерия аминокислотПостройте изомеры для
2- аминобутановой кислоты
Дайте им названия по
систематической и
рациональной номенклатуре
19.
Физические свойствааминокислот
Аминокислоты – бесцветные кристаллические
вещества, хорошо растворимые в воде,
температура плавления 230-3000, многие
аминокислоты имеют сладкий вкус.
20.
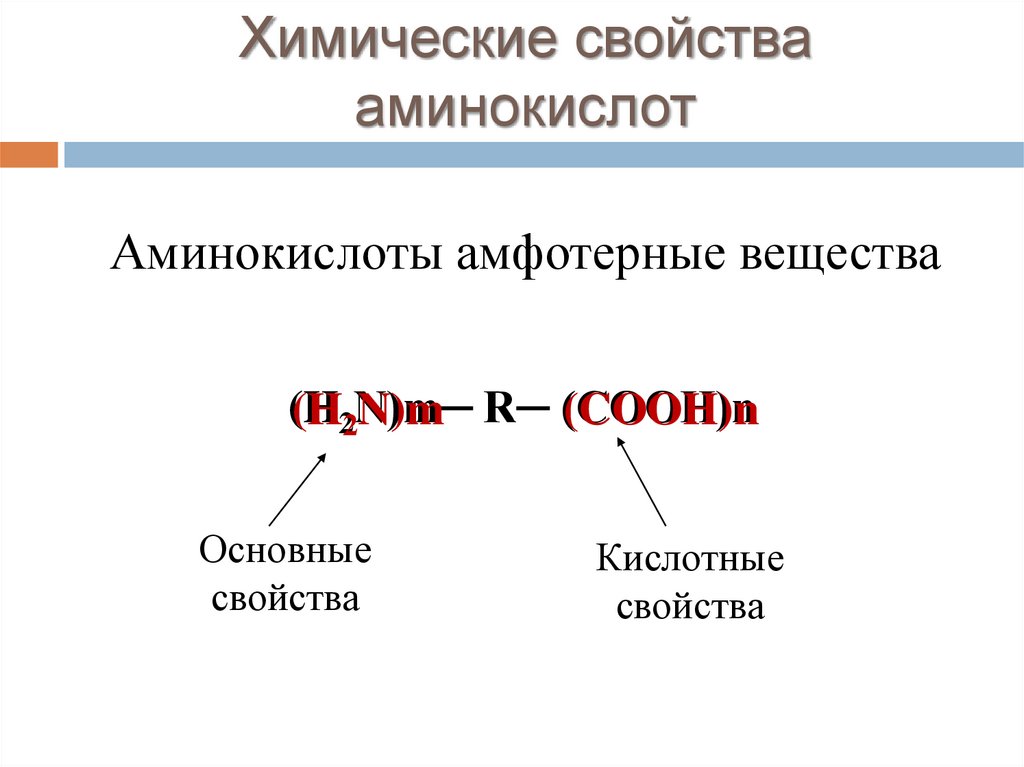
Химические свойствааминокислот
Аминокислоты амфотерные вещества
(H22N)m─
N)m R─ (COOH)n
(COOH)n
Основные
свойства
Кислотные
свойства
21.
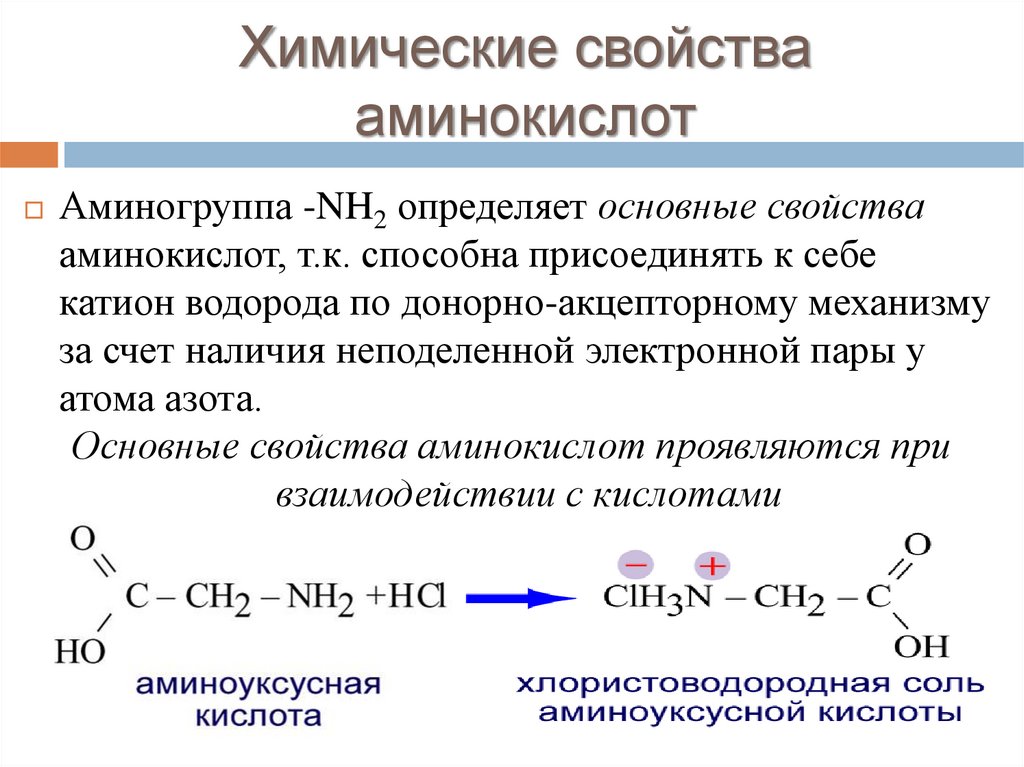
Химические свойствааминокислот
Аминогруппа -NH2 определяет основные свойства
аминокислот, т.к. способна присоединять к себе
катион водорода по донорно-акцепторному механизму
за счет наличия неподеленной электронной пары у
атома азота.
Основные свойства аминокислот проявляются при
взаимодействии с кислотами
22.
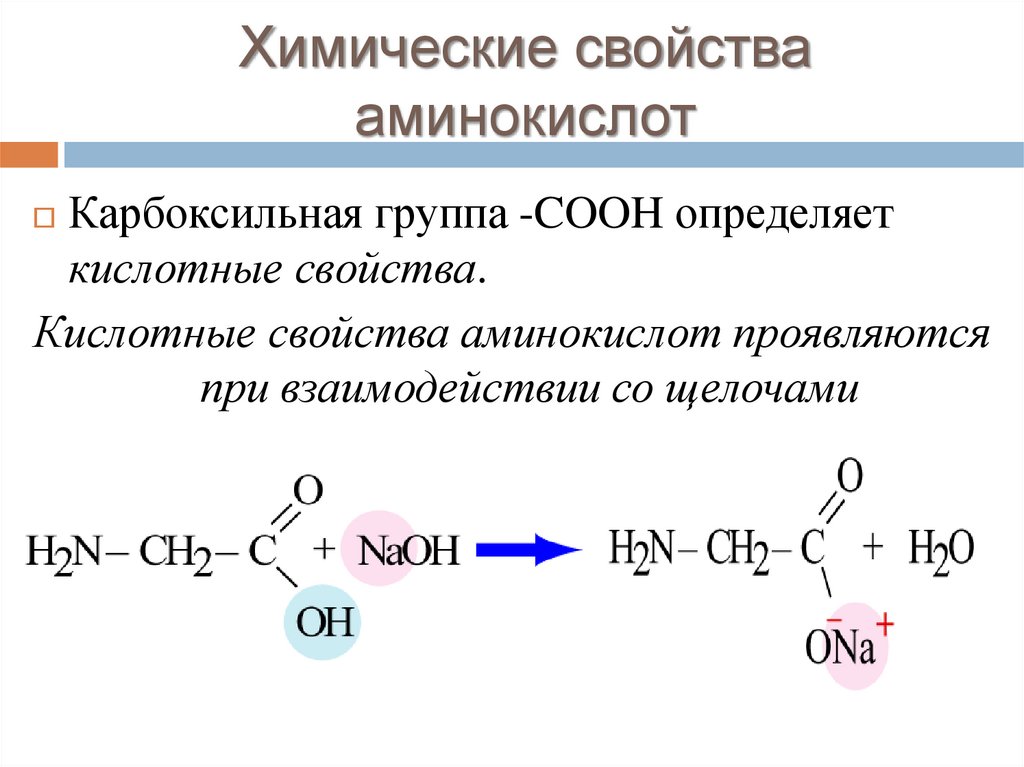
Химические свойствааминокислот
Карбоксильная группа -COOH определяет
кислотные свойства.
Кислотные свойства аминокислот проявляются
при взаимодействии со щелочами
23.
Химические свойствааминокислот
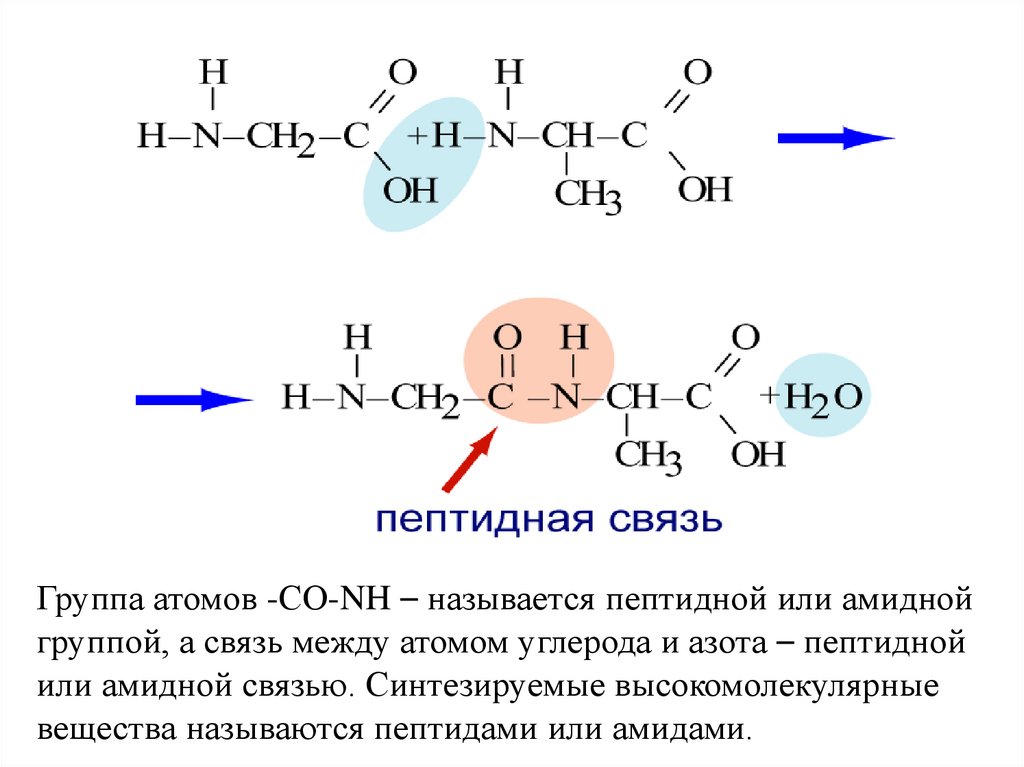
Взаимодействие аминокислот друг с другом –
образование пептидов
Важнейшим свойством аминокислот является
их способность вступать в реакцию
поликонденсации друг с другом.
24.
Группа атомов -СО-NH – называется пептидной или амиднойгруппой, а связь между атомом углерода и азота – пептидной
или амидной связью. Синтезируемые высокомолекулярные
вещества называются пептидами или амидами.
25.
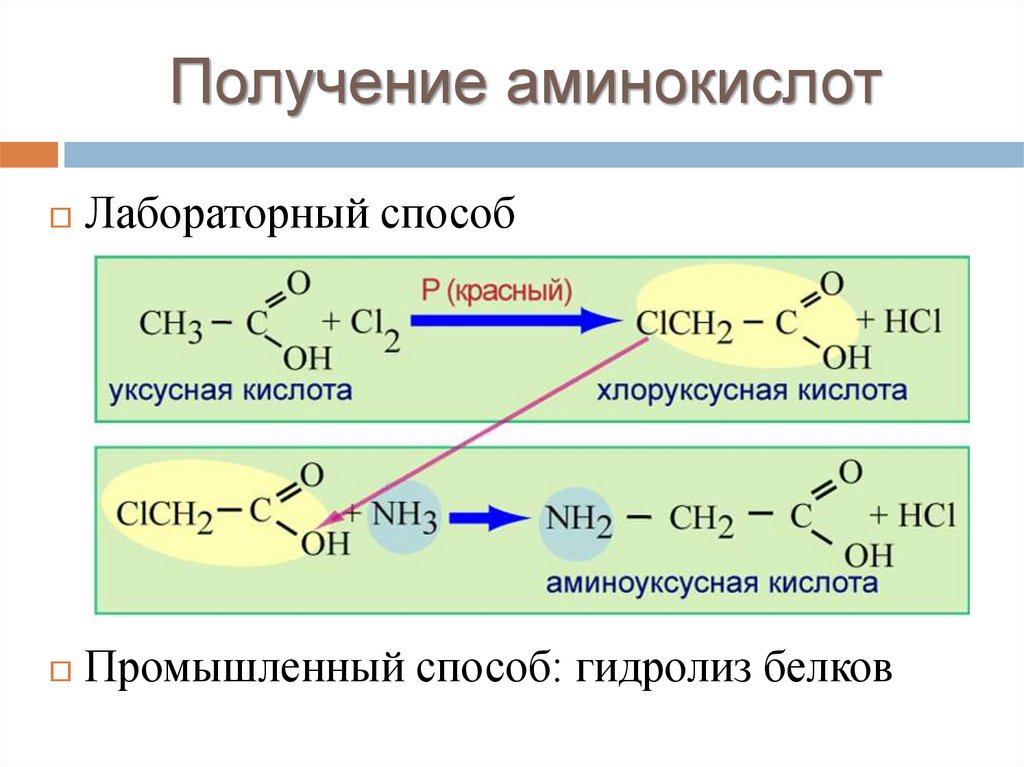
Получение аминокислотЛабораторный способ
Промышленный способ: гидролиз белков
26.
БелкиБелки – высокомолекулярные
органические соединения,
состоящие из α-аминокислот,
соединенных пептидными
связями.
Белки – это органические
соединения, которые
обеспечивают все жизненные
процессы любого организма.
Таким образом белки являются
основой всего живого на земле.
27.
БелкиПо химическому составу белки делят на две
основные группы. К первой группе –
протеины – относятся те белки, при
гидролизе которых образуются только
аминокислоты. Вторую группу – протеиды –
составляют белки, при гидролизе которых
помимо аминокислот образуются и другие
соединения, например, липиды, углеводы,
фосфорные кислоты и др.
28.
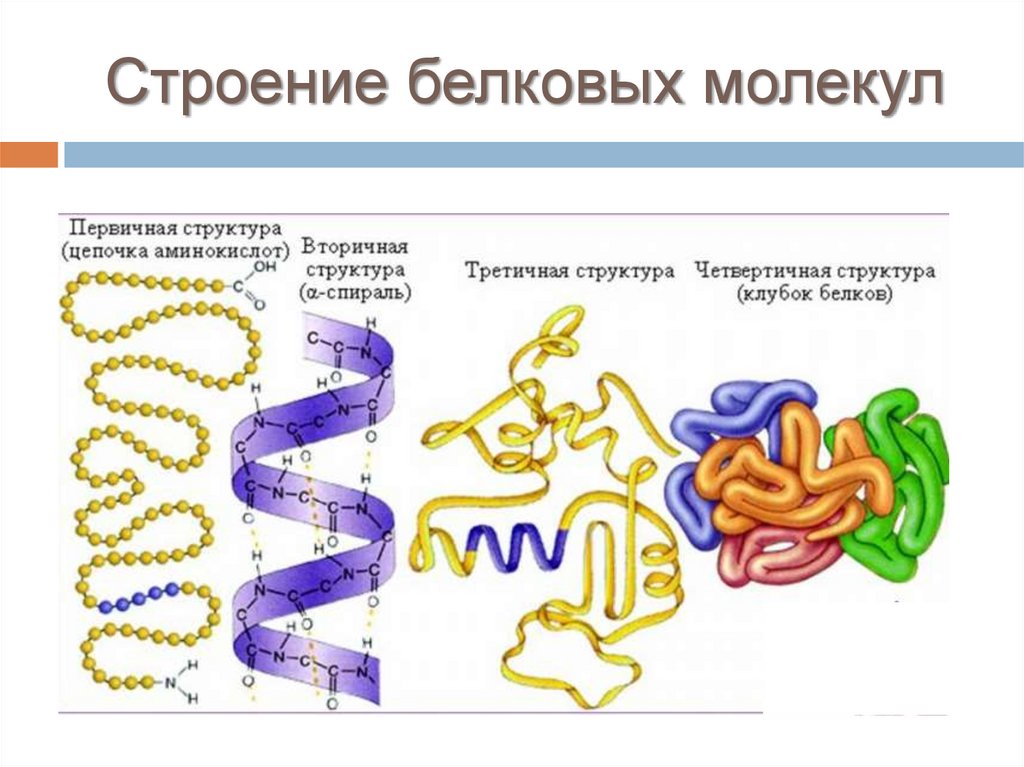
Строение белковых молекул29.
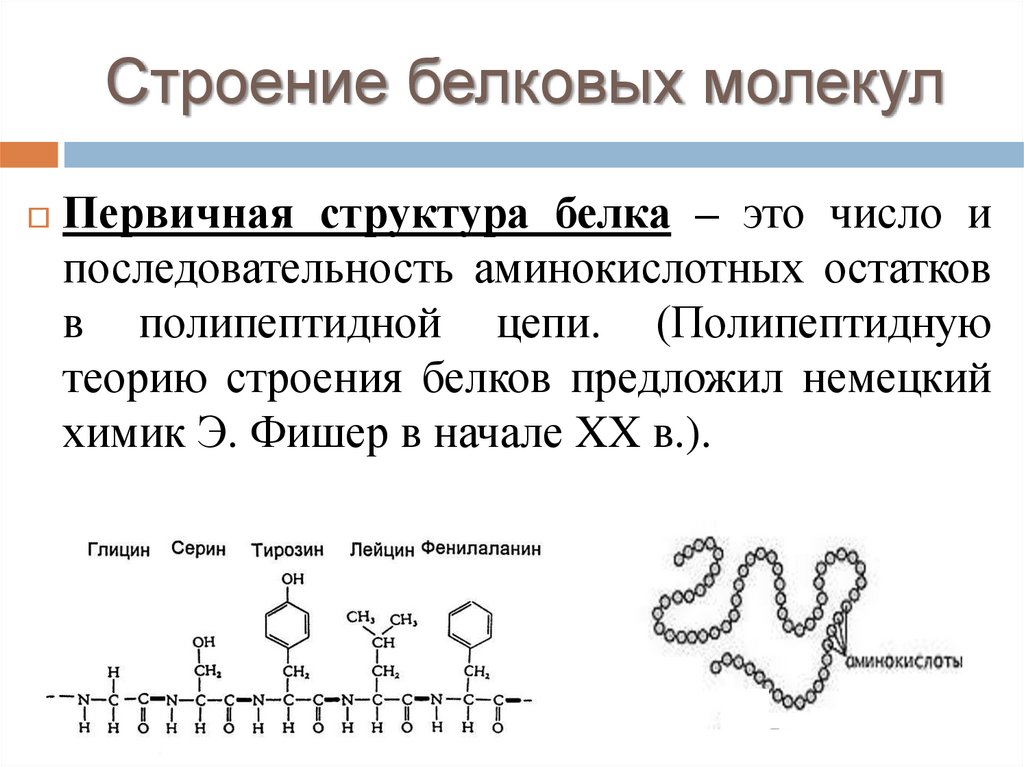
Строение белковых молекулПервичная структура белка – это число и
последовательность аминокислотных остатков
в полипептидной цепи. (Полипептидную
теорию строения белков предложил немецкий
химик Э. Фишер в начале XX в.).
30.
Строение белковых молекулИнсулин
Белковый гормон,
вырабатываемый
поджелудочной железой.
А цепь –21 аминокислоту,
В цепь – 30 аминокислот.
Недостаток инсулина
ведет к диабету
(повышенное содержание
сахара в крови).
31.
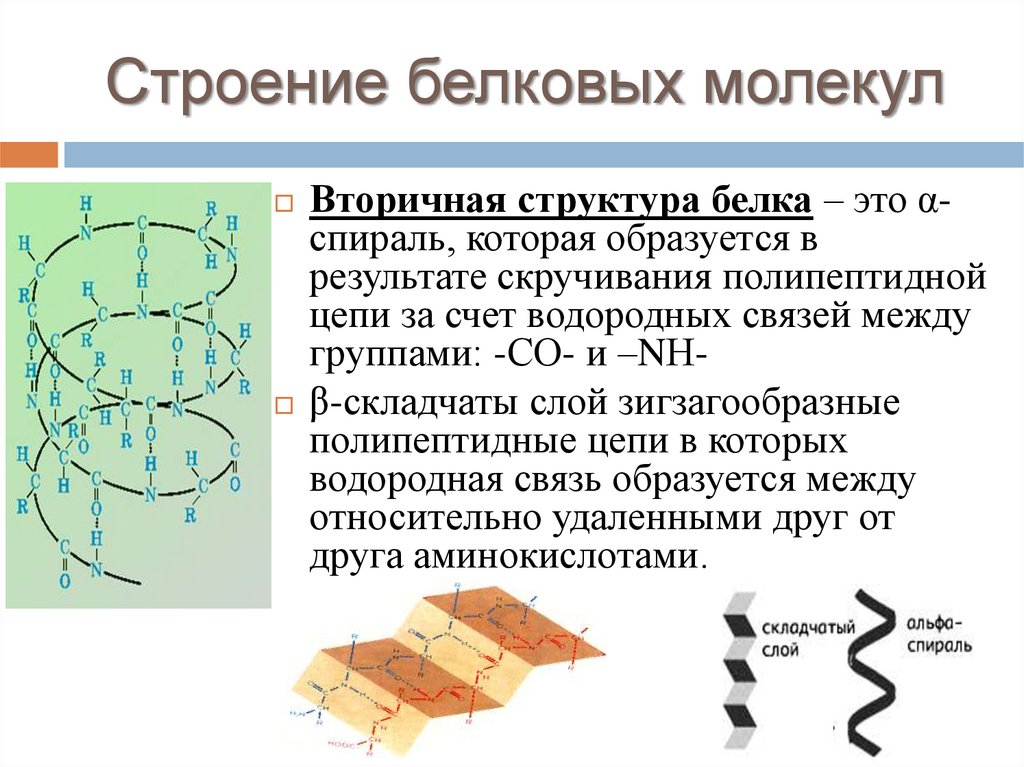
Строение белковых молекулВторичная структура белка – это αспираль, которая образуется в
результате скручивания полипептидной
цепи за счет водородных связей между
группами: -СО- и –NН β-складчаты слой зигзагообразные
полипептидные цепи в которых
водородная связь образуется между
относительно удаленными друг от
друга аминокислотами.
32.
Вторичная структурабыла установлена
американским химиком
Л. Полингом в 1951 г.
33.
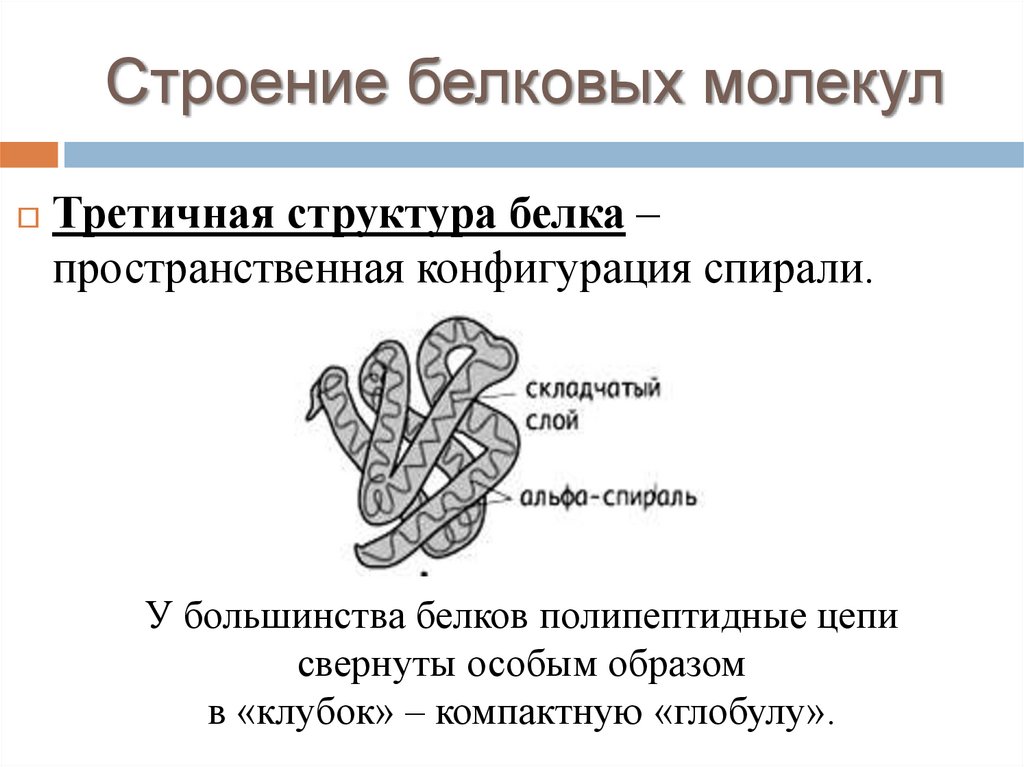
Строение белковых молекулТретичная структура белка –
пространственная конфигурация спирали.
У большинства белков полипептидные цепи
свернуты особым образом
в «клубок» – компактную «глобулу».
34.
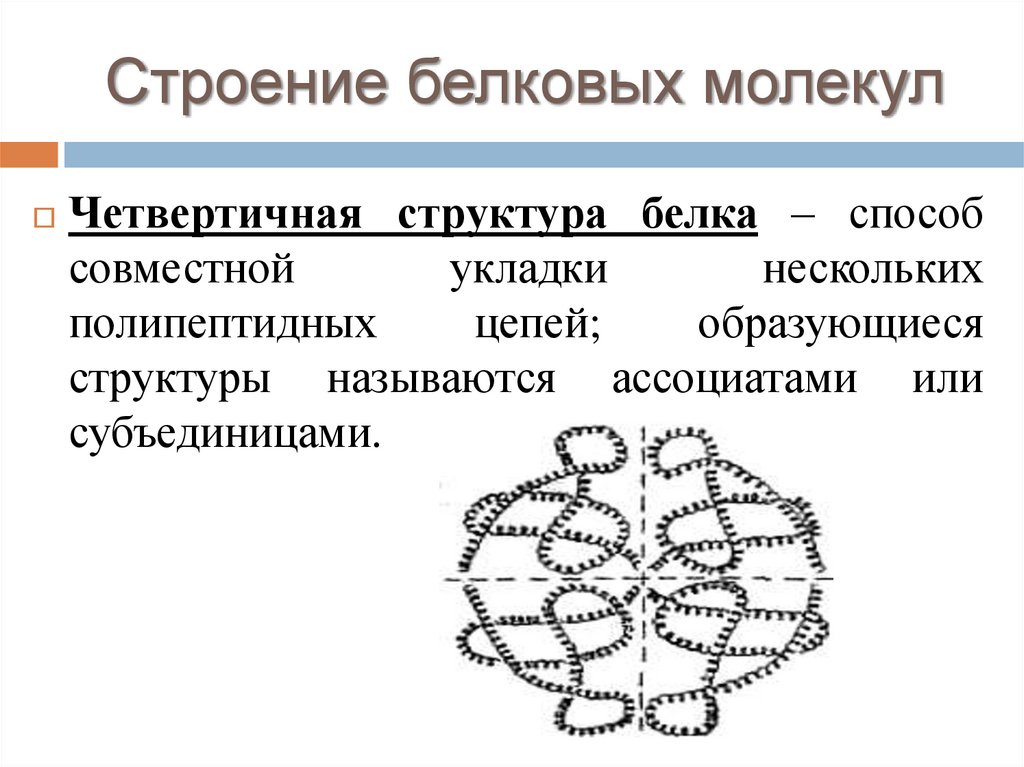
Строение белковых молекулЧетвертичная структура белка – способ
совместной
укладки
нескольких
полипептидных
цепей;
образующиеся
структуры называются ассоциатами или
субъединицами.
35.
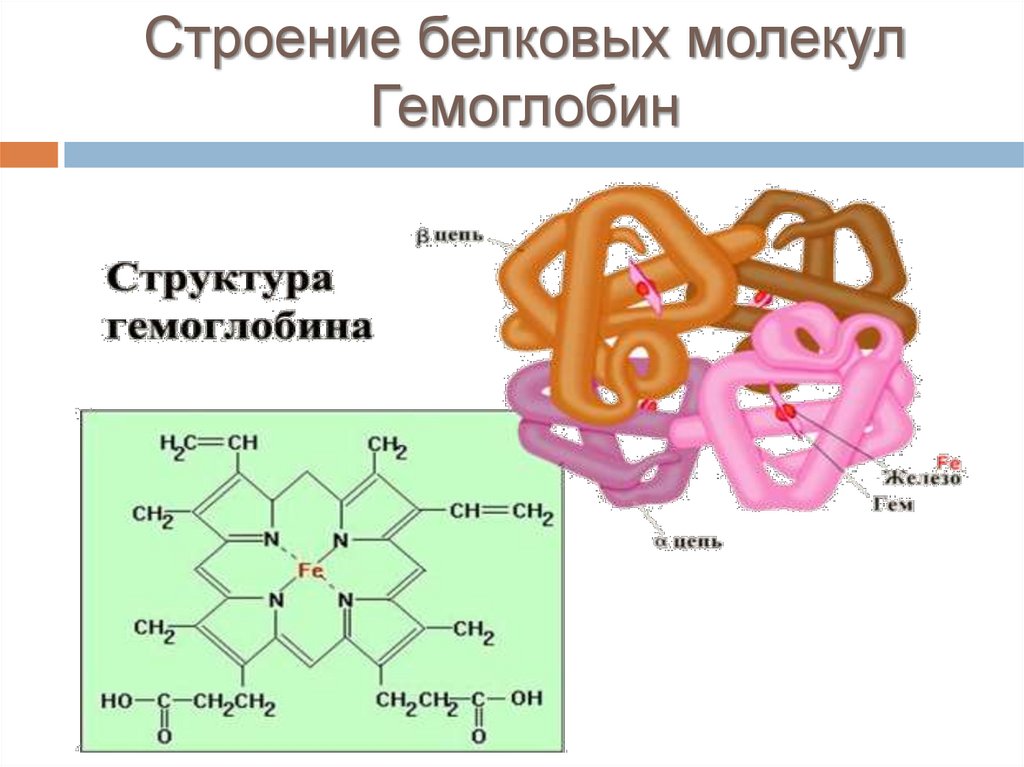
Строение белковых молекулГемоглобин
36.
Физические свойства белковСвойства белков разнообразны, как и функции,
которые они выполняют. Одни белки растворяются
в воде, образуя, как правило, коллоидные растворы
(например, белок яйца); другие растворяются в
разбавленных растворах солей; третьи
нерастворимы (например, белки покровных тканей).
37.
Химические свойства белковГидролиз белков
Белки + Н2О → α-аминокислоты.
38.
Химические свойства белковОсаждение белков
(обратимое высаливание)
При обработке хлоридом натрия
раствор белка выпадает в осадок
(раствор становится мутным).
Свойства белков в таком состоянии
не меняются поэтому при
добавлении воды они обратно
переходят в раствор.
39.
Химические свойства белковНеобратимое осаждение
(денатурация, свертывание)
При действии таких реагентов как соли
тяжелых металлов, концентрированные
кислоты и щелочи, нагревание, радиация
происходит разрушение вторичной и
третичной структуры белка и изменение его
свойст.
40.
Денатурация - потеря белками ихестественных свойств вследствие нарушения
пространственной структуры их молекул
В процессе приготовления
куриных яиц происходит
денатурация яичных белков
41.
Цветные (качественные) реакциина белки
а) ксантопротеиновая реакция (на остатки
аминокислот, содержащих бензольные
кольца):
Белок + HNO3 (конц.) → желтое окрашивание
42.
Цветные (качественные) реакциина белки
б) биуретовая реакция (на пептидные связи):
Белок + CuSO4 (насыщ) + NaOH (конц) →
ярко-фиолетовое окрашивание
43.
Цветные (качественные) реакциина белки
в) цистеиновая реакция
(на остатки аминокислот, содержащих серу):
Белок + NaOH + Pb(CH3COO)2 → Черное
окрашивание
44.
Функции белков в организмеПластическая
Транспортная
Защитная
Энергетическая
Каталитическая
Сократительная
Регуляторная
45.
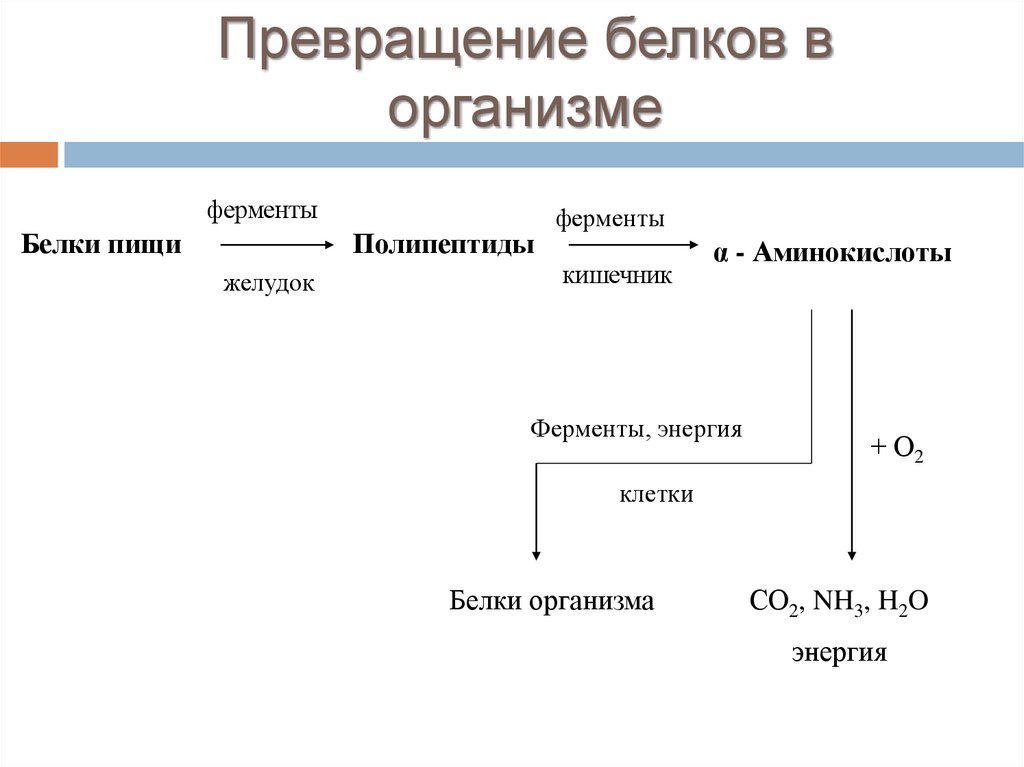
Превращение белков ворганизме
ферменты
Белки пищи
Полипептиды
желудок
ферменты
кишечник
α - Аминокислоты
Ферменты, энергия
+ О2
клетки
Белки организма
СО2, NH3, H2O
энергия




















 Химия
Химия