Похожие презентации:
Наглядное пособие «Динамические модели». Химическое равновесие в растворах
1.
Лилия КузнецоваНаглядное пособие
«Динамические модели»
Электронное приложение к учебнику «Химия-9»
© Кузнецова 2005
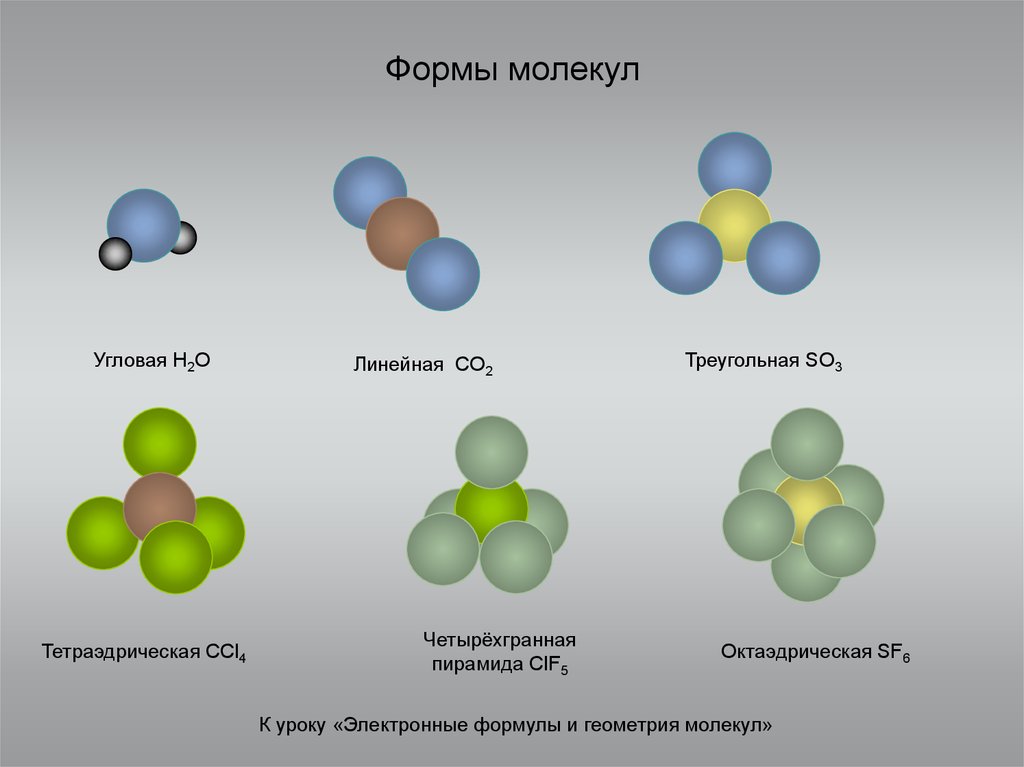
2. Формы молекул
Угловая H2OТетраэдрическая CCl4
Линейная CO2
Четырёхгранная
пирамида ClF5
Треугольная SO3
Октаэдрическая SF6
К уроку «Электронные формулы и геометрия молекул»
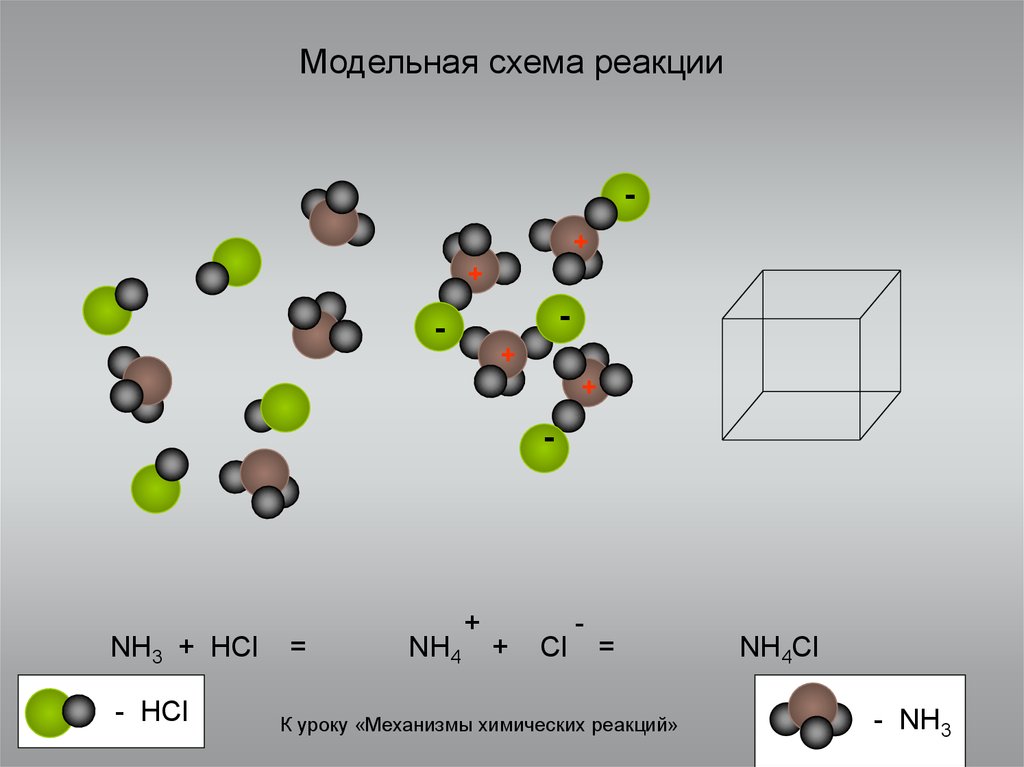
3. Модельная схема реакции
++
-
-
+
+
-
NH3 + HCl
- HCl
=
NH4
+
+
Cl
-
=
К уроку «Механизмы химических реакций»
NH4Cl
- NH3
4. Модельная схема возникновения активированного комплекса
СО + NO2 = CO2 + NO- СО
К уроку «Влияние температуры на скорость реакции»
- NО2
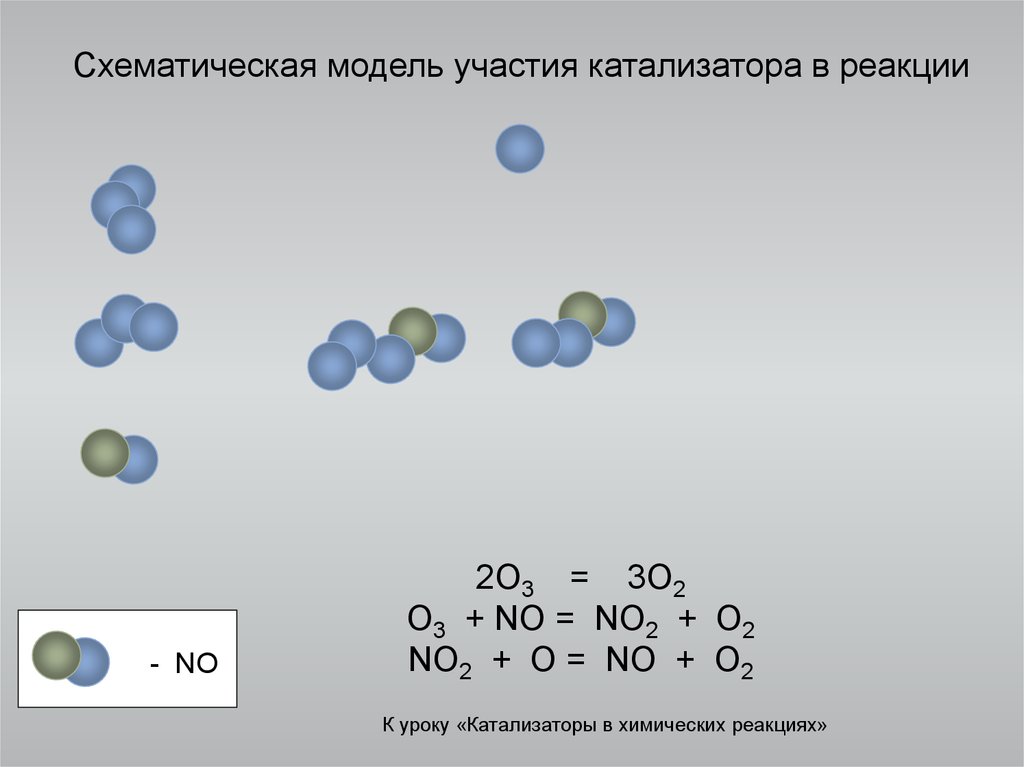
5. Схематическая модель участия катализатора в реакции
- NO2O3 = 3O2
O3 + NO = NO2 + O2
NO2 + O = NO + O2
К уроку «Катализаторы в химических реакциях»
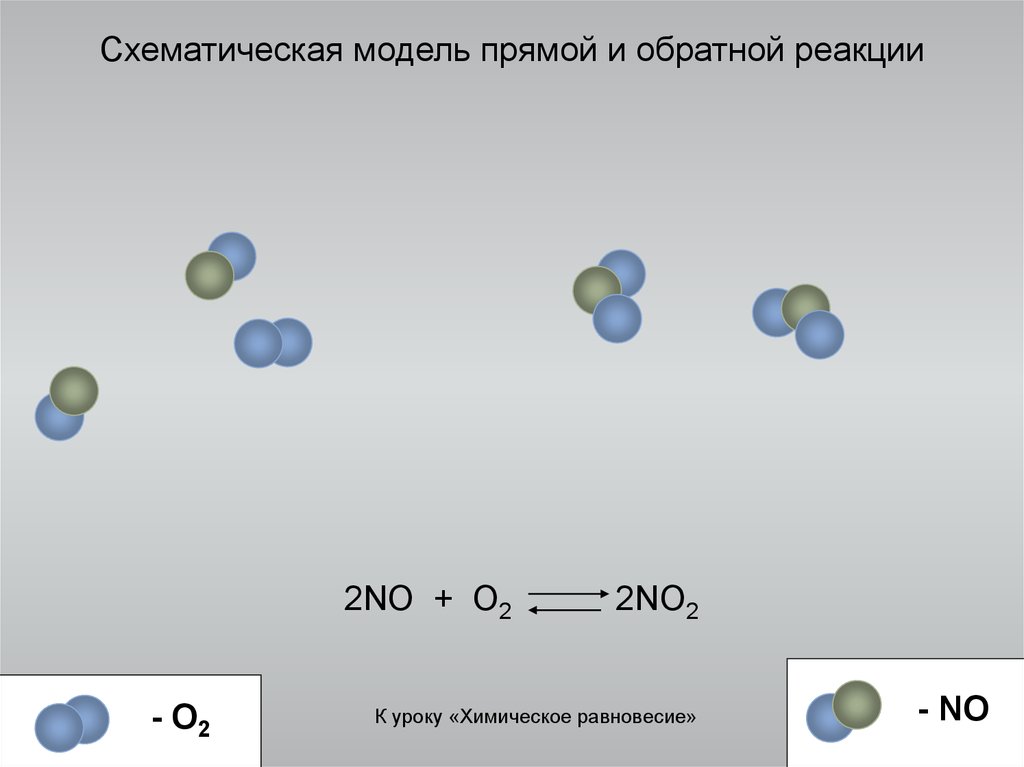
6. Схематическая модель прямой и обратной реакции
2NO + O2- O2
2NO2
К уроку «Химическое равновесие»
- NO
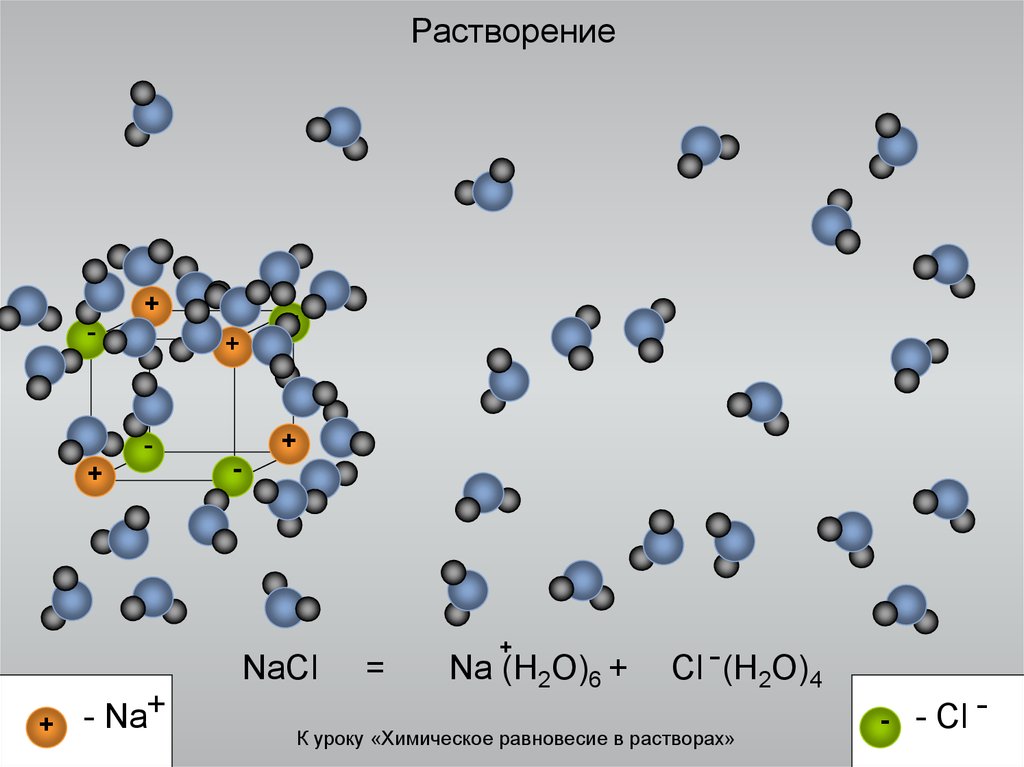
7. Растворение
+-
-
+
+
+
-
NaCl
+
- Na+
=
+
Na (H2O)6 +
Cl - (H2O)4
К уроку «Химическое равновесие в растворах»
-
- Cl -
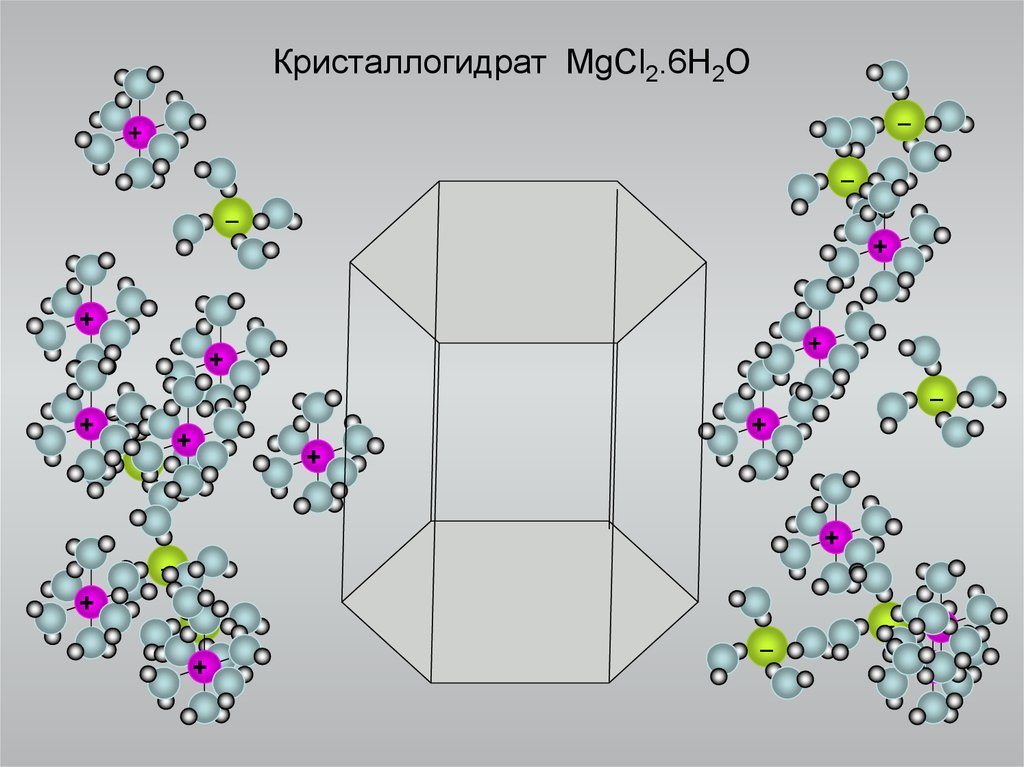
8. Кристаллогидрат MgCl2.6H2O
_+
_
_
+
+
+
+
_
+
+
+
_
+
+
_
+
_
_
_
+
+
+
9. Ионизация и диссоциация хлороводорода
+-
HCl + H2O = H3O + + Cl - HCl
К уроку «Химическое равновесие в процессах
электролитической диссоциации»
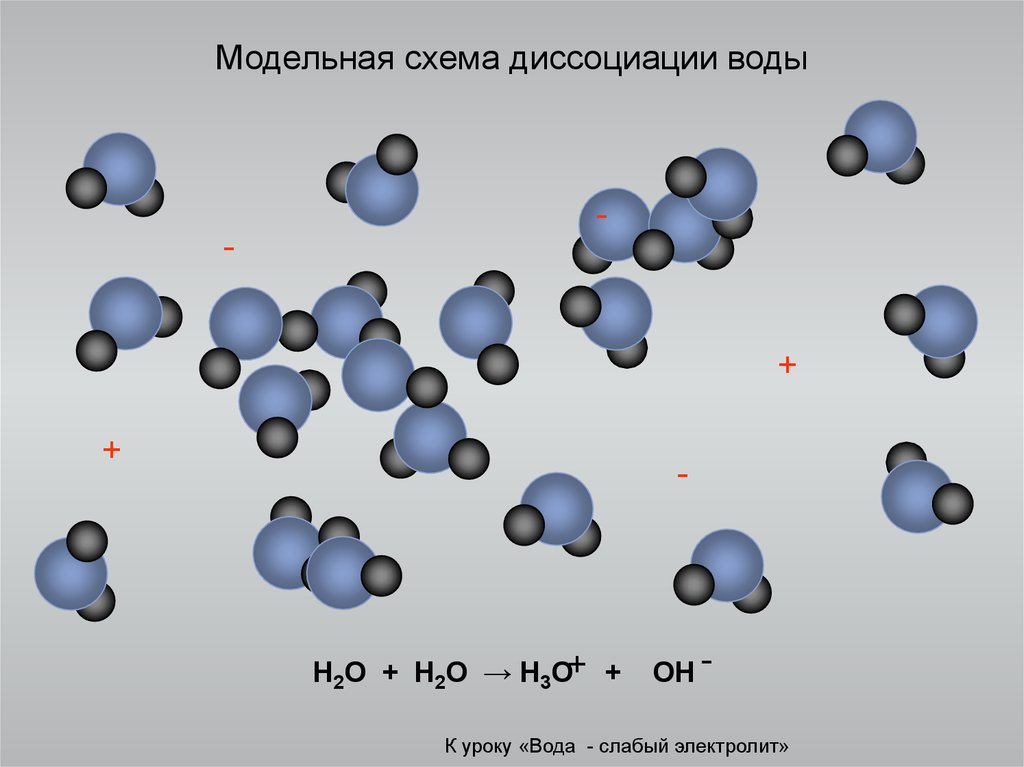
10. Водородная связь в воде
К уроку «Вода - слабый электролит»11. Модельная схема диссоциации воды
-+
+
-
H2O + H2O → H3O+ +
OH -
К уроку «Вода - слабый электролит»
12. Гидролиз по аниону
2-СO32-
-
OH HСO3-
СO32-
+
H2O
HСO3- +
К уроку «Гидролиз солей»
OH -
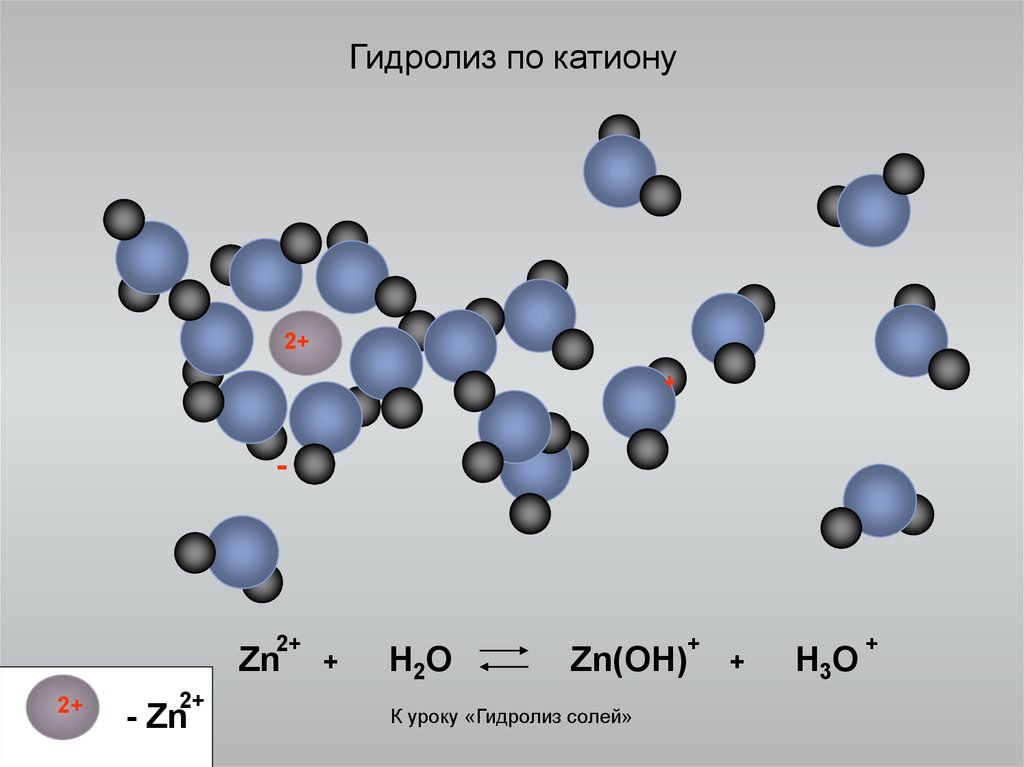
13. Гидролиз по катиону
2++
-
2+
Zn
2+
2+
- Zn
+
H2O
Zn(OH)
К уроку «Гидролиз солей»
+
+
H3O
+
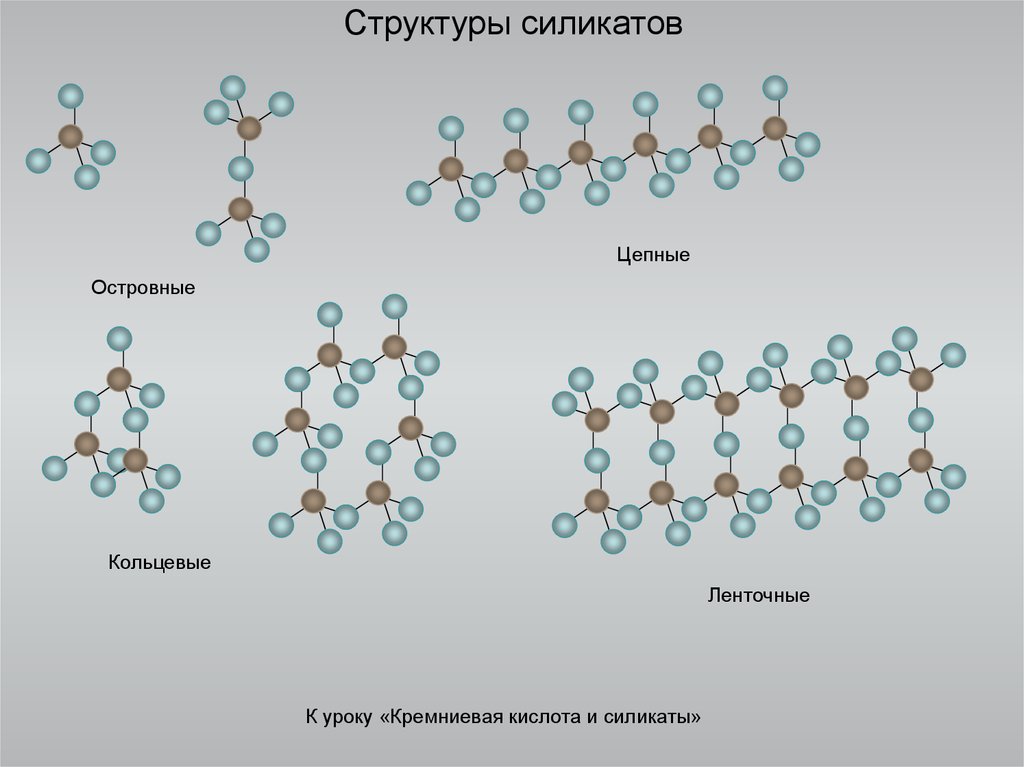
14. Структуры силикатов
ЦепныеОстровные
Кольцевые
Ленточные
К уроку «Кремниевая кислота и силикаты»
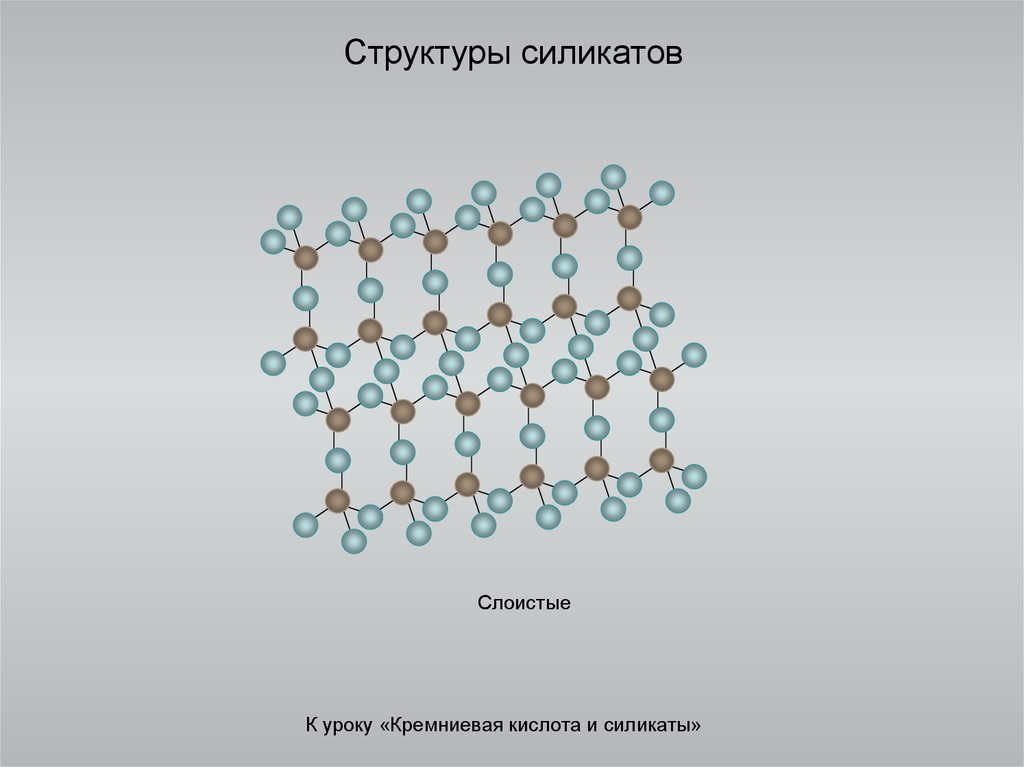
15. Структуры силикатов
СлоистыеК уроку «Кремниевая кислота и силикаты»





 Химия
Химия








