Похожие презентации:
Коллигативные свойства растворов. Закон Вант-Гоффа. Изотонический коэффициент
1.
Коллигативные свойства растворов. ЗаконВант-Гоффа. Изотонический коэффициент
1
2.
Коллигативными называются свойства, которые зависят отприроды растворителя, т.е. от числа его частиц в единице
объема, но не зависят от свойств этих частиц.
Коллигативные свойства проявляются, когда в равновесии
находятся 2 фазы, одна из которых содержит растворитель
и растворенное вещество, а вторая – только растворитель.
Среди набора коллигативных свойств выделим основные:
1. понижение температуры замерзания растворов,
2. повышение температуры кипения растворов,
3. осмотическое давление.
2
3.
Криоскопия1. В отличие от чистой жидкости, раствор при охлаждении не замерзает
целиком при постоянной температуре. При определенной температуре из
раствора начинают выделяться кристаллы растворителя и, по мере
охлаждения, количество их растет и наконец, весь раствор
закристаллизовывается. Температурой кристаллизации (или замерзания)
раствора считают температуру, при которой начинается образование
кристаллов.
Замерзание растворов характеризуют величиной понижения температуры
замерзания ∆Тзам, равной разности между температурой замерзания
чистого растворителя Т°зам и температурой начала кристаллизации
раствора Тзам:
∆Тзам = Т°зам– Тзам
3
4.
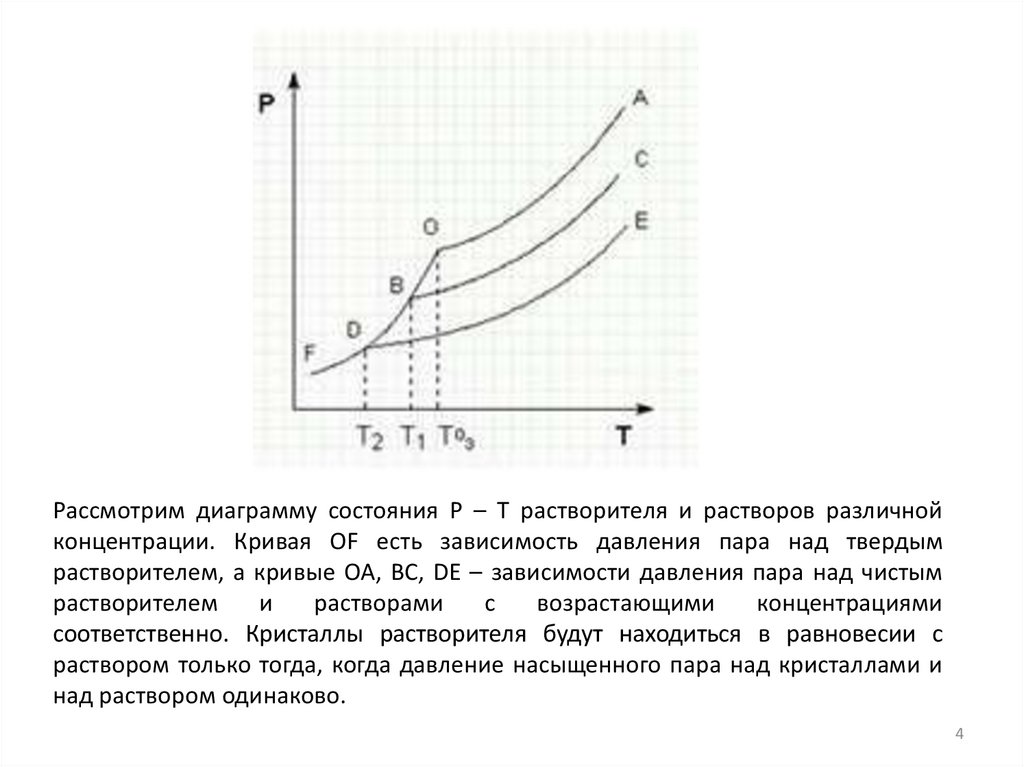
Рассмотрим диаграмму состояния Р – Т растворителя и растворов различнойконцентрации. Кривая ОF есть зависимость давления пара над твердым
растворителем, а кривые ОА, ВС, DE – зависимости давления пара над чистым
растворителем
и
растворами
с
возрастающими
концентрациями
соответственно. Кристаллы растворителя будут находиться в равновесии с
раствором только тогда, когда давление насыщенного пара над кристаллами и
над раствором одинаково.
4
5.
Поскольку давление пара растворителя над раствором всегда ниже, чем надчистым растворителем, температура, отвечающая этому условию, всегда
будет более низкой, чем температура замерзания чистого растворителя. При
этом понижение температуры замерзания раствора ∆Тзам не зависит от
природы растворенного вещества и определяется лишь соотношением числа
частиц растворителя и растворенного вещества.
С увеличением концентрации раствора температура замерзания понижается –
∆Тзам прямопропорционально моляльной концентрации раствора.
∆Тзам = К ∙ m,
уравнение называют вторым законом Рауля, где m – моляльная концентрация
раствора, К – коэффициент пропорциональности, криоскопическая
постоянная растворителя, определяется природой растворителя.
Физический смысл криоскопической постоянной: К равна понижению
температуры замерзания одномоляльного раствора если m = 1 тогда ∆Тзам
= К.
Криоскопия – (от греческого «криос» – холод)явление понижения
температуры замерзания раствора по сравнению с чистым растворителем.
Явление криоскопии используется для определения молекулярной массы
растворенного вещества.
5
6.
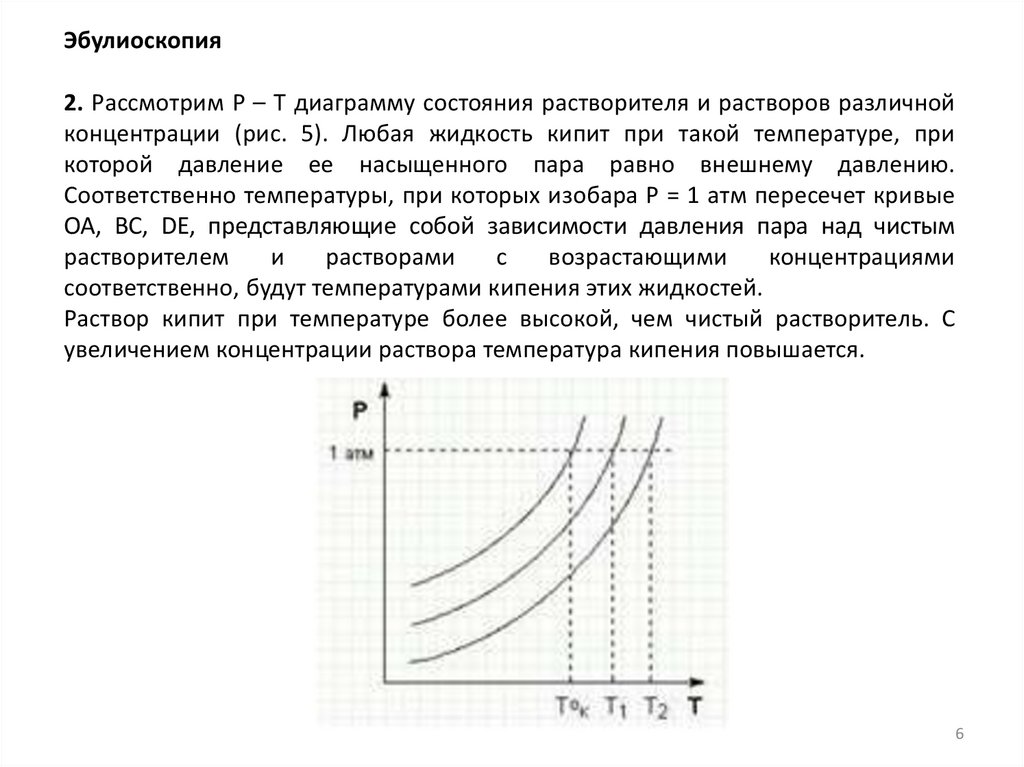
Эбулиоскопия2. Рассмотрим Р – Т диаграмму состояния растворителя и растворов различной
концентрации (рис. 5). Любая жидкость кипит при такой температуре, при
которой давление ее насыщенного пара равно внешнему давлению.
Соответственно температуры, при которых изобара Р = 1 атм пересечет кривые
ОА, ВС, DE, представляющие собой зависимости давления пара над чистым
растворителем
и
растворами
с
возрастающими
концентрациями
соответственно, будут температурами кипения этих жидкостей.
Раствор кипит при температуре более высокой, чем чистый растворитель. С
увеличением концентрации раствора температура кипения повышается.
6
7.
Повышение температуры кипения пропрционально понижению давлениянасыщенного пара и, следовательно, прямо пропорционально моляльной
концентрации раствора:
∆Ткип = Е ∙ m,
где ∆Ткип = Ткип раствора – Т°кип растворителя, m – моляльная
концентрацияраствора,
Е
–
коэффициент
пропорциональности,
эбуллиоскопическая постоянная растворителя, зависит от природы
растворителя. Физический смысл эбуллиоскопической постоянной: Е есть
повышение температуры кипения одномоляльного раствора - m = 1 тогда ∆Ткип =
Е.
Эбуллиоскопия – (от латинского «эбулиос» - вскипать) явление повышения
температуры кипения раствора по сравнению с чистым растворителем.
Явление эбуллиоскопии используется для определения молекулярной
массы растворенного вещества.
Т.о., второй закон Рауля можно сформулировать следующим образом:
Понижение температуры замерзания и повышение температуры кипения
разбавленного раствора нелетучего вещества прямо пропорционально
моляльной концентрации раствора и не зависит от природы
растворенного вещества.
Второй закон Рауля является следствием из первого, данный закон
справедлив только для бесконечно разбавленных растворов.
7
8.
Явление осмосаВозьмем сосуд, разделенный точно пополам полупроницаемой перегородкой,
которая не доходит до конца сосуда и отделяет растворитель от раствора,
имеющих постоянную и одинаковую температуру. Через перегородку могут
проходить молекулы растворителя и не проходят молекулы растворенного
вещества. Будет наблюдаться явление самопроизвольного перехода
растворителя через мембрану из менее концентрированного раствора в более
концентрированный – явление осмоса.
8
9.
Благодаря осмосу уровень раствора установится выше уровнярастворителя.
Осмотические свойства раствора количественно характеризуются
величиной осмотического давления. Сила, заставляющая
переходить растворитель через мембрану в раствор
называется осмотическим давлением П.
Величина осмотического давления определяется по уравнению
Вант-Гоффа:
π , (Па)
где С – молярная концентрация раствора.
Уравнение Вант-Гоффа показывает, что осмос и вызванное им
осмотическое давление зависят от количества растворенного
вещества (n) и температуры раствора.
9
10.
Закон Вант-Гоффа:Осмотическое давление разбавленного идеального раствора неэлектролита
равно тому давлению, которое производило бы растворенное вещество, если бы
при той же температуре находилось бы в газообразном состоянии и занимало бы
объем, равный объему раствора.
Однако это уравнение справедливо только для растворов, в которых отсутствует
взаимодействие частиц, т. е. для идеальных растворов. В реальных растворах имеют
место межмолекулярные взаимодействия между молекулами вещества и
растворителя, которые могут приводить или к диссоциации молекул растворенного
вещества на ионы, или к ассоциации молекул растворенного вещества с
образованием из них ассоциатов.
Диссоциации молекул растворенного вещества в водном растворе на ионы
характерна для электролитов. В результате диссоциации число частиц в растворе
увеличивается.
Ассоциация наблюдается, если молекулы вещества лучше взаимодействуют между
собой, чем с молекулами растворителя. Это характерно для коллоидных растворов,
что приводит к уменьшению числа частиц в растворе.
10
11.
Для учета межмолекулярных взаимодействий в реальных растворах Вант-Гоффпредложил использовать изотонический коэффициент i.
Для молекул растворенного вещества физический смысл изотонического
коэффициента:
i = число частиц растворенного вещества / число частиц исходного вещества.
i = 1 – для разбавленных растворов неэлектролитов;
i > 1 – для разбавленных растворов электролитов;
i < 1 – для коллоидных растворов, содержащих ассоциаты.
Взаимосвязь изотонического
выражается уравнением:
коэффициента
со
степенью
диссоциации
i = 1 + α(n–1)
где n – число ионов, образующих данный электролит.
Для растворов электролитов осмотическое давление рассчитывается по
формуле:
Росм = i CХ R T
Изотонические растворы – имеют равное осмотическое давление.
Гипертонические растворы– имеют большее осмотическое давление по
сравнению с другим раствором. Гипотонические растворы – имеют меньшее
осмотическое давление по сравнению с другим раствором.
11









 Химия
Химия








