Похожие презентации:
Распределение электронов по энергетическим уровням
1.
Тема урока :«Распределение
электронов по
энергетическим
уровням»
подготовила : Виноградова Ольга Николаевна
учитель химии
2.
Цель урокаВсе учащиеся смогут
- понимать как распределяются электроны
на энергетических уровнях.
Большинство учащихся смогут
- объяснять порядок заполнения
электронов в атоме;
Некоторые учащиеся смогут
• - определять по строению электронной
оболочки расположение в атома в
периодической сисмеме.
3.
Повторим• Свойства ……..тел, а также ………. И …………
соединений элементов……………в
периодической ……………… от …………атомных
………… элементов.
Слова для подсказки: зависимости, натрий,
простых, калий, формы, свойства, находятся,
приходятся, величины, весов, гирь
4.
5.
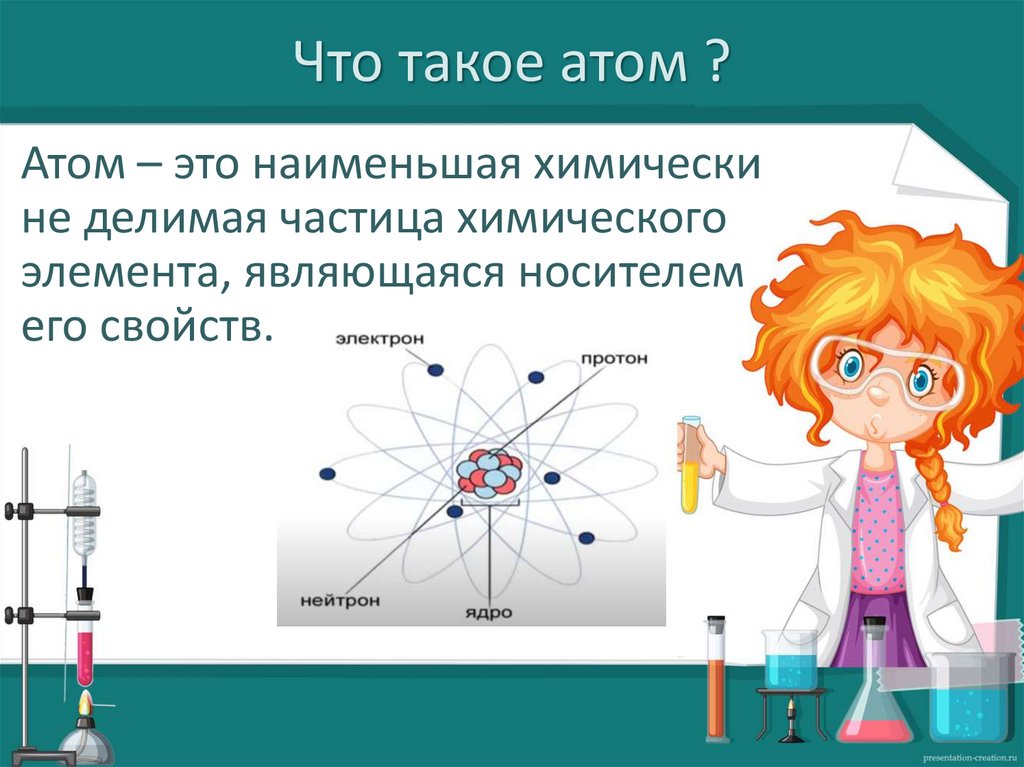
Что такое атом ?Атом – это наименьшая химически
не делимая частица химического
элемента, являющаяся носителем
его свойств.
6.
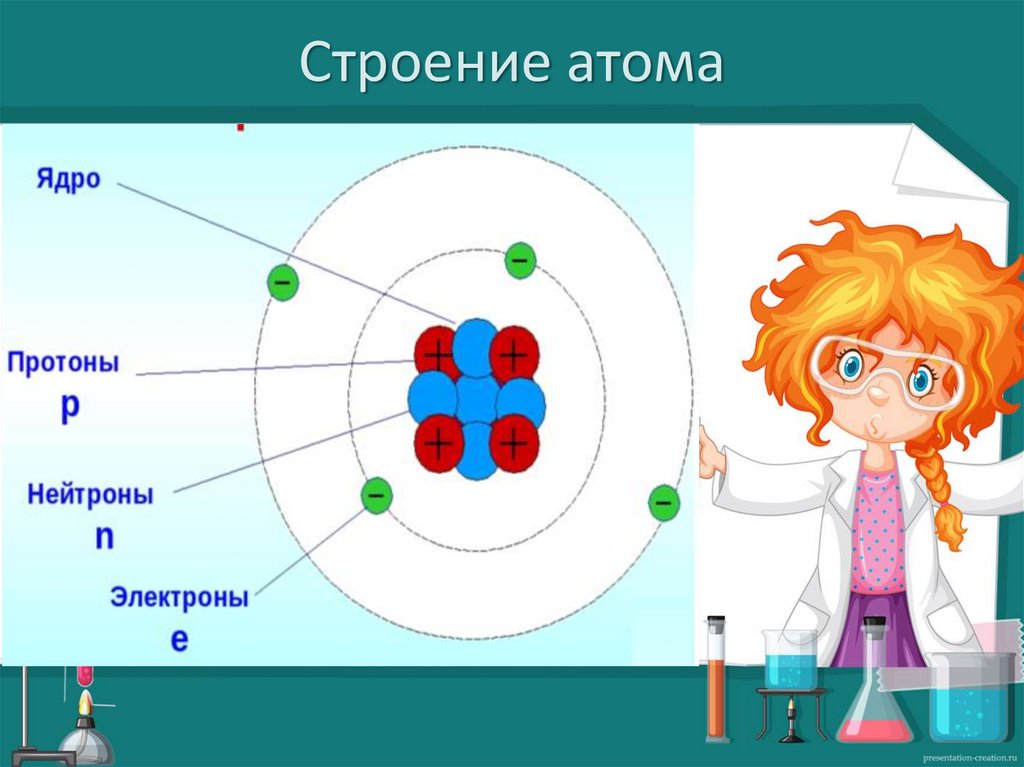
Строение атома7.
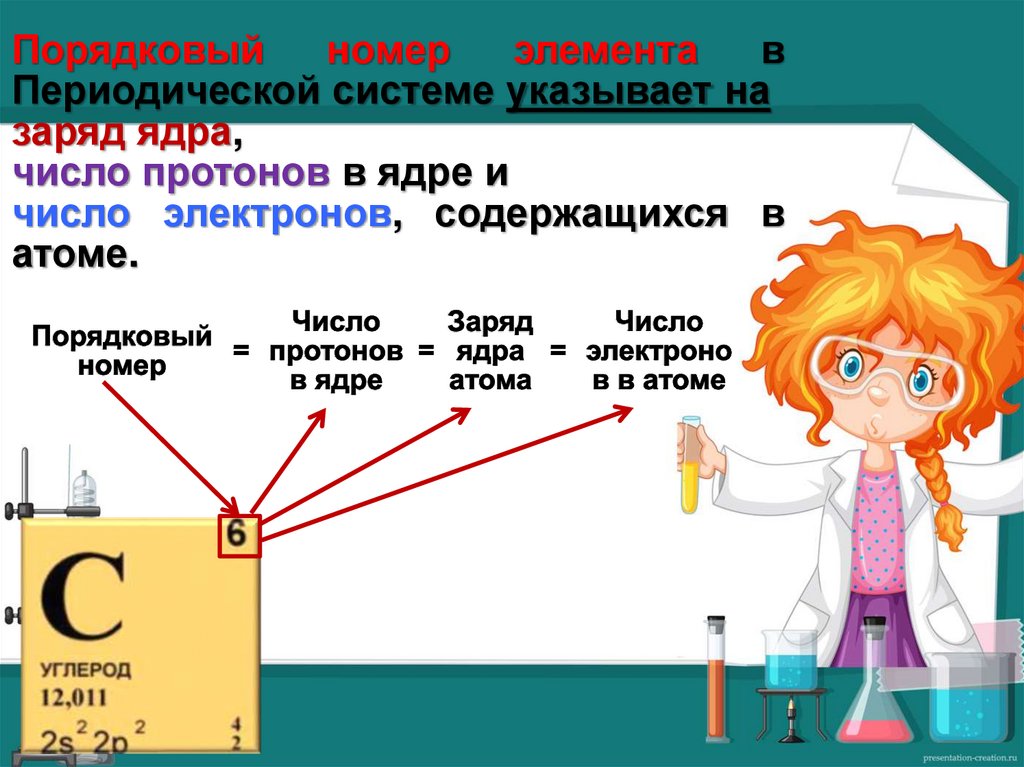
Порядковыйномер
элемента
в
Периодической системе указывает на
заряд ядра,
число протонов в ядре и
число электронов, содержащихся в
атоме.
8.
Порядковый номер углерода 6.Следовательно, в атоме углерода
6 протонов, 6 электронов, заряд ядра
равен +6.
Порядковый номер
Массовое число атома А
9.
Строение электронной оболочки атомаЭлектронная
оболочка
атома
(атомная орбиталь) – это область
пространства, в которой вероятность
нахождения электронов максимальна.
Электроны, в электронной оболочке
атома, размещаются вокруг ядра
электронными слоями.
Каждый
слой
состоит
из
электронов с близкими значениями
энергии, поэтому слои электронов
называют энергетическими уровнями.
10.
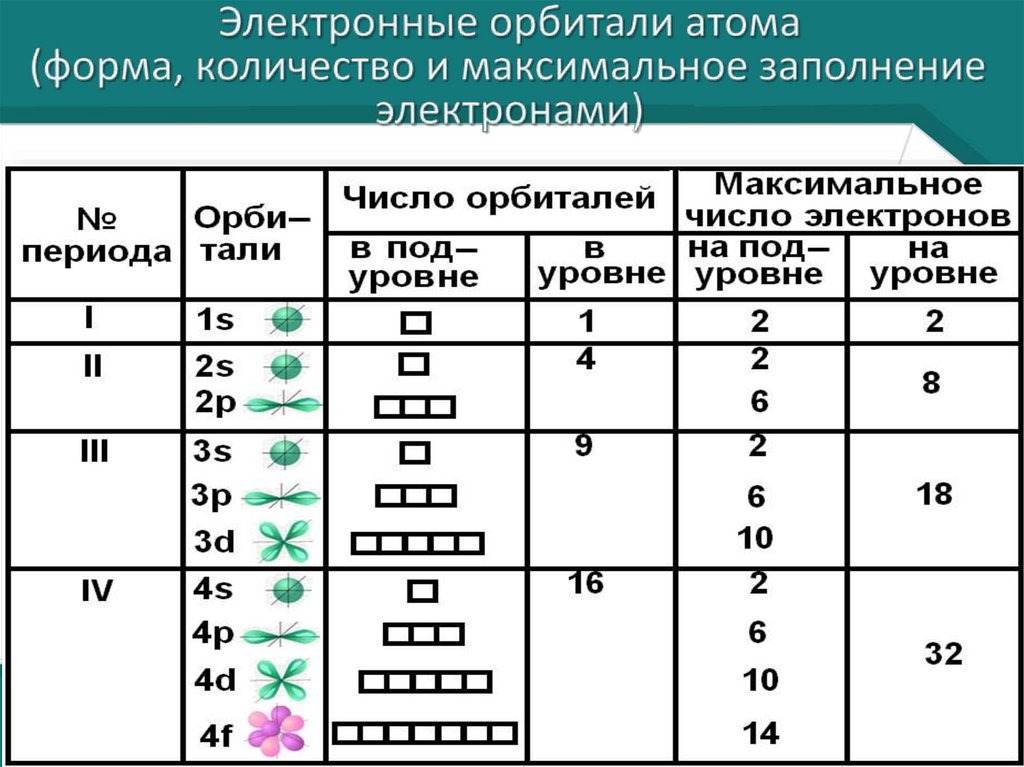
Распределение электронов по уровням• N=2n² - формула для
вычисления количество
электронов на энергетических
уровнях
• 1 –й уровень – 2 электрона.
• 2-й уровень – 8 электронов.
• 3-й уровень – 18 электронов.
• 4-й уровень – 32 электрона
11.
1Энергетический
уровень
называют
завершённым, если содержит
максимальное число электронов.
2
Энергетический уровень называют
незавершённым, если не содержит
максимального числа электронов
3
На первом энергетическом
уровне Максимально может
быть только 2 электрона.
12.
Распределение электронов поэнергетическим уровням
13.
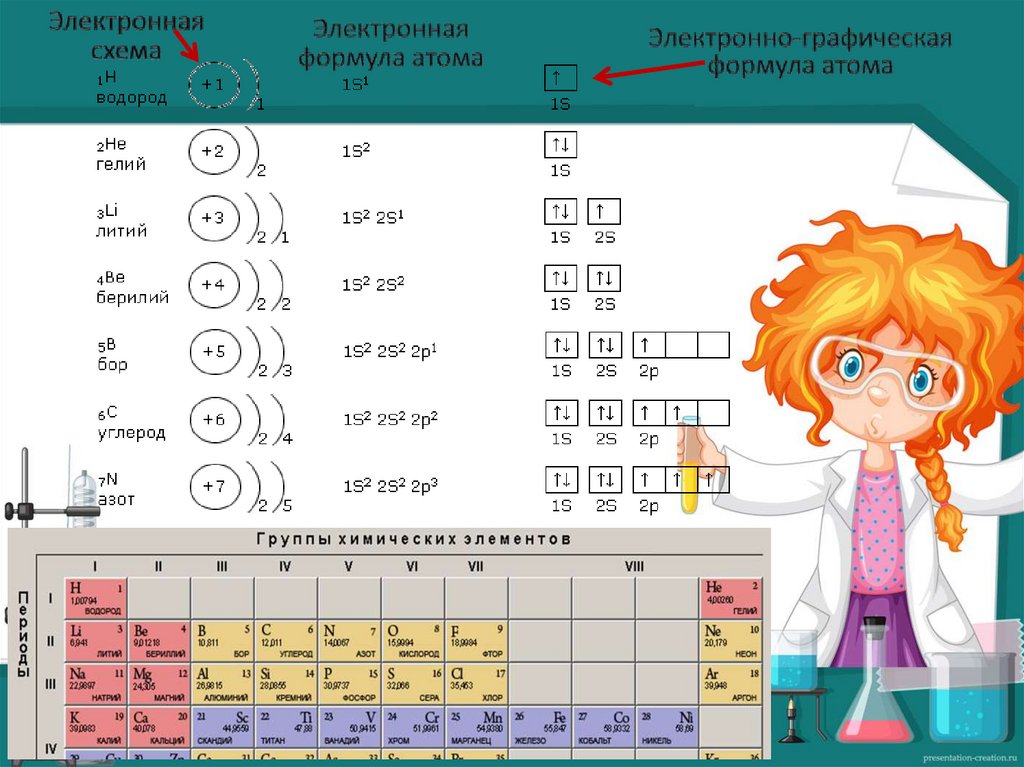
Схему расположения электроновпо
энергетическим
уровням,
называют
электронной
схемой
(электронной конфигурацией) атома.
14.
15.
Орбитали (изображают квадратиками)заполняются электронами (изображают
стрелками – первая вверх, а вторая –
вниз) сначала заполняют квадратики по
одному, а затем добавляют, по мере
заполнения, второй электрон.
В каждой орбитали может находиться
не более 2-х электронов.
Если в орбитале находится:
1электрон, то он называется не
спаренным,
если 2 – то это спаренные электроны.
16.
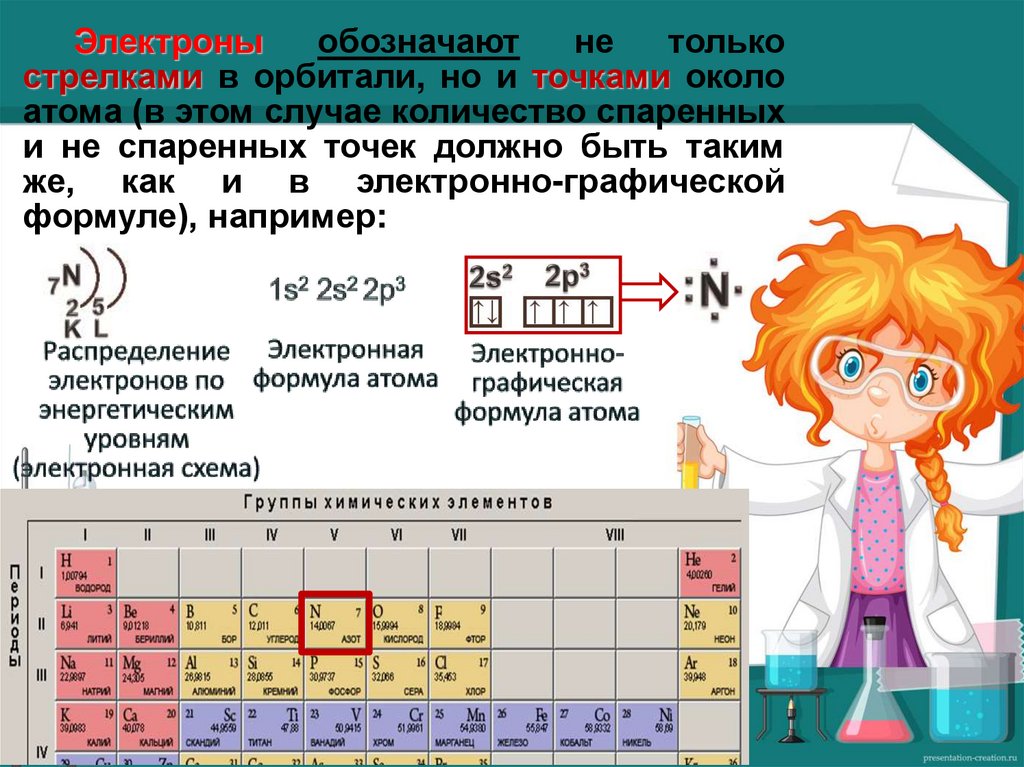
Электроныобозначают
не
только
стрелками в орбитали, но и точками около
атома (в этом случае количество спаренных
и не спаренных точек должно быть таким
же, как и в электронно-графической
формуле), например:
17.
18.
Домашнее заданиеСоставьте схемы элементов
3 периода
• Электронные схемы
• Электронные формулы
атомов
• Электронно-графические
формулы
19.
Источники информации1. Рудзитис Г. Е. Химия. Неорганическая химия, 8 класс: учеб. для общеобразоват.
учреждений с прил. на электрон. носителе/ Г. Е. Рудзитис, Ф.Г.Фельдман.-15-е изд.-М.
: Просвещение. 2017 . -176 с.: ил.
2. https://foxford.ru/wiki/himiya/stroenie-elektronnyh-obolochek Строение электронных
оболочек
3 http://www.yoursystemeducation.com/periodicheskij-zakon-i-stroenie-atoma/ Модель
строения атома
4 http://ru.solverbook.com/spravochnik/ximiya/11-klass/stroenie-atoma/sxema/ Схема
строения атома
5. https://www.youtube.com/watch?v=UdpJV0HjojQ Строение атома
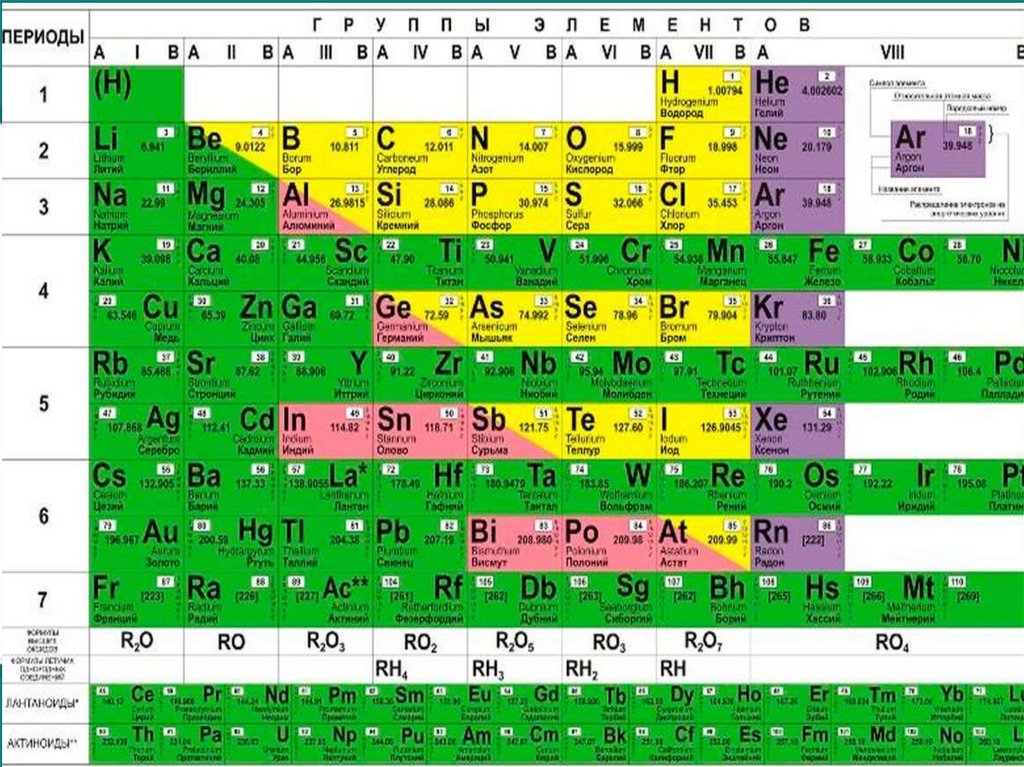
6. https://filtravod.ru/literature/periodicheskaia-tablitsa-elementov-d-i-mendeleeva
Периодическая Таблица Элементов Д. И. Менделеева
7. https://myslide.ru/presentation/skachat-periodicheskij-zakon-d-i-mendeleeva-ielektronnoe-stroenie-atoma Периодический закон и строение атома












 Химия
Химия








