Похожие презентации:
Электронная природа химической связи в органических соединениях
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ ПРОФЕССОРА В.Ф. ВОЙНО-ЯСЕНЕЦКОГО»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ
Тема: Электронная природа
химической связи в органических
соединениях
Преподаватель химии: Агафонова Н.В.
2.
План:1. Строение атома.
2. Характеристика положения электрона
в атоме.
3. Электронно-графические формулы на
примере атома углерода.
4. Гибридизация и ее типы.
3.
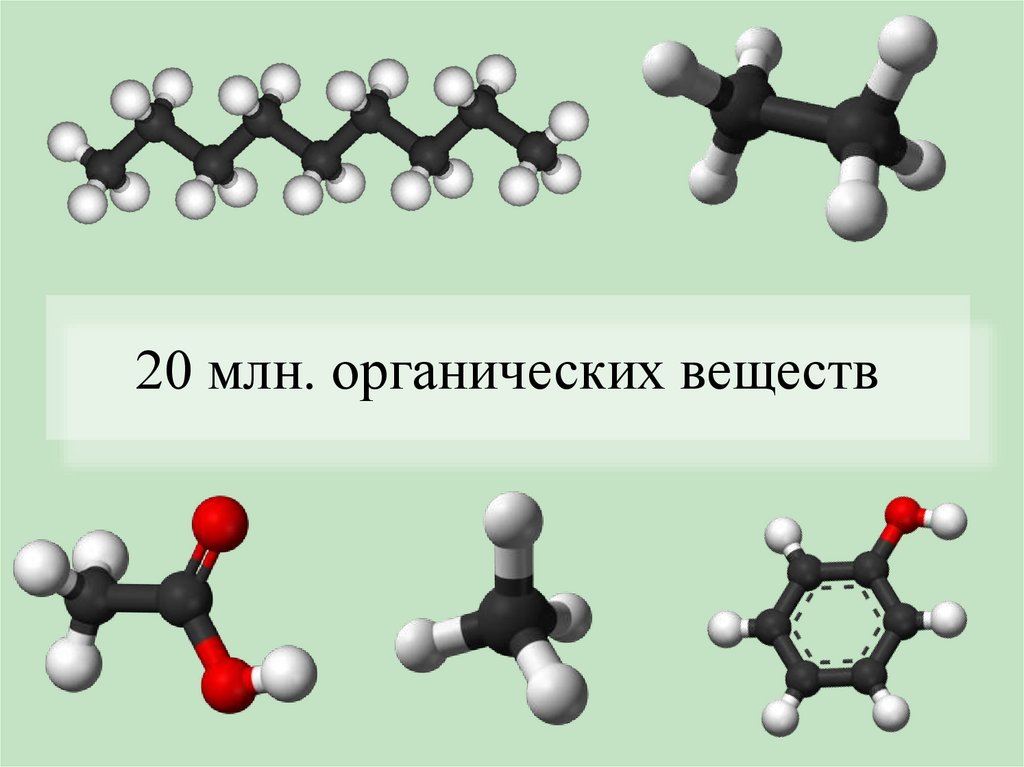
20 млн. органических веществ4.
Модель строения атомаПротон – это частица, которая имеет
положительный заряд. Заряд протона в условных
единицах равен +1. Символ протона – 1р.
Нейтрон – нейтральная частица, заряд нейтрона
равен 0. Символ нейтрона – 0n.
Вокруг ядра атома движутся электроны, которые
имеют отрицательный заряд. Заряд электрона в
условных единицах равен – 1.
Символ электрона – ē.
5.
Модель строения атома1913 г. модель строения атома Резерфорда
6.
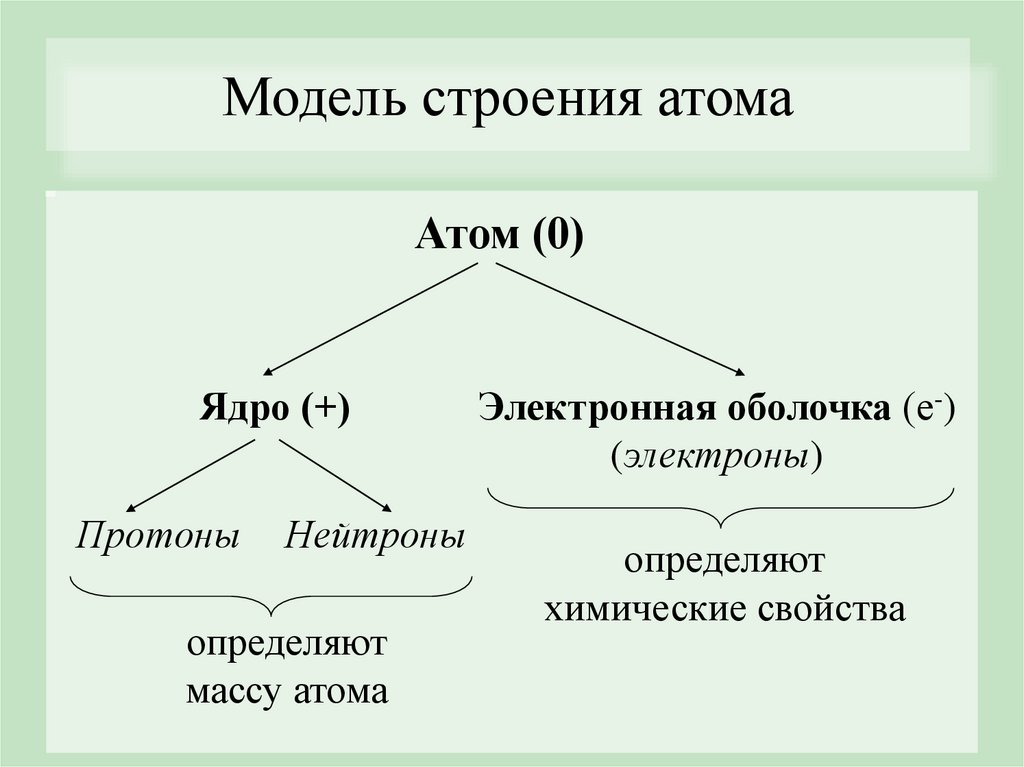
Модель строения атомаАтом (0)
Ядро (+)
Протоны
Нейтроны
определяют
массу атома
Электронная оболочка (е-)
(электроны)
определяют
химические свойства
7.
Модель строения атомаКаждое цифровое обозначение в
периодической системе Д.И.
Менделеева отражает какую-либо
особенность в строении атомов
8.
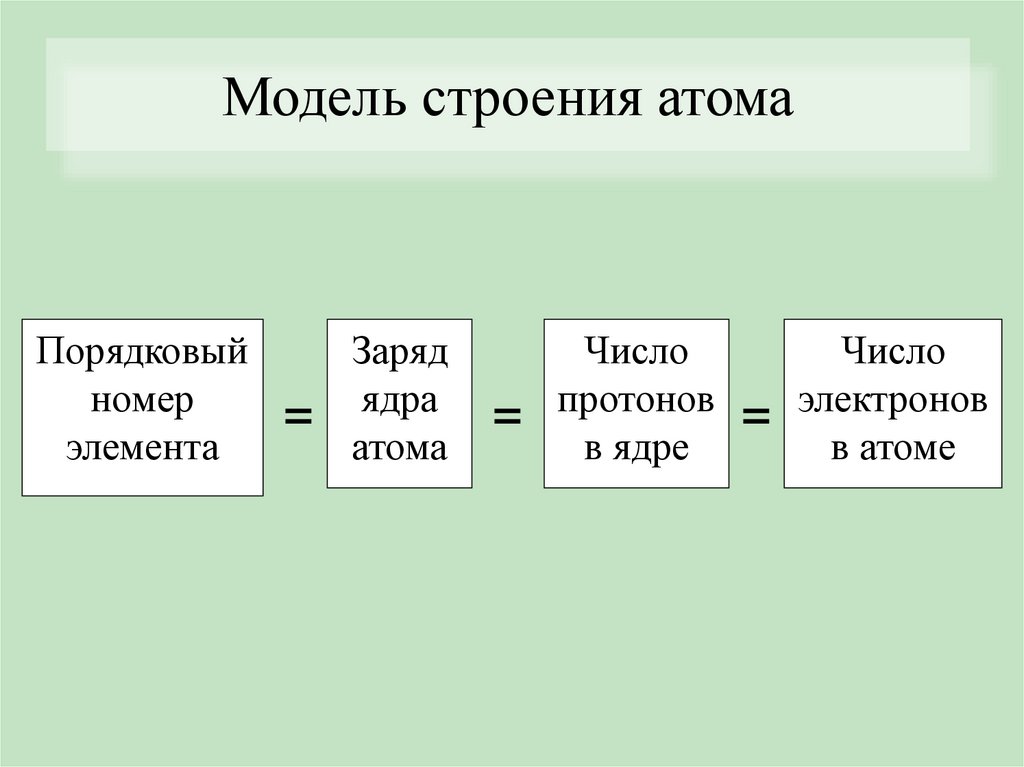
Модель строения атомаПорядковый
номер
элемента
=
Заряд
ядра
атома
=
Число
Число
протонов = электронов
в ядре
в атоме
9.
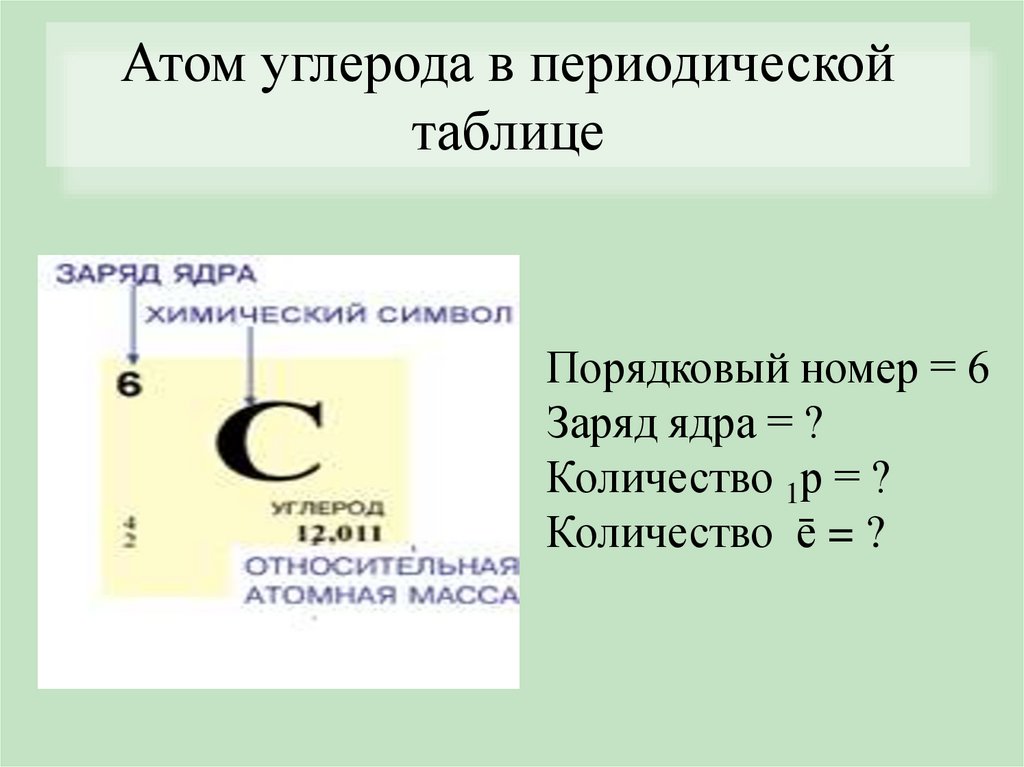
Атом углерода в периодическойтаблице
Порядковый номер = 6
Заряд ядра = ?
Количество 1р = ?
Количество ē = ?
10.
Принцип неопределенностиПринцип неопределенности: невозможно как-либо
установить местонахождение электрона в атоме.
Электрон может находиться в любой точке
пространства вокруг ядра.
говорить о
В Поэтому
1927 гможно
В. Гейзенберг
вероятности пребывания электрона в данной области
сформулировал
пространства.
принцип
Часть атомного пространства, в которой
вероятность
нахождения электрона наибольшая
называется атомной
неопределенности
орбиталью.
Каждый электрон в атоме, образует электронное
облако, которое образуется в результате совокупности
Вайнер Гейзенберг
различных
положений быстро движущегося электрона.
11.
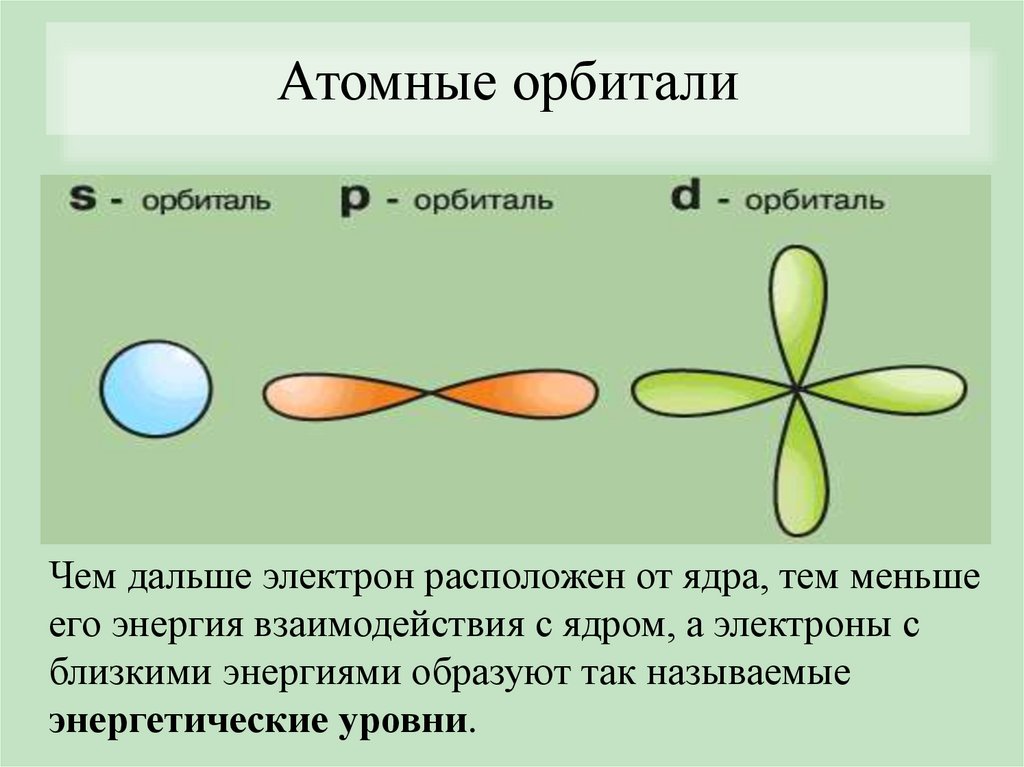
Атомные орбиталиЧем дальше электрон расположен от ядра, тем меньше
его энергия взаимодействия с ядром, а электроны с
близкими энергиями образуют так называемые
энергетические уровни.
12.
Энергетические уровниМаксимальное количество электронов
1 уровень - 2 на s-орбитали (всего 2)
2 уровень - 2 на s-орбитали, 6 на р-орбитали
(всего 8)
3 уровень - 2 на s-орбитали, 6 на р-орбитали,
10 на d-орбитали (всего 18)
4 уровень - 2 на s-орбитали, 6 на р-орбитали,
10 на d- орбитали, 14 на f-орбитали (всего 32)
13.
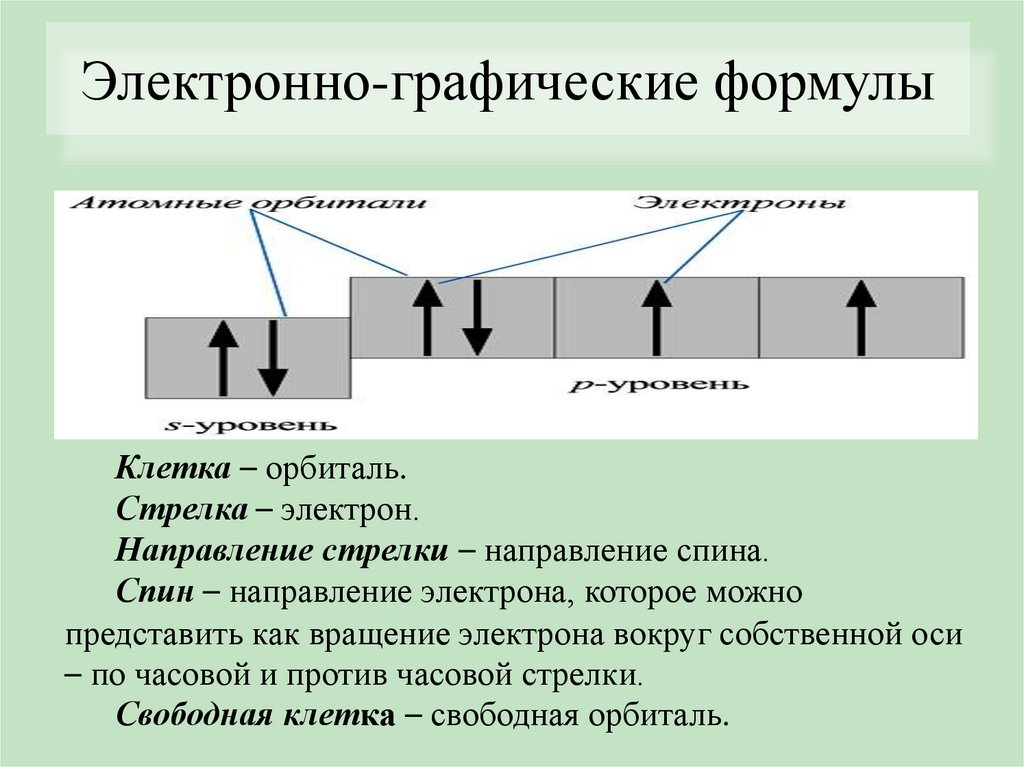
Электронно-графические формулыСтроение электронных оболочек отображают с
помощью электронно-графических формул
Клетка – орбиталь.
Стрелка – электрон.
Направление стрелки – направление спина.
Спин – направление электрона, которое можно
представить как вращение электрона вокруг собственной оси
– по часовой и против часовой стрелки.
Свободная клетка – свободная орбиталь.
14.
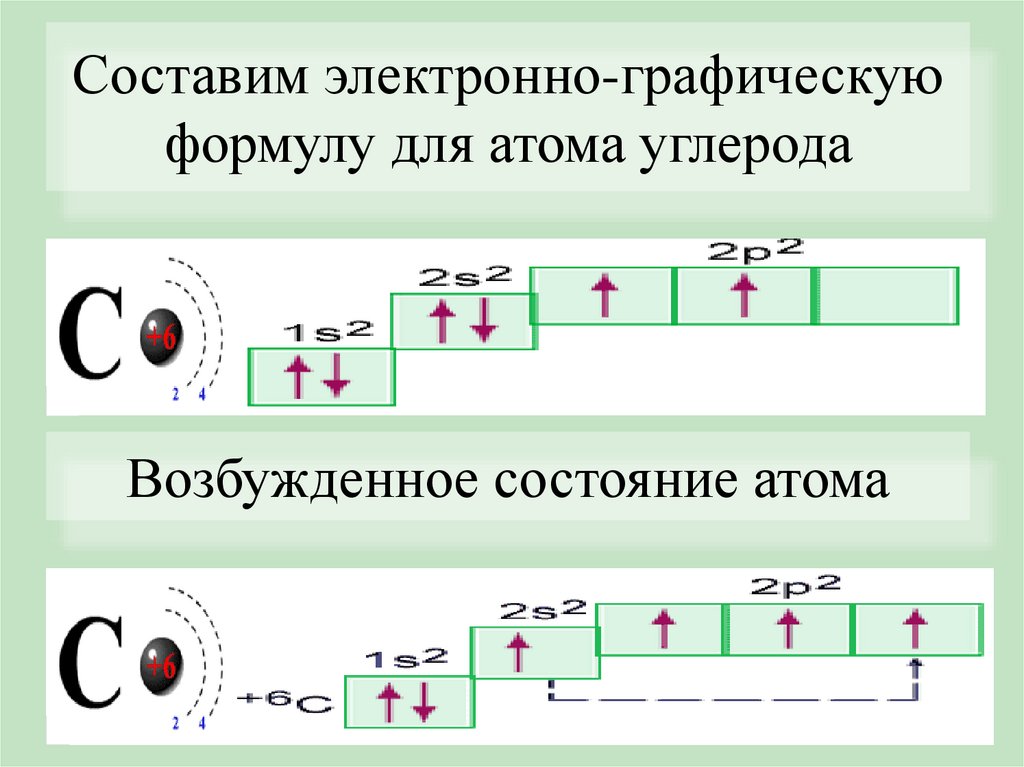
Составим электронно-графическуюформулу для атома углерода
Возбужденное состояние атома
15.
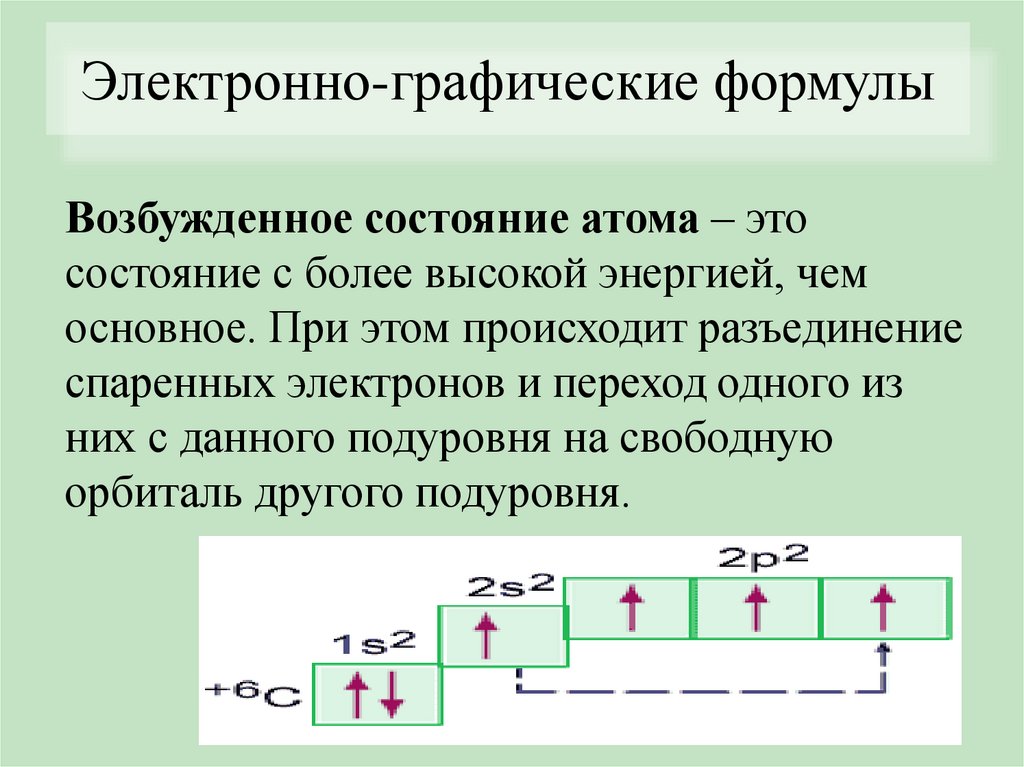
Электронно-графические формулыВозбужденное состояние атома – это
состояние с более высокой энергией, чем
основное. При этом происходит разъединение
спаренных электронов и переход одного из
них с данного подуровня на свободную
орбиталь другого подуровня.
16.
Гибридизация и ее типыГибридизация – это смешение атомных
орбиталей различного типа, в результате
которого образуется одинаковые по форме и
энергии орбитали.
Типы гибридизации
3
SP
2
SP
SP
17.
Типы химических связейобразуемых гибридными облаками
• Сигма - связь (σ)
• Пи - связь (π)
18.
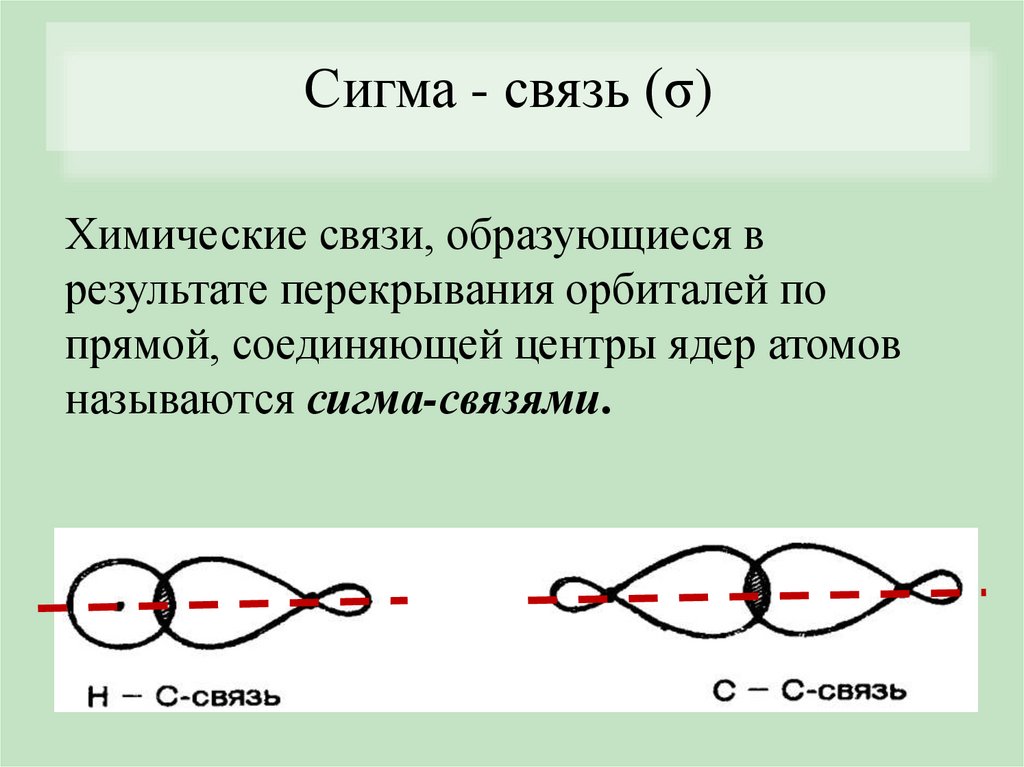
Сигма - связь (σ)Химические связи, образующиеся в
результате перекрывания орбиталей по
прямой, соединяющей центры ядер атомов
называются сигма-связями.
19.
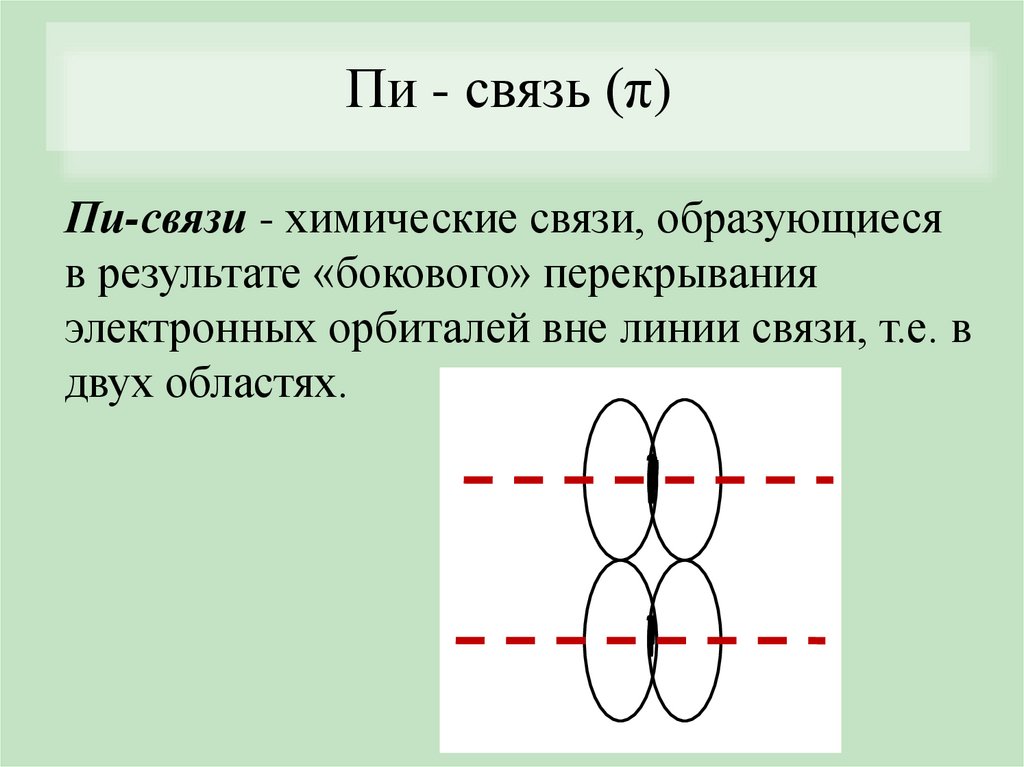
Пи - связь (π)Пи-связи - химические связи, образующиеся
в результате «бокового» перекрывания
электронных орбиталей вне линии связи, т.е. в
двух областях.
20.
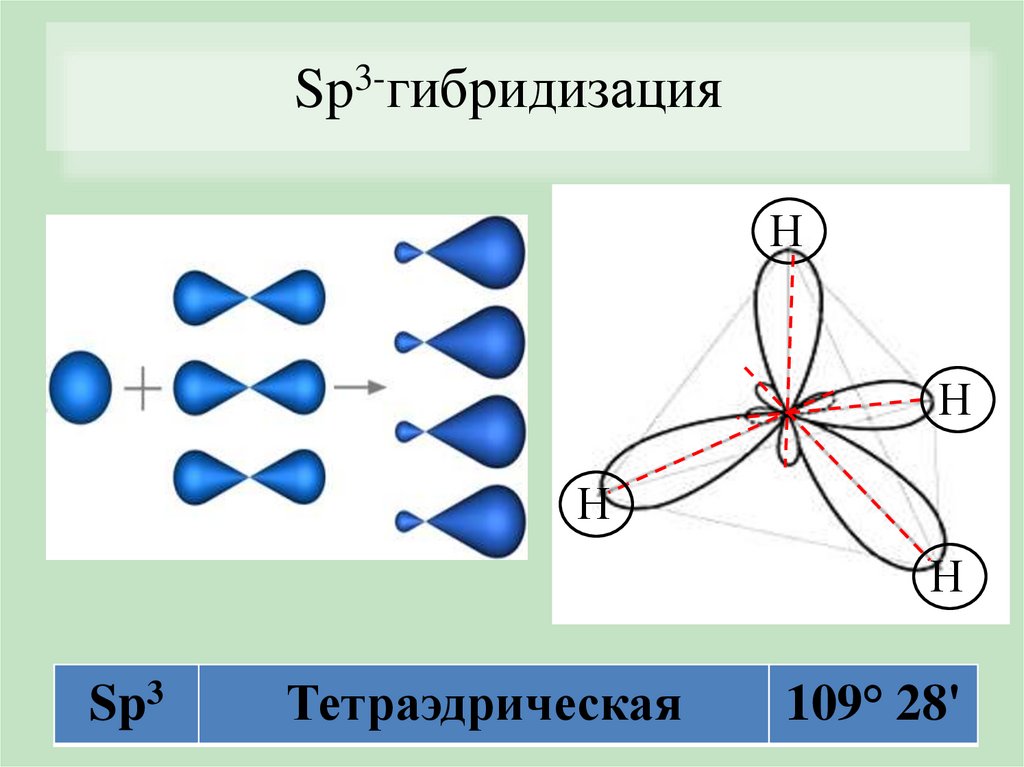
Sp3-гибридизацияН
Н
Н
Н
Sp3
Тетраэдрическая
109° 28'
21.
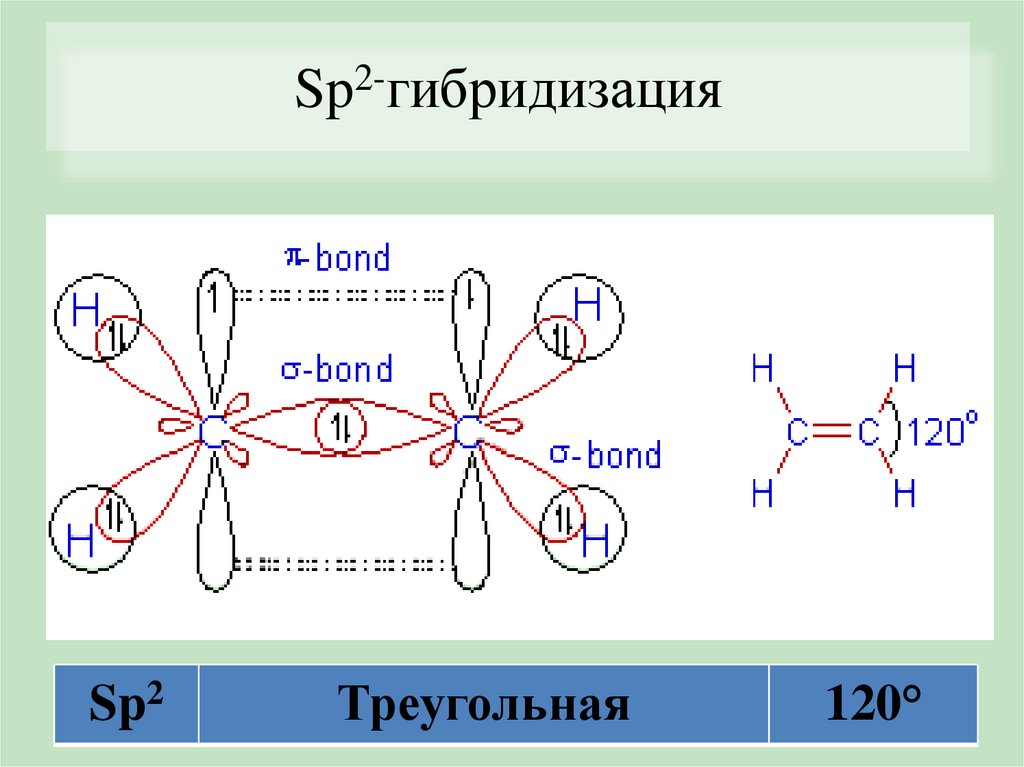
Sp2-гибридизацияSp2
Треугольная
120°
22.
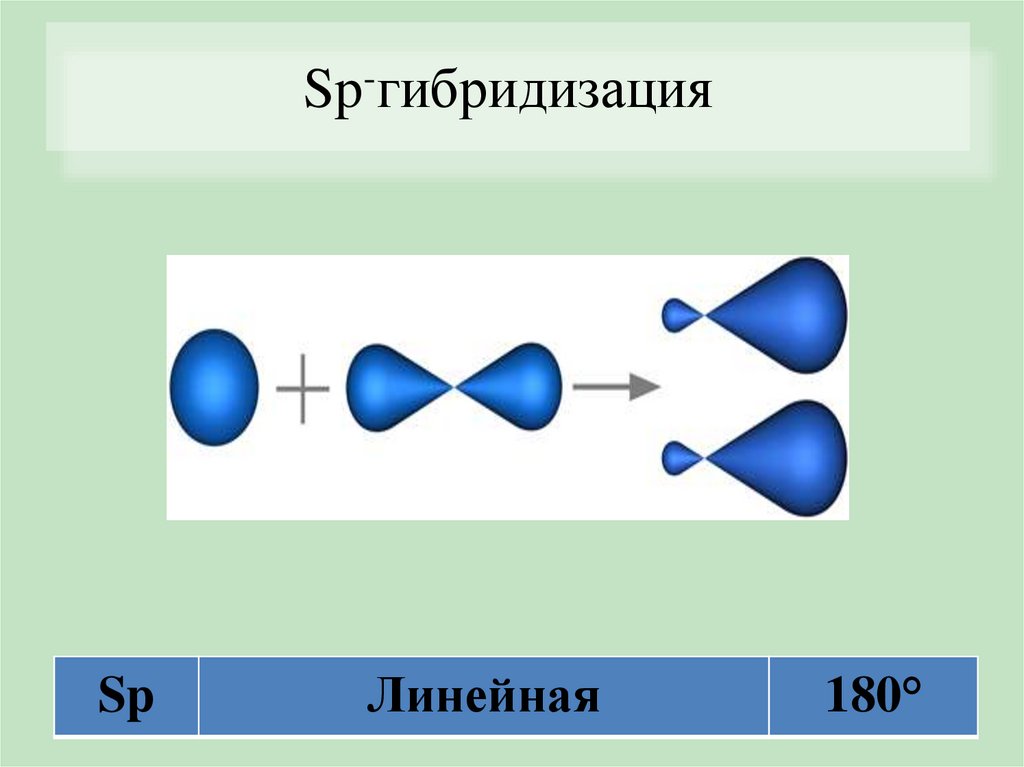
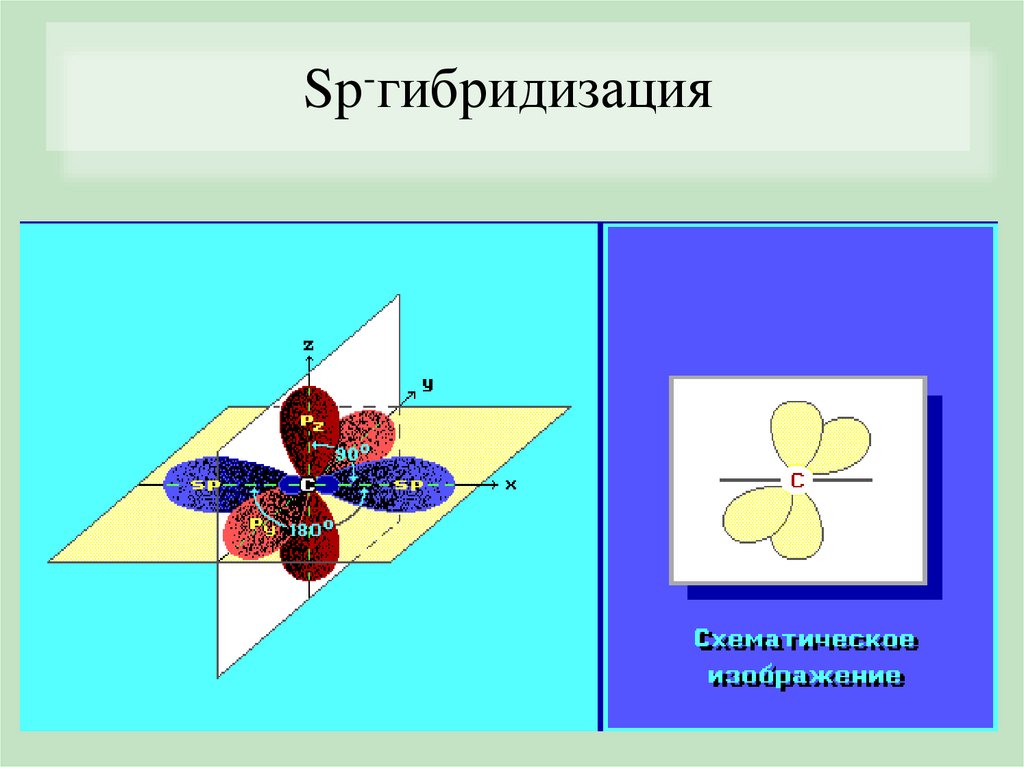
Sp-гибридизацияSp
Линейная
180°









 Химия
Химия








