Похожие презентации:
Вещества. Проверочный тест
1.
“В природе ничего другого нет,Ни здесь, ни там, в космических
глубинах.
Все от песчинок малых до планет
Из элементов состоит единых”
Степан Щипачев
2.
ПРОВЕРОЧНЫЙ ТЕСТЗадание : подбери соответствие.
1.Аргентум
2.Аурум
3.Гидраргирум
4.Силициум
5.Натрий
6.Плюмбум
7.Фосфор
8.Кальций
9.Купрум
10.Феррум
а) Ag
б) Cu
в) Fe
г) Cа
д) Na
е) Hg
ж) Pb
з) Р
и) Si
к) Au
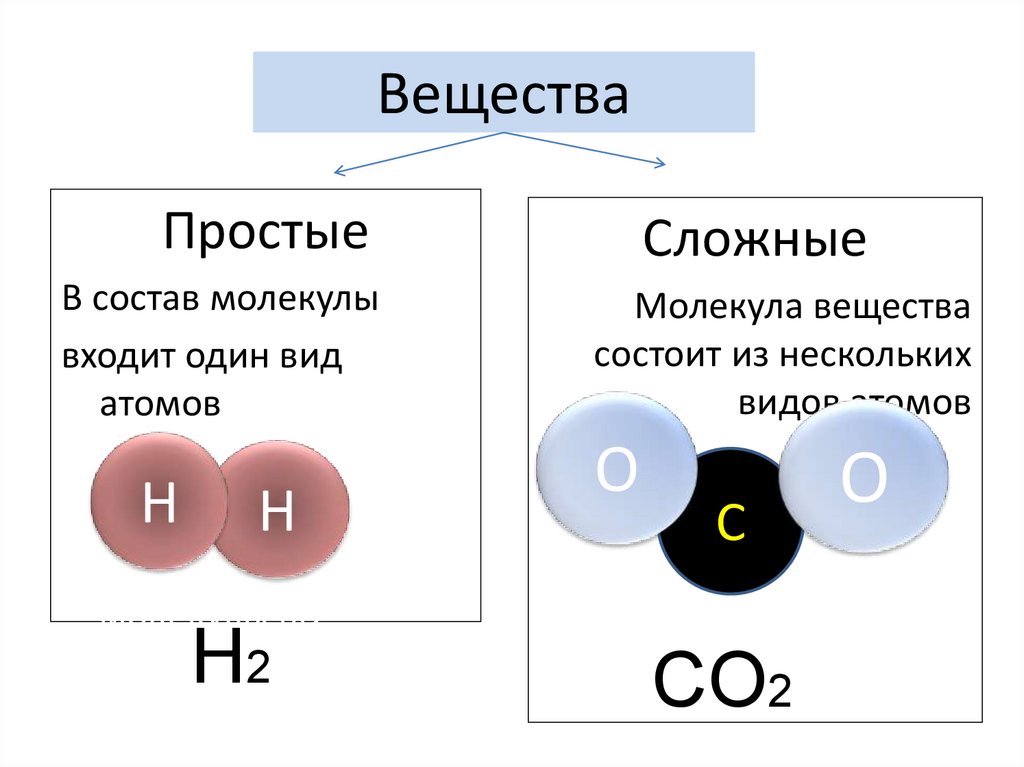
3. Вещества
ПростыеВ состав молекулы
входит один вид
атомов
H молекулы
H
• в состав
веществв состав
молекулы вD
• ещества 2
входит один
вид атомов
H
Сложные
Молекула вещества
состоит из нескольких
видов атомов
O
C
CO2
O
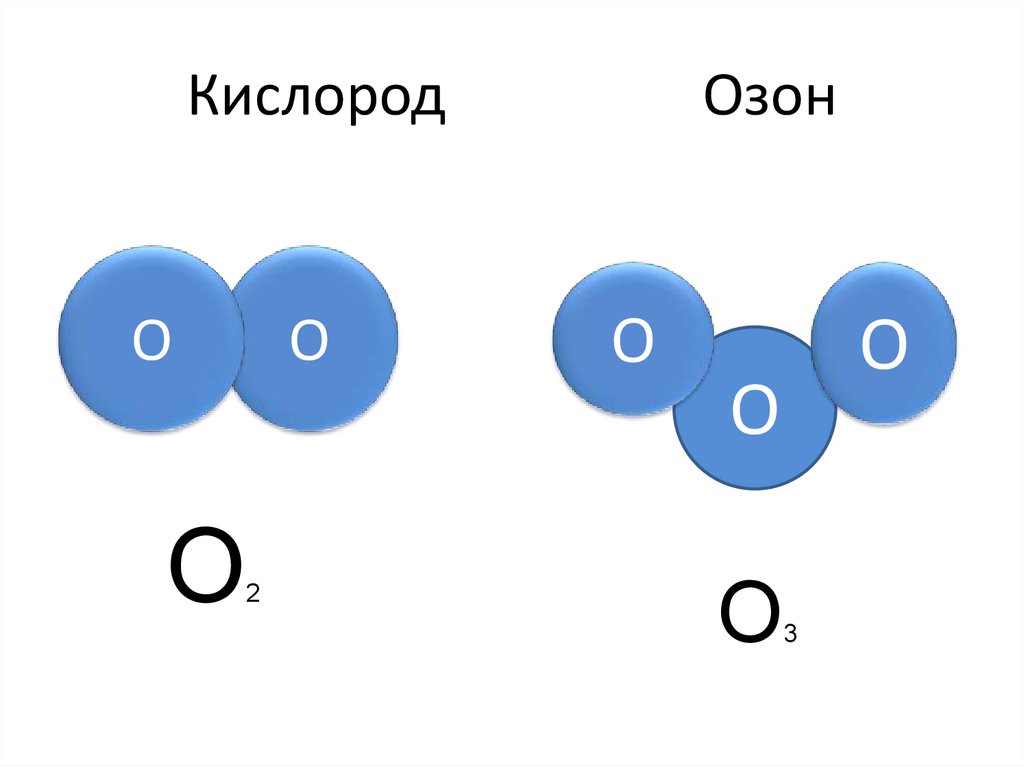
4. Кислород Озон
КислородO
O
O
2
Озон
O
O
O
O
3
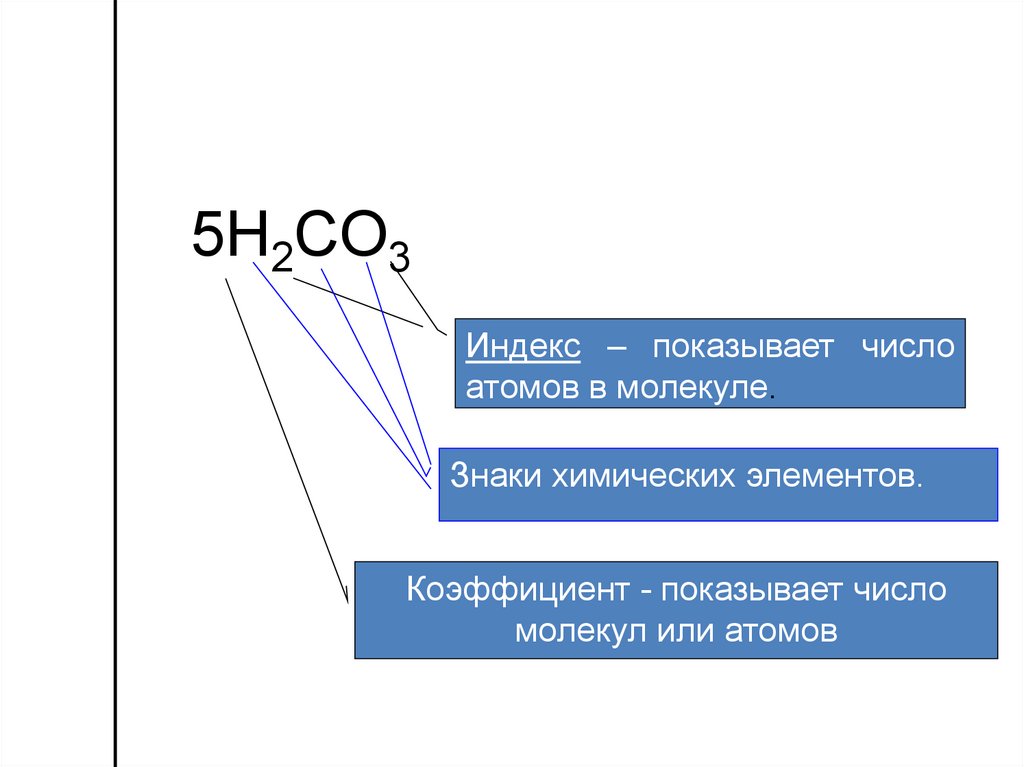
5.
5H2СO3Индекс – показывает число
атомов в молекуле.
Знаки химических элементов.
Коэффициент - показывает число
молекул или атомов
6.
• Химическая формула – этоусловная запись состава
вещества, посредствам
химических знаков и символов.
7.
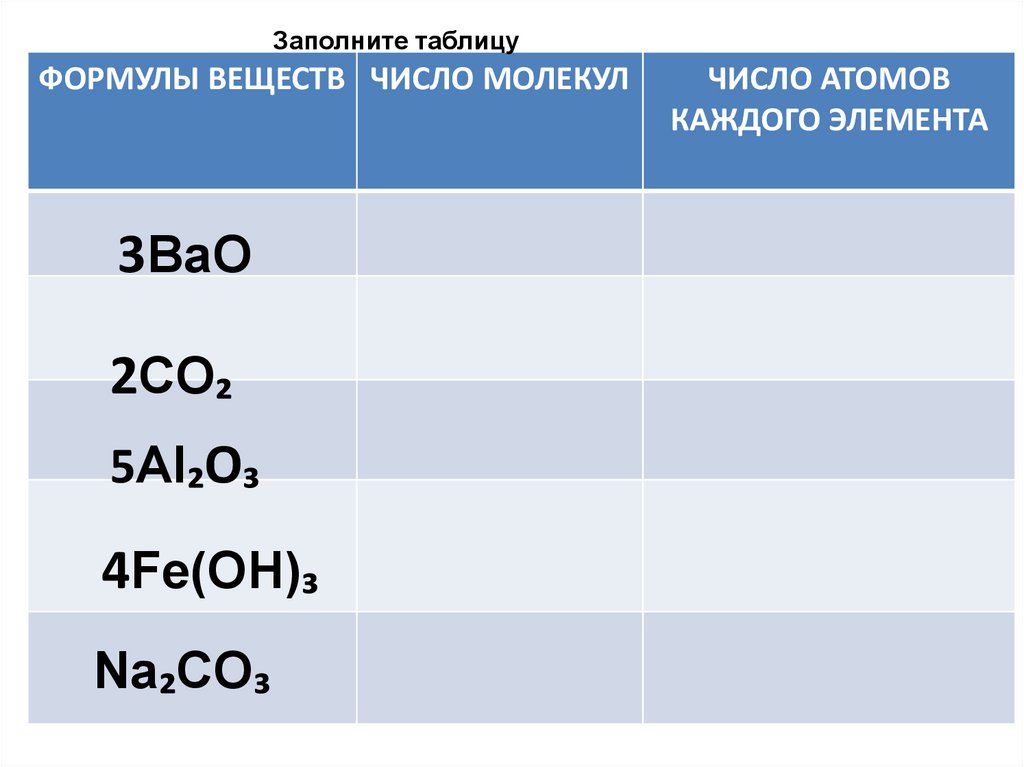
Заполните таблицуФОРМУЛЫ ВЕЩЕСТВ ЧИСЛО МОЛЕКУЛ
3BaO
2CO₂
5Al₂O₃
4Fe(OH)₃
Na₂CO₃
ЧИСЛО АТОМОВ
КАЖДОГО ЭЛЕМЕНТА
8. Относительная масса атома
• mат (Н) = 0,000 000 000 000 000 000 000 001674 г = 0,1674∙10-23 г• mат (О) = 0,000 000 000 000 000 000 000 026667 г = 2,6667∙10-23 г
• mат (C) = 0,000 000 000 000 000 000 000 01993 г = 1,993∙10-23 г
-Ar – относительная атомная масса
1 а.е.м. – величина равная 1/12 массы атома углерода.
1 а.е.м. = mат(C)/12 = 1,674 ∙ 10-24г
1а.е.м. = = 1,993∙10-23 г/ 12 = 1,674 ∙ 10-24г
• Относительная атомная масса – это величина,
показывающая, во сколько раз масса атома больше
1/12 массы атома углерода
9.
mат (Н) = 0,000 000 000 000 000 000 000 001674 г = 0,1674∙10-23 гmат (О) = 0,000 000 000 000 000 000 000 026667 г = 2,6667∙10-23 г
mат (C) = 0,000 000 000 000 000 000 000 01993 г = 1,993∙10-23 г
2,6667 10 г
16
Аr(О) =
- 23
0,1674 10 г
-23
1,993 10-23 г
12
Аr(C) =
- 23
0,1674 10 г
10.
II. Нахождение Ar с помощью периодическойсистемы.
Правила округления:
- если после запятой стоит цифра меньше 5, то число остается без
изменения.
- если после запятой стоит цифра 5 или больше 5 , то число
увеличивается на единицу.
Пример:
Fe
Ar(Fe)=56
55,847
Cu
63,546
Pb
Ar(Pb)=207
207,19
Ar(Fe)=64
Ag
107,868
Ar(Ag)=108
11.
Мr(Н2О) = 2∙Ar(H) + A r(O) = 2∙1 + 16 = 18Мr(Н2SО4) = ?
Мr(Ca(OH)2 = 40 + 2(16 +1) = 74
Mr(Ca(OH)2 = 40 + 16 ∙2 +1 ∙2 =74
Мr(СuOH)2CO3 = ?
Мr(HNO3) = ?
12. !!!!Домашнее задание
• 1.Прочитать § Химическиеформулы.Относительная
атомная и молекулярная массы
• 2 Выписать определение из
презентации (слайд № 3,6)
• 3 Выполнить задания в тетради
(слайд № 7,11)








 Химия
Химия








