Похожие презентации:
Строение атомов химических элементов и природа химической связи
1.
ХИМИЯ2.
3.
Химия — естественная наука,вещества и их превращения.
которая
изучает
Разделы химии:
Неорганическая химия или её ещё называют химия неживой
природы. Предмет изучения - химические элементы и их соединения;
Биохимия изучает процессы, которые происходят в организмах при
обмене веществ, дыхании и т. д.;
Органическая химия по- другому называют
«химия соединений углерода» или «химия углеводородов и их
производных»;
Физическая химия рассматривает закономерности реакций;
Аналитическая химия, благодаря качественному и количественному
анализу позволяет исследовать смеси.
4.
5.
https://www.youtube.com/watch?v=i9hhPBAV4E6.
Химический язык – система условныхобозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Химические знаки (химические символы) буквенные
обозначения
химических
элементов. Состоят из первой или из первой и
одной из следующих букв латинского названия
элемента.
Символ химического элемента – условное
обозначение химического элемента.
7.
Атом – это электронейтральная частица,состоящая из положительно заряженного
ядра и отрицательно заряженных
электронов. Атом- носитель свойств
химического элемента.
Абсолютно каждый атом имеет положительно заряженное ядро и,
вращающиеся вокруг него, отрицательные электроны. Атом не имеет
никакого заряда, иными словами, нейтрален.
8.
ИСамое тяжёлое в атоме – это ядро —
положительно заряженная часть атома,
состоящая из протонов (имеют заряд +)
нейтронов (заряд 0).
9.
Протоны — это частицы с положительнымзарядом +1 (в условных единицах) и
относительной массой, равной 1. Протон
обозначают латинской буквой р (или +1р).
Нейтроны — это электронейтральные
(незаряженные) частицы с относительной
массой, также равной 1. Нейтрон обозначают латинской буквой п (или 0n).
Следовательно, положительный заряд ядра равен числу протонов.
Электроны (обозначают е-) — это частицы с отрицательным зарядом -1 (в
условных единицах) и относительной массой, равной массы протона
Число протонов = число электронов = порядковому номеру химического
элемента.
10.
11.
Почему алхимики не смогли найтирецепт философского камня????
Запомните!
Количество
протонов
в
химическом
элементе, не изменяется в ходе химических
реакций.
12.
A(массовое число атома) = Z(атомныйномер элемента, заряд ядра, число протонов) +
N(число нейтронов)
A=Z+N
Из этой формулы следует:
N(число нейтронов) = A(массовое число атома) —
Z(атомный номер элемента, заряд ядра, число
протонов). )
N= A - Z
Запомните!
Массовое число атома А приблизительно (округлённо) равно
относительной атомной массе Аг. химического элемента.
Число нейтронов = Атомная масса (Ar) – Порядковый номер (N)
13.
14.
Изотопы — разновидности атомов какого-либохимического элемента, которые имеют одинаковый атомный
номер, но при этом разные массовые числа.
Запомните!
Изотопы одного и того же
химического элемента имеют
разную массу, так как в их атомных
ядрах содержится разное
количество нейтронов.
15.
Запомните!Изотопы одного и того же химического
элемента имеют разную массу, так как в их
атомных ядрах содержится
разное количество нейтронов.
16.
Запомните!Для изотопов водорода введены особые
названия.
Химический элемент водород представлен
тремя изотопами:
Протий: +11 H (e-= 1; p+= 1; n0 = 1-1 = 0)
Дейтерий: +12Н (e-= 1; p+= 1; n0 = 2-1 = 1)
Тритий: +13Н (e-= 1; p+= 1; n0 = 3-1 = 2)
17.
ХимическийХимический элемент
элемент —
— это
это совокупность
совокупность атомов
атомов
сс одинаковым
одинаковым зарядом.
зарядом.
Формы(способы) существования элементов
18.
19.
По запасу энергии, электроны в атоме распределены по электроннымслоям – энергетическим уровням. Количество энергетических
уровней соответствует номеру периода в ПСХЭ Д.И. Менделеева.
Максимальное число электронов на уровне определяется формулой:
N=2n2,
где N – максимальное число электронов, а n – номер энергетического
уровня.
Исходя из данной формулы:
I уровень 2 × 12 = 2.
III уровень 2 × 32 = 18.
II уровень 2 × 22 = 8.
IV уровень 2 × 42 = 32.
Следует помнить, что последний уровень является внешним.
20.
Схема написания атома по энергетическим уровням21.
Схема написания атома по энергетическим уровням22.
Правила составления электронных конфигураций атомовСперва следует заполнить орбитали с наименьшей энергией, и только
после переходить к энергетически более высоким
На орбитали (в одной "ячейке") не может располагаться более двух
электронов
Орбитали заполняются электронами так: сначала в каждую ячейку
помещают по одному электрону, после чего орбитали дополняются еще
одним электроном с противоположным направлением
Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d
→ 4p → 5s → 4d → 5p → 6s
23.
24.
—+
+
Электроны
—
+
—
Количество электронов на внешнем (валентном)
уровне - это число электронов на наивысшем
энергетическом уровне, которого достигает элемент.
Такие электроны называются валентными: они
могут быть спаренными или неспаренными.
25.
O SOВалентность — это число химических
связей, которые данный атом может образовать с
другими атомами. Зная валентность химических
элементов, можно составлять формулы веществ.
26.
Выделяют две группы:с постоянной и переменной валентностью
Элементы
с постоянной валентностью
Элемент
H, F, Li, Na, K, Ag
O, Be, Mg, Ca, Ba, Zn
Al
Валентность
I
II
III
27.
Правило вычисления переменной валентностивысшая валентность для элементов главных подгрупп
совпадает с номером группы (№ гр);
низшая валентность вычисляется по формуле: 8 − № гр;
промежуточная валентность — число между низшей и
высшей валентностью. Обычно промежуточные
валентности соответствуют четности группы.
28.
29.
Все возможные переменные валентности длянекоторых химических элементов.
Элемент
C, Si
N
P
S
Cl, Br, I
Fe
Cu
Валентность
II, IV
I, II, III, IV
III, V
II, IV, VI
I, III, V, VII
II, III
I, II
30.
Алгоритм для составления формул бинарныхсоединений по валентности элементов
1. Записываем символы элементов в нужном
порядке и обозначаем их валентность.
III II
Al, O
IV II
С, S
2. Вычисляем наименьшее общее
кратное(НОК) для значений валентностей
элементов.
НОК
(III и II) = 6
НОК
(IV и II) = 4
3. Число атомов данного элемента равно
отношению НОК к валентности этого
элемента.
6: III = 2 (Al)
6: II = 3 (O)
4: IV= 1 (С)
4: II = 2 (S)
Записываем полученные индексы после
символов элементов.
III II
Al2 O3
IV II
С S2
31.
—+
+
Электроны
—
+
—
Химическая связь — это связь между
атомами, осуществляемая в молекулах и
кристаллах вещества с помощью энергии
электронов, входящих в состав атомов.
32.
Как понятно из определения химической связи, привзаимодействии двух атомов один из них может притянуть
к себе внешние электроны другого. Эта способность называется
электроотрицательностью (ЭО).
33.
Ряд химических элементов, расположенных всоответствии с уменьшением их
электроотрицательности
F→ O→ N → CI → Br → I → S → C → Si →P → H
С уменьшением электроотрицательности
уменьшаются и способность атома смещать общую
электронную пару ближе к своему ядру.
34.
Существует два механизма взаимодействия атомовобменный — предполагает выделение по одному внешнему
электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом
(донор) выделяет два электрона, а второй атом (акцептор)
принимает их на свою свободную орбиталь.
Образование химической связи сопровождается выделением
энергии!!!
35.
Основные виды химических связейКовалентная
неМе+неМе
Ионная
Ме+неМе
Металлическая
Ме+Ме
связь между
атомами за счёт
связь между
атомами за счёт
общих
электронных пар
связь между
атомами
элементов
металлов
общих
электронных пар
36.
Ковалентная связьПолярная
Неполярная
осуществляется
между разными
атомами
химических
элементов
осуществляется
между атомами
одинаковых
химических
элементов
37.
Молекула водородаКовалентная неполярная связь образуется между
одинаковыми атомами элементов-неметаллов
38.
НFфтороводород
Полярная ковалентная связь может образовываться
только между атомами разных элементов-неметаллов.
39.
ИТОГ ЗАНЯТИЯРассмотрели современную модель атома, узнали, что
заначит понятие «Символический язык химии», научились
составлять электронную конфигурацию атома разными
способами, вспомнили, что такое химический элемент,
научились классифицировать химические элементы по
энергетическим уровням, различать виды химических
связей и попрактиковались в решении задач на валентность.
40.
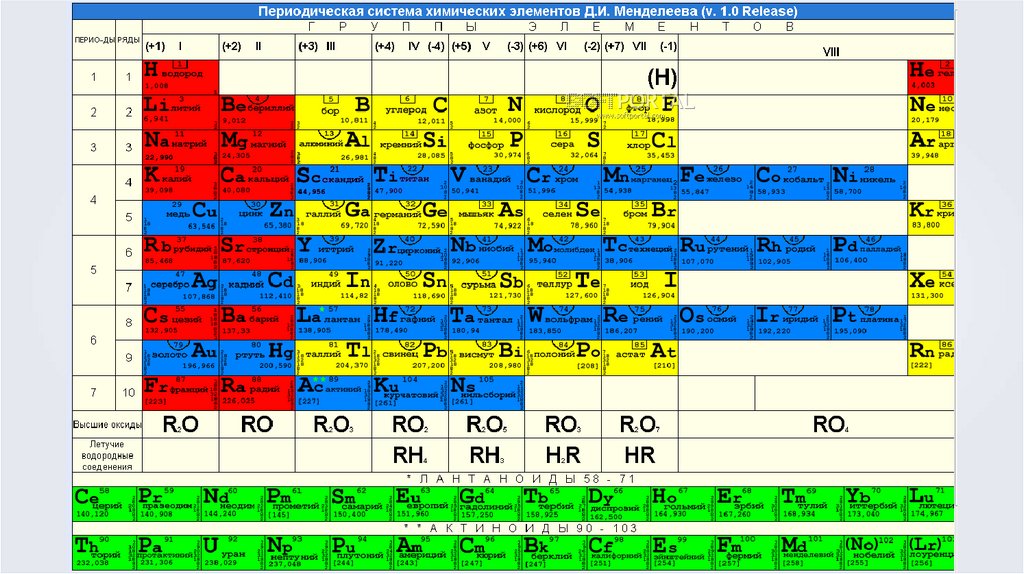
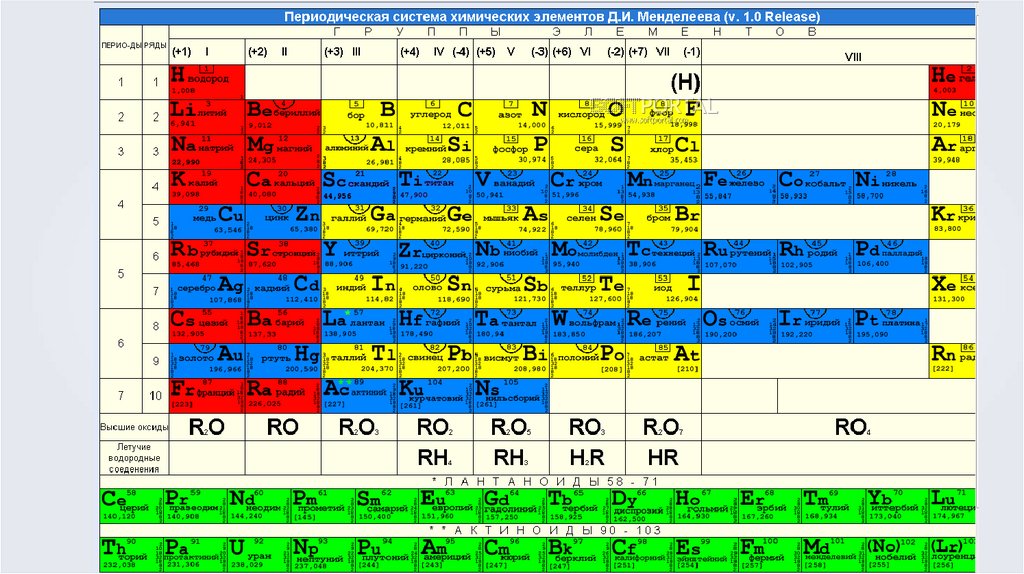
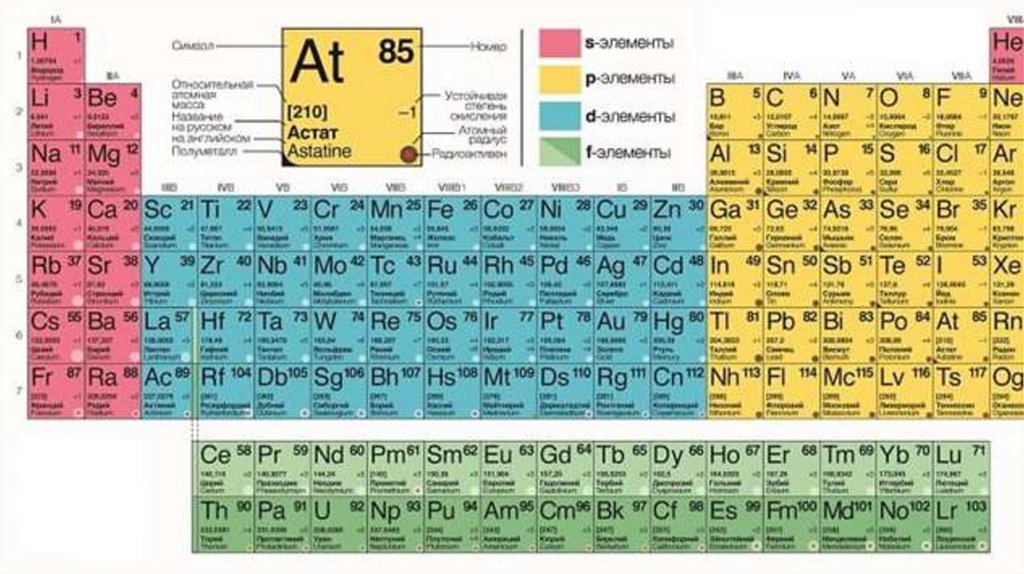
На занятии понадобится:Таблица ПСХЭ Д.И. Менделеева
Тетрадь для лекций
Тетрадь для проверочных работ -12 л.
41.
ДОМАШНЕЕ ЗАДАНИЕ1.
2.
3.
4.
5.
6.
7.
8.
9.
Какие существуют разделы химии, что они изучают.
Строение атома.
Правила составления электронных конфигураций атомов.
Как узнать высшую и низшую валентность какого-либо химического
элемента?
Правило вычисления переменной валентности.
Алгоритм для составления формул бинарных соединений по валентности
элементов.
В каком случае ковалентная связь будет полярной, а в каком — неполярной?
Какие элементы взаимодействуют в молекуле вещества в ходе образования
металлической связи?
Назовите характеристики ионной связи.






































 Химия
Химия