Похожие презентации:
Строение атома, химические связи
1.
Строение атома, электроннаяконфигурация, химические связи
2.
Химия•Наука о веществах и их
превращениях.
3.
Творение 1-го дня. МирозданияМатерия
Пространство
Информация
Энергия
Время
4.
Атомы под электронныммикроскопом
5.
Сканирующий туннельный микроскоп6.
7.
8.
Молекулы под электронным микроскопоммолекула ламинина
молекула пентацена
Одна капля воды (1 миллилитр, 0,01 г) содержит 3,37•1020 молекул воды.
9.
Строение атома-
+
Ядро
Электронное
облако
10.
Ядро составляет массу атомаПротоны p+
Нейтроны
n0
Масса атома в граммах крайне
мала, поэтому пользуются
относительной атомной массой.
Масса атома железа равна 9,3•10-23
г.
Масса электрона меньше нейтрона
в 1839 раз.
11.
Количество протонов в атоме равно количеству электронов,поэтому атом электрически нейтрален.
Количество протонов определяет порядковый номер
элемента.
1. Водород H
2. Гелий He
3. Литий Li
12.
13.
14.
Ядерная энергия15.
Радиоактивный распад16.
17.
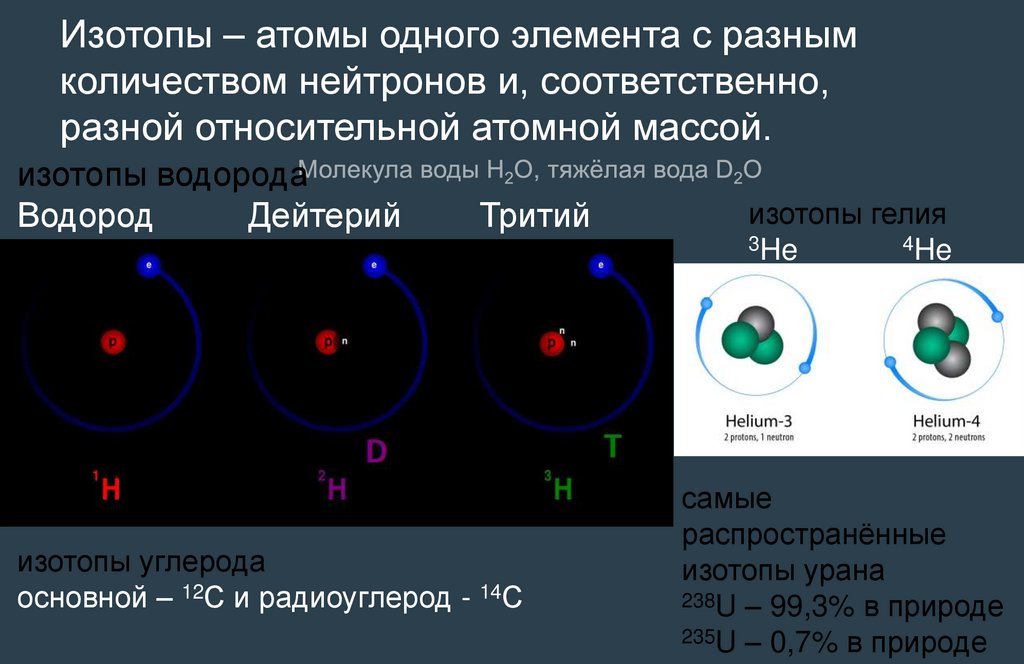
Изотопы – атомы одного элемента с разнымколичеством нейтронов и, соответственно,
разной относительной атомной массой.
изотопы водорода
Водород
Дейтерий
Тритий
изотопы углерода
основной – 12С и радиоуглерод - 14С
изотопы гелия
3He
4He
самые
распространённые
изотопы урана
238U – 99,3% в природе
235U – 0,7% в природе
18.
В природе встречается 92,7%изотопа 7Li и 7,3% изотопа 6Li.
Относительная атомная масса
лития =
6,93
=
19.
Электронные облака. ОрбиталиЭлектроны eЭлектроны отвечают за связь с другими
атомами.
Испускают излучение.
На каждой орбитали размещаются 2 электрона.
20.
21.
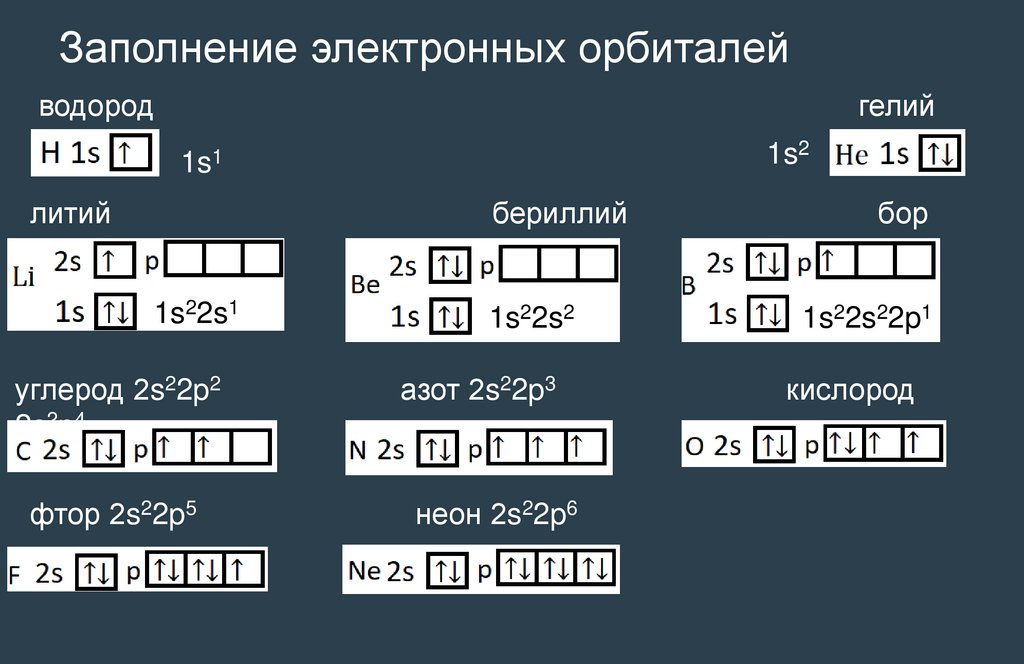
Заполнение электронных орбиталейгелий
водород
1s2
1s1
1s22s1
1s22s2
1s22s22p1
22.
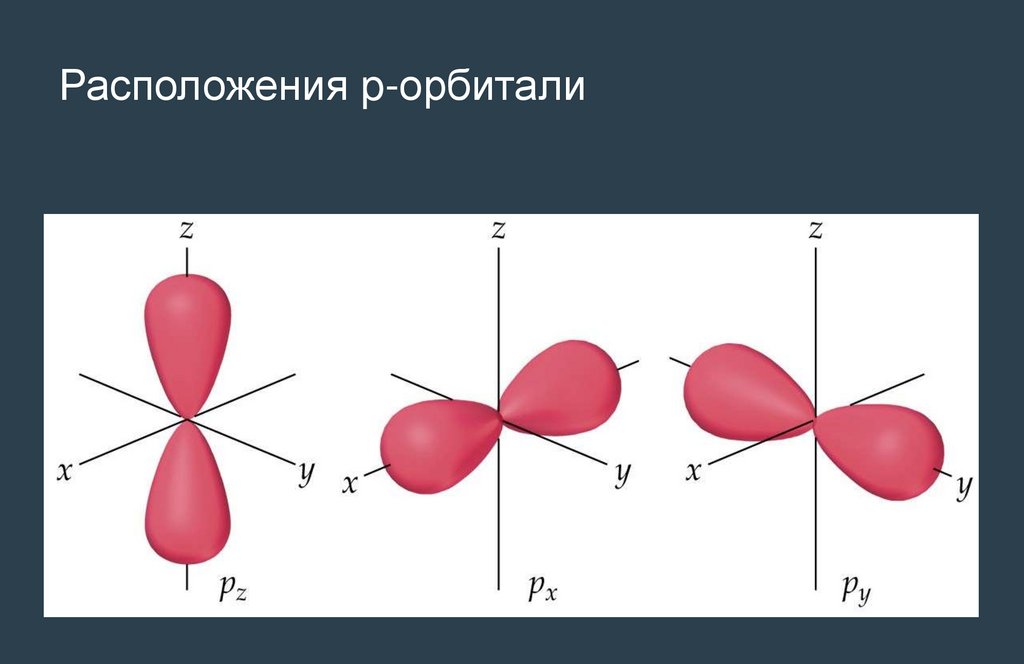
Расположения p-орбитали23.
Заполнение электронных орбиталейгелий
водород
1s2
1s1
литий
бериллий
бор
1s22s1
1s22s2
1s22s22p1
углерод 2s22p2
2s2p4
азот 2s22p3
кислород
фтор 2s22p5
неон 2s22p6
24.
25.
Заполнение электронных орбиталей у атоманатрия
26.
27.
28.
Расположения d-орбитали29.
Конфигурация внешнего уровня: 3d24s230.
Проскок (провал) электронаХром Cr 3d54s1
Медь Cu 3d104s1
31.
Проскок e- есть у 24Cr, 29Cu, 41Nb, 42Mo, 44Ru,45Rh, 47Ag, 78Pt, 79Au.
32.
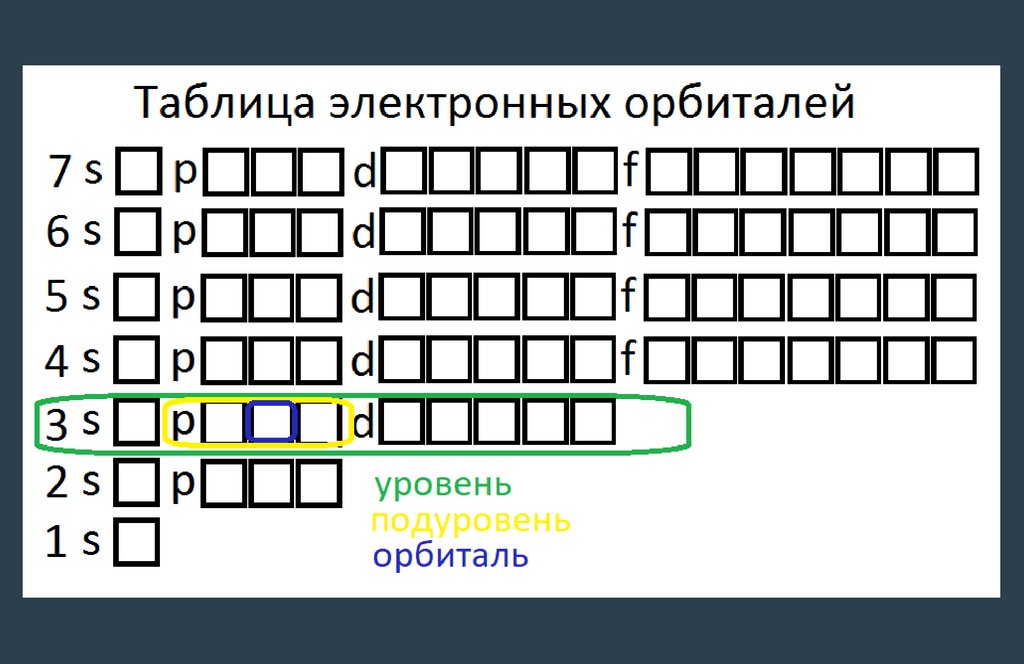
Порядок заполнения электронныхподуровней
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f
33.
34.
Появление света35.
Свечение лампочки36.
Химические связиОкисление – отдача электронов.
Восстановление – принятие e-.
Окислитель отбирает электроны.
Восстановитель отдаёт электроны.
37.
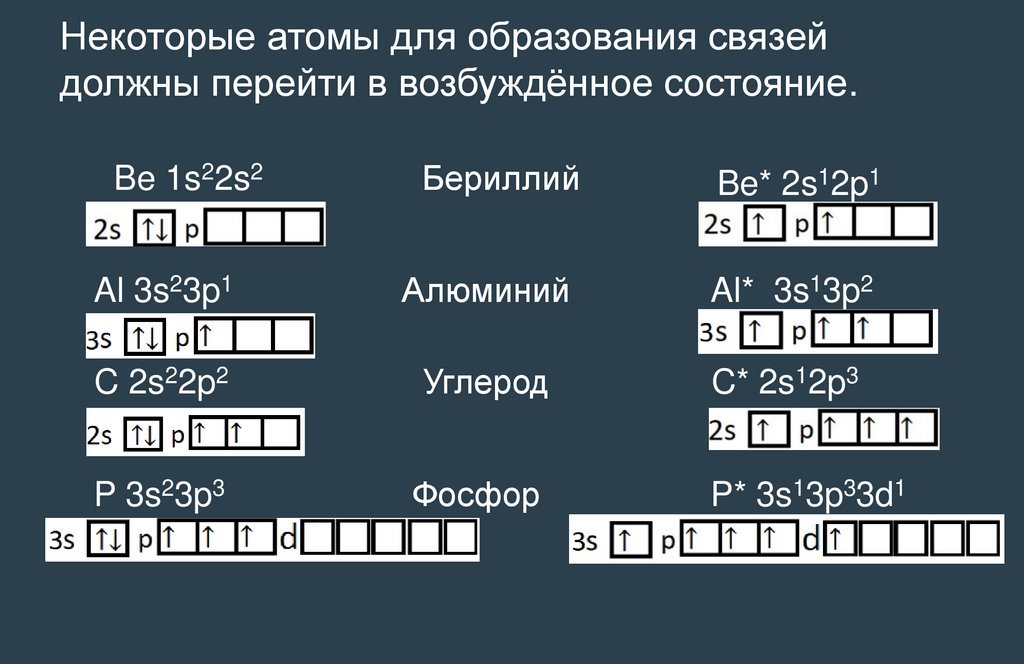
Некоторые атомы для образования связейдолжны перейти в возбуждённое состояние.
Be 1s22s2
Бериллий
Be* 2s12p1
Al 3s23p1
Алюминий
Al* 3s13p2
C 2s22p2
Углерод
C* 2s12p3
P 3s23p3
Фосфор
P* 3s13p33d1
38.
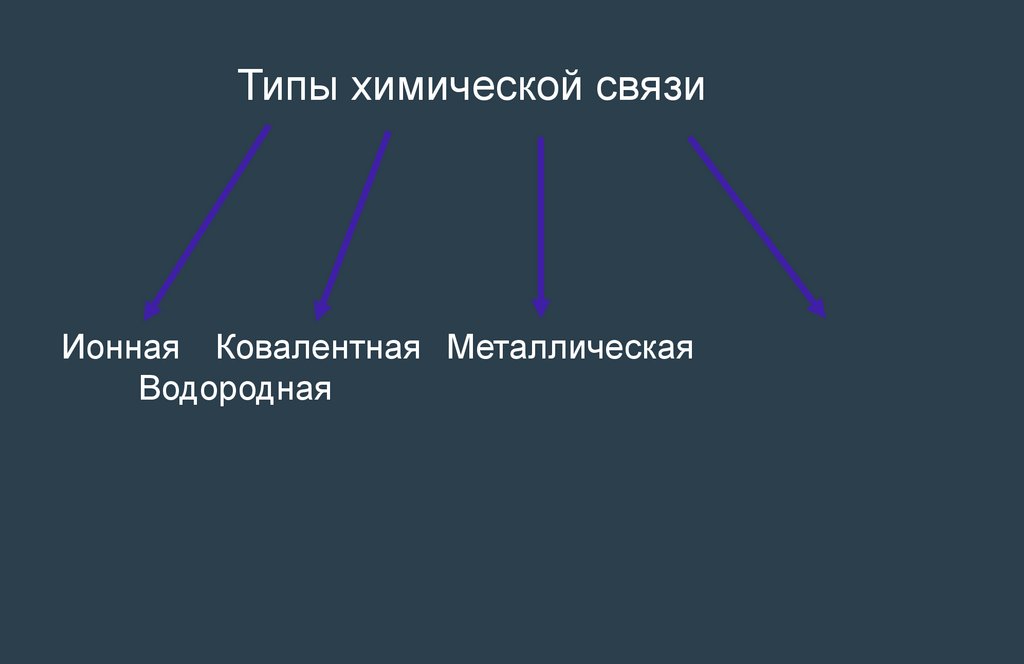
Типы химической связиИонная Ковалентная Металлическая
Водородная
39.
Ионная связьСвязь между металлом и неметаллом.
Металл полностью отдаёт электрон, неметалл полностью
забирает e-.
У металла степень окисления положительная, т.к. p+ > e-,
У неметалла степень окисления отрицательная, т.к. e- > p+.
Ионы – заряженные частицы, в которых p+ ≠ e.
Катионы – положительно заряженные ионы.
Анионыв–paint.
отрицательно заряженные ионы.
Перейти
40.
41.
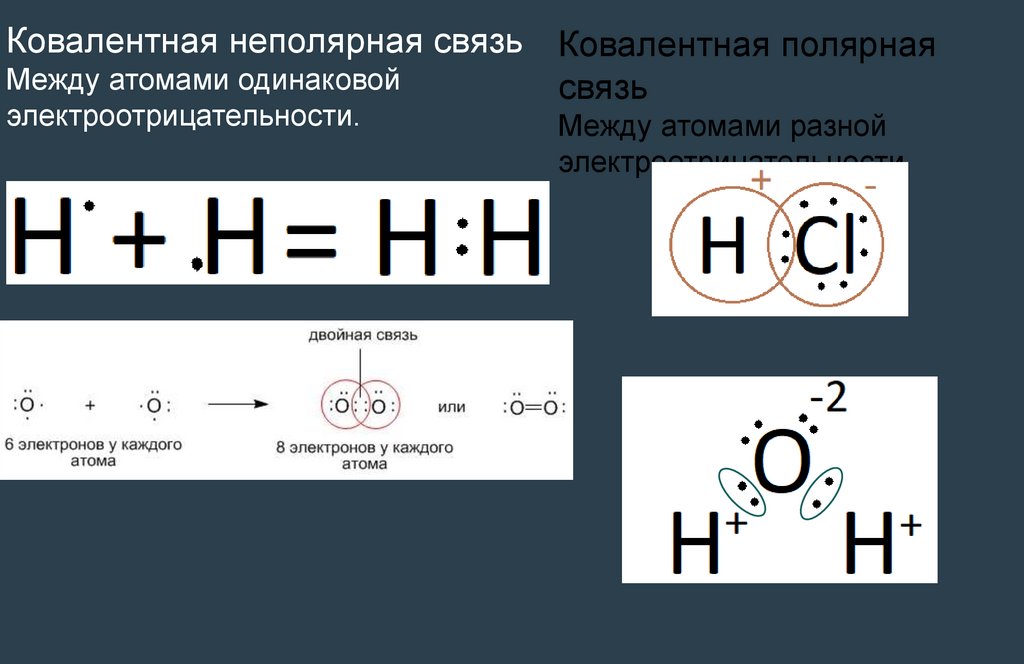
Ковалентная неполярная связь Ковалентная полярнаяМежду атомами одинаковой
связь
электроотрицательности.
Между атомами разной
электроотрицательности
42.
Донорно-акцепторный механизмМеталлическая связь – связь между
43.
Водородные связиОбразуются между атомом H и сильным
электроотрицательным атомом N, O, F. Примеры:
межмолекулярное взаимодействие воды H2O, аммиака NH3,
спиртов, внутримолекулярные связи в ДНК
(дезоксирибонуклеиновая кислота).












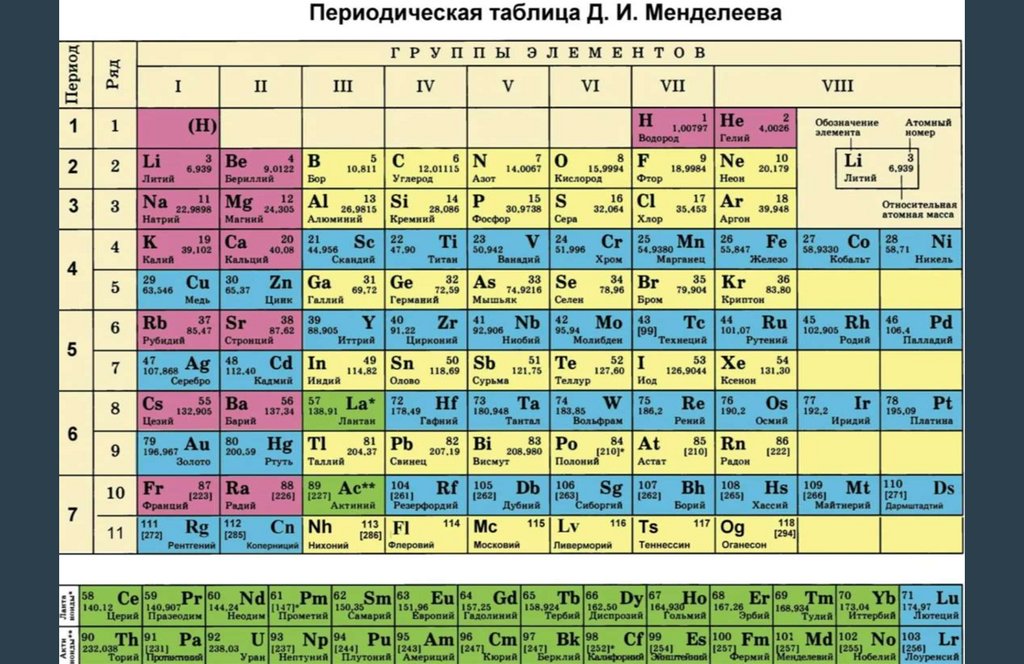


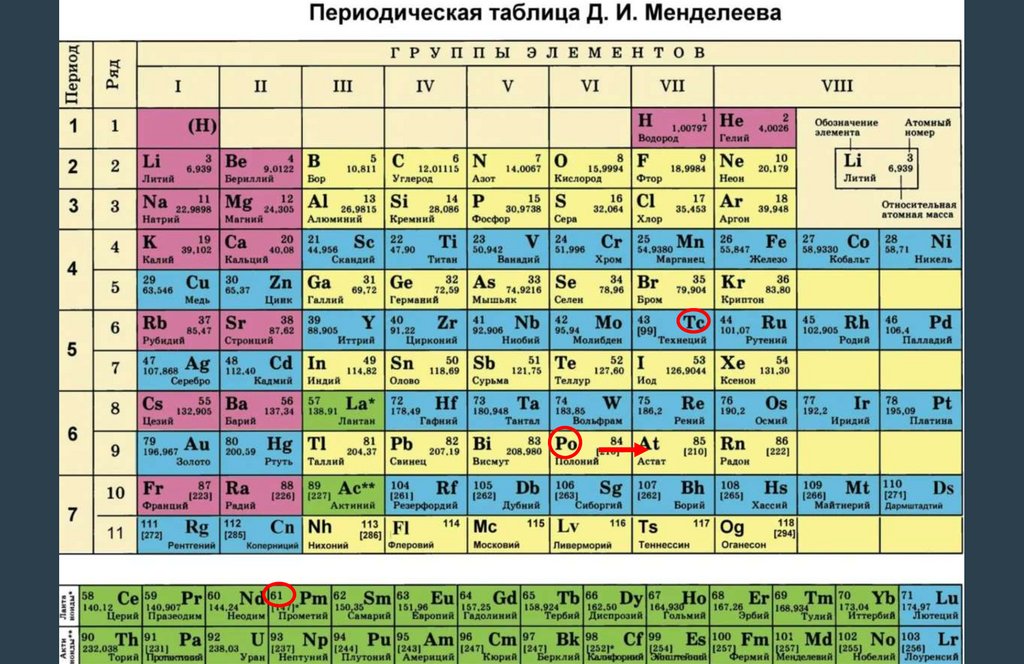




















 Химия
Химия