Похожие презентации:
Химические реакции. Явление - любое изменение
1. Химические реакции
2. Задачи урока:
Расширить и углубить знания о химическихреакциях.
2. Рассмотреть классификацию химических
реакций по различным признакам.
1.
3. Явление – любое изменение
Энергиякинетическая
потенциальная
внутренняя
4. К каким явлениям относятся данные превращения?
5. Химическая реакция (или химическое явление)
это процесс, в результатекоторого из одних веществ
образуются новые вещества.
6. РЕАКЦИИ ВОКРУГ НАС
В печени человека протекает около20 000 000 химических реакций
Ежесекундно в организме человека происходят сотни и тысячи
всевозможных реакций.
7. Признаки химических реакций
изменение цветаобразование(растворение
) осадка
изменение запаха
выделение (поглощение)
теплоты
выделение газа
8. Назовите химические процессы:
Скисание молока.Горение свечи.
Измельчение куска мела.
Испарение воды.
Ржавление железа
Брожение виноградного сока
Плавление воска.
Взбивание масла.
9. Историческая справка
В 1748 году сформулирован законсохранения массы веществ
«Все перемены, в натуре случающиеся,
такого суть состояния, что сколько
чего у одного тела отнимается,
столько присовокупится к другому»
М.В.Ломоносов
10.
«Масса веществ до реакцииравна массе веществ после
реакции»
М.В.Ломоносов
11. Уравнение химической реакции
NaOH + HCl = NaCl + H2O12. Классификация химических реакций
Число и состав реагентов.2. Изменение степеней окисления
элементов
3. Направление химической реакции.
4. Участие катализатора.
5. Тепловой эффект реакции.
6. Агрегатное состояние веществ.
1.
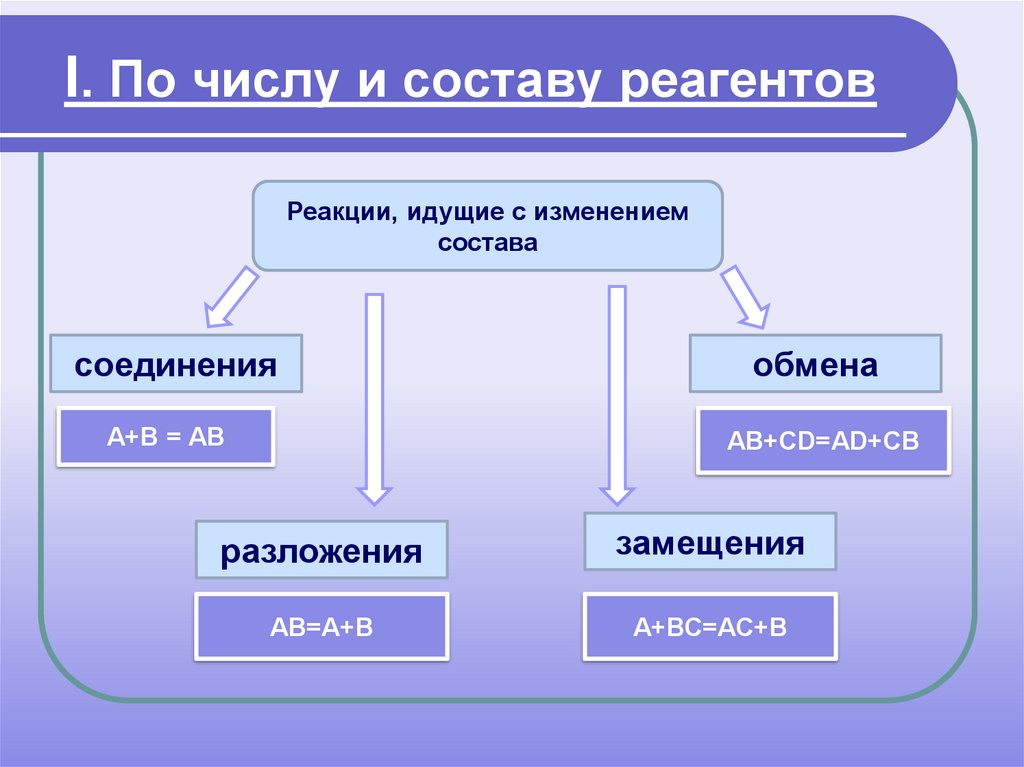
13. I. По числу и составу реагентов
Реакции, идущие с изменениемсостава
соединения
обмена
А+В = АВ
АВ+СD=АD+CВ
разложения
замещения
АВ=А+В
А+ВС=АС+В
14. II. По направлению процесса
1) необратимые - реакции,протекающие в одном
направлении.(→ или =)
2) обратимые - реакции,
протекающие в обоих
направлениях.(↔ или →
←)
15. III. По тепловому эффекту
1) экзотермические реакции( +Q)2) эндотермические реакции( -Q)
Подсказка: во всех реакциях +Q, кроме
реакций разложения (-Q)
16. IV. По изменению степеней окисления химических элементов
1) окислительно – восстановительные(ОВР), СО меняются в левой и правой
частях;
2) не окислительновосстановительные (не ОВР)
(С.О. – const)
17. V. По агрегатному состоянию реагентов
1) гомогенные реакции – одинаковыеагрегатные состояния (газ+газ; жид+жид)
2) гетерогенные реакции – разные
агрегатные состояния (газ+тв; газ+жид;
жид+тв; тв+тв)
Подсказка: в реакциях разложения
агрегатные состояния пишем у всех
веществ.
18. VI. По участию катализатора
1) каталитические (или слово «кат», илиформула над → или над =)
2) некаталитические
19. Основной вывод:
Независимо от того, между какимивеществами – органическими или
неорганическими – происходит
химическое превращение, для них
характерны одни и те же
закономерности.
20. Домашнее задание
Найти: 1) какие реакции называютсяреакциями соединения, разложения,
замещения, обмена;
2) кто такой катализатор?
3) на стр. 32 очень хорошо разобрать
характеристику х.р., записать в тетрадь
4) дать полную характеристику (шесть
пунктов) реакции (смотреть на следующем
слайде)




















 Химия
Химия








