Похожие презентации:
Химические свойства кислот в свете теории электролитической диссоциации
1.
ЭТИХ ВЕЩЕСТВ ОЧЕНЬ МНОГО НА СВЕТЕ,ИХ ОПАСАЮТСЯ ВЗРОСЛЫЕ, ДЕТИ!
ЕСЛИ НЕ ТАК ИХ СМЕШАЕШЬ С
ВОДОЙ,
МОЖЕТ ВСЕ ОБЕРНУТЬСЯ БЕДОЙ!
2.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ ВСВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ
ДИССОЦИАЦИИ
3.
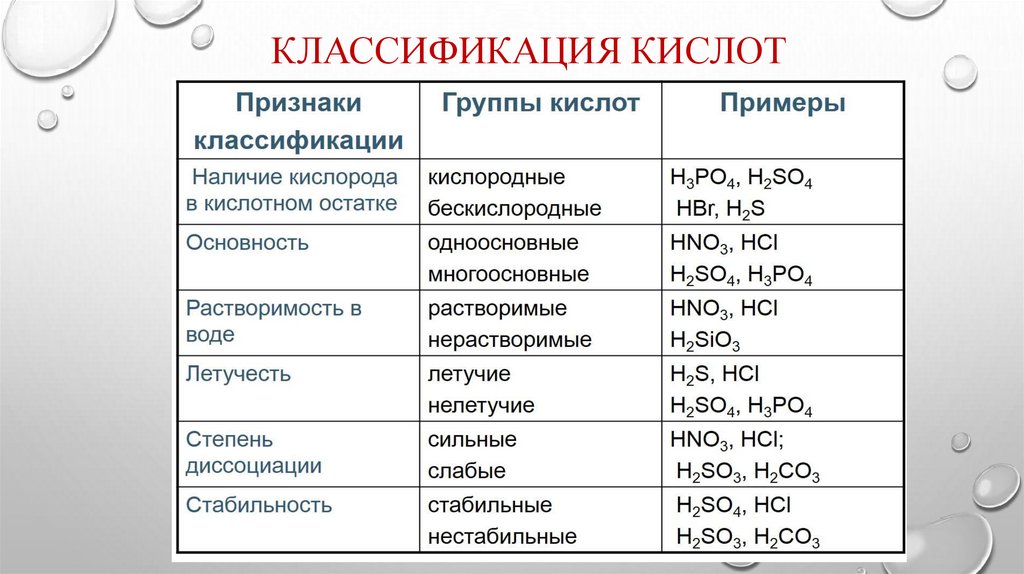
КЛАССИФИКАЦИЯ КИСЛОТ4.
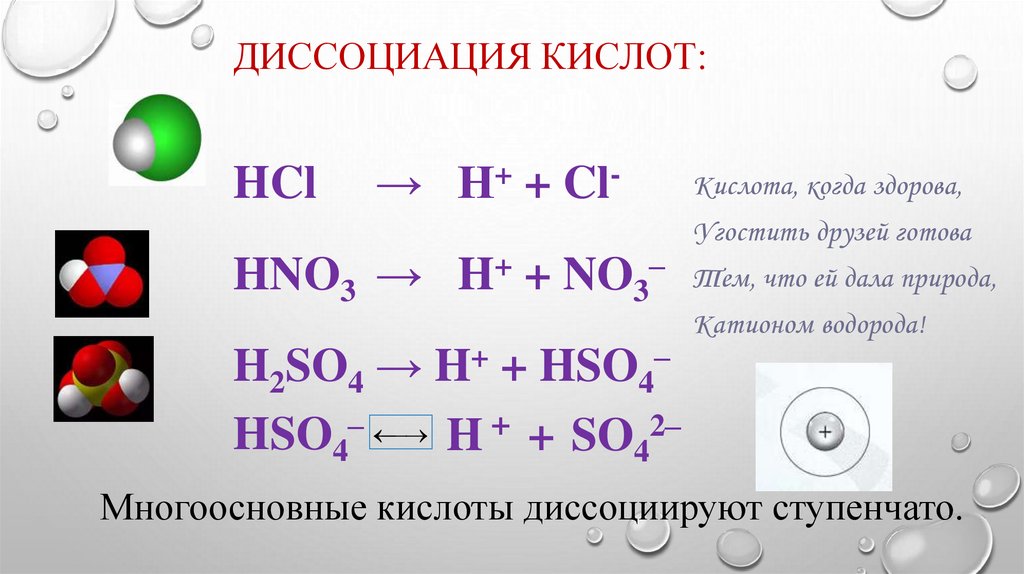
ДИССОЦИАЦИЯ КИСЛОТ:HCl
→ Н+ + Cl-
Кислота, когда здорова,
Угостить друзей готова
+
–
HNO3 → H + NO3 Тем, что ей дала природа,
Катионом водорода!
H2SO4 → H+ + HSO4–
+
–
HSO4
H + SO42–
Многоосновные кислоты диссоциируют ступенчато.
5.
ДИССОЦИАЦИЯ КИСЛОТ:Диссоциация многоосновной кислоты протекает главным образом по
первой ступени, в меньшей степени по второй и лишь в незначительной
степени по третьей.
I Н3РО4 = Н+ + Н2РО-4(первая ступень)
II Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень)
III НРО2-4 ↔ Н + + PОЗ-4 (третья ступень)
Поэтому в водном растворе, например, фосфорной
кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно
уменьшающихся количествах)
Н2РО-4, НРО2-4 и РО3-4.
6.
7.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ1. Изменение цвета универсального индикатора
в красный цвет.
8.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ2. Взаимодействие с Ме, стоящими в ряду
напряжений до водорода
(искл. H2SiO3, HNO3; образующаяся соль должна
быть растворима в воде):
Zn + HCl →
Ме + кислота → растворимая соль + Н2↑
9.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ3. Взаимодействие с оксидами металлов:
CaO + HNO3 →
оксид Ме + кислота → соль + вода
10.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ4. Взаимодействие с основаниями:
а) растворимыми:
NaOH + H2SO4 →
б) нерастворимыми:
Fe(OH)3 + H2SO4 →
основание + кислота → соль + вода
- реакция нейтрализации
11.
Химические свойства кислотПримеры
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3K+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3K+ + 3Cl—
Fe3+ + 3OH— = Fe(OH)3
ZnS + H2SO4 = ZnSO4 + H2S
ZnS + 2H+ + SO42— = Zn2+ + SO42— + H2S
ZnS + 2H+ = Zn2+ + H2S
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Na+ + [Al(OH)4]— + 4H+ + 4Cl— = Na+ + Cl— + Al3+ + 3Cl— + H2O
[Al(OH)4]— + 4H+ = Al3+ + 4H2O
12.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ5. Взаимодействие с солями (реакция осуществима,
если в результате выпадает осадок или выделяется
газ):
BaCl2 + H2SO4 →
Na2CO3 + HCl →
соль + кислота → новая соль + новая кислота
13.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ6. Нерастворимые кислоты при нагревании
разлагаются:
t
H2SiO3 →
кислота → оксид неметалла + вода
14.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ7. Реакции этерификации – образование сложных эфиров
при взаимодействии спиртов с кислородсодержащими
неорганическими и органическими кислотами
этиловый эфир азотной кислоты
уксусноэтиловый эфир
15.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ8. Окислительные свойства кислот проявляются при взаимодействии кислот с
металлами. Взаимодействие азотной и серной кислот с металлами.
При взаимодействии концентрированной кислоты с неактивными
металлами и металлами средней активности азотная кислота
восстанавливается до оксида азота (IV) NO2:
Cu+ 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
При взаимодействии разбавленной азотной кислоты с металлами выделяется
оксид азота (II) :
3Cu+ 8HNO3(конц.) = 3Cu(NO3)2 + 2NO + 4H2O
Медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
С разбавленной серной кислотой медь не взаимодействует:
Cu0 + 2H2S+6O4(разб.) = реакция не идет
16.
ДОМАШНЯЯ РАБОТА§18, № 7, стр.99 Напишите все уравнения в
молекулярной, полной ионной и сокращенной
ионной форме.














 Химия
Химия








