Похожие презентации:
Гетерогенные процессы равновесия в растворах. Лекция №4
1.
КрасГМУ им. проф. Войно-Ясенецкого. КафедраБиологической химии с курсом медицинской,
фармацевтической, и токсикологической химии
ГЕТЕРОГЕННЫЕ ПРОЦЕССЫ
РАВНОВЕСИЯ В РАСТВОРАХ
Лекция №4 для студентов 1 курса,
обучающихся по специальности
31.05.03 - стоматология
Лектор: ст. преподаватель
Пащенко Светлана Ивановна
Красноярск, 2023
И
2.
ЦЕЛЬ ЛЕКЦИИИзучить понятия «растворимость», условия
растворимости.
Изучить особенности поведения ненасыщенных,
насыщенных и пересыщенных растворов, особенности
гетерогенных ионных равновесий в растворах
малорастворимых электролитов, условия образования и
растворения осадков, последовательность осаждения
ионов, способы достижения полного осаждения.
Изучить особенности образования костной ткани и
камнеобразования, влияние процессов растворения
и расслоения на жизнедеятельность клетки.
3.
АКТУАЛЬНОСТЬГетерогенные процессы имеют важное
значение в процессах жизнедеятельности
организма и позволяют понять механизм
формирования вещества костной ткани,
действие кальциевого буфера, физикохимические основы развития таких
заболеваний, как мочекаменная болезнь,
рахит, подагра и др., а также обосновать ряд
терапевтических мероприятий и
диагностических методов исследования.
Глубокое понимание закономерностей
образования и растворения
малорастворимых
солей в организме человека необходимо
будущему врачу.
4.
ПЛАН ЛЕКЦИИ1. Понятие «растворимость».
2. Процессы растворения и кристаллизации.
2. Химическое равновесие.
3. Произведение растворимости.
4. Условия образования осадка.
5. Условия растворения осадка.
6. Дробное осаждения.
7. Солевой эффект.
8. Процессы, происходящие в в организме в случае физиологических
насыщенных, пересыщенных и ненасысыщенных растворов.
5.
РАСТВОРИМОСТЬРастворимость – это способность веществ растворятся я в
каком-либо растворителе.
Растворимость показывает сколько граммов вещества
способно растворяться в 100 граммах растворителя
6.
КЛАССИФИКАЦИЯ ВЕЩЕСТВ ПО РАСТВОРИМОСТИВЕЩЕСТВА С НЕОГРАНИЧЕННОЙ
РАСТВОРИМОСТЬЮ
ВЕЩЕСТВА С ОГРАНИЧЕННОЙ
РАСТВОРИМОСТЬЮ
Смешиваются с водой в любых
соотношениях, образуя истинные
растворы.
«Подобное растворяется в
В растворах этих веществ существует
область концентраций, в которой они
существуют как истинный раствор.
При определённых условиях(С,Р t)
система может стать гетерогенной.
Растворение этих веществ следует
рассматривать как динамический
процесс в котором может наступить
состояние равновесия, когда
Vрастворения = V выделения
в-во + р-ль
р-р
подобном»
В воде хорошо растворяются
многие соли, сахар, жидкость и
газы, полярные молекулы.
В бензине хорошо растворяются
бензол, воск, каучук, молекулы
которых неполярны.
7.
ПРОЦЕСС РАСТВОРЕНИЯ8.
9.
10.
ПРОЦЕСС РАСТВОРЕНИЯЧем сильнее эти межмолекулярные взаимодействия,
тем вещество лиофильнее и тем лучше оно растворяется
в данном растворителе
11.
НАСЫЩЕННЫЕ РАСТВОРЫНасыщенными растворами называется
термодинамически устойчивая равновесная
система, в которой скорость растворения
вещества равна скорости его выделения из раствора
Vрастворение
=
Vвыделения
12.
НЕНАСЫЩЕННЫЙ РАСТВОРНенасыщенным раствором называется
термодинамически устойчивая неравновесная система,
в которой концентрация вещества меньше,
чем в насыщенном растворе.
V растворения
> Vвыделения
13.
ПЕРЕСЫЩЕННЫЙ РАСТВОРПересыщенным раствором называется
термодинамически неустойчивая псевдоравновесная
система, в которой концентрация вещества больше,
чем в насыщенном растворе.
V растворения <Vвыделения
Пересыщенные растворы могут
самопризвольно выделять растворённое
вещество, превращаясь в гетерогенные
системы.
Пересыщенные растворы получаются из
насыщенных растворов при изменении
условий растворения: температуры,
концентрации, давления.
14.
ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ В РАСТВОРАХ,СВЯЗАННЫЕ С ПРОЦЕССОМ КРИСТАЛЛИЗАЦИИ
Насыщенный раствор с осадком
представляет собой равновесную
гетерогенную систему
15.
КОНСТАНТА РАСТВОРИМОСТИ КS ДЛЯ СУЛЬФАТАБАРИЯ
Кs = крастворим./ ккристал.[Ba2+ ]* [ SO42- ]
Константа растворимости при постоянной
температуре определяется только произведением
концентраций ионов малорастворимого
электролита в насыщенном растворе. ( КПР или
ПР, Кs)
16.
ПРОДОЛЖЕНИЕ (В ОБЩИЙ ВИДЕ КОНСТАНТЫРАСТВОРИМОСТИ)
Для малорастворимого электролита константа растворимости Кs
определяется стехиометрическим произведением концентраций
ионов,
Посылаемых в раствор данным электролитом.
17.
Величина Кs характеризует растворимость электролита при даннойтемпературе и зависит от природы малорастворимого электролита и
растворителя. Значения констант растворимости приводятся в
справочниках физико-химических величин.
18.
ХАРАКТЕРИСТИКИ СООТНОШЕНИЙ МЕЖДУКОНЦЕНТРАЦИЯМИ В НИХ ИОНОВ И КОНСТАНТОЙ
РАСТВОРИМОСТИ
19.
РАСТВОРИМОСТЬ МАЛОРАСТВОРИМОГОЭЛЕКТРОЛИТА -S
Растворимость – это молярность его насыщенного раствора.
20.
ЧЕТЫРЕ ПРАВИЛА СМЕЩЕНИЯ ИОННОГОГЕТЕРОГЕННОГО РАВНОВЕСИЯ:
1. ОБРАЗОВАНИЕ ОСАДКА;
2. РАСТВОРЕНИЕ ОСАДКА;
3. ПОСЛЕДОВАТЕЛЬНОСТЬ ОСАЖДЕНИЯ ОСАДКОВ;
4. ДОСТИЖЕНИЕ ПОЛНОТЫ ОСАЖДЕНИЯ ИОНОВ.
Смещение ионных гетерогенных равновесий происходит в
соответствии с принципами Ле Шателье в направлении
наиболее полного связывания ионов.
Изменение концентрации ионов в растворах
малорастворимых электролитов приводит к значительному
изменению его растворимости, при этом Кs остаётся
постоянной.
21.
ОБРАЗОВАНИЕ ОСАДКАОсадок малорастворимого электролита Ktn Anm выпадает из
пересыщенного раствора
Осадок малорастворимого сильного электролита
образуется, если стехиометрическое произведение
концентраций его ионов в растворе станет
большее константы растворимости .
Cm(A n+)∙C n (B m- ) > КS
22.
РАСТВОРЕНИЕ ОСАДКАОсадок малорастворимого сильного электролита
растворяется
в том случае, если раствор над ним станет ненасыщеным
Осадок малорастворимого сильного электролита
растворяется, если в растворе над осадком этого
малорастворимого электролита создать условия, при
которых стехиометрическое произведение концентраций
ионов станет меньше его константы растворимости.
С m(A n+)∙С n (B m- ) < КS
23.
ХИМИЧЕСКИЕ РЕАКЦИИ, ЛЕЖАЩИЕ В ОСНОВЕРАСТВОРЕНИЯ ОСАДКОВ
1. Химическое связывание одного из ионов в растворе
Кислотно-основное взаимодействие
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
2 Образование воднорастворимых комплексов.
Комплексообразование
AgCl + 2(NH3)*H2O = [Ag(NH3)2]Cl + 2H2O
3 Изменение степени окисления одного из элементов.
Окислительно – восстановительные реакции
3ZnS + 8 HNO3
3Zn(NO3) + 2NO +S + 4 H2O
Конкуренцию выигрывает то равновесие, которое приводит к
более полному связыванию хотя бы одного из общих ионов,
участвющих в этих равновесиях.
24.
ПОСЛЕДОВАТЕЛЬНОСТЬ ОСАЖДЕНИЯ ИОНОВЕсли к раствору, содержащему смесь ионов, осаждаемых
одним и тем же ионом осадителя, добавлять этот
осадитель, то образование осадков малорастворимых
электролитов происходит ступенчато: первым
осаждается тот электролит, для достижения константы
растворимости Ks которого требуется наименьшая
концентрация ионов осадител
25.
ДОСТИЖЕНИЯ ПОЛНОТЫ ОСАЖДЕНИЯ26.
ДОСТИЖЕНИЕ ПОЛНОТЫ ОСАЖДЕНИЯ ИОНОВДля достижения полноты осаждения одного
вида ионов малорастворимого сильного
электролита из его насыщенного раствора следует
увеличить в растворе концентрацию другого
вида ионов этого электролита
CaHPO4
Ca2+ (р ) + HPO4 2- (р)
Добавление ионов кальция (хлорид кальция) к плазме крови способствует
смещению равновесия влево, увеличению осадка гидрофосфата кальция.
Концентрация гидрофосфат-иона уменьшается.
27.
ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ В ЖИВЫХОРГАНИЗМАХ
В организме человека важные гетерогенные процессы с участием
неорганических соединений протекают прежде всего при образовании
костной ткани, а также различного вида камней при почечной и
желченокаменной болезнях
В клетках костной ткани остеобластомах, интенсивно омываемых
кровью, происходит минерализация – конечный этап образования
костной ткани.
Основной минеральный компонент костной ткани – гидроксифосфат кальция
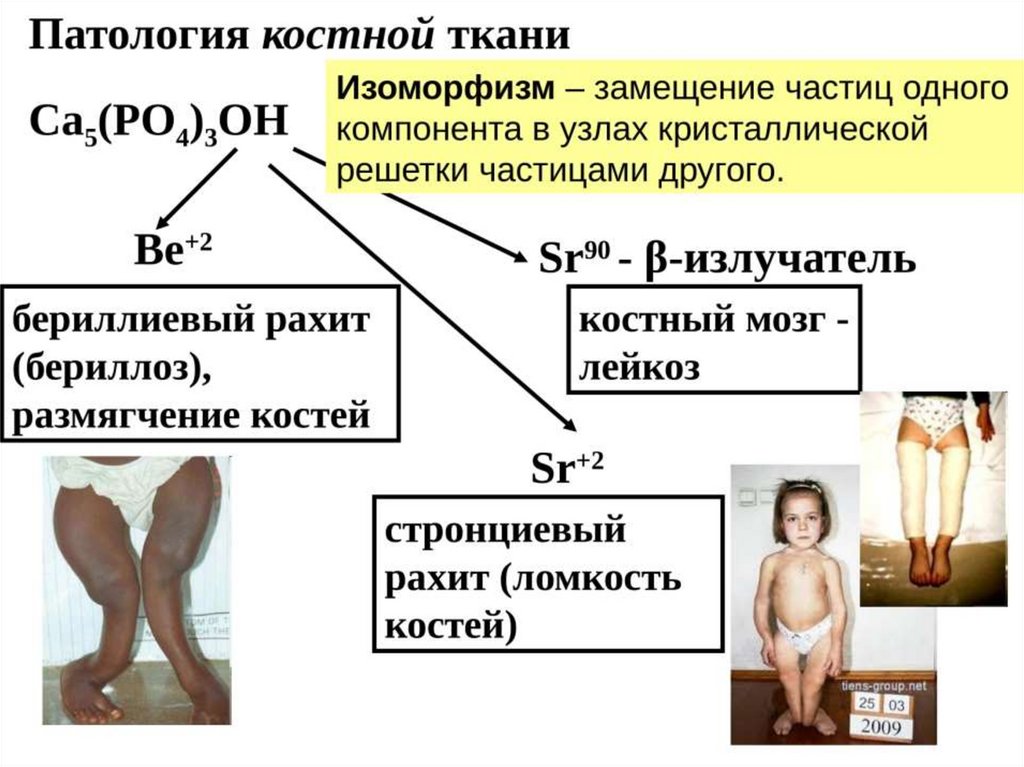
(ИЛИ ГИДРОКСИАППАТИТ) Ca5(PO4)3OH
(Ks = 1,6*10-58 ) – ЭТО ОЧЕНЬ НИЗКИЙ ПОРОГ РАСТВОРИМОСТИ, КОТОРЫЙ ЛЕГКО
ПРЕОДОЛЕТЬ И ОБРАЗОВАТЬ ОСАДОК
28.
ОБРАЗОВАНИЯ КОСТНОЙ СВЯЗИ29.
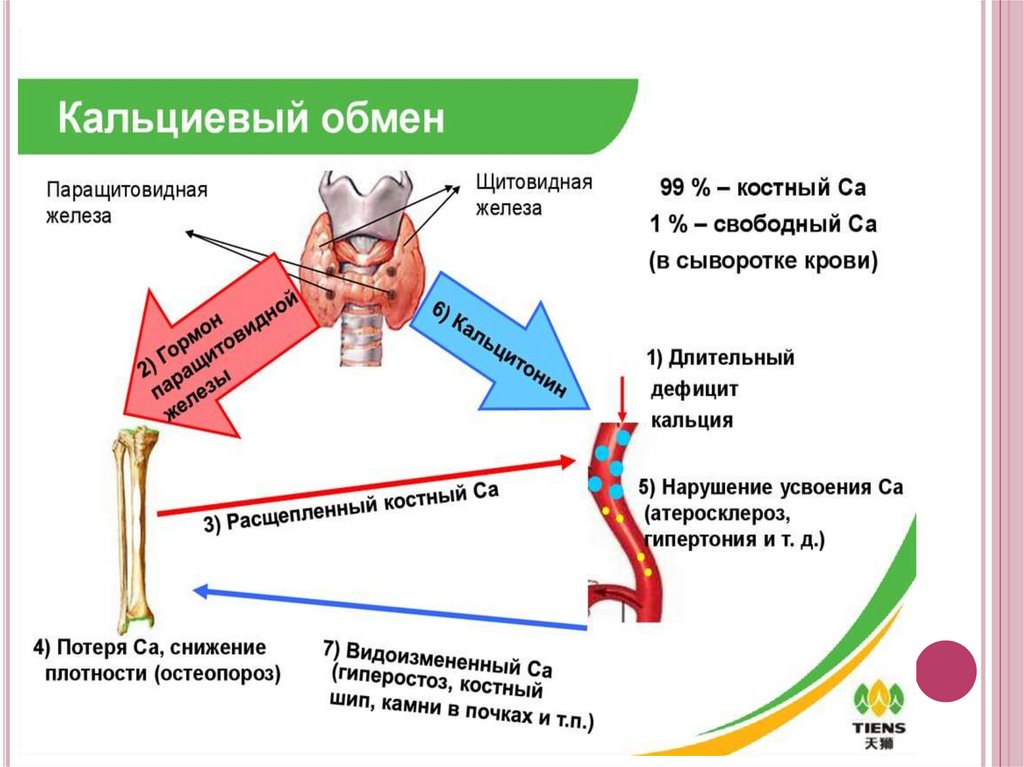
КАЛЬЦИЕВЫЙ БУФЕРНаряду с гидроксиаппатитом в поверхностных слоях кости образуются
некоторое количество аморфного фосфата кальция (Ca3(PO4)2)
(Ka =2,0*10-29 ), более растворимой соли, которая является лобильным
резервом кальция и фосфат-анионов в организме.
Поверхность костного скелета -2000км2. Ежедневно из костей скелета
уходит и возвращается в него 700-800мг кальция. Полная перестройка
костной ткани человека происходит примерно каждые 10 лет.
Основной регулятор кальций-фосфатного обмена в организме
человека являются витамин D и гормоны паратирин и кальцитонин.
30.
РАЗРУШЕНИЕ КОСТНОЙ ТКАНИПри небольшом повышении содержания протонов
кость начинает растворяться
1 Отрываются ионы кальция
Ca5(PO4) OH + 2H+
Ca4H(PO4)3 + Ca2+ + H2O
2. Происходит полный распад костной ткани
. Ca5(PO4) OH + 7H+
3H2PO4- + 5Ca2+ +H2O
Эти процессы могут легко протекать зубами. В полости рта
в результате жизнедеятельности микробов образуются достаточно
сильные кислоты: пировиноградная, молочная, янтарная, которые
разрушают зубы не только вследствие повышения кислотности среды, но
и в результате связывания катионов кальция в устойчивые комплексные
соединения
31.
32.
ИЗОМОРФИЗМ КОСТНОЙ ТКАНИ33.
34.
35.
36.
37.
ОСОБЕННОСТИ ПРОЦЕССА КАМНЕОБРАЗОВАНИЯВ организме человека ионы Ca2+могут образовывать
разные малорастворимые соединения, которые называют
камнями.
Формирование камней происходит из коллоидных частиц
в результате процесса коагуляции
38.
ПОЧЕЧНЫЕ КАМНИ – УРАТЫ, ФОСФАТЫ ИОКСОЛАТЫ КАЛЬЦИЯ.
39.
ХОЛЕСТЕРИНОВЫЕ КАМНИ40.
ВЫВОДБудущему врачу необходимо понимание закономерностей
образования и растворения малорастворимых солей для
профилактики и лечения различных заболеваний,
вызываемых нарушениями минерального обмена в
организме человека
41.
УВАЖАЕМЫЕ СТУДЕНТЫ. ЦИКЛ ЛЕКЦИЙ ПООБЩЕЙ ХИМИИ ЗАКОНЧЕН. ОН НАПРАВЛЕН
НА ФОРМИРОВАНИЕ ЗНАНИЙ О ХИМИЧЕСКИХ
ПРОЦЕССАХ В ОРГАНИЗМЕ ЧЕЛОВЕКА. МЫ
НАДЕЕМСЯ, ЧТО ЭТО ПОМОЖЕТ ВАМ СТАТЬ
ВЫСОКОПРОФЕССИОНАЛЬНЫМИ ДОКТОРАМИ,
ПОНИМАЮЩИМИ ПРИРОДУ НЕКОТОРЫХ
ЗАБОЛЕВАНИЙ И ИХ ПРОФИЛАКТИКЕ
ВПЕРЕДИ ВАС ЖДЁТ ЦИКЛ ЛЕКЦИЙ ПО
ОРГАНИЧЕСКОЙ ХИМИИ – ВХОЖДЕНИИ В
ПРЕКРАСНУЮ НАУКУ БИОХИМИЮ.








































 Химия
Химия