Похожие презентации:
Гидролиз солей (9 класс)
1. Гидролиз солей
Всё познаётся в сравнении.Гидролиз солей
2.
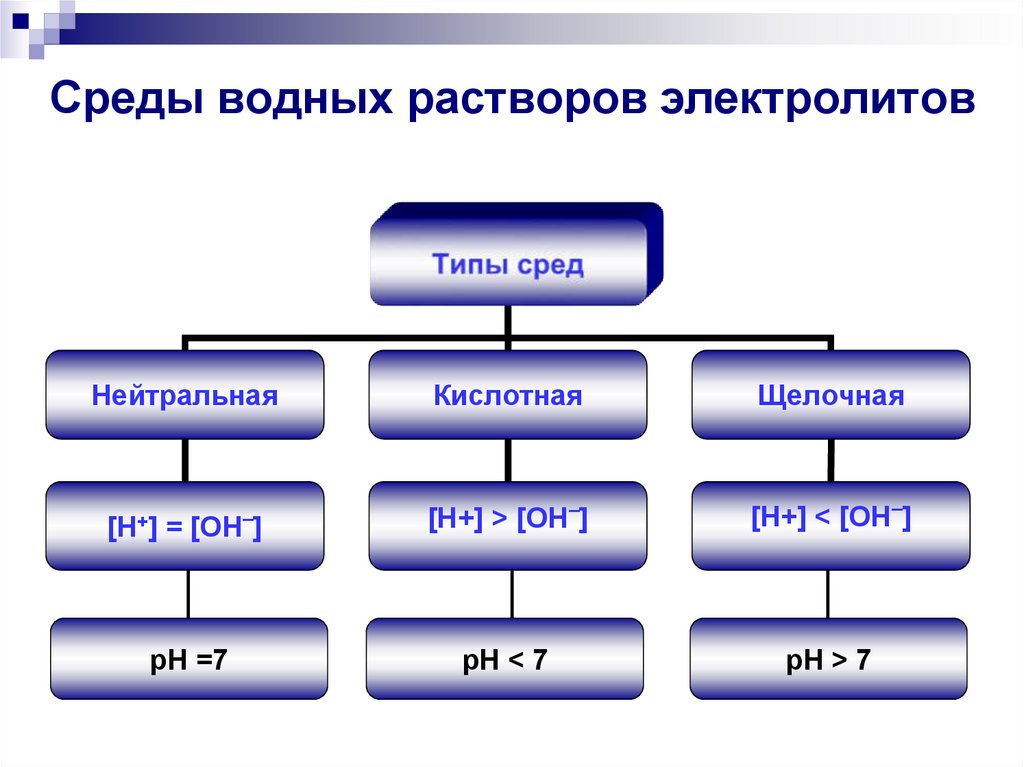
3. Среды водных растворов электролитов
НейтральнаяКислотная
Щелочная
[H+] = [OH–]
[H+] > [OH–]
[H+] < [OH–]
pH =7
pH < 7
pH > 7
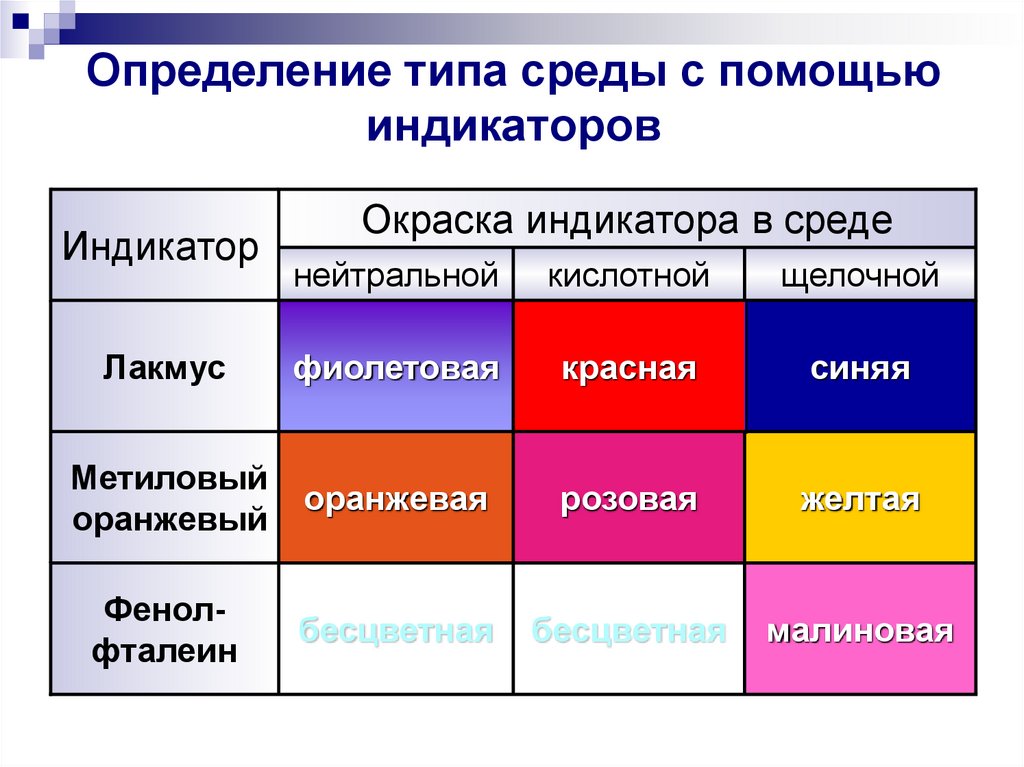
4. Определение типа среды с помощью индикаторов
ИндикаторОкраска индикатора в среде
нейтральной
кислотной
щелочной
Лакмус
фиолетовая
красная
синяя
Метиловый
оранжевый
оранжевая
розовая
желтая
Фенолфталеин
бесцветная
бесцветная
малиновая
5. Что такое гидролиз?
Гидролиз(от греческого hydro – вода;
lysis – разложение)
6. Определение гидролиза
Гидролиз соли – это химическаяреакция обмена соли с водой,
в результате которой ионы слабого
электролита, входящие в состав соли,
соединяются с составными частями
воды: H+ и OH- .
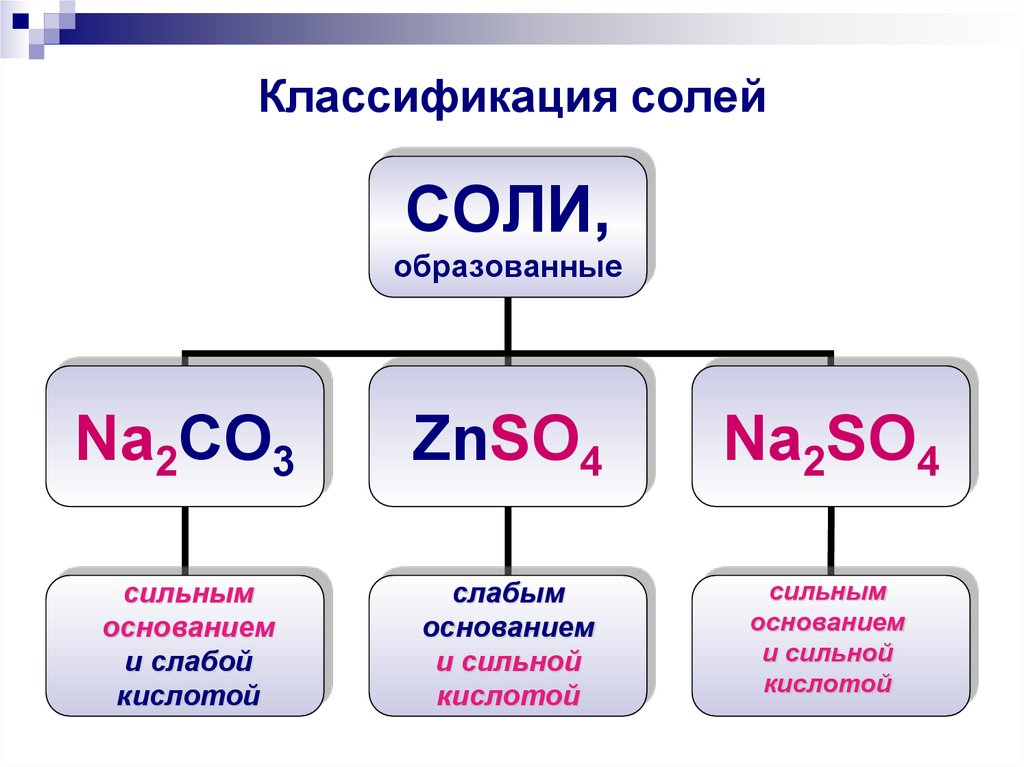
7. Классификация солей
СОЛИ,образованные
Na2CO3
ZnSO4
Na2SO4
сильным
основанием
и слабой
кислотой
слабым
основанием
и сильной
кислотой
сильным
основанием
и сильной
кислотой
8.
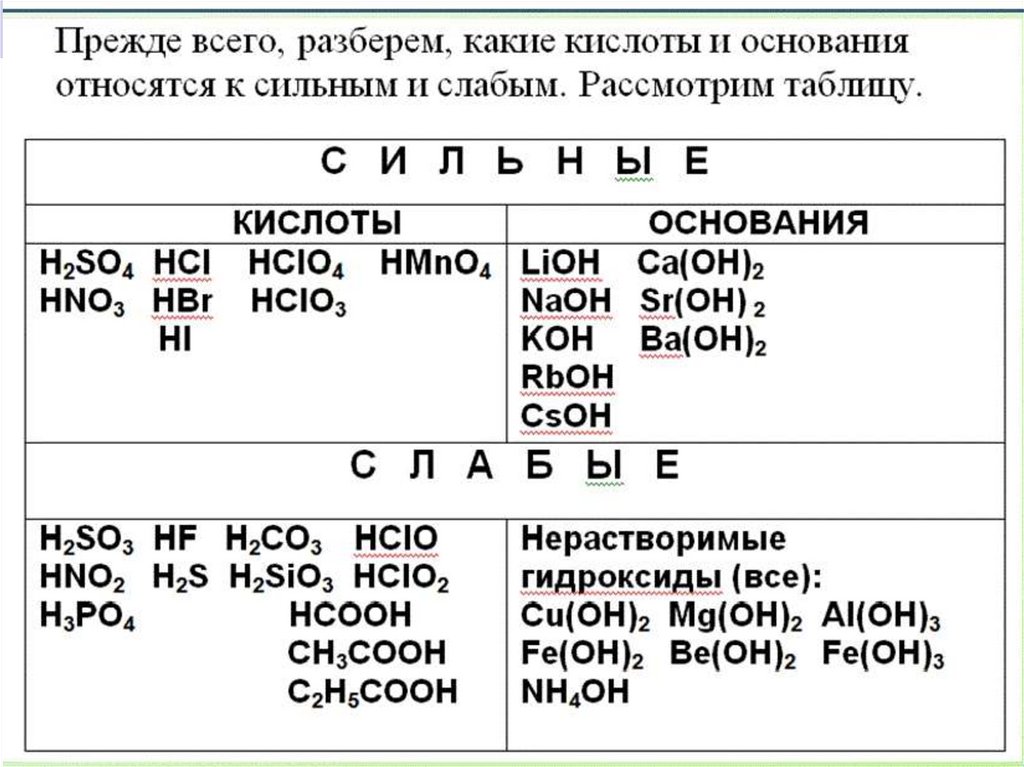
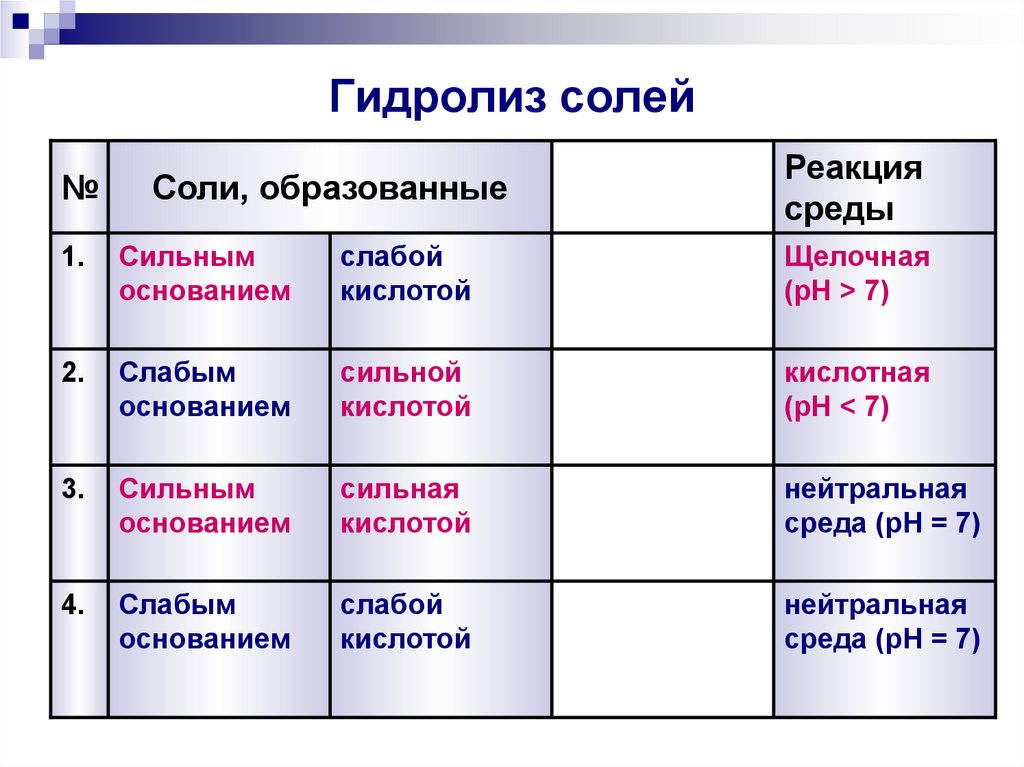
9. Гидролиз солей
№Соли, образованные
Реакция
среды
1.
Сильным
основанием
слабой
кислотой
Щелочная
(pH > 7)
2.
Слабым
основанием
сильной
кислотой
кислотная
(pH < 7)
3.
Сильным
основанием
сильная
кислотой
нейтральная
среда (pH = 7)
4.
Слабым
основанием
слабой
кислотой
нейтральная
среда (pH = 7)
10.
Для веществ, приведённых в перечне,определите характер среды их водных
растворов
1) нитрат бария
2) карбонат натрия
3) серная кислота
4) сульфат железа(III)
11.
Для веществ, приведённых в перечне,определите характер среды их водных
растворов
1) сульфат железа(III)
2) сульфат натрия
3) сульфид калия
4) гидроксид бария
12.
Для веществ, приведённых в перечне,определите характер среды их водных
растворов,
1) иодид бария
2) нитрат меди(II)
3) гидроксид цезия
4) фосфат калия







 Химия
Химия








