Похожие презентации:
Обзор белковых структур
1.
Обзор белковыхструктур
(ch.4)
THE PRESENTATION IS
PREPARED BY ALI TILEK
2.
• Остов типичного белка обусловленобразованием сотен ковалентных
связей. Вокруг многих из этих
связей возможно свободное
вращение, поэтому молекула белка
может принимать бесчисленное
множество различных
конформаций .
• Однако каждый белок несет
специфическую химическую или
структурную функцию, для
реализации которой необходимо,
чтобы он имел строго
определенную трехмерную
структуру
3.
• В данной лекции мы рассмотрим как аминокислотная последовательность определяеттрехмерную структуру белка. В связи с этим рассмотрим пять основных вопросов.
• Во-первых, трехмерная структура белка определяется его аминокислотной
последовательностью.
• Во-вторых, функции белка зависят от его структуры.
• В-третьих, выделенный белок обычно существует в одной или нескольких стабильных
структурных формах.
• В-четвертых, наиболее важный вклад в стабилизацию специфической структуры белка
вносят не ковалентные, а другие взаимодействия.
• Наконец, в-пятых, среди огромного числа уникальных белковых структур можно выделить
некоторые общие типы, помогающие понять принципы архитектуры белковых молекул.
4.
• Пространственная организация атомов в молекуле белка называется конформацией.Конформации белка — это все структурные формы, которые он может принимать без
разрыва ковалентных связей.
• В теории белок может принимать сотни конформации, но в реальности их число очень малое
• Почему?
• Все зависит от термодинамической стабильности
• Реализуемые конформации обычно наиболее термодинамически выгодные и
характеризуются наименьшим значением свободной энергии Гиббса (G). Белок в любой из
функциональных конформаций называется нативным белком.
5.
Конформация белка в значительной степени стабилизирована слабымивзаимодействиями
• Если мы говорим о структуре белка, то стабильность (устойчивость) белка можно
определить как его способность сохранять свою нативную конформацию.
• Нативные белки в физиологических условиях стабильны лишь условно, при переходе от
свернутого к развернутому белку изменение энергии G в диапазоне 20—65 кДж/моль.
• Любая полипептидная цепь теоретически может принимать бессчетное число различных
конформаций, в результате чего развернутый белок характеризуется высокой
конформационной энтропией. Эта энтропия, а также водородные связи между
многочисленными группами в полипептидной цепи и молекулами растворителя (воды)
стремятся удержать белок в развернутом состоянии.
• Среди химических взаимодействий, противостоящих этим силам и стабилизирующих
нативную конформацию, следует назвать дисульфидные связи и слабые (нековалентные)
взаимодействия: водородные связи, гидрофобные и ионные взаимодействия.
6.
• Во многих белках дисульфидных мостиков нет. Условия внутри большинства клеток являютсясильно восстановительными, что препятствует образованию связей —S—S—.
• У эукариот дисульфидные связи обнаруживаются в основном в секретируемых внеклеточных
белках (например, в молекуле инсулина). В бактериальных белках дисульфидные связи также
встречаются редко.
• Однако у термофильных бактерий и архей обычно много белков с дисульфидными связями,
стабилизирующими эти белки; возможно, это один из способов адаптации к существованию в
условиях повышенных температур.
• Для разрыва одинарной ковалентной связи требуется от 200 до 460 кДж/моль, в то время как для
нарушения слабых взаимодействий достаточно 4—30 кДж/моль. Отдельные ковалентные связи,
участвующие в поддержании нативной конформации белка, такие как дисульфидные связи,
удерживающие вместе части полипептидной цепи, очевидно, являются гораздо более прочными,
чем отдельные слабые взаимодействия. Однако благодаря своей множественности именно
слабые взаимодействия вносят ос- новной вклад в стабилизацию структуры белка. Обычно
конформация белка с самой низкой свободной энергией (т. е. наиболее устойчивая) отличается
максимальным числом реализованных слабых взаимодействий.
7.
• При рассмотрении вкладов слабых взаимодействий в стабильности белка мы обнаружим, чтообычно среди них преобладают гидрофобные взаимодействия (гидрофобные
аминокислотные остатки в значительной степени убраны внутрь молекулы белка для
минимизации контакта с водой;).
• Стабилизировать нативную конформацию некоторых белков могут также взаимодействия
между противоположно заряженными группами, образующими ионные пары (солевые
мостики)
• Ионные взаимодействия также ограничивают подвижность белковой структуры и придают
ей определенную уникальность, которую неспецифические гидрофобные взаимодействия
обеспечить не могут.
8.
Пептидныесвязи обладают
жесткостью и
плоской
конфигурацией
9.
10.
11.
Вторичная структура• Термин вторичная структура может относиться к любому выбранному фрагменту
полипептидной цепи и описывает локальную пространственную укладку атомов,
составляющих основную цепь, без учета конформации боковых цепей или их
взаимодействия с другими фрагментами.
• Регулярная вторичная структура имеет место тогда, когда величины обоих торсионных углов
фи и пси остаются постоянными или почти постоянными на протяжении определенного
участка цепи
• Наиболее известными типами вторичной структуры являются альфа-спирали и бета-слои;
также довольно часто встречаются бета-повороты.
12.
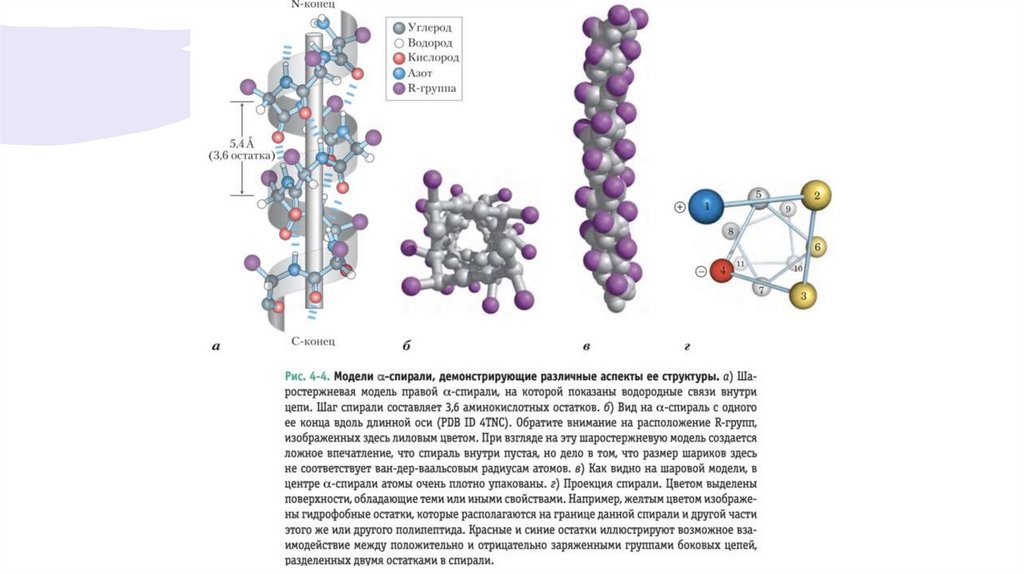
Альфа-Спираль — это распространенный видвторичной структуры белка
• В этой структуре полипептидный остов образует плотные витки вокруг длинной оси
молекулы, причем R-группы аминокислотных остатков выступают из спирального остова
наружу.
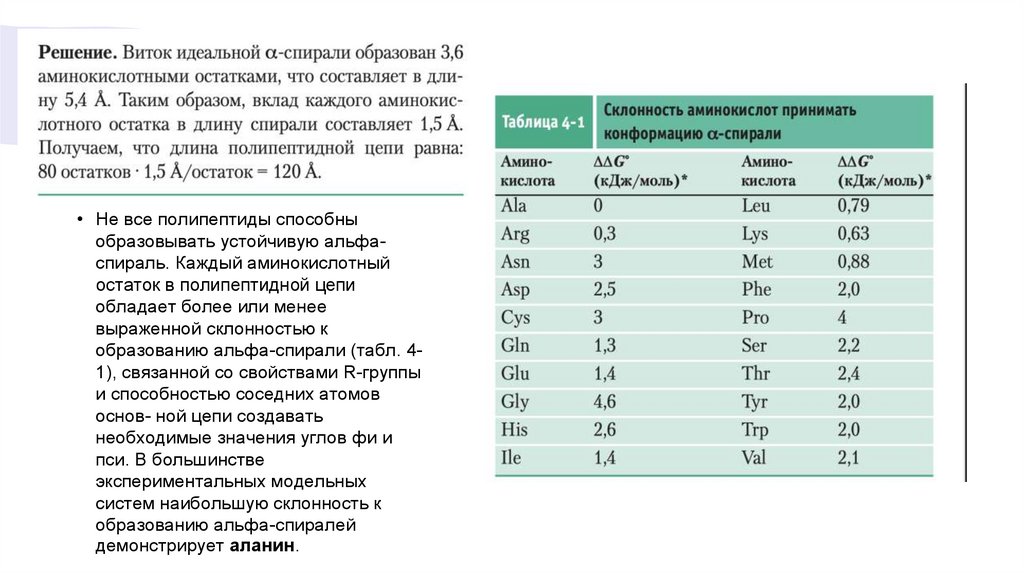
• Аминокислотные остатки в альфа-спирали имеют значения углов phi= –57° и psi= –47°,
причем каждый виток спирали содержит 3,6 аминокислотных остатка.
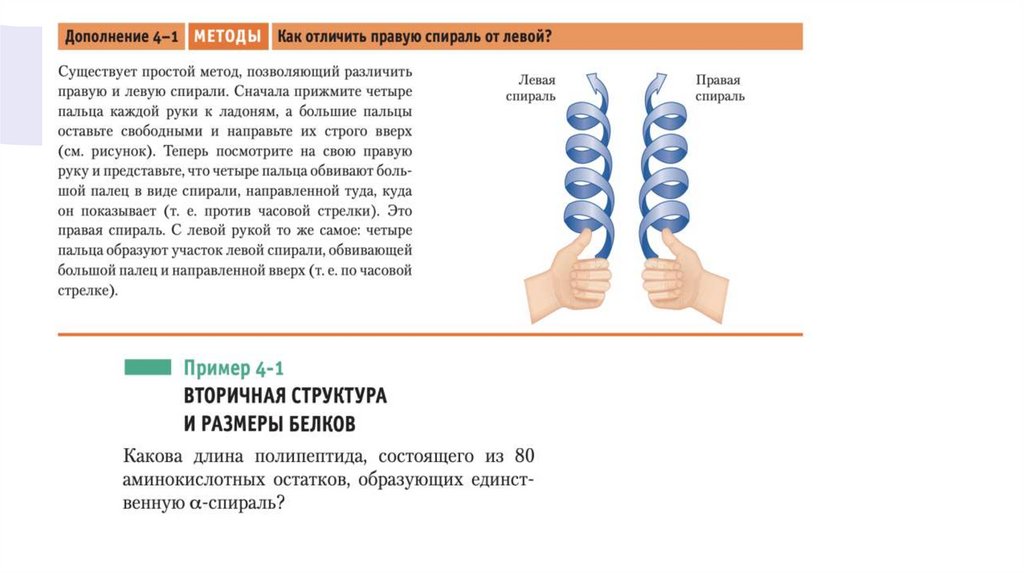
• Во всех белках альфа-спираль закручена вправо
• Почему альфа-спираль образуется чаще других возможных структур?
• До некоторой степени это объясняется тем, что в альфа-спирали оптимальным образом
используются водородные связи внутри молекулы. Данная структура стабилизируется
водородными связями между атомом водорода, соединенным с электроотрицательным
атомом азота пептидной связи, и электроотрицательным атомом кислорода карбонильной
группы четвертой аминокислоты (считая вдоль цепи назад)
• В образовании подобных водородных связей участвует каждая пептидная группа альфаспирали (за исключением концевых групп).
13.
14.
• Не все полипептиды способныобразовывать устойчивую альфаспираль. Каждый аминокислотный
остаток в полипептидной цепи
обладает более или менее
выраженной склонностью к
образованию альфа-спирали (табл. 41), связанной со свойствами R-группы
и способностью соседних атомов
основ- ной цепи создавать
необходимые значения углов фи и
пси. В большинстве
экспериментальных модельных
систем наибольшую склонность к
образованию альфа-спиралей
демонстрирует аланин.
15.
• Виток альфа-спирали обеспечивает взаимодействие между боковой цепью однойаминокислоты и боковой цепью другой аминокислоты, расположенной от первой на
расстоянии трех или четырех остатков (рис. 4-4, г). Часто положительно заряженные
аминокислоты располагаются на расстоянии трех остатков от отрицательно заряженных, что
способствует образованию ионной пары. Две ароматические аминокислоты часто
расположены в пространстве одинаковым обра-зом, что обеспечивает возможность
гидрофобных взаимодействий.
• Препятствием для образования альфа-спирали является присутствие остатков Pro или Gly,
которые менее всего склонны образовывать альфа-спираль.
• Итак, на устойчивость альфа-спирали влияют пять факторов: 1) склонность аминокислотных
остатков образовывать -спираль; 2) взаимодействия между R-группами, особенно между
находящимися на расстоянии трех (или четырех) аминокислотных остатков; 3) близкое
расположение аминокислотных остатков с R-группами большого размера; 4) наличие остатков
Gly и Pro; 5) взаимодействие между аминокислотными остатками на N- и С-концах
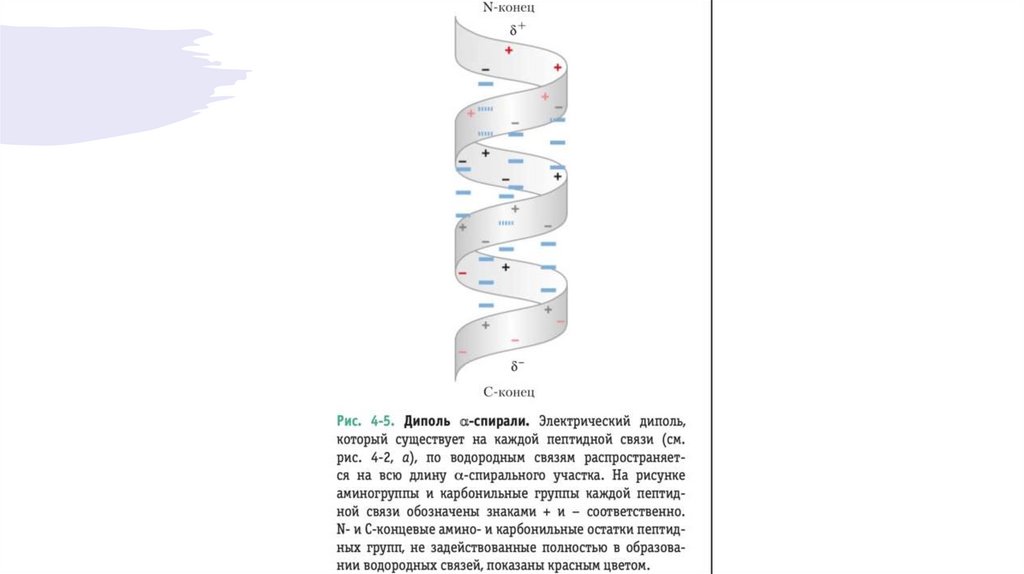
спирального участка и электрическим диполем, возникающем в спирали. Таким образом,
способность конкретного участка полипептидной цепи образовывать альфа-спираль зависит
от того, какие аминокислоты и в каком порядке расположены на этом участке.
16.
17.
18.
19.
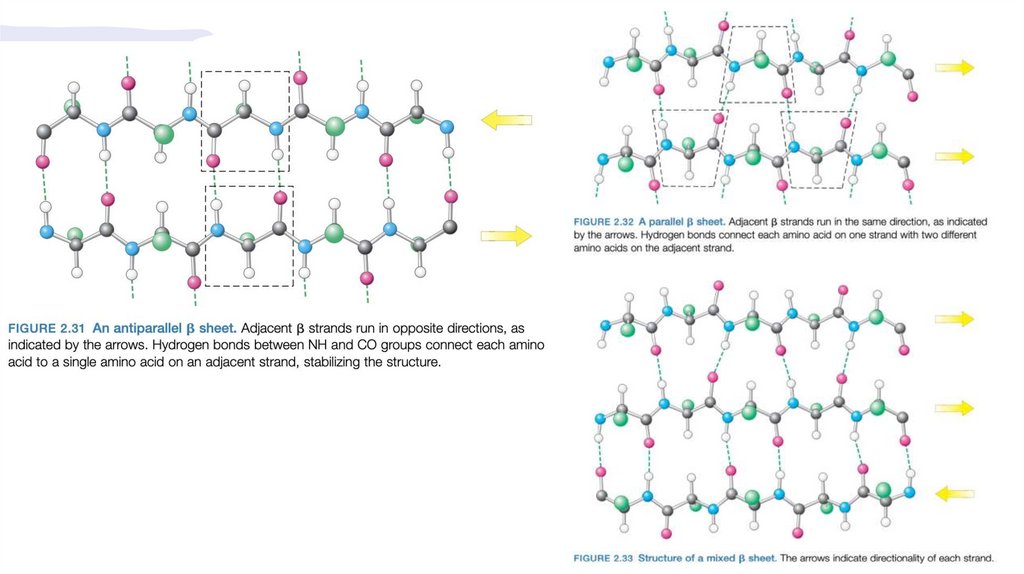
Участки полипептидных цепей с бета-конформацией образуютбета-слои
• В данном случае остов полипептидной цепи образует не спиральную, а зигзагообразную
структуру
• Некоторые аминокислотные последовательности ограничивают возможности образования
бета-слоев. В частности, для того чтобы в белке два (или более) бета-слоя могли при
укладке соприкасаться, R-группы аминокислотных остатков должны иметь сравнительно
небольшие размеры. Например, в таких бета-кератинах, как фиброины шелка и паутины,
очень высокое содержание остатков Gly и Ala, R-группы которых самые маленькие. В
фиброине шелка на протяжении довольно длинных участков последовательности
чередуются остатки Gly и Ala.
20.
21.
22.
В белковых структурах часто встречаются бета-повороты• В глобулярных белках, характеризующихся компактной упаковкой полипептидных цепей, около
трети всех аминокислотных остатков приходится на повороты и петли, возникающие при
изменении направления укладки полипептидной цепи
• Эти элементы структуры связывают между собой участки альфа-спиралей и бета-слоев.
• Наиболее часто встречаются бета-повороты, связывающие концы двух соседних участков
антипараллельного бета-слоя. Эта структура представляет собой повернутую на 180° петлю, в
которой задействовано четыре аминокислотных остатка, причем кислород карбонильной группы
первого остатка образует водородную связь с водородом аминогруппы четвертого остатка.
• Часто в этих структурах встречаются остатки Gly и Pro: первый — благодаря своему малому
размеру и гибкости, а второй — благодаря легкости, с которой пептидная связь с участием азота
иминогруппы пролина принимает цис-конфигурацию, способствующую образованию петли
• Эти структуры обычно находятся близко к поверхности белка, где две средние аминокислоты из
тех четырех, что образуют поворот, могут участвовать в образовании водородных связей с водой.
Сравнительно реже в белках можно встретить состоящие из трех аминокислотных остатков
гамма-повороты, в которых водородная связь возникает между первым и третьим остатками.
23.
24.
Вторичные структурыбелка характеризуются
определенными углами
связей
25.
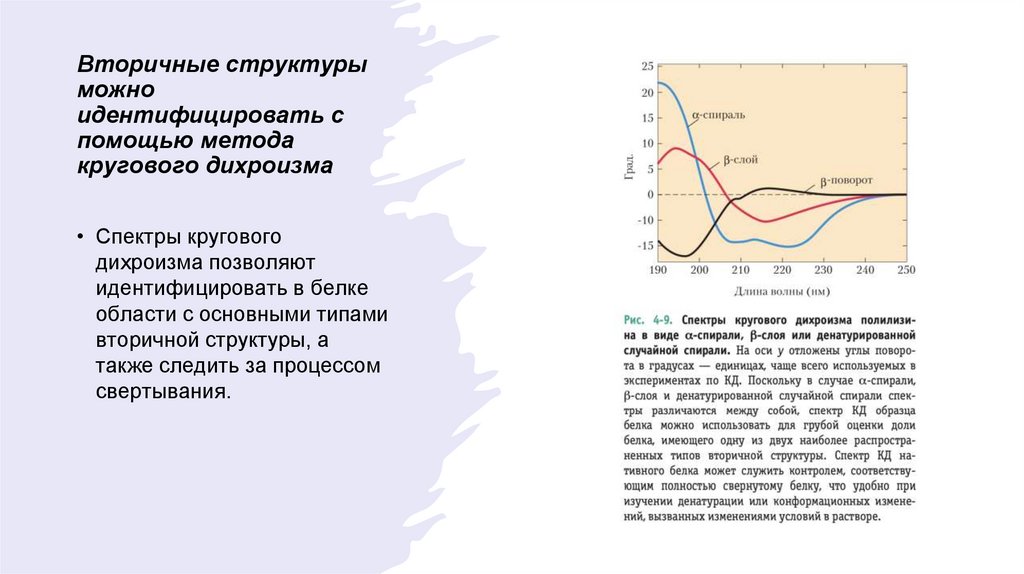
Вторичные структурыможно
идентифицировать с
помощью метода
кругового дихроизма
• Спектры кругового
дихроизма позволяют
идентифицировать в белке
области с основными типами
вторичной структуры, а
также следить за процессом
свертывания.
26.
Третичная и четвертичная структуры белка• Общая организация всех атомов белка в пространстве называется третичной структурой.
Если термин «вторичная структура» относится к пространственной организации
аминокислотных остатков, расположенных близко друг от друга в полипептидной цепи,
третичная структура подразумевает способ организации молекулы белка в целом.
• Некоторые белки состоят из двух или большего числа отдельных полипептидных цепей,
называемых субъединицами, которые могут быть как одинаковыми, так и разными.
Взаимное расположение субъединиц белка в пространстве определяет четвертичную
структуру белка.
• При рассмотрении этих более высоких уровней организации белковой структуры удобно
разделить все белки на два основных класса: фибриллярные белки, полипептидные цепи
которых организованы в виде длинных нитей или волокон, и глобулярные белки, чьи
полипептидные цепи образуют сферические структуры — глобулы.
• Эти два класса белков заметно различаются по структуре: фибриллярные белки обычно
характеризуются одним типом вторичной структуры, а отдельные участки глобулярных
белков часто имеют разную вторичную структуру.
27.
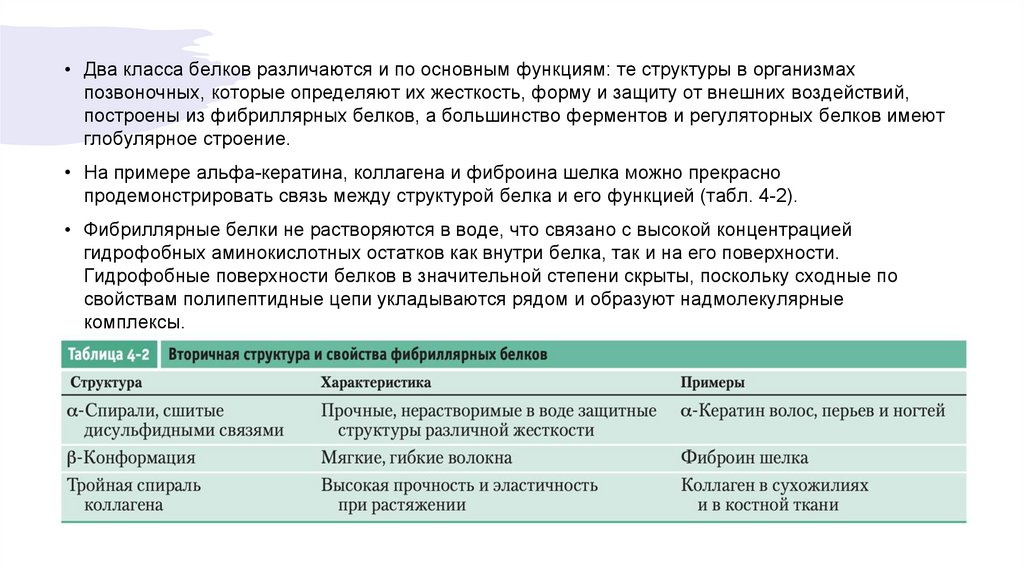
• Два класса белков различаются и по основным функциям: те структуры в организмахпозвоночных, которые определяют их жесткость, форму и защиту от внешних воздействий,
построены из фибриллярных белков, а большинство ферментов и регуляторных белков имеют
глобулярное строение.
• На примере альфа-кератина, коллагена и фиброина шелка можно прекрасно
продемонстрировать связь между структурой белка и его функцией (табл. 4-2).
• Фибриллярные белки не растворяются в воде, что связано с высокой концентрацией
гидрофобных аминокислотных остатков как внутри белка, так и на его поверхности.
Гидрофобные поверхности белков в значительной степени скрыты, поскольку сходные по
свойствам полипептидные цепи укладываются рядом и образуют надмолекулярные
комплексы.
28.
Альфа-Кератин• Эти фибриллярные белки созданы природой для придания жесткости структурам организма.
• У млекопитающих эти белки — основные компоненты волос, шерсти, ногтей, когтей, перьев, рогов,
копыт и многих других поверхностных образований кожи.
• Альфа-Кератины относятся к широкому семейству белков — промежуточным филаментам. Другие
белки промежуточных филаментов обнаружены в цитоскелете клеток животных. Все белки этого
семейства выполняют структурную функцию и имеют такие же структурные особенности, как альфакератины.
• Молекула альфа-кератина представляет собой правую спираль, которая встречается во многих
других белках.
• Альфа-спираль кератина организована в виде двухспиральной катушки. Две ориентированные
параллельно нити альфа-кератина (т. е. с N-концами с одной и той же стороны) закручиваются одна
вокруг другой, образуя суперскрученную спираль.
• Такая суперскрученность придает всей структуре дополнительную прочность — точно так же, как
скрученные веревки придают прочность канату
• Супервитки альфа-спирали образуют левую спираль, т. е. супервитки закручены в другую сторону,
чем сама альфа-спираль. Поверхности соприкосновения двух альфа-спиралей состоят из
гидрофобных аминокислотных остатков, а их R-группы сцеплены друг с другом регулярным
образом. Это создает компактную упаковку полипептидных цепей в левозакрученной суперспирали.
29.
• Отдельные полипептидные цепи в двойной спирали -кератина имеют сравнительно простуютретичную структуру, в которой доминируют альфа-спиральные участки, сами образующие
левые суперспирали вокруг своей оси. Взаимодействие между отдельными альфа-спиралями
представляет собой пример четвертичной структуры.
• Четвертичная структура альфа-кератинов может быть и сложнее. Множество спиральных
катушек могут быть собраны в большой надмолекулярный комплекс; такую структуру,
например, имеют молекулы альфа-кератина в промежуточных филаментах волос.
• В альфа-кератинах в качестве стабилизирующих четвертичную структуру связей выступают
дисульфидные мостики
30.
31.
Коллаген• Подобно альфа-кератинам, коллаген обеспечивает прочность структур организма. Он
присутствует в соединительных тканях, таких как сухожилия, хрящи, органическое
вещество костного матрикса и роговица глаза.
• Спираль коллагена — это уникальная вторичная структура, отличающаяся от альфаспирали. Полипептидные цепи коллагена уложены в левую спираль (редкость!), один виток
которой построен из трех аминокислотных остатков
• Эти спирали также образуют суперспиральные структуры, однако имеющие совсем другое
строение: три полипептидных цепи, называемые альфа-цепями (не путайте с альфаспиралями), закручены одна вокруг другой
32.
• Необычный аминокислотный состав коллагена определяет его уникальную структуру.• Последовательность аминокислот в коллагене обычно представляет собой чередование
трипептидных звеньев Gly–X–Y, где часто X — пролин Pro, а Y — 4-гидроксипролин Hyp.
Только остаток Gly может поместиться в узкую щель между отдельными альфа-цепями
(рис. 4-11, г), а остатки Pro и 4-Hyp обеспечивают крутой поворот спирали коллагена.
Аминокислотная последовательность и суперспиральная структура коллагена приводят к
тому, что три полипептидные цепи очень плотно упакованы.
• В структуре коллагена очень важен 4-гидроксипролин; эта аминокислота сыграла
определенную роль в истории человечества (доп. 4-3).
• Тесное сплетение альфа-цепей в тройной спирали коллагена в пересчете на единицу
площади по- перечного сечения обеспечивает при растяжении более высокую прочность,
чем прочность стальной проволоки.
• Обычно у млекопитающих присутствует более 30 структурных разновидностей коллагена,
характерных для определенных видов тканей и несколько различающихся по
аминокислотной последовательности и функциям. Некоторые генетические дефекты
человека, связанные со структурой коллагена, служат примером тесной связи между
аминокислотной последовательностью и трехмерной структурой этого белка.
Несовершенный остеогенез характеризуется аномальным развитием костей у
младенцев, а синдром Элерса–Данлоса проявляется гипермобильностью суставов. Оба
этих состояния могут быть летальными, и оба связаны с заменой Gly в каждой альфа-цепи
на аминокислоту, имеющую более объемную R-группу, например Cys или Ser (в двух
названных заболеваниях происходит замена разных остатков Gly). Замена всего лишь
одного аминокислотного остатка приводит к катастрофическим последствиям, поскольку
33.
34.
Фиброин шелка• Белок шелка фиброин синтезируют насекомые и пауки
• Его полипептидные цепи существуют преимущественно в бета-конформации. Фиброин
содержит много остатков Ala и Gly, что способствует плотной упаковке бета-слоев и
взаимному проникновению их R-групп
• Вся структура в целом стабилизируется протяженными водородными связями между
пептидными группами всех полипептидов в каждом бета-слое, а также за счет оптимизации
ван-дер-ваальсовых взаимодействий между слоями.
• Шелк не тянется, поскольку полипептидные цепи в бета-конформации и так максимально
растянуты
• Однако подобная структура довольно гибкая, поскольку слои удерживаются вместе не
ковалентными связями, такими как дисульфидные мостики в альфа-кератинах, а множеством
слабых взаимодей- ствий.
35.
36.
Разнообразие структур отражает функциональное многообразиеглобулярных белков
• Глобулярную структуру имеют ферменты, транспортные белки, двигательные белки, регуляторные белки,
иммуноглобулины и множество других белков с разными функциями.
• Трехмерную структуру типичного глобулярного бел- ка можно представить как набор полипептидных сегментов,
уложенных в виде альфа-спиралей или –бета-слоев и соединенных друг с другом связующими
последовательностями.
• В глобулярных белках отдельные участки полипептидной цепи (или несколько полипептидных цепей) уложены
вместе, образуя более компактную структуру, чем у фибриллярных белков
• Первым прорывом в понимании трехмерной структуры белка стало исследование молекулы миоглобина
методом рентгеноструктурного анализа, осуществленное Джоном Кендрю с коллегами в 1950-х гг.
• Миоглобин — это относительно небольшой белок мышечных клеток (Mr = 16 700), связывающий кислород. Его
функция заключается как в хранении кислорода, так и в облегчении его диффузии в быстро сокращающихся
мышечных тканях
• Миоглобин состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка,
последовательность которых известна, и гема (комплекса железа(II) с протопорфирином). Именно с наличием
гема связана темная красно-коричневая окраска миоглобина и гемоглобина. Особенно много миоглобина у
морских млекопитающих — китов, тюленей и дельфинов, так что их мышцы имеют корич- невый цвет.
37.
38.
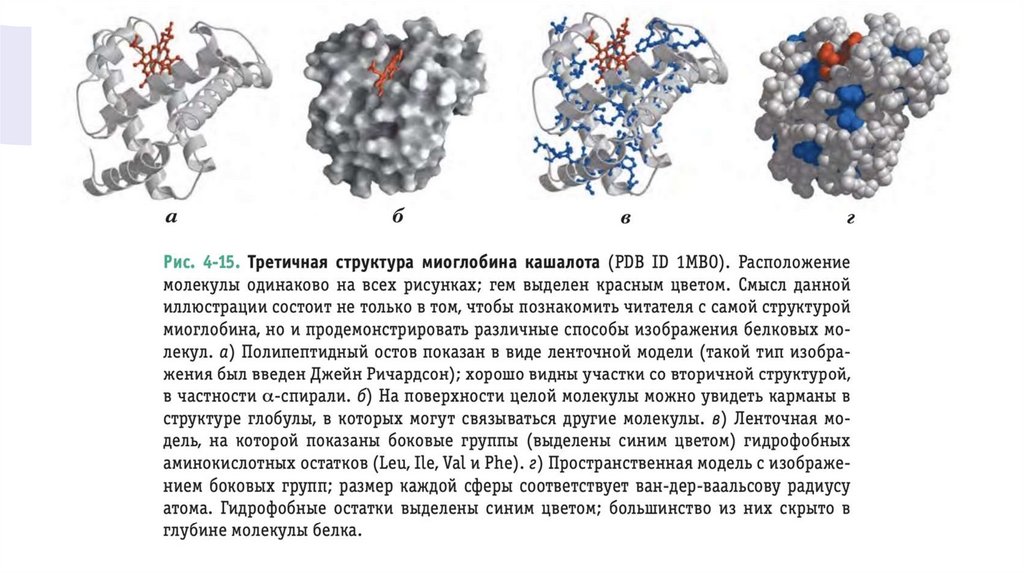
• Гем имеет плоскую форму и находится в щели(кармане) на молекуле миоглобина. В центре гема
расположен атом железа, две координационные
связи которого направлены перпендикулярно к
плоскости гема
• Одна из этих связей соединена с R-группой остатка
His в позиции 93, другая служит для связывания
молекулы кислорода. Внутри кармана доступность
гема для растворителя крайне ограничена. Это
очень важно, поскольку свободный гем очень быстро
окисляется, в результате чего ион Fe2+
превращается в Fe3+, а в такой форме гем не
способен связывать кислород.






























 Биология
Биология








