Похожие презентации:
Роль свободных аминокислот внутри организма. Структуры белковой молекулы. Лекция 2
1.
Лекция 210.09.21
• Роль свободных
аминокислот внутри
организма
• Структуры белковой
молекулы
Самостоятельно – о строении и биологической роли
кератинов, коллагена (!!!), фиброина
гемоглобина (!!!), белках плазмы крови (по учебнику
Анисимова).
2. Содержание лекции
Функции своб акт внутри организма. Первичн и вторичн тр-ры иОбщая характеристика и классификация белков – учить по
Анисимову.
СВОБОДНЫЕ ПЕПТИДЫ – НА САМОСТОЯТЕЛЬНОЕ
ИЗУЧЕНИЕ по учебнику Анисимова (п.2.3 + дополнительный
документ про пептиды и гликопротеины на Sourse!!!)
Декарбоксилирование, амиды.Аминирование, амины. Примеры.
Уровни структурной организации белковой молекулы
(Анисимов, п.2.4, дополнительная литература – Нельсон, Кокс).
Первичная структура белков (определения УЧИТЬ, связи знать,
уметь писать пептидную цепочку). Характеристики пептидной
связи. Вторичная и сверхвторичная структура белков. Домены.
Третичн и четвертичн стр-ры.
Гемоглобин. Строение. Другие дыхательные пигменты
(хлорокруорин, гемэритрин, гемоцианин). Легоглобин и его роль
у растений.
Понятия денатурации, ренатурации Представление о
шаперонах (БТШ), фолдинге, мисфолдинге.,
3.
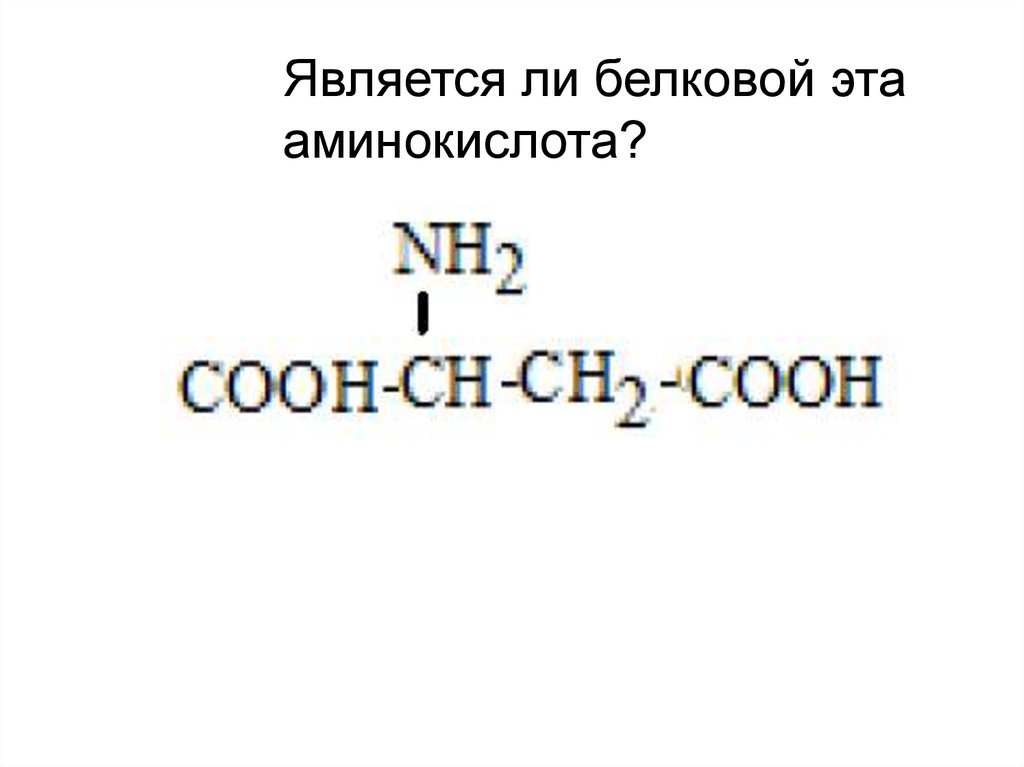
Является ли белковой этааминокислота?
4. Функции аминокислот внутри организма
1. “Строительныйматериал”
2. Сигнальная
Мономеры белков,пептидов
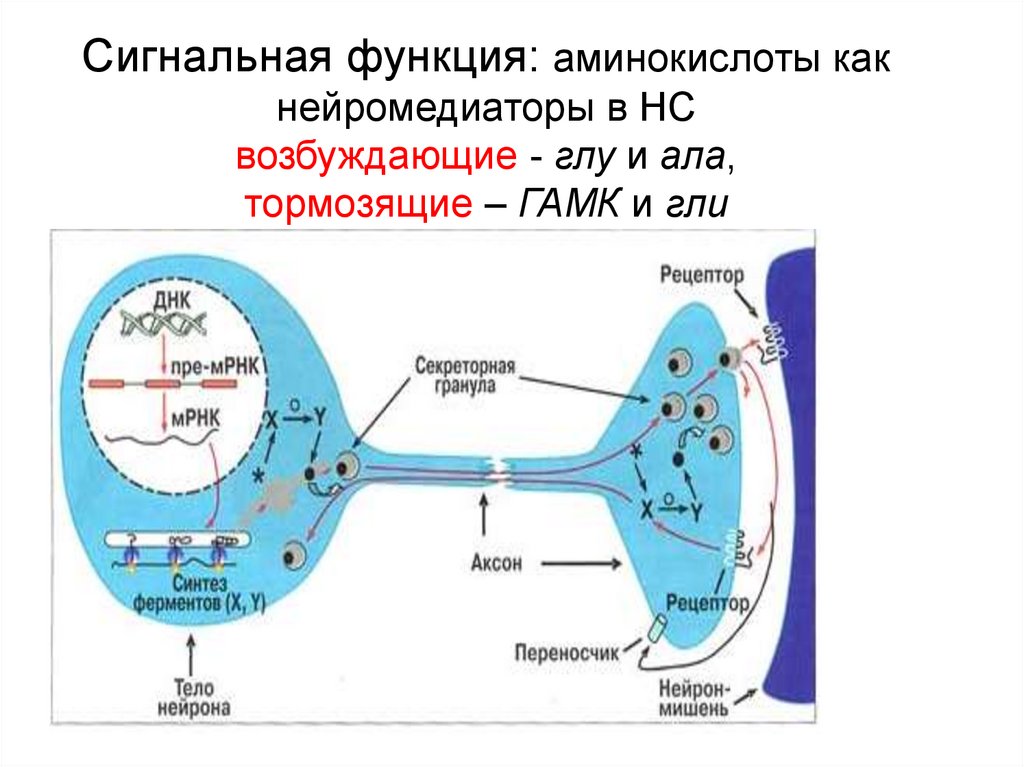
Нейромедиаторы (Глу,
гли,ала, ГАМК)
3. Предшественники для
синтеза, промежуточные
соединения в биосинтезах
- амидов
- биогенных аминов –
нейромедиаторов и гормонов
(тир, три, гис)
- нуклеотидов (асп, глн, гли)
- NO (арг)
- хлорофилла и др.
4. Защитная
- от аммиака (глу, асп)
- осмопротекторы (про)
5. Сигнальная функция: аминокислоты как нейромедиаторы в НС возбуждающие - глу и ала, тормозящие – ГАМК и гли
6. Глутамат как пищевая добавка Е621 Вкус “умами”
• Синдром гиперактивности…• “Синдром китайских ресторанов” –
видимо, не существует?
…сенсорные и моторные нарушения,
ощущения жжения и напряжения лица, боли в
грудной клетке и в голове (несовершенство
гематоэнцефалического барьера,
находящегося в эндотелии капилляров
мозга?)
7. γ-аминомасляная кислота (ГАМК)
Сигнальная функция (ГАМК) и предшественник (глу)γ-аминомасляная кислота (ГАМК)
КФ 4.1.1.15, активна в основном в
сером веществе мозга
• основной нейромедиатор торможения,
рецепторы ГАМК A и ГАМК C – ионные каналы,
активация которых блокирует передачу нервного
импульса
• усилитель усвоения и переработки глюкозы в
ЦНС (→ больше АТФ)
• В 2007 г. рецепоры ГАМК найдены и в эпителии
дых. путей (участие в развитии астмы?).
8. Глицин
• Тормозной нейромедиатор. Связываясь сопределенными белками-рецепторами
(кодируемыми генами GLRA1, GLRA2, GLRA3
и GLRB) - «тормозит» нейроны.
• В спинном мозге тормозит мотонейроны
(используют для устранения повышенного
мышечного тонуса).
• Модулятор: снижает выделение из нейронов
ГЛУ, повышает – ГАМК. НО: Связываясь с
NMDA-рецепторами, способствует передаче
сигнала, вызванного глу и асп.
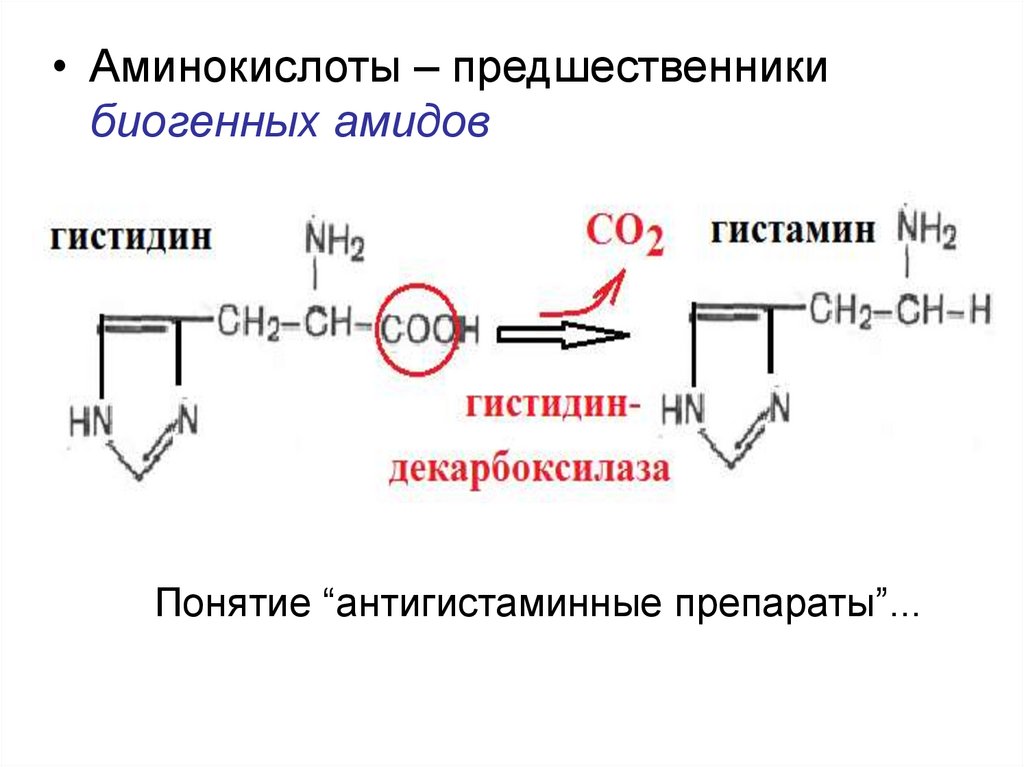
9. Аминокислоты – предшественники амидов
• Амины - орг. соединения, из NH3, вкотором Н замещен на углеводородные
радикалы. Амиды – производные орг.
кислот, у которых в СООH ОН замещен
на NH2.
• Внимание! Амид глутаминовой кислоты
(глу) – глутамин (глн), аспарагиновой -...
Реакция аминирования
10.
• Аминокислоты – предшественникибиогенных амидов
Понятие “антигистаминные препараты”...
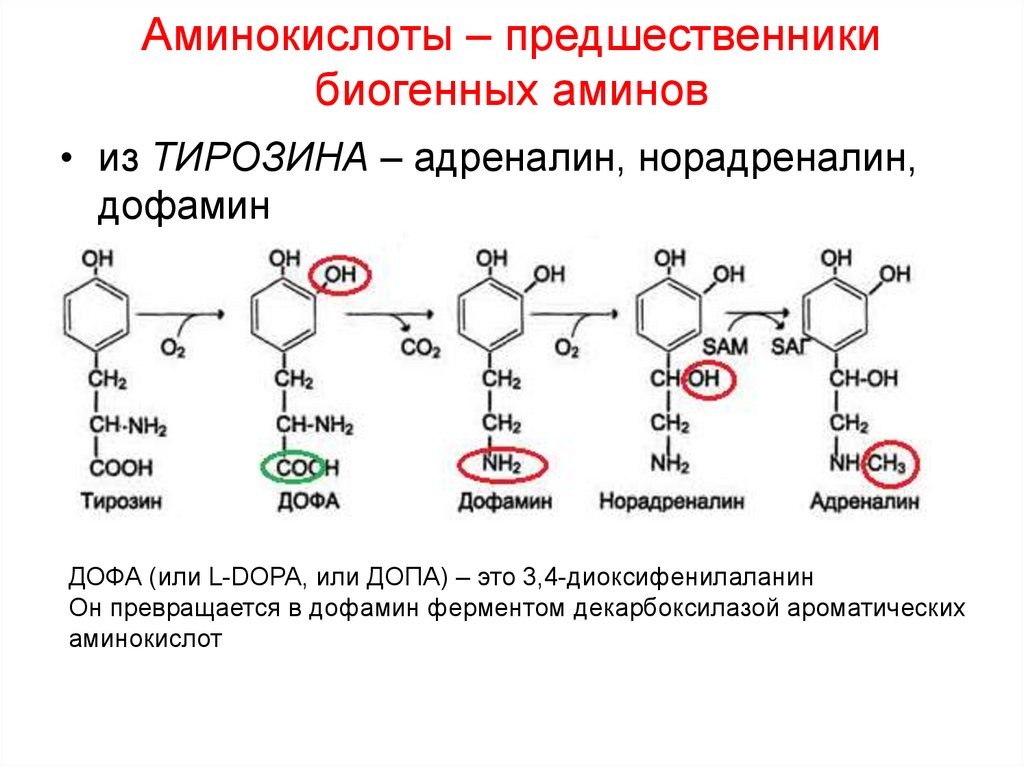
11. Аминокислоты – предшественники биогенных аминов
• из ТИРОЗИНА – адреналин, норадреналин,дофамин
ДОФА (или L-DOPA, или ДОПА) – это 3,4-диоксифенилаланин
Он превращается в дофамин ферментом декарбоксилазой ароматических
аминокислот
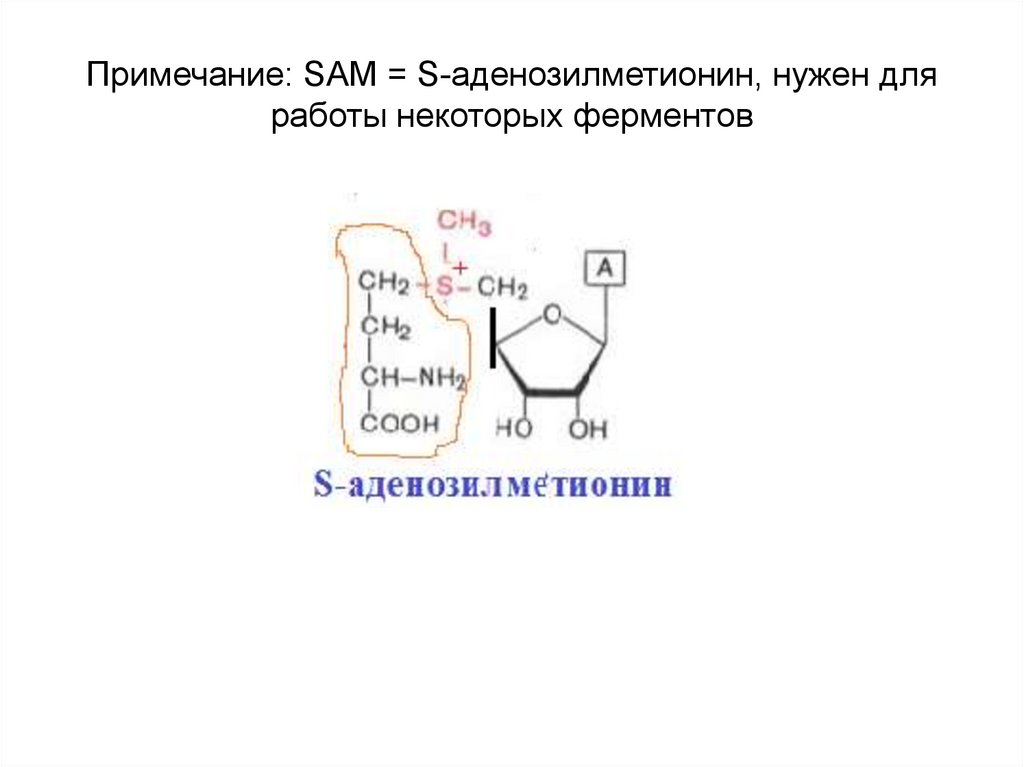
12. Примечание: SAM = S-аденозилметионин, нужен для работы некоторых ферментов
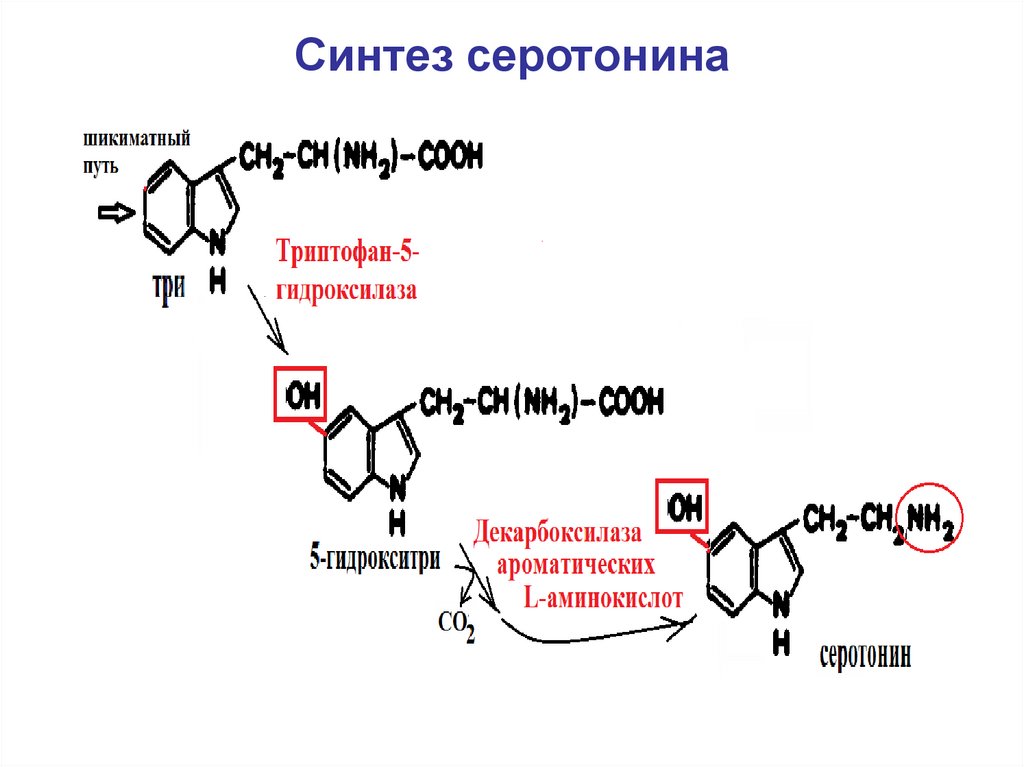
13. Синтез серотонина
14.
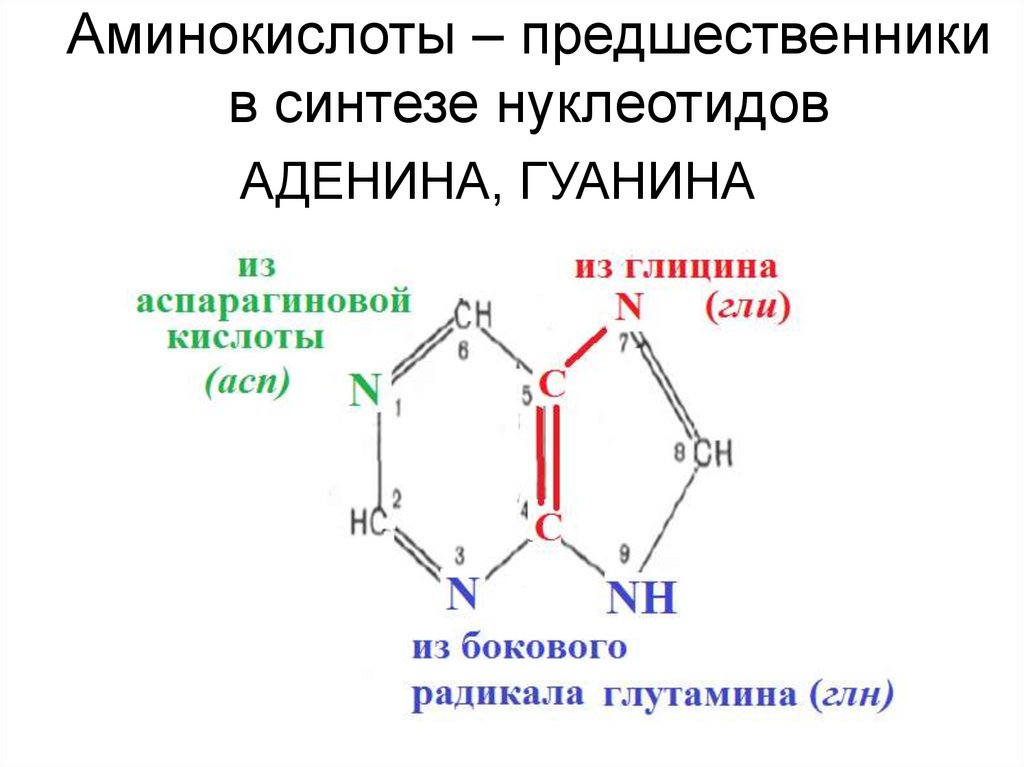
Болезнь Паркинсона15. Аминокислоты – предшественники в синтезе нуклеотидов
АДЕНИНА, ГУАНИНА16. Аргинин – предшественник для синтеза NO.
• Об NO и его эффектах – см. Сосунов А.А.Оксид азота как межклеточный посредник//
Соросовский образовательный журнал,
2000, Т.6, №12.
“NO – это мощный сосудорасширитель, который, как
утверждают, усиливает кровоток в тренируемых мышцах,
повышает спортивную результативность и ускоряет
восстановление” - предтренировочные бустеры оксида
азота (NO), косметические средства…”
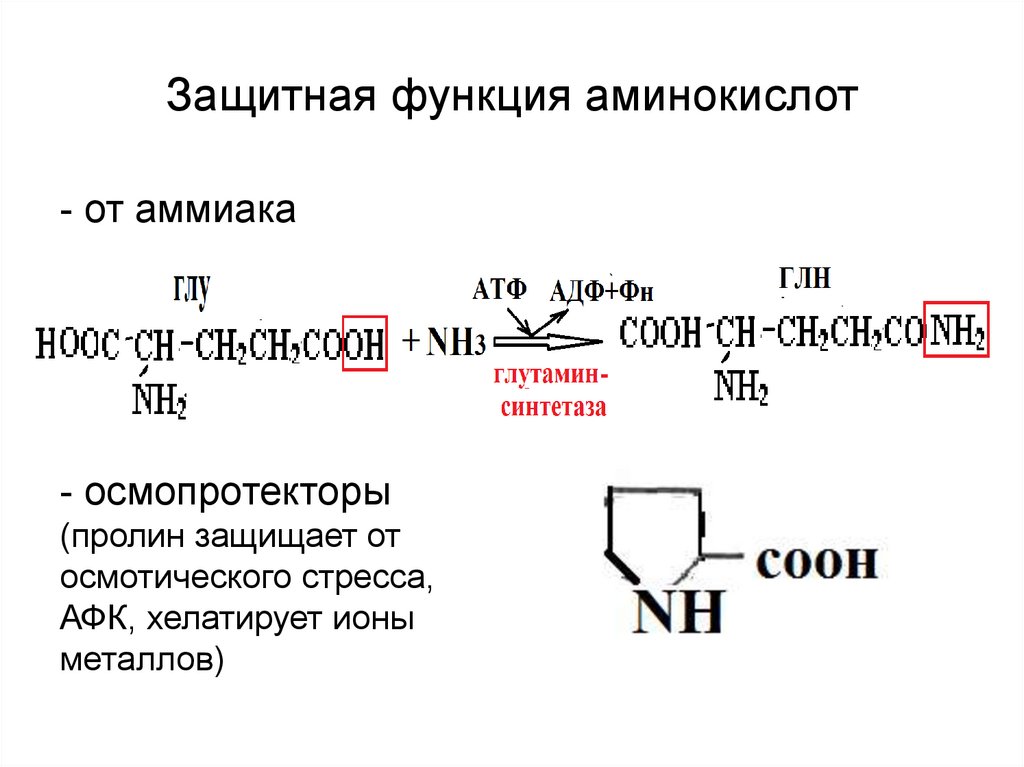
17. Защитная функция аминокислот
- от аммиака- осмопротекторы
(пролин защищает от
осмотического стресса,
АФК, хелатирует ионы
металлов)
18. БЕЛКИ
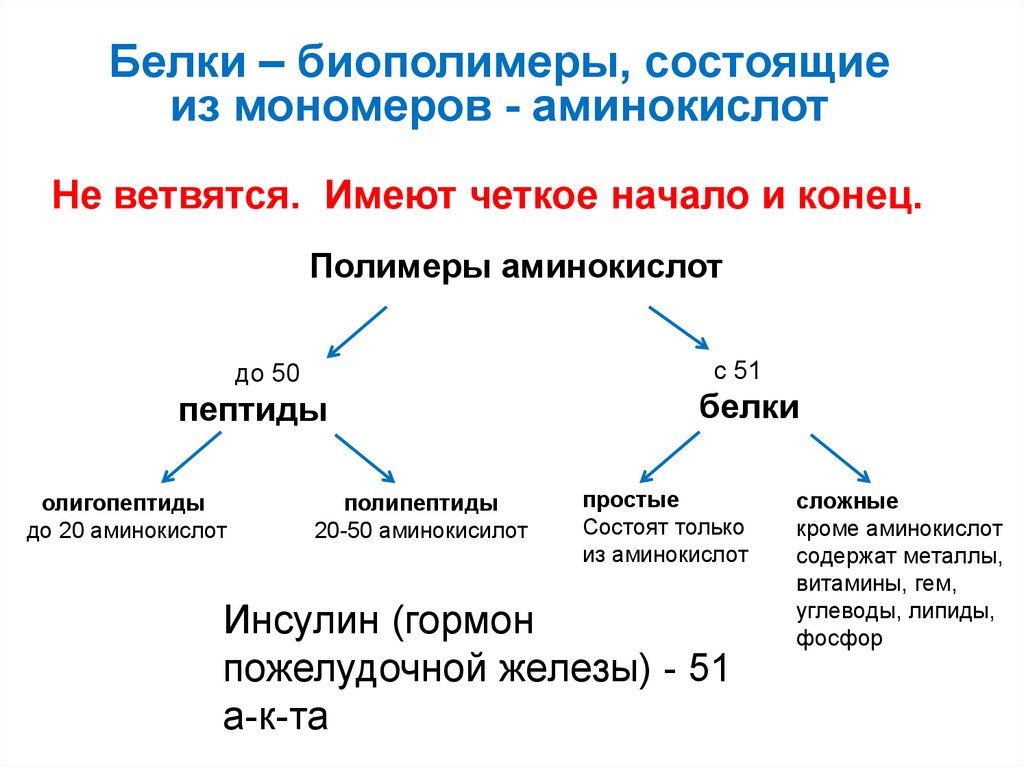
19. Белки – биополимеры, состоящие из мономеров - аминокислот
Не ветвятся. Имеют четкое начало и конец.Полимеры аминокислот
с 51
до 50
пептиды
олигопептиды
до 20 аминокислот
полипептиды
20-50 аминокисилот
белки
простые
Состоят только
из аминокислот
Инсулин (гормон
пожелудочной железы) - 51
а-к-та
сложные
кроме аминокислот
содержат металлы,
витамины, гем,
углеводы, липиды,
фосфор
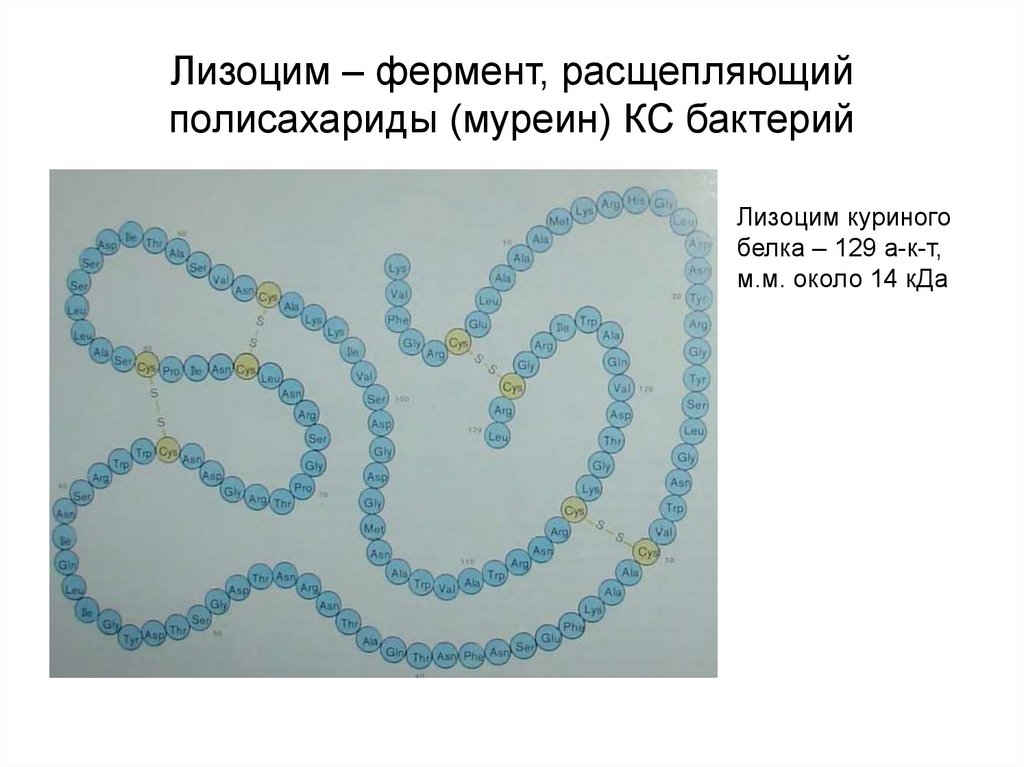
20. Лизоцим – фермент, расщепляющий полисахариды (муреин) КС бактерий
Лизоцим куриногобелка – 129 а-к-т,
м.м. около 14 кДа
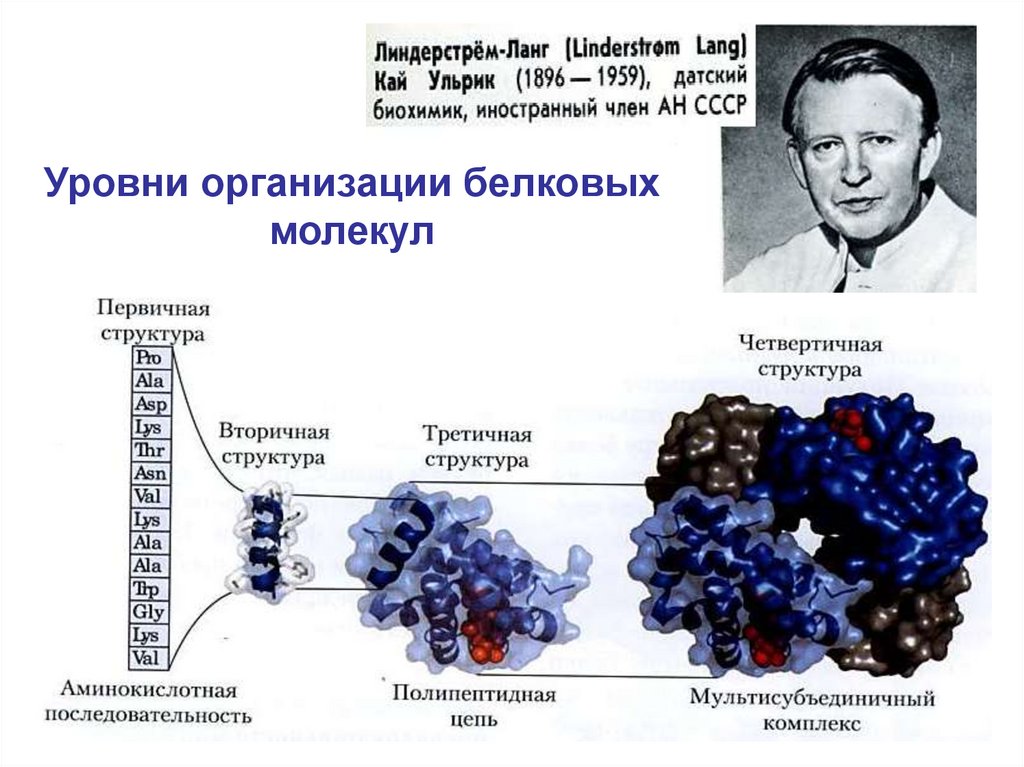
21.
Уровни организации белковыхмолекул
22.
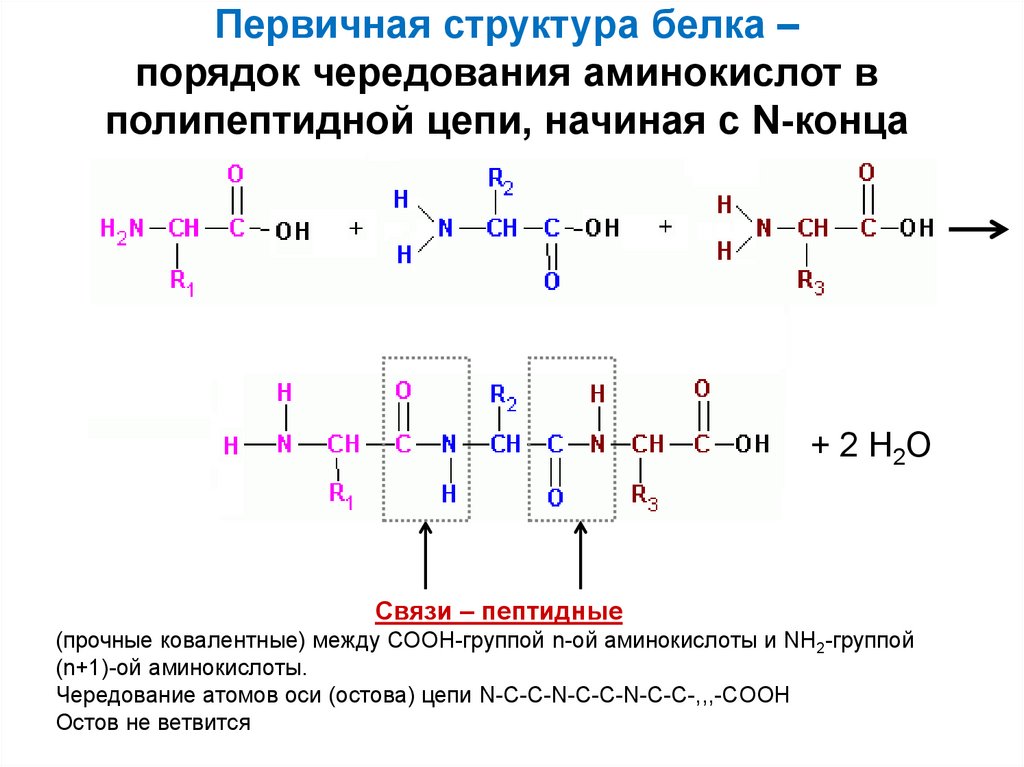
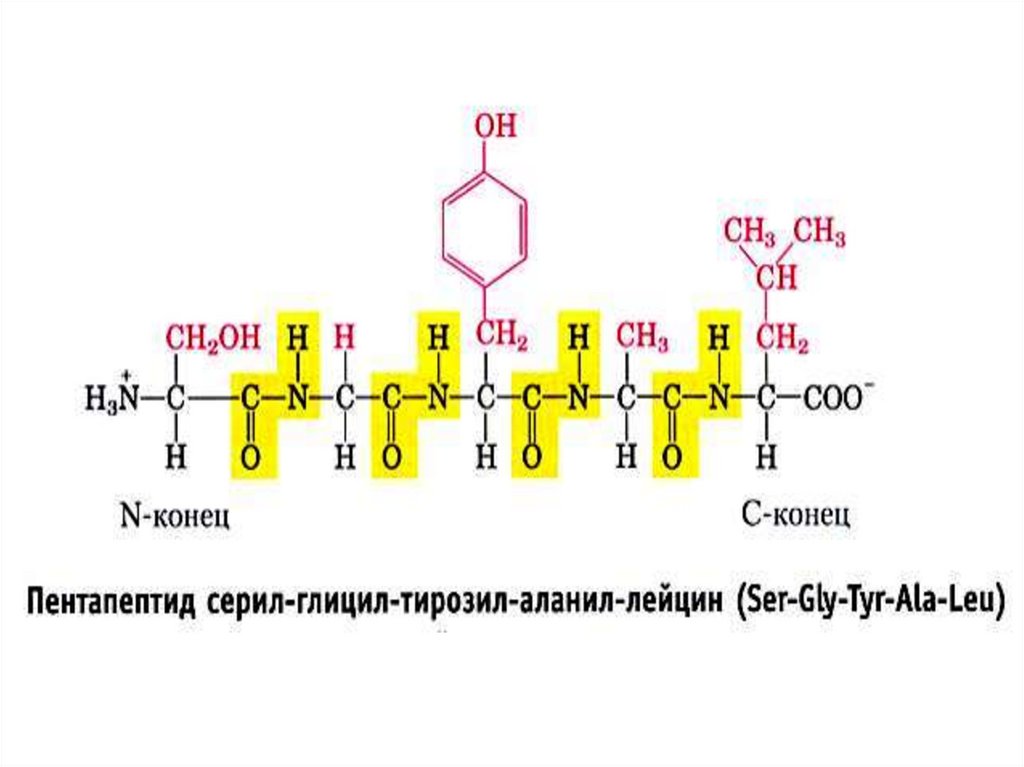
23. Первичная структура белка – порядок чередования аминокислот в полипептидной цепи, начиная с N-конца
+ 2 Н2ОСвязи – пептидные
(прочные ковалентные) между СООН-группой n-ой аминокислоты и NH2-группой
(n+1)-ой аминокислоты.
Чередование атомов оси (остова) цепи N-C-C-N-C-C-N-C-C-,,,-COOH
Остов не ветвится
24.
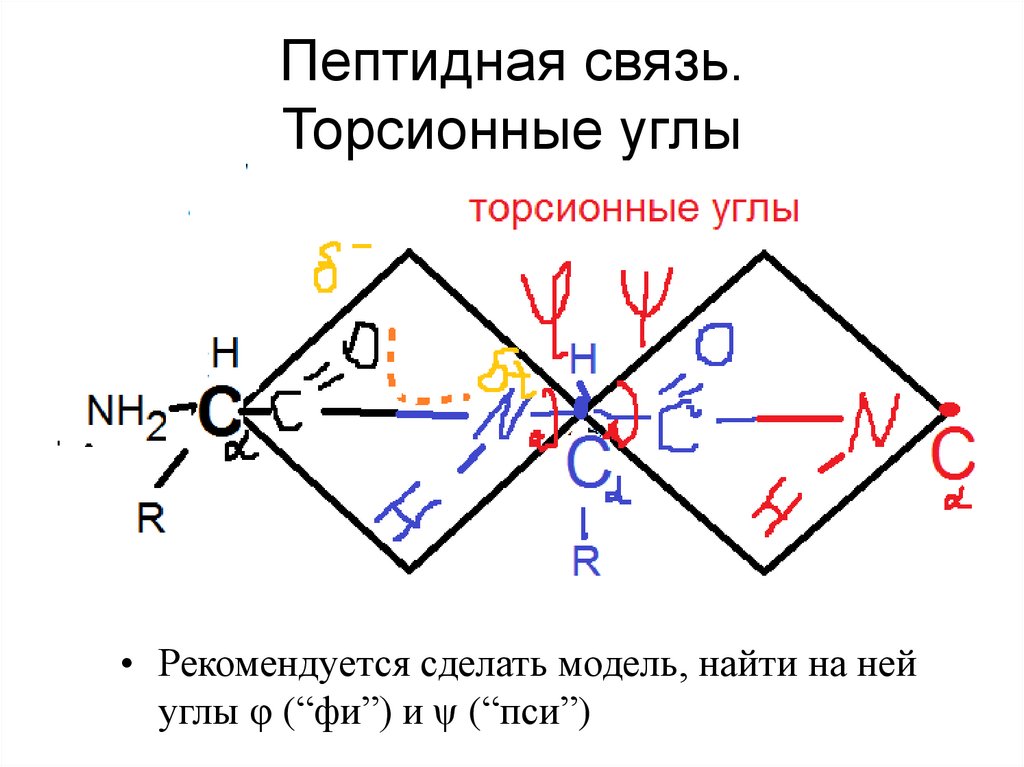
25. Пептидная связь. Торсионные углы
• Рекомендуется сделать модель, найти на нейуглы φ (“фи”) и ψ (“пси”)
26.
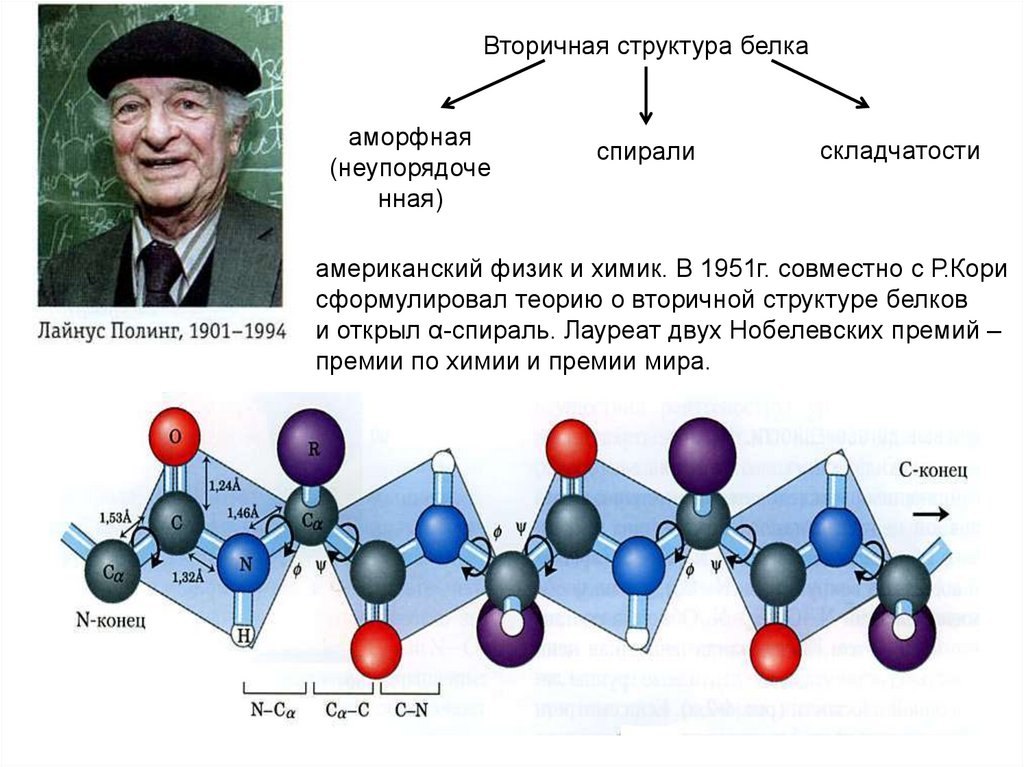
Вторичная структура белкааморфная
(неупорядоче
нная)
спирали
складчатости
американский физик и химик. В 1951г. совместно с Р.Кори
сформулировал теорию о вторичной структуре белков
и открыл α-спираль. Лауреат двух Нобелевских премий –
премии по химии и премии мира.
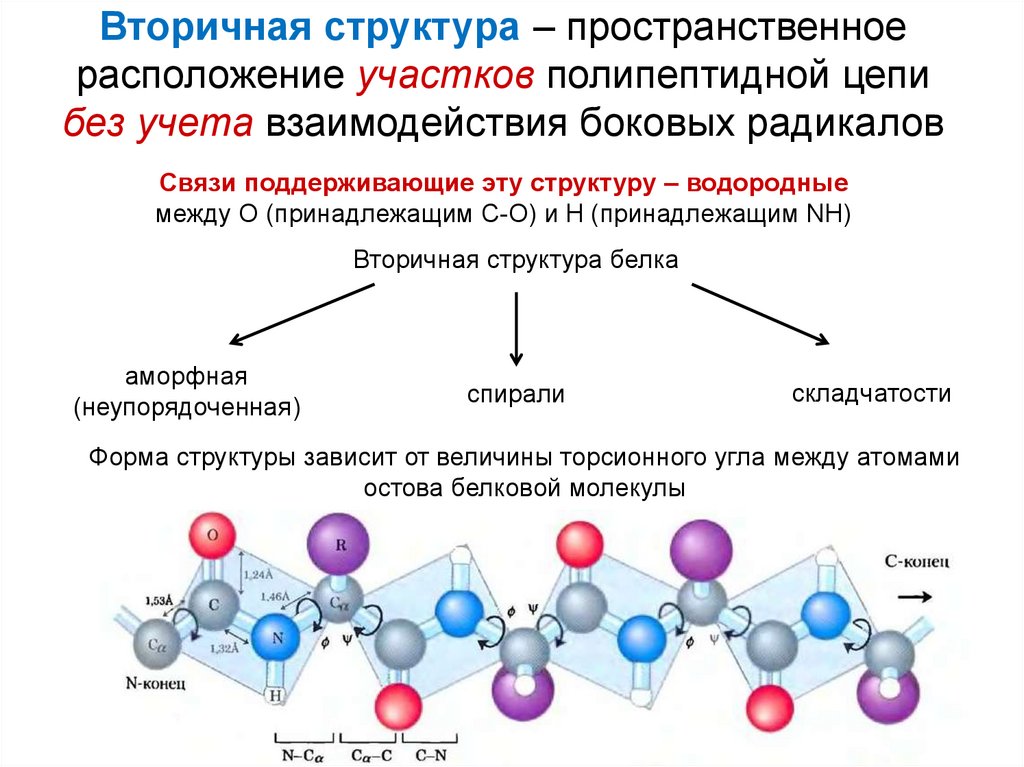
27. Вторичная структура – пространственное расположение участков полипептидной цепи без учета взаимодействия боковых радикалов
Связи поддерживающие эту структуру – водородныемежду О (принадлежащим С-О) и Н (принадлежащим NН)
Вторичная структура белка
аморфная
(неупорядоченная)
спирали
складчатости
Форма структуры зависит от величины торсионного угла между атомами
остова белковой молекулы
28.
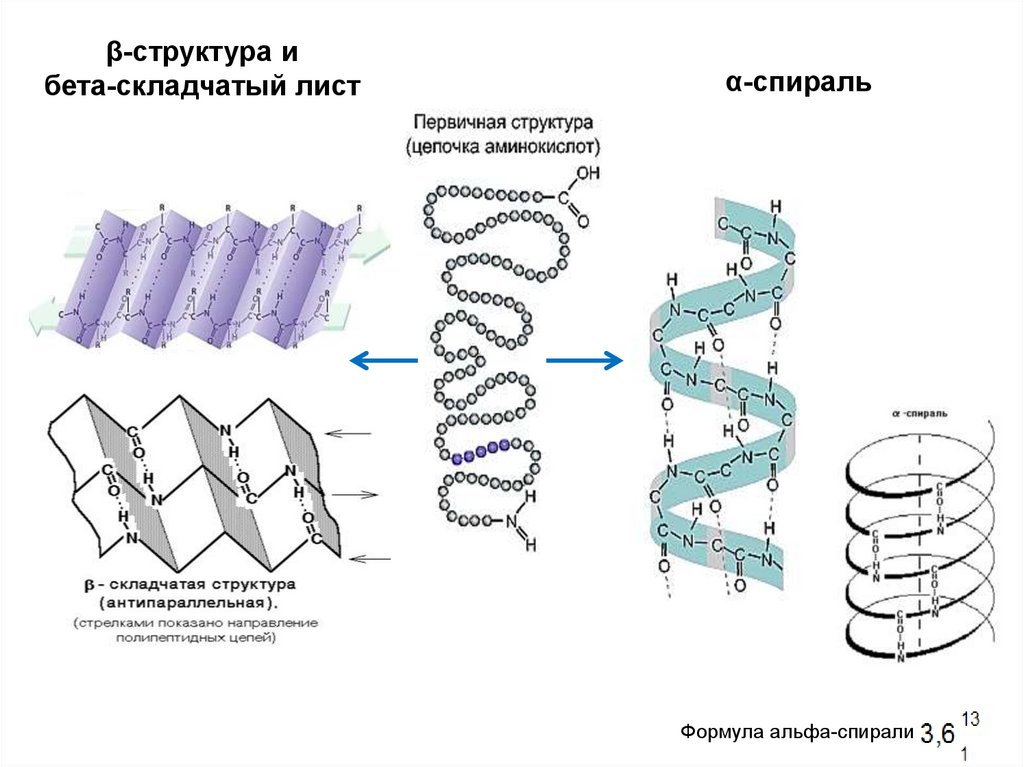
β-структура ибета-складчатый лист
α-спираль
Формула альфа-спирали
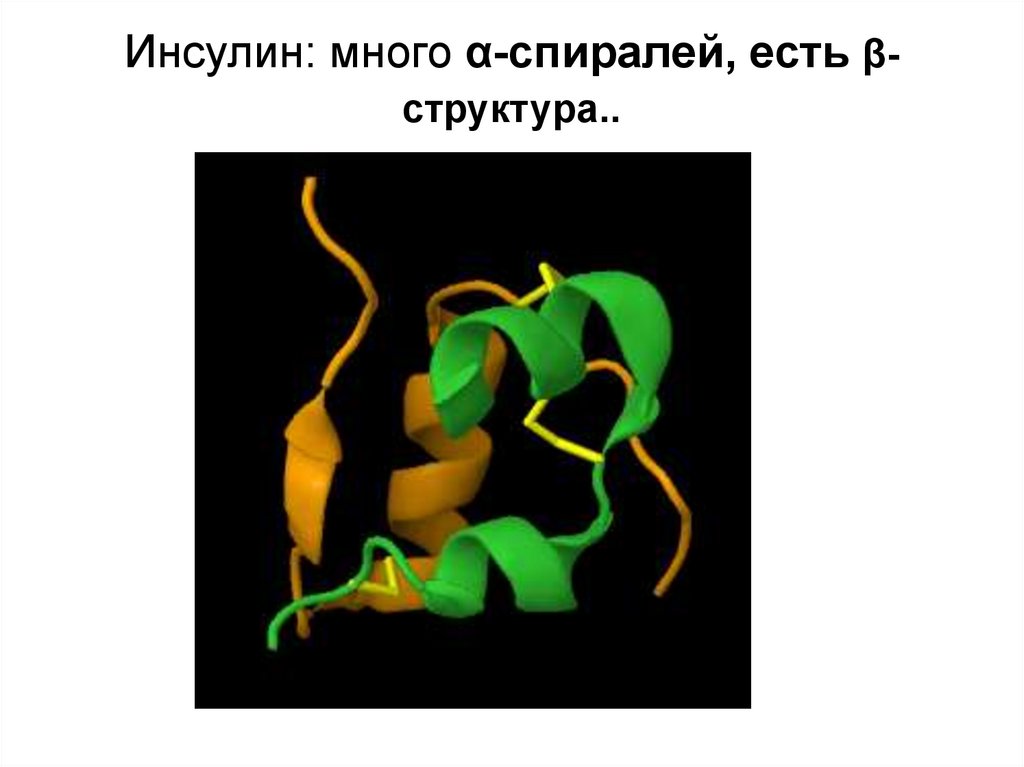
29. Инсулин: много α-спиралей, есть β-структура..
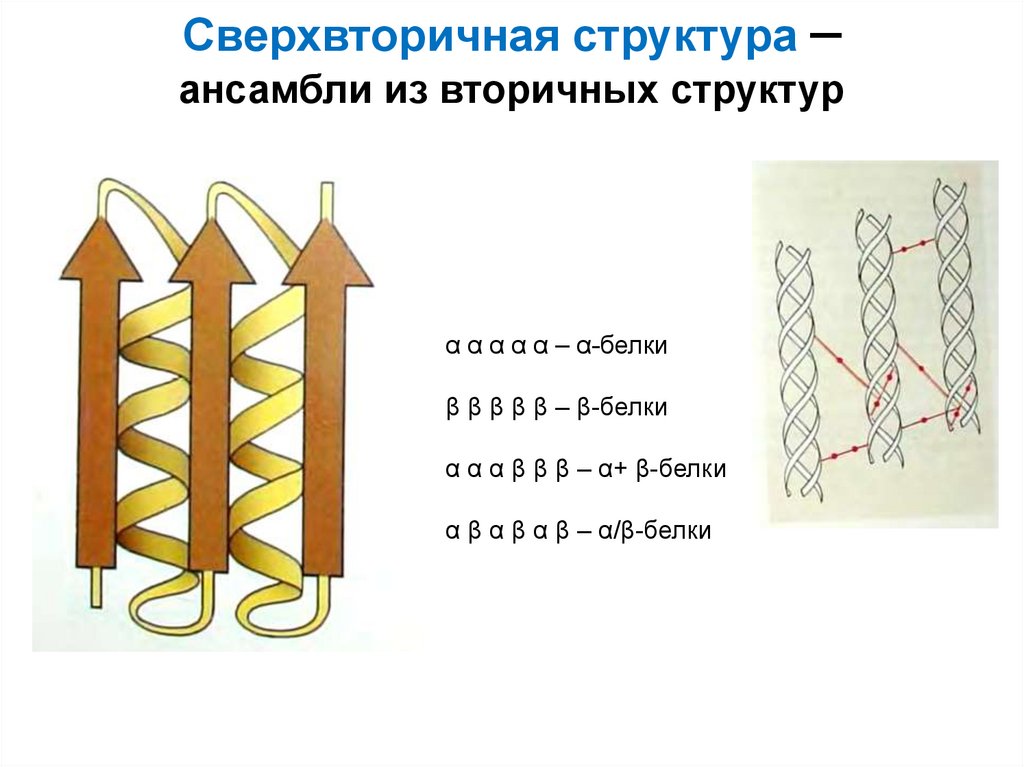
Инсулин: много α-спиралей, есть βструктура..30. Сверхвторичная структура – ансамбли из вторичных структур
α α α α α – α-белкиβ β β β β – β-белки
α α α β β β – α+ β-белки
α β α β α β – α/β-белки
31.
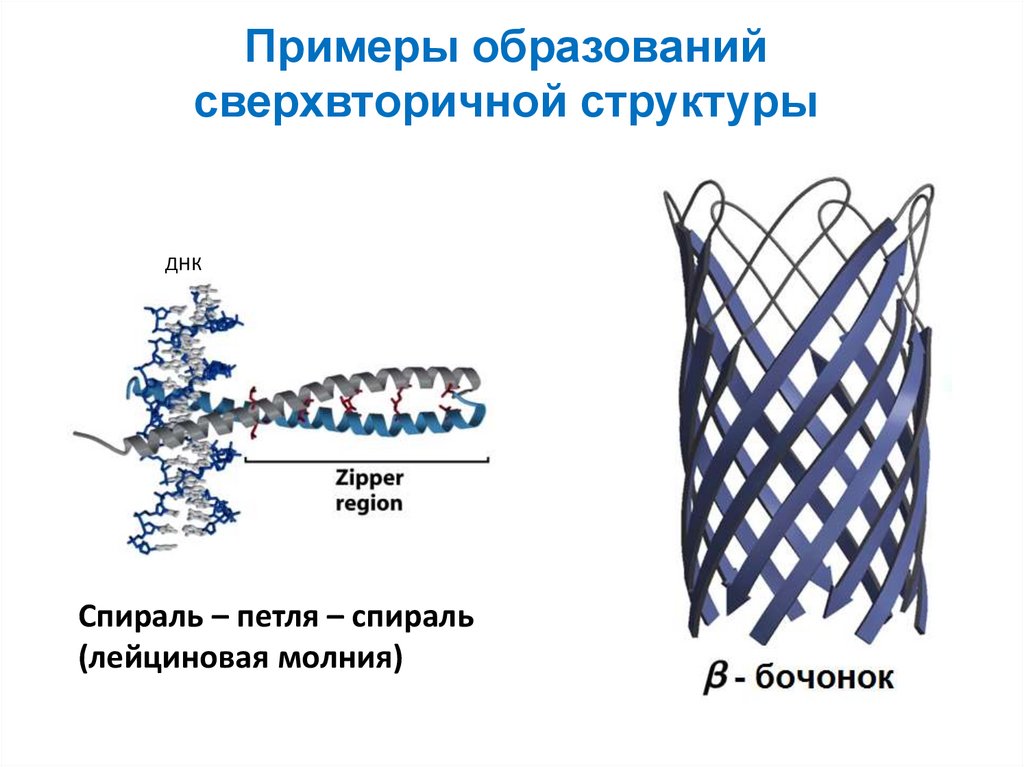
32. Примеры образований сверхвторичной структуры
ДНКСпираль – петля – спираль
(лейциновая молния)
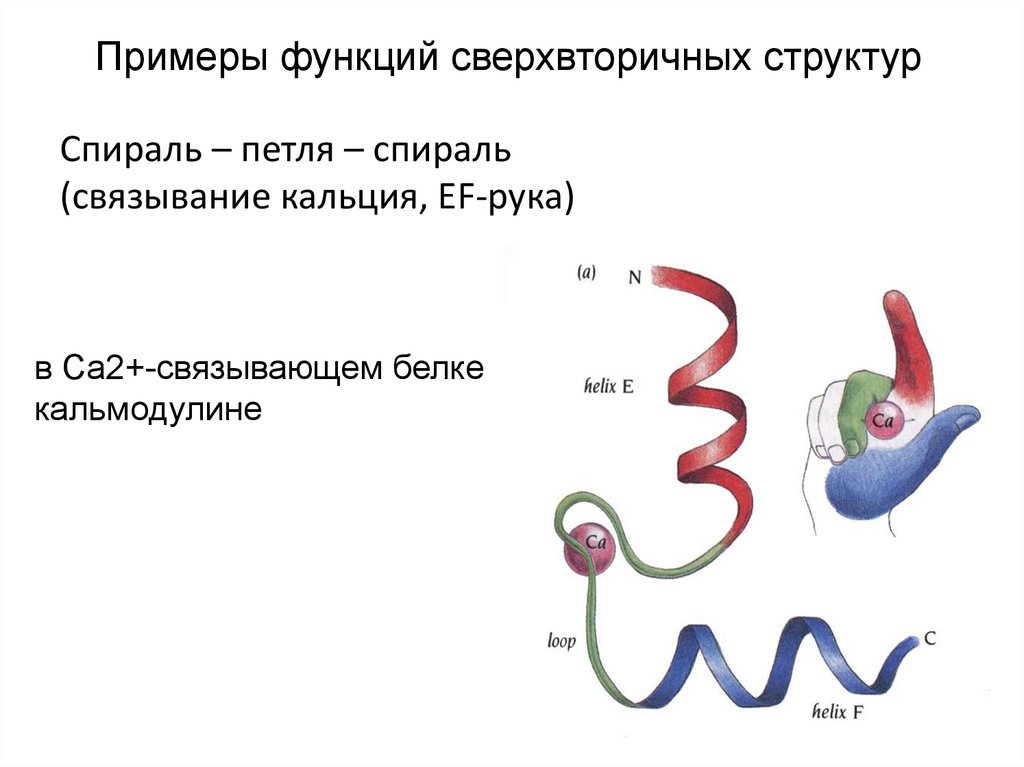
33. Примеры функций сверхвторичных структур
Спираль – петля – спираль(связывание кальция, EF-рука)
в Са2+-связывающем белке
кальмодулине
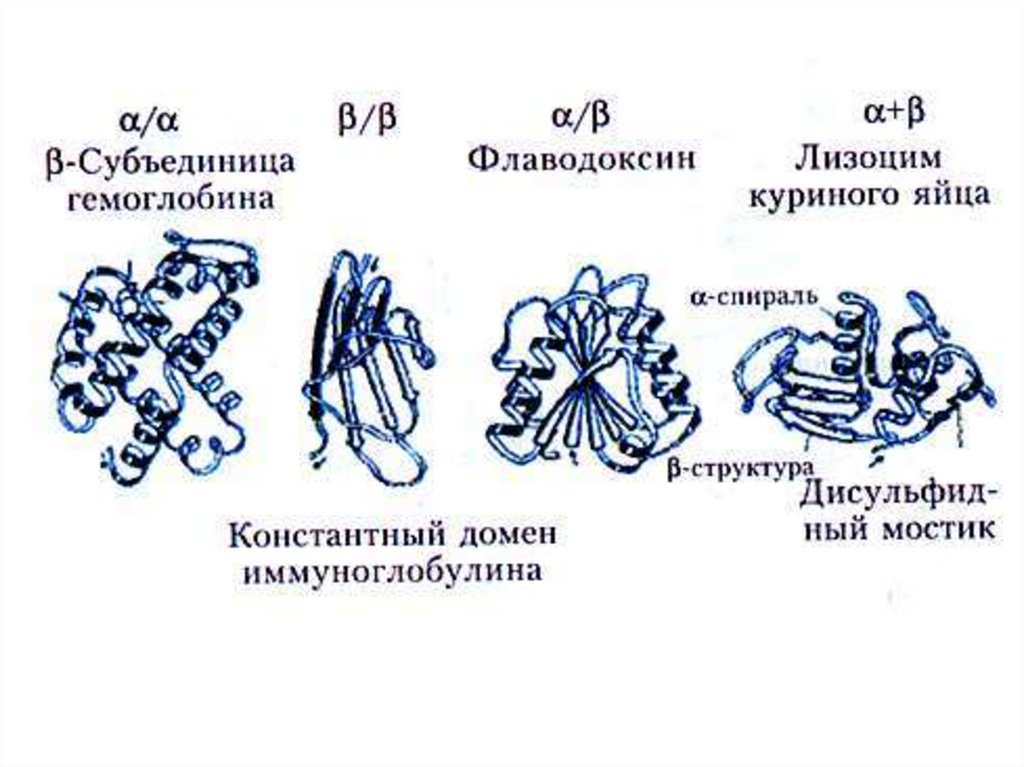
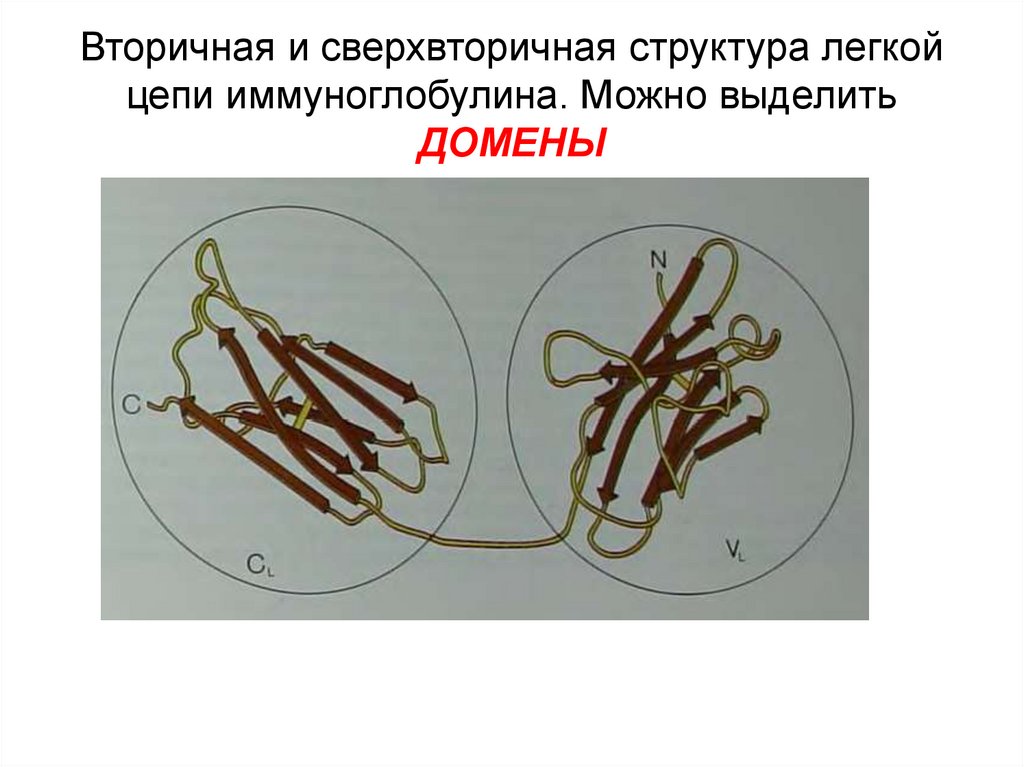
34. Вторичная и сверхвторичная структура легкой цепи иммуноглобулина. Можно выделить ДОМЕНЫ
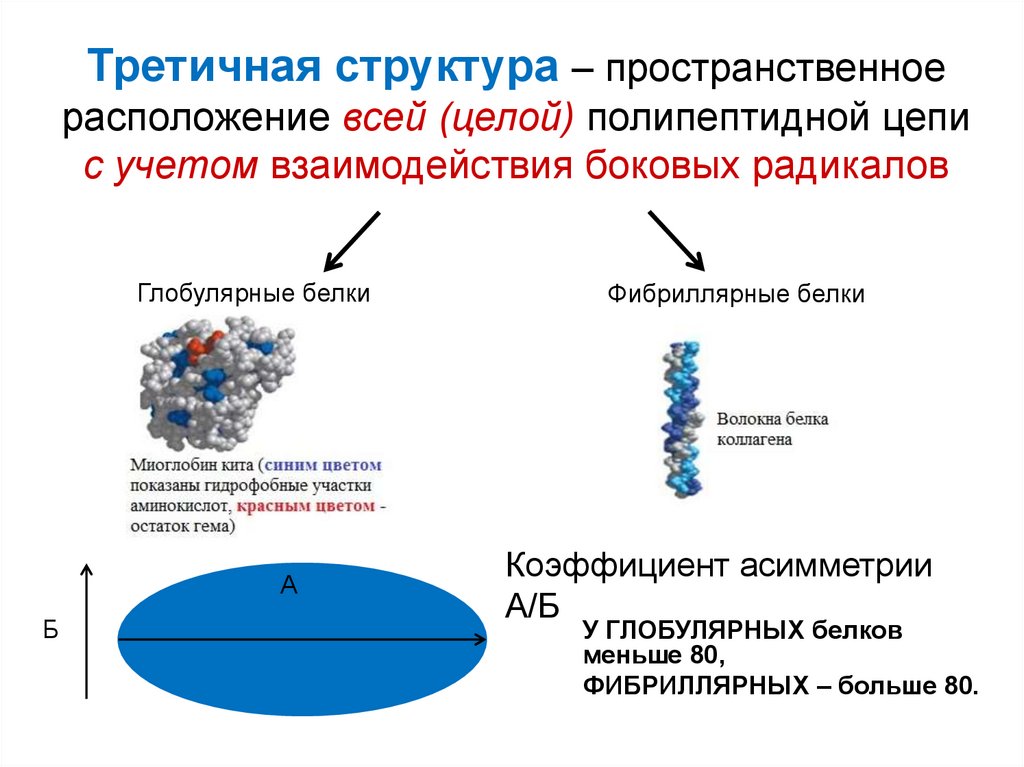
35. Третичная структура – пространственное расположение всей (целой) полипептидной цепи с учетом взаимодействия боковых радикалов
Глобулярные белкиА
Б
Фибриллярные белки
Коэффициент асимметрии
А/Б
У ГЛОБУЛЯРНЫХ белков
меньше 80,
ФИБРИЛЛЯРНЫХ – больше 80.
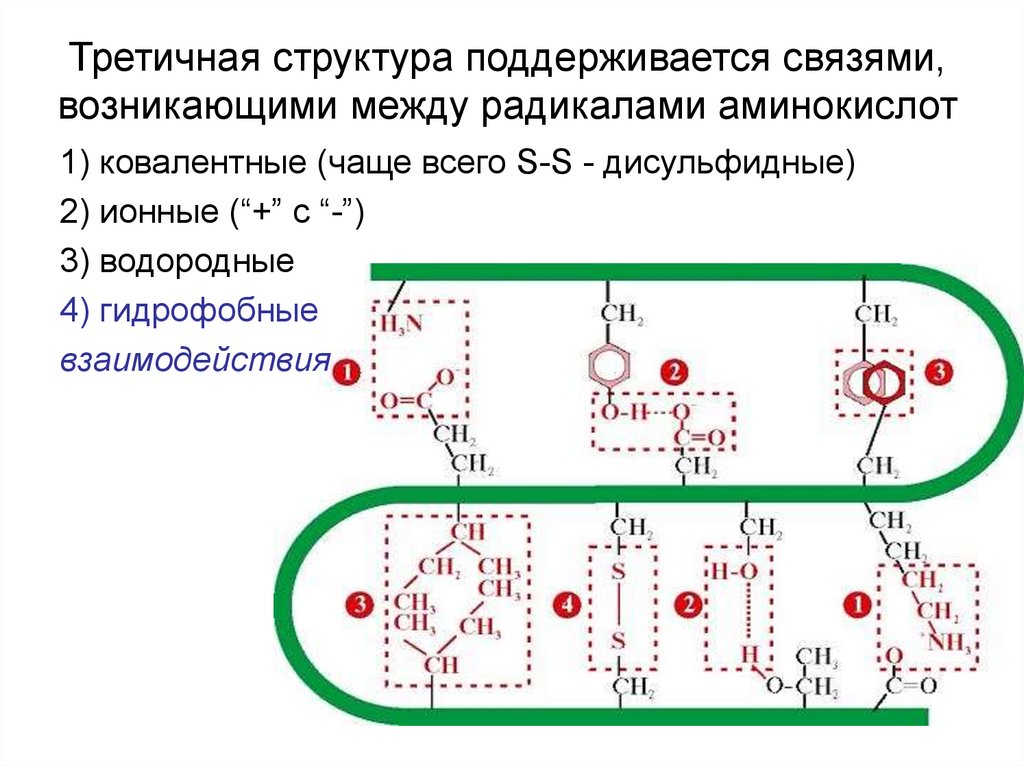
36. Третичная структура поддерживается связями, возникающими между радикалами аминокислот
1) ковалентные (чаще всего S-S - дисульфидные)2) ионные (“+” c “-”)
3) водородные
4) гидрофобные
взаимодействия
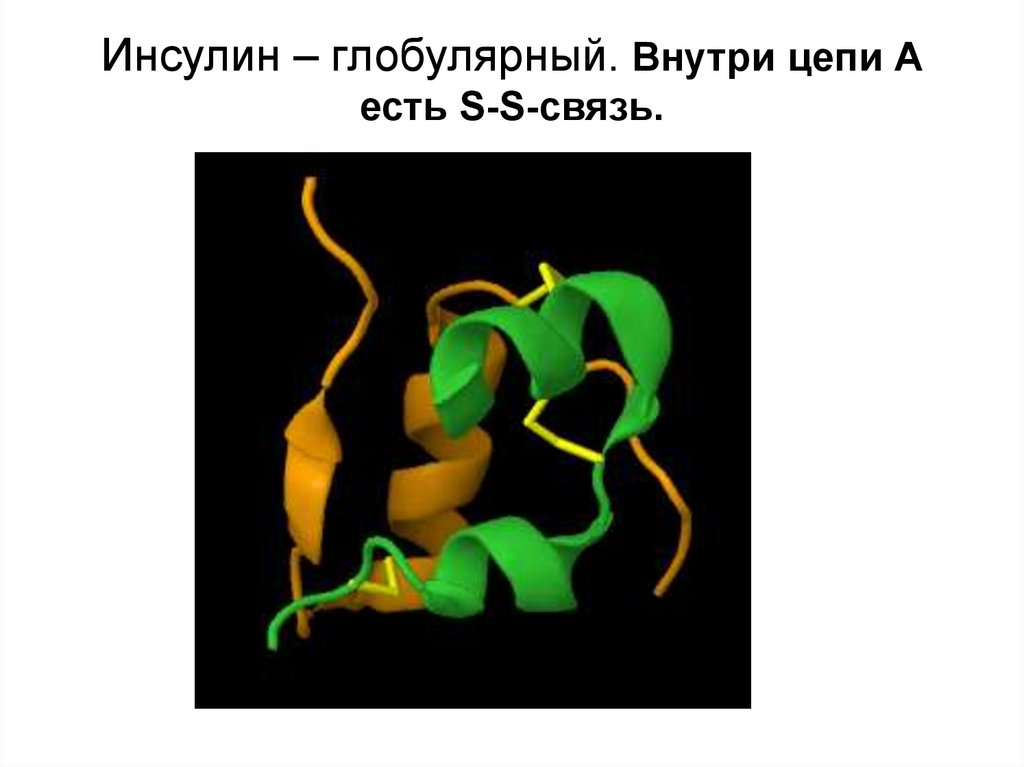
37. Инсулин – глобулярный. Внутри цепи А есть S-S-связь.
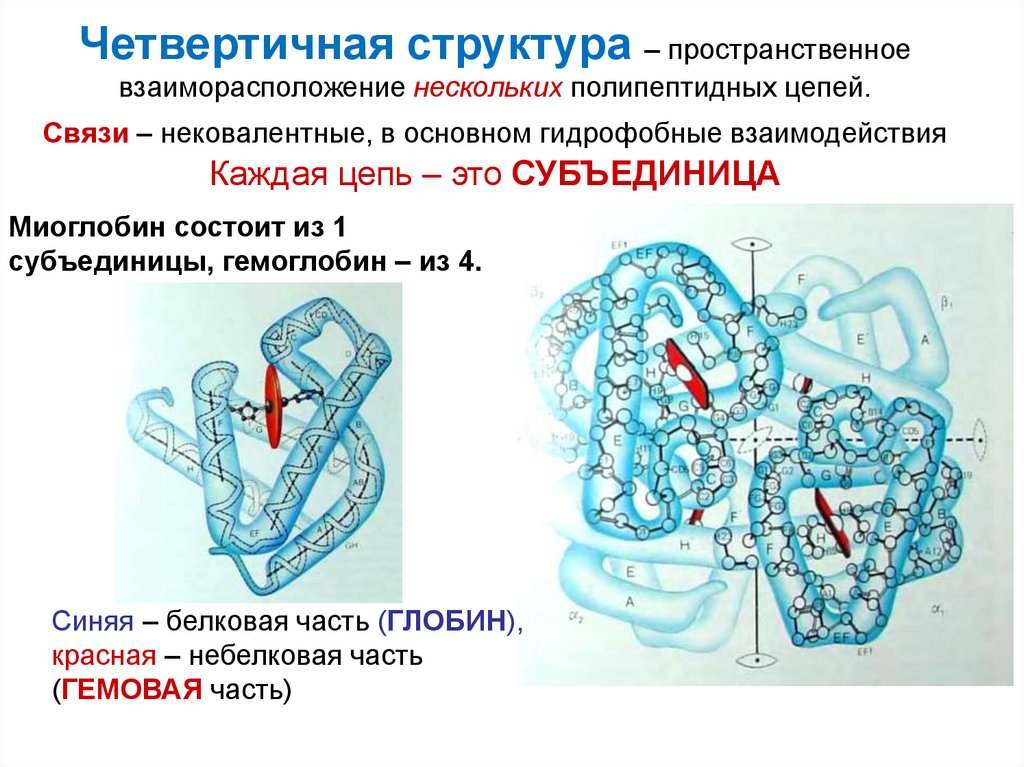
38. Четвертичная структура – пространственное взаиморасположение нескольких полипептидных цепей. Связи – нековалентные, в основном
гидрофобные взаимодействияКаждая цепь – это СУБЪЕДИНИЦА
Миоглобин состоит из 1
субъединицы, гемоглобин – из 4.
Синяя – белковая часть (ГЛОБИН),
красная – небелковая часть
(ГЕМОВАЯ часть)
39.
40. Глутаминсинтетаза Escherichia coli состоит из 12 одинаковых субъединиц
РНК-полимераза E. coliсостоит из 5 разных
субъединиц
41.
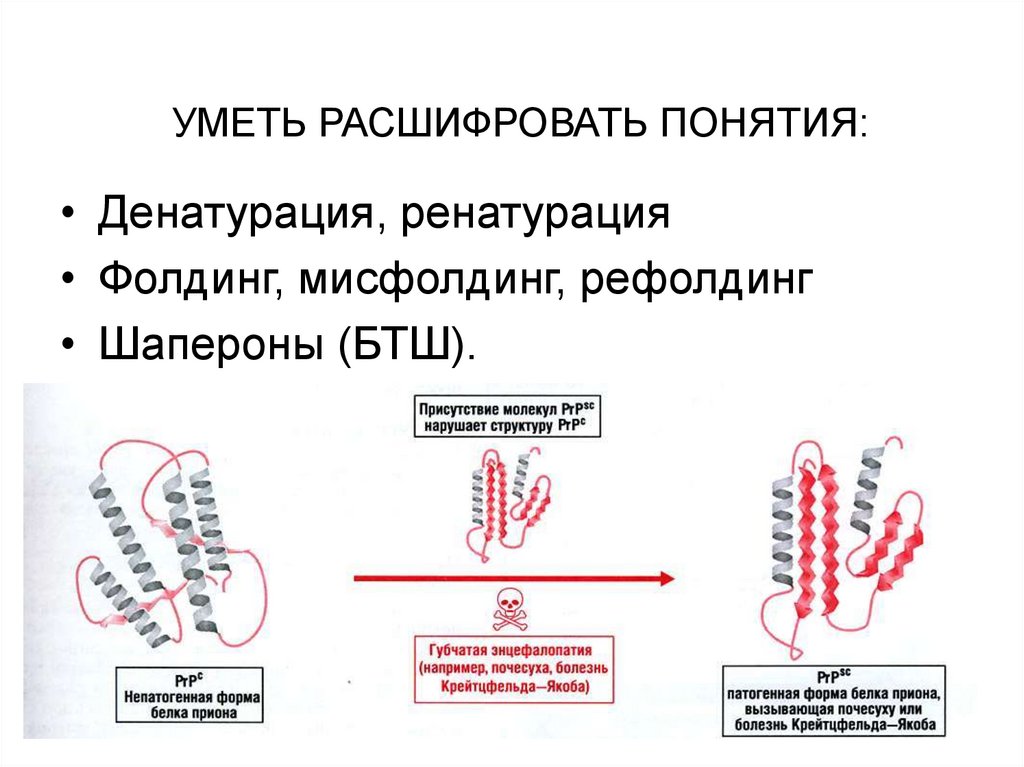
УМЕТЬ РАСШИФРОВАТЬ ПОНЯТИЯ:• Денатурация, ренатурация
• Фолдинг, мисфолдинг, рефолдинг
• Шапероны (БТШ).
42. Особенности структуры гемоглобина. Связь с функциями. Другие дыхательные пигменты.
английский биохимик,с помощью рентгеноструктурного
анализа расшифровал
пространственное строение
гемоглобина (1960)
43. Знать и уметь пояснить:
• Сложный белок – хромопротеин• Транспортный – переносит О2 к тканям и СО2
от них. Окси- и карбаминоHb.
• Есть четвертичная структура, проявляет
кооперативность
• Обладает гетерогенностью (видовой,
онтогенетической, популяционной...)
• Аномальные гемоглобины (генетически
дефектные и обусловленные химическими
агентами) – примеры.
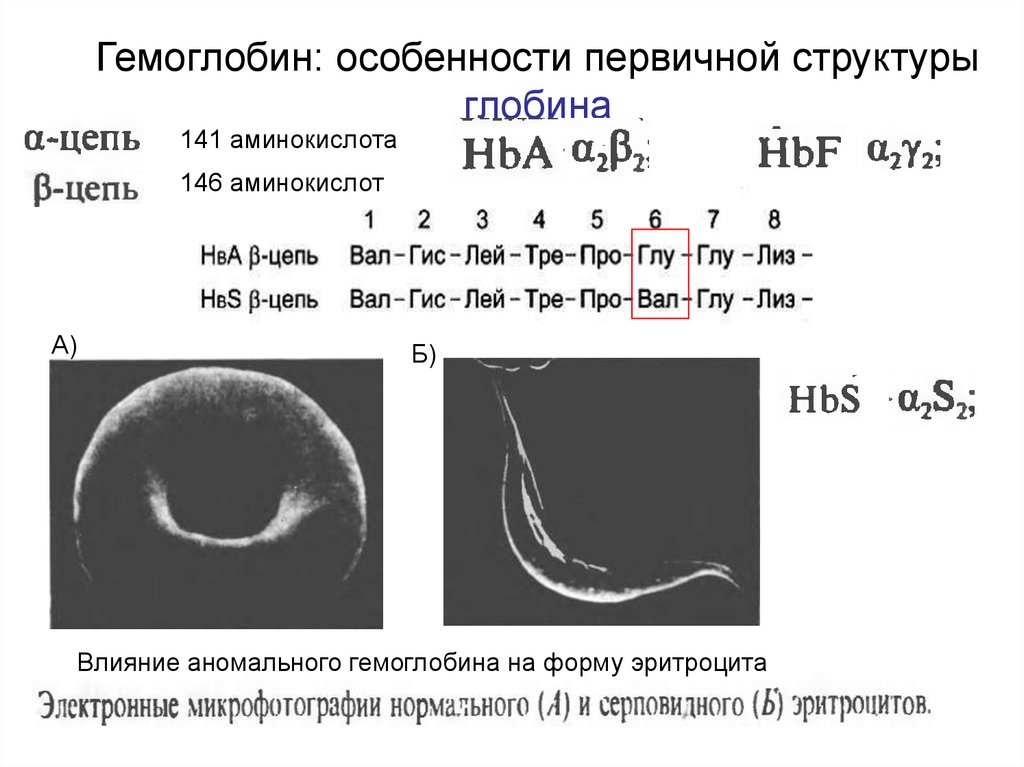
44. Гемоглобин: особенности первичной структуры глобина
141 аминокислота146 аминокислот
А)
Б)
Влияние аномального гемоглобина на форму эритроцита
45. Гемоглобин: особенности вторичной структуры
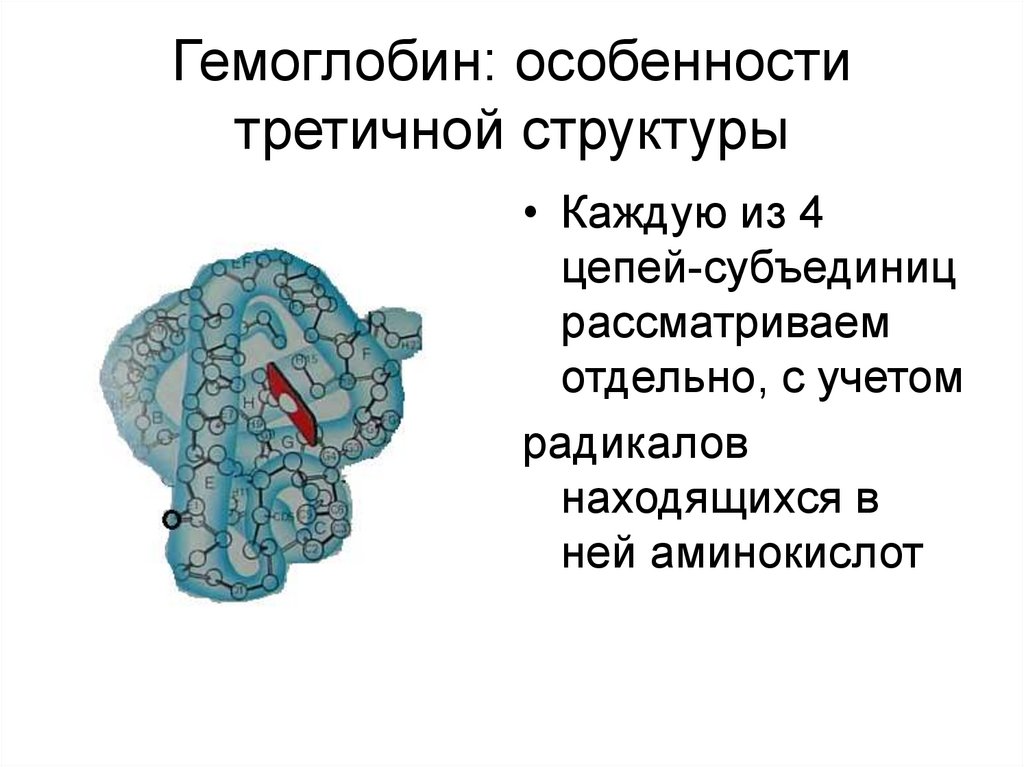
Примерно 80% молекулы – в виде α-спиралей.46. Гемоглобин: особенности третичной структуры
• Каждую из 4цепей-субъединиц
рассматриваем
отдельно, с учетом
радикалов
находящихся в
ней аминокислот
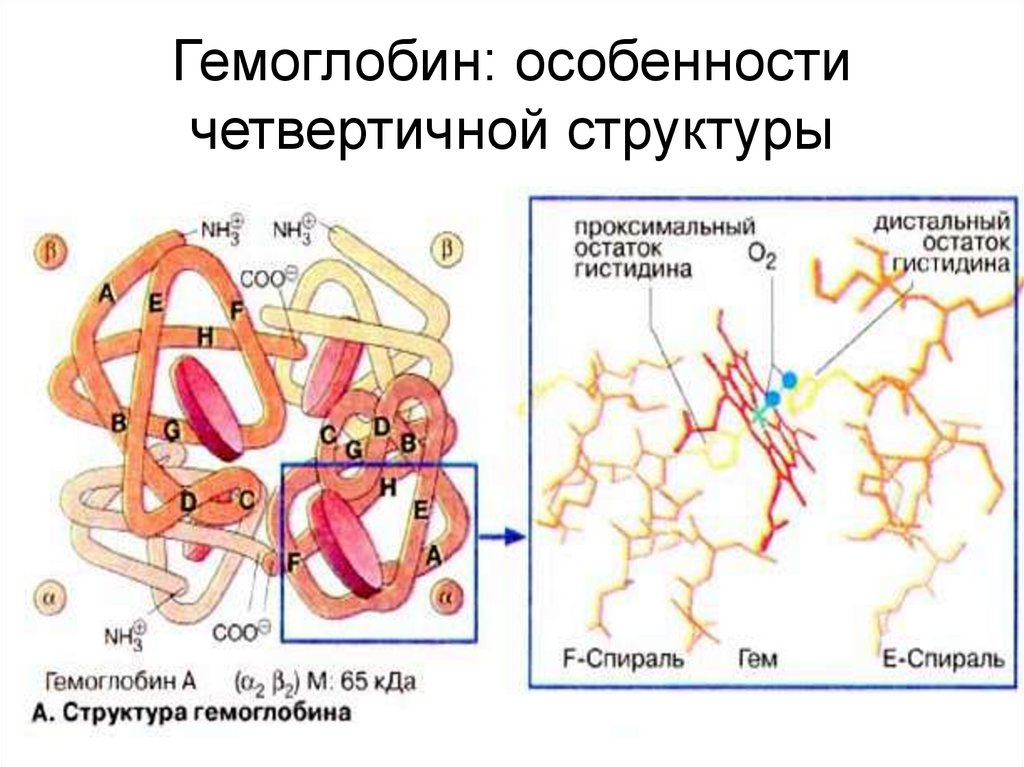
47. Гемоглобин: особенности четвертичной структуры
48.
Взрослый человек: 2 α и 2 β-цепи (!!! это не вторичныеструктуры, а принятое обозначение отдельных
полипептидных цепей).
4 гема
“Гемовый карман” выстлан гидрофобными
аминокислотами, оттуда вытеснена вода.
МОЛЕКУЛЯРНАЯ МАССА (М.м.)–
ОКОЛО 66 000 Да = 66 кДа
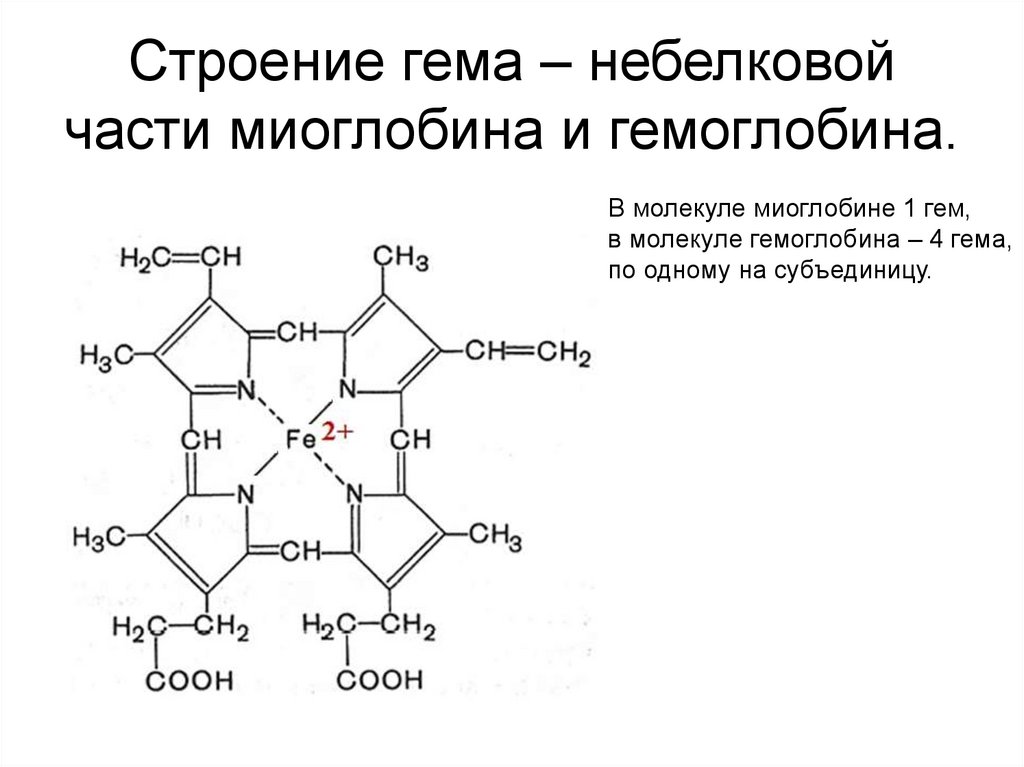
49. Строение гема – небелковой части миоглобина и гемоглобина.
В молекуле миоглобине 1 гем,в молекуле гемоглобина – 4 гема,
по одному на субъединицу.
50.
Свойство кооперативности длягемоглобина описал датский физиолог
Кристиан Бор (1903, 1904) – уметь
объяснить, в чем заключается и из-за
каких особенностей структуры
становится возможно.
См. по учебнику Анисимова или др.
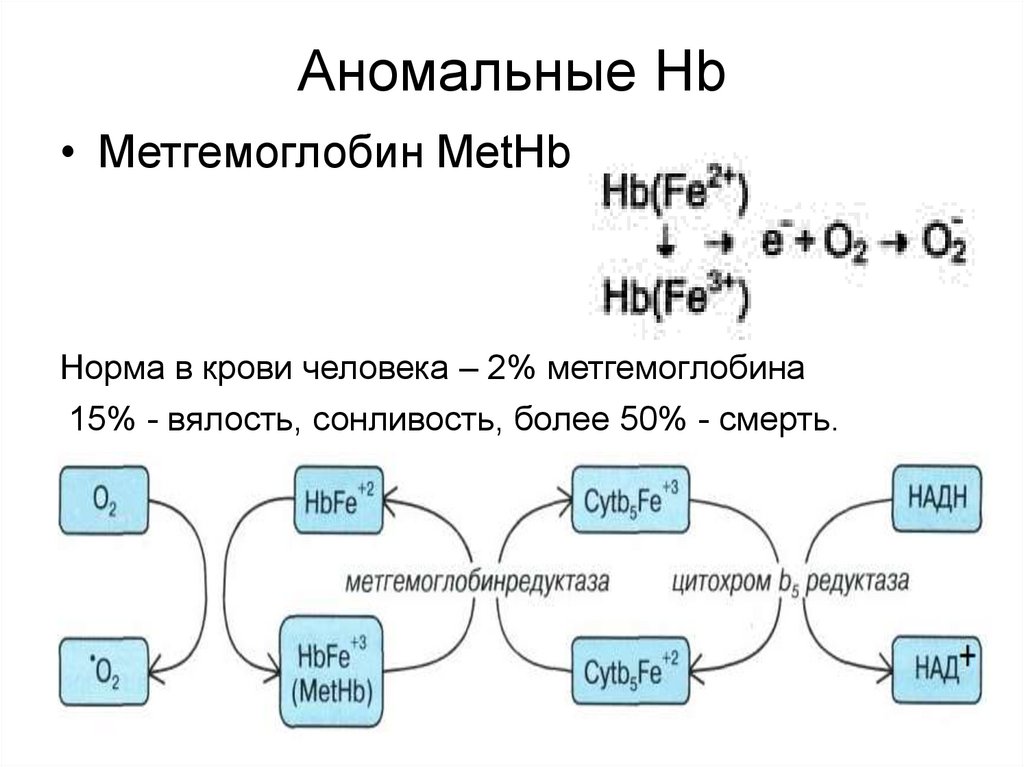
51. Аномальные Hb
• Метгемоглобин MetHbНорма в крови человека – 2% метгемоглобина
15% - вялость, сонливость, более 50% - смерть.
52.
• Карбоксигемоглобин• Сродство СО (угарного газа) к гему Hb
более чем в 200 раз выше, чем для О2.
53.
• Мутантные формы гемоглобинов- при серповидноклеточной анемии
- “Канзас” – потеря свойства
кооперативности
- мутации с положительным эффектом
54. Другие дыхательные пигменты
У животных - несколько кислородпереносящих белков:---2 Fe-содержащих: 1) хлорокруорин (по свойствам
похож на Hb, но зеленого цвета из-за ХЛОРОГЕМА
несколько иного строения, чем гем). Только у кольчатых
червей.
2) гемэрин (в нем Fe связано с белковой частью
молекулы ковалентно, а не кординационной связью, как в
Hb). У моллюсков и членистоногих
---1 Cu-содержащий - гемоцианин. У моллюсков и
членистоногих
Аналоги гемоглобина есть и у бактерий, и у грибов, и у
растений
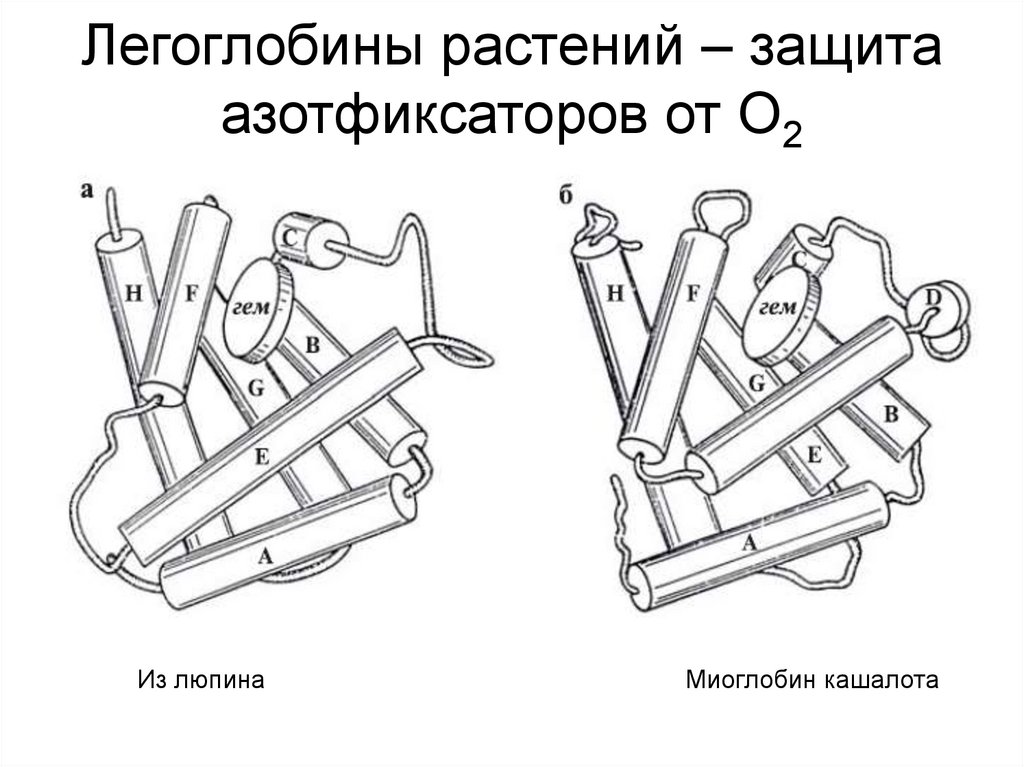
55. Легоглобины растений – защита азотфиксаторов от О2
Из люпинаМиоглобин кашалота
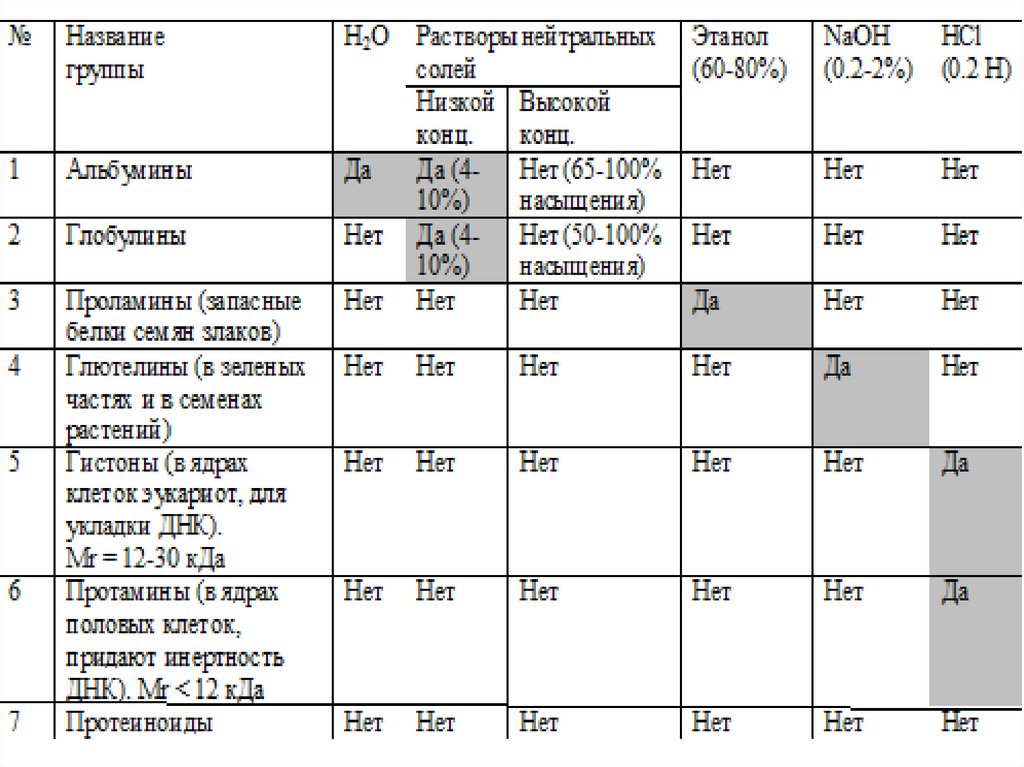
56. Классификация белков
Простые – только изаминокислот
1) Альбумины
2) Глобулины
3) Проламины
(запасные белки семян
злаков)
4) Глютелины (в разных
частях растений)
5) Гистоны
(в ядре для укладки ДНК)
6) Протамины
(в ядрах половых клеток,
для инертности ДНК)
7) Протеиноиды
Сложные – имеют
“белковую” и
“небелковую” части
1) Металлопротеины
2) Хромопротеины (гемоглобин)
3) Гликопротеины
4) Липопротеины
5) Фосфопротеины
6) Нуклеопротеины
57.
• В таблице на следующем слайде – группыпростых белков и реагенты, в которых они
способны растворяться. Это важно для
выделения определенной группы. Разобрать
подробно самостоятельно по
учебнику (Анисимов) и в “Малом практикуме по
биохимии. Ч.1”
работа “ВЫДЕЛЕНИЕ ПРОСТЫХ БЕЛКОВ ИЗ СЕМЯН
ЗЛАКОВЫХ И БОБОВЫХ”
58.
59. Биологические функции белков и пептидов (учить самим! уметь приводить примеры!)
1) Ферменты2) Защита и
нападение
(иммуноглобулины,
пептидные антибиотики,
гликопротеины первоцветов,
яды и токсины)
3) Двигательные
(актин, миозин)
4) Структурные
(коллаген, фиброин, белки
паутины)
5) Запасные
(овальбумин, зеин кукурузы,
казеин молока)
6) Транспортные
(гемоглобин, альбумины крови,
кинезин, динеин)
7) Регуляторные
(белковые факторы
транскрипции и трансляции,
гормон инсулин)
8) Рецепторные
(родопсин, рецепторы гормонов)
























 Биология
Биология Химия
Химия








