Похожие презентации:
Неидеальные растворы. Положительные и отрицательные отклонения от закона Рауля
1.
ОБЩАЯ ХИМИЯ(лекция 10)
Продолжение лекции «Растворы»
2.
д.х.н., профессоркафедры общей химии
Конюхов Валерий Юрьевич
VK id2476227
3.
План лекций4.
Растворы. Равновесие в водных растворах• Растворы. Равновесие в водных растворах
Идеальные и реальные растворы. Химические потенциалы
компонентов идеального и реального растворов. Сольватация
(гидратация) электролитов; диссоциация, ионная и молекулярная
ассоциация.
Растворители и их свойства. Особенности воды как
растворителя. Электролитическая диссоциация воды и
водородный показатель.
Коллигативные свойства. Законы Рауля и Вант-Гоффа. Связь
свойств растворов (осмотическое давление, температуры
кипения и замерзания) с состоянием растворенного вещества.
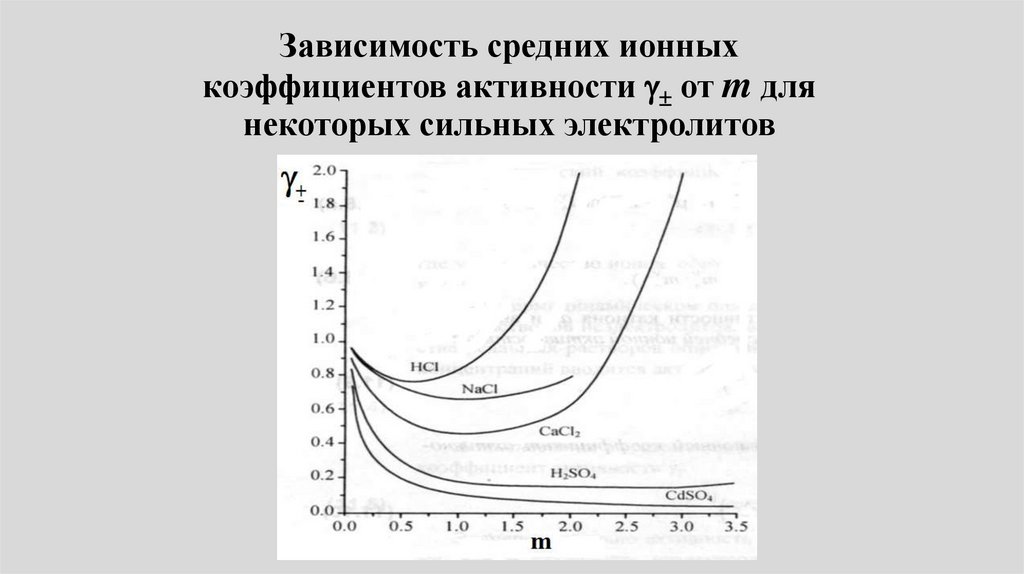
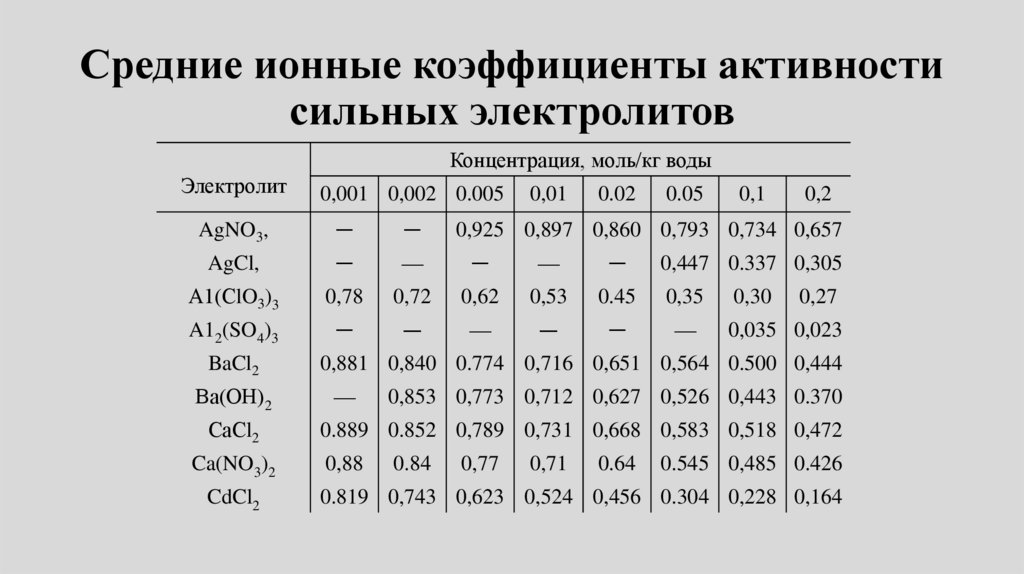
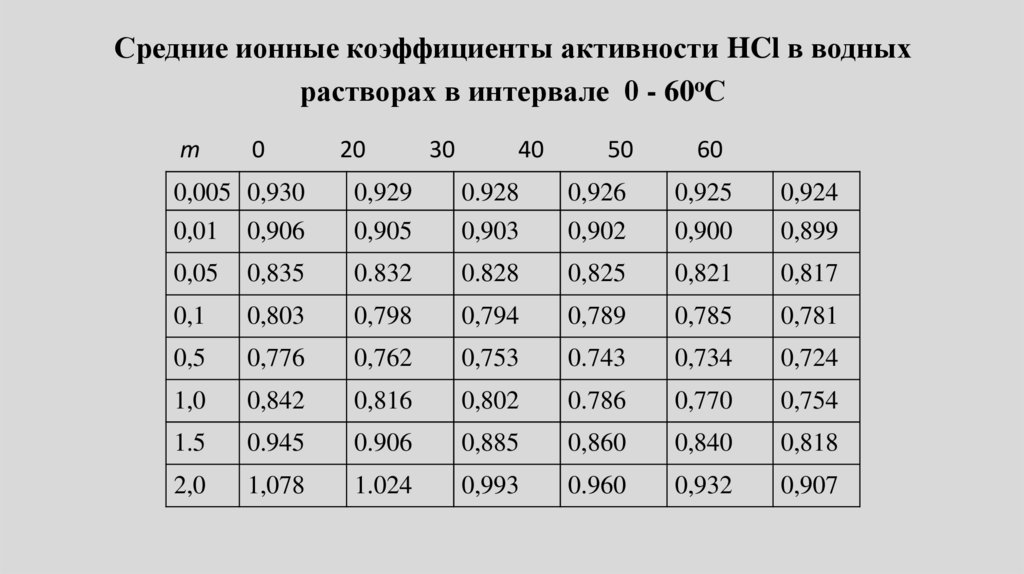
• Свойства реальных растворов. Активность электролитов.
Среднеионный коэффициент активности. Предельный закон
Дебая-Хюккеля. Константа и степень диссоциации слабых
электролитов. Закон разбавления.
5.
Тема 17. КОНТРОЛЬНЫЕ ВОПРОСЫПО КУРСУ ХИМИИ
(для подготовки к экзамену и выполнения
итогового домашнего задания)
1. Растворы. Способы выражения концентрации. Растворители
и их свойства. Особенности воды как растворителя.
Водородный показатель. Электролитическая диссоциация,
сольватация и ассоциации в растворах. Связь свойств
растворов
(осмотического
давления,
повышения
температуры
кипения
и
понижения
температуры
замерзания) с состоянием растворенного вещества.
2. Идеальные растворы, закон Рауля. Реальные растворы,
активность и коэффициент активности компоненты
раствора. Среднеионный коэффициент активности и
активность ионов в растворах электролитов.
6.
Электрохимия• Типы электрохимических процессов. Окислительно-восстановительные
системы. Двойной электрический слой, скачок потенциала на межфазной
границе. Электродный потенциал. Уравнение Нернста. Зависимость
электродного потенциала от материала электродов и состава раствора.
Электрохимический ряд напряжения. Стандартный электрод сравнения.
Классификация электродов: металлические, неметаллические, окислительновосстановительные, газовые электроды (водородный, кислородный) и
электродные реакции, протекающие на них.
Ионоселективные электроды.
Химические источники тока: обратимые, необратимые, концентрационные.
Гальванический элемент, аккумулятор, разовые источники тока, топливный
элемент.
Устройство и принцип действия.
Электродвижущая сила.
Электролиз. Последовательность электродных процессов для водных
растворов электролитов. Перенапряжение.
Основные виды коррозии металлов. Электрохимическая коррозия. Коррозия
металлов и проблема надежности. Методы защиты от коррозии.
7.
Список литературы1. Н.В. Коровин. Общая химия. М.: Высшая школа.
2014.
2. Н.С.Ахметов. Общая и неорганическая химия –
М.:ВШ, 2012.
3. Н.Л. Глинка «Общая химия» М.: Изд. «Химия»,
2002.
4. Жукова Т.В., Глаголева М.А., Липанова Н.В.,
Сергиевский В.В., Сорока И.В. Общая химия
(основные понятия, примеры, задачи). М.: МИФИ,
2008.
5. Сергиевский В.В., Ананьева Е.А., Жукова Т.В.,
Звончевская М.Ф., Кучук Ж.С., Котыхова О.А.
Неорганическая химия: учебное пособие для
внеаудиторной работы. М.: МИФИ, 2007.
8.
Литература• Общая химия лабораторные работы
(под редакцией Е.А. Ананьевой) М.:
МИФИ, 2010.
• Сборник тестов и задач по курсу
химии. НИЯУ МИФИ. М.: 2014.
• Общая и неорганическая химия (под
редакцией А.Ф. Воробьева).
• Т. 1 и 2. М.: Академкнига. 2004.
9.
Повторение мать учения!Это мать учения
10.
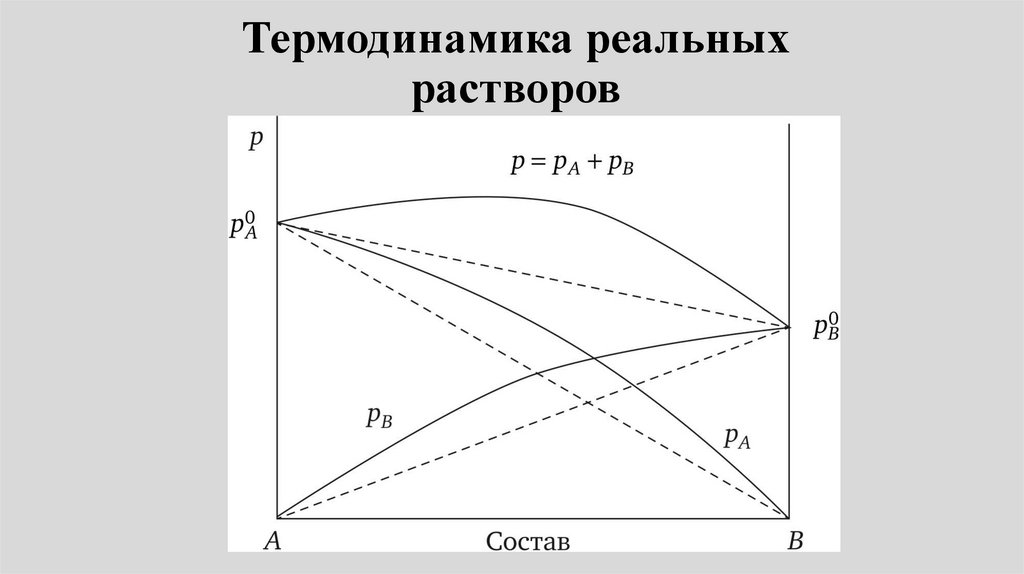
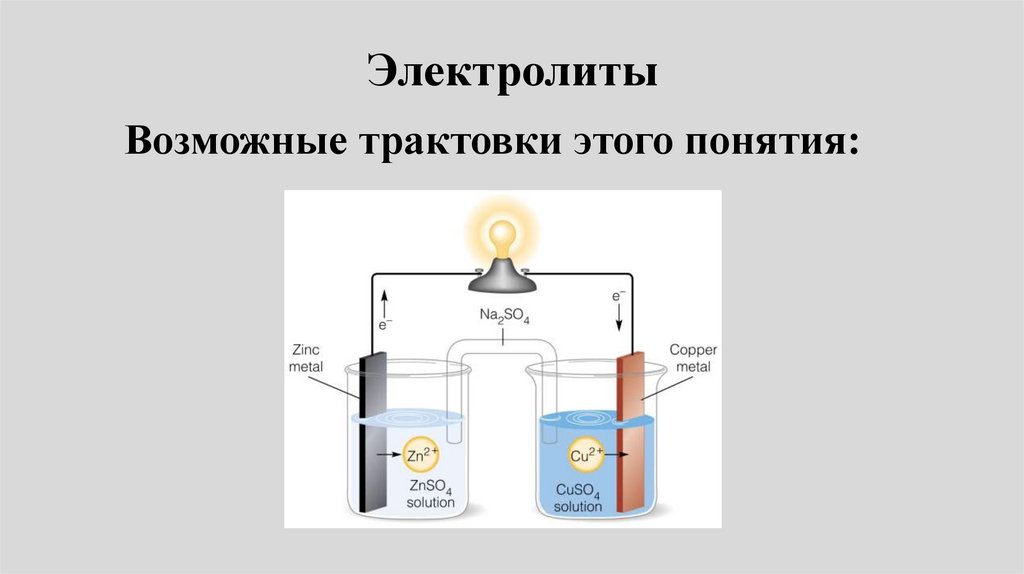
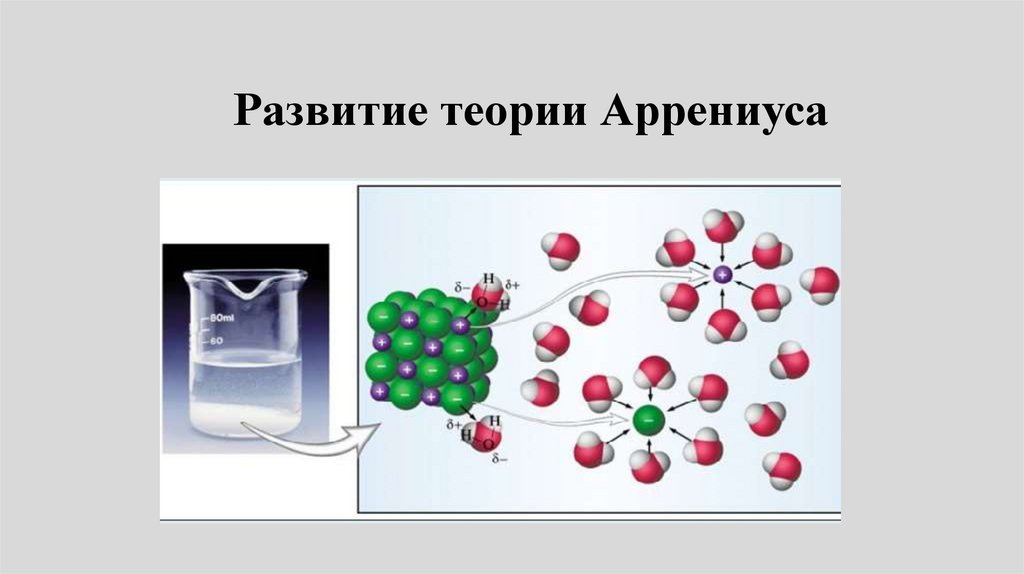
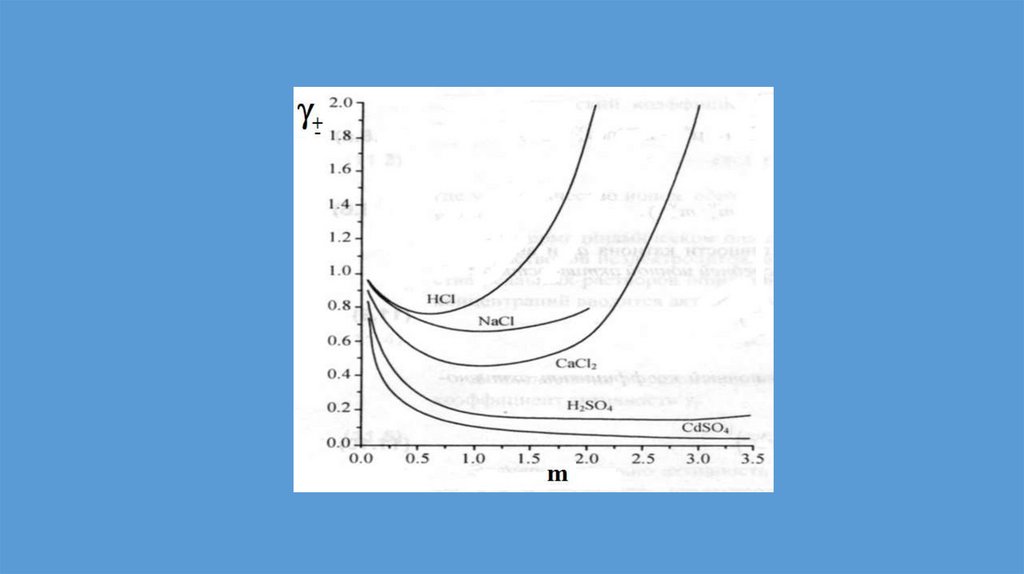
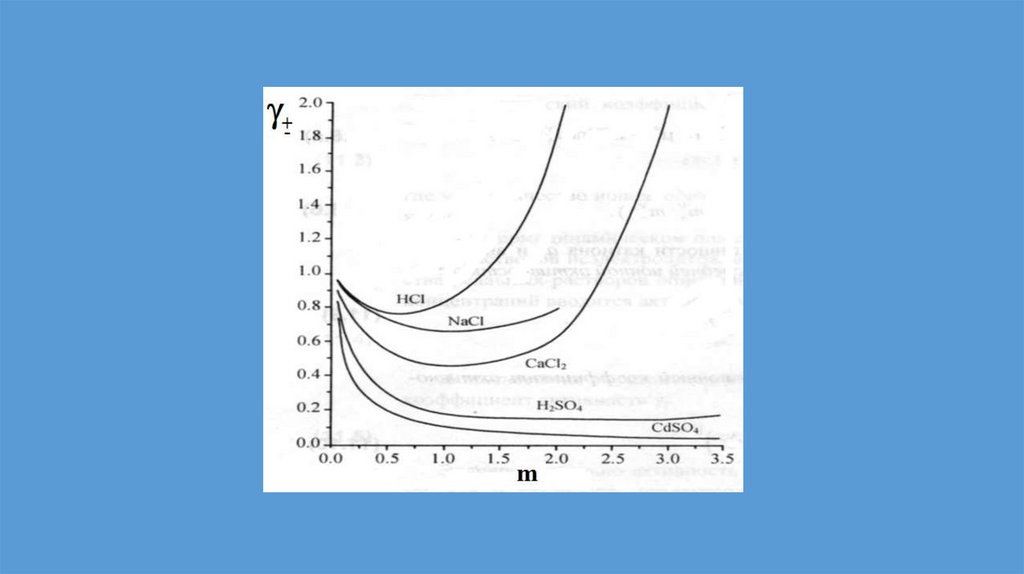
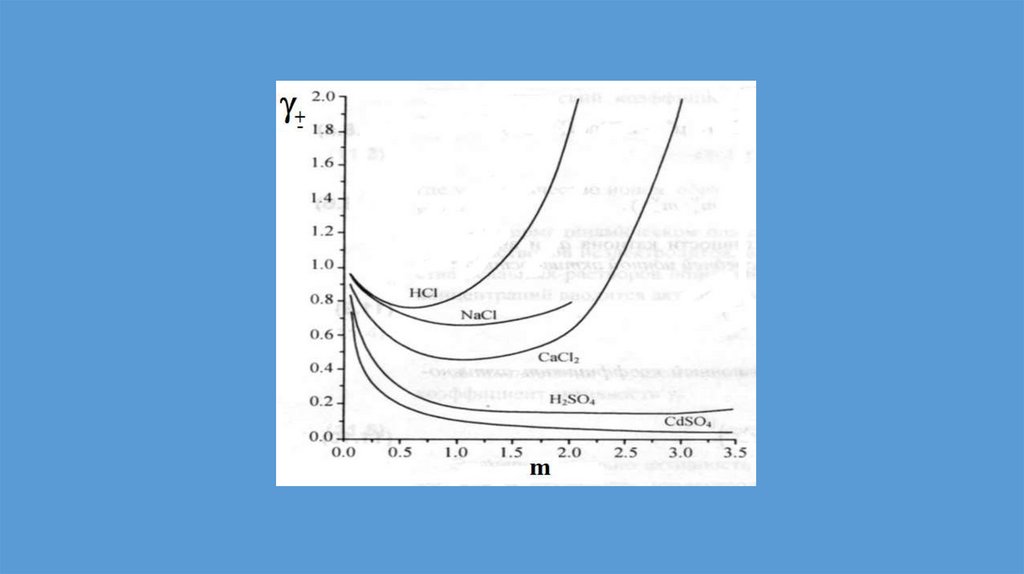
Реальные растворы11.
Неидеальные растворы.Положительные и отрицательные
отклонения от закона Рауля
12.
• При образовании реальныхрастворов наблюдаются
отклонения от закона Рауля.
•т.е. зависимость между
парциальными давлениями
компонентов и их содержанием в
жидкости нелинейная:
•Рi Рoi хi
13.
•Не выполняются итермодинамические
условия образования
идеальных растворов:
14.
• растворение сопровождаетсятепловым эффектом:
• смН ≠ 0,
• при образовании раствора
происходит изменение объёма
системы:
• смV ≠ 0
15.
•Изменение энергии Гиббса иэнтропии нельзя вычислить по
уравнениям:
• смG RT(n1 lnx1 + n2 lnx2)
• смS R(n1 lnx1 + n2 lnx2)
16.
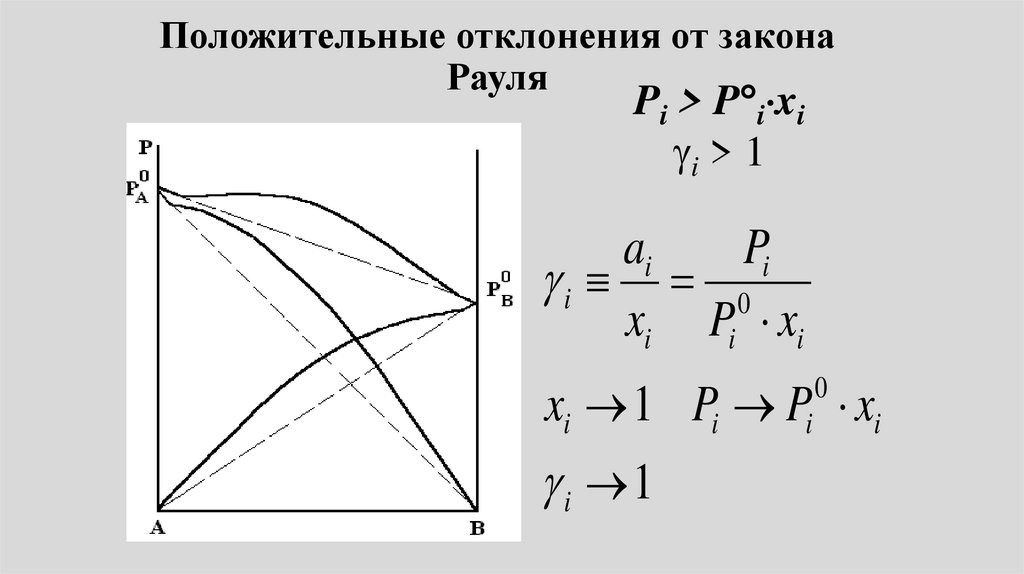
Положительные отклонения отзакона Рауля
17.
• Энергия взаимодействия междуразноименными молекулами меньше
энергии взаимодействия между
одноименными молекулами:
• ЕА-В < ЕА-А и ЕВ-В
• - энергия сольватации меньше
энергии ассоциации.
18.
• Образование таких растворовсопровождается их
разрыхлением:
• (объём раствора больше суммы
объёмов компонентов порознь):
• смV > 0
19.
• Облегчается переход молекул впар. Следовательно, давление над
полученными растворами больше,
чем, если бы они были идеальными
o
• Рi > Р i хi.
• Имеют место положительные
отклонения от закона Рауля.
20.
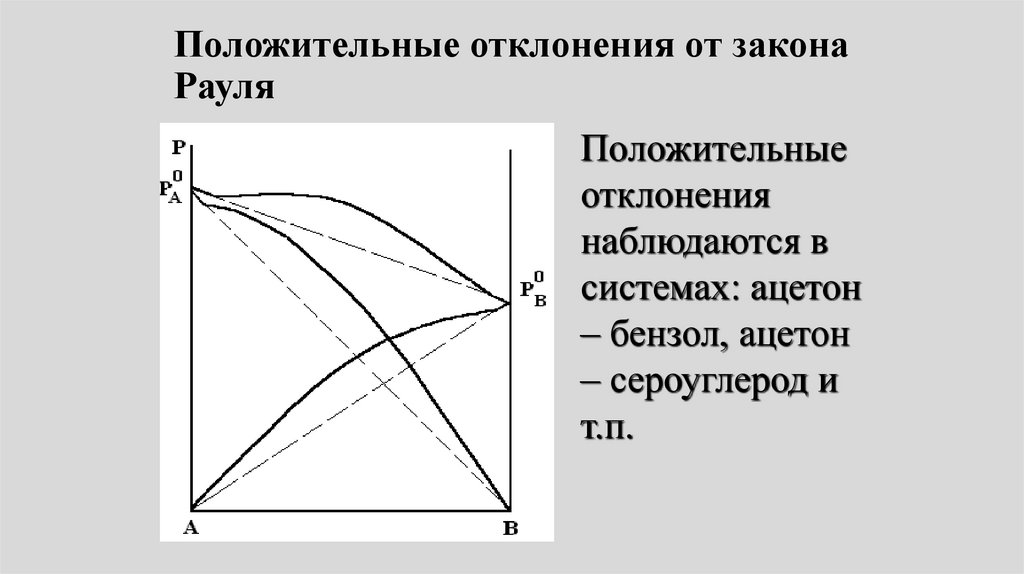
Положительные отклонения от законаРауля
Положительные
отклонения
наблюдаются в
системах: ацетон
– бензол, ацетон
– сероуглерод и
т.п.
21.
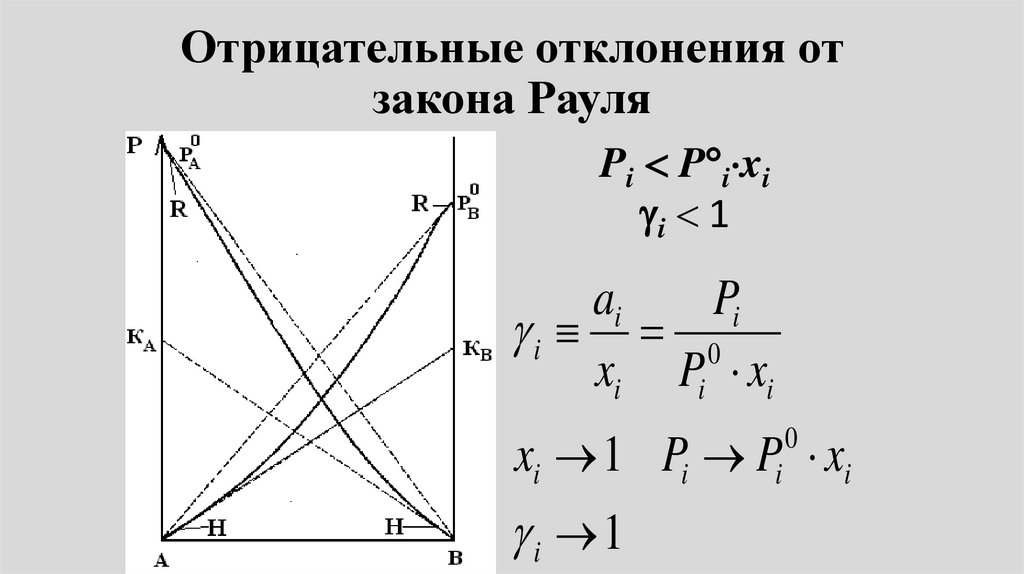
Отрицательные отклонения отзакона Рауля
22.
• Энергия взаимодействия междуразноименными молекулами больше
энергии взаимодействия между
одноименными молекулами:
• ЕА-В > ЕА-А и ЕВ-В
• – энергия сольватации больше
энергии ассоциации.
23.
•В этом случае при смешениикомпонентов выделяется
энергия, т.е. тепловой эффект
смешения
• смН < 0.
24.
•Образование растворовсопровождается их сжатием
(объём раствора меньше суммы
объёмов компонентов порознь):
• смV < 0
25.
• Затрудняется переход молекул впар. Следовательно, давление над
полученными растворами меньше,
чем, если бы они были
идеальными:
•Рi <
o
Р i хi
• Имеют место отрицательные
отклонения от закона Рауля.
26.
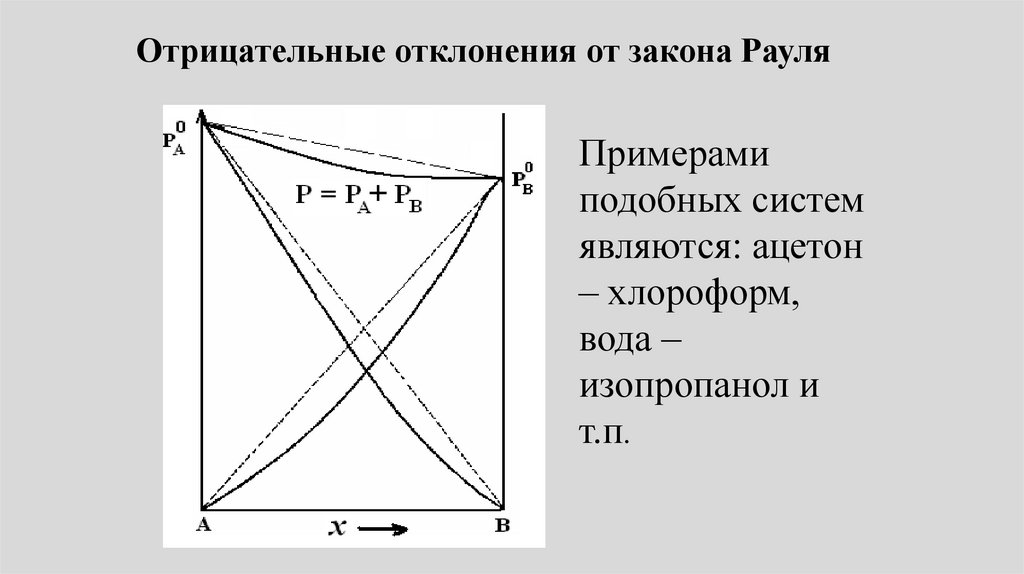
Отрицательные отклонения от закона РауляПримерами
подобных систем
являются: ацетон
– хлороформ,
вода –
изопропанол и
т.п.
27.
• Примером системы с отрицательнымотклонением от закона Рауля является
система вода – этанол.
• Действительно, при смешении 50 см3
воды с 50 см3 этанола в сумме получается
не 100 см3 раствора, а лишь 97 см3, при
этом раствор нагревается за счёт
выделяющейся энергии в форме теплоты.
28.
Идеальные предельноразбавленные растворы. Закон
Генри
29.
•Смеси непохожих веществ могутсильно отклоняются от закона
Рауля, но даже они следуют этому
закону, когда в системе содержание
одного из компонентов в десятки
раз больше, чем другого, т.е. в
области разбавленных растворов.
30.
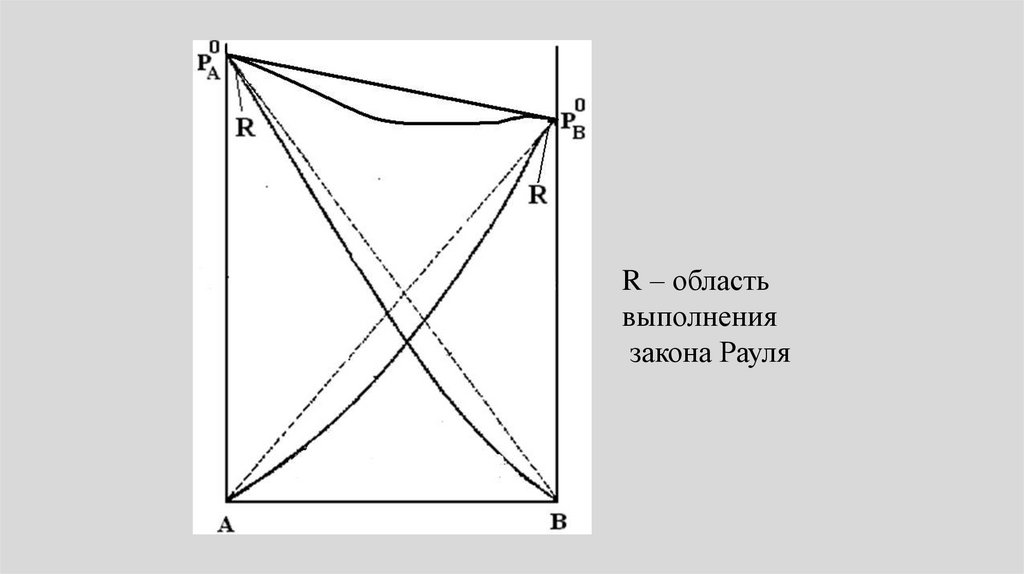
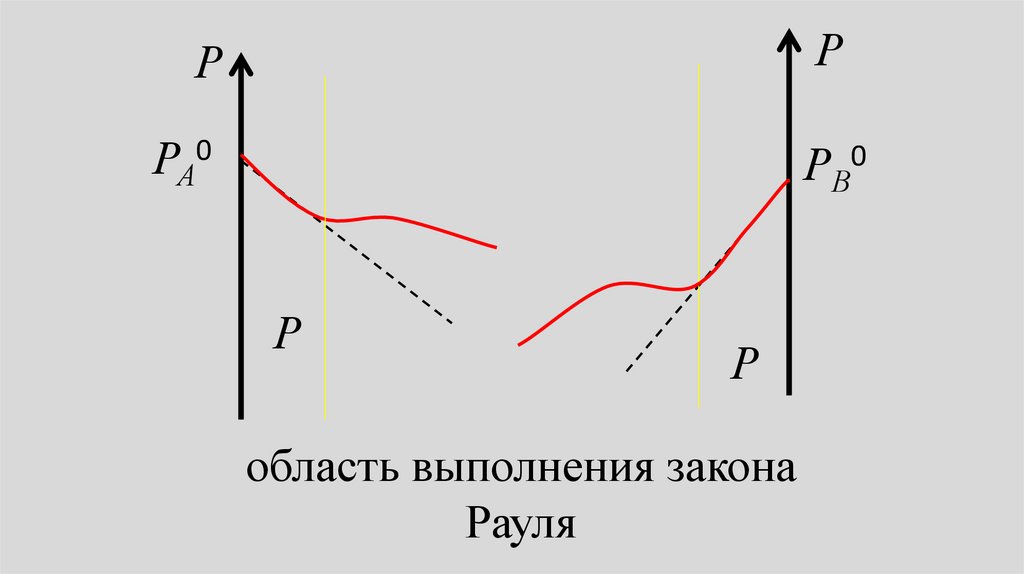
• Всегда можно выделить областьконцентраций (x1 1, x2 0 ), в
которой для растворителя
выполняется закон Рауля, т.е. линии
парциального и общего давления
сливаются с прямыми,
соответствующими закону Рауля.
31.
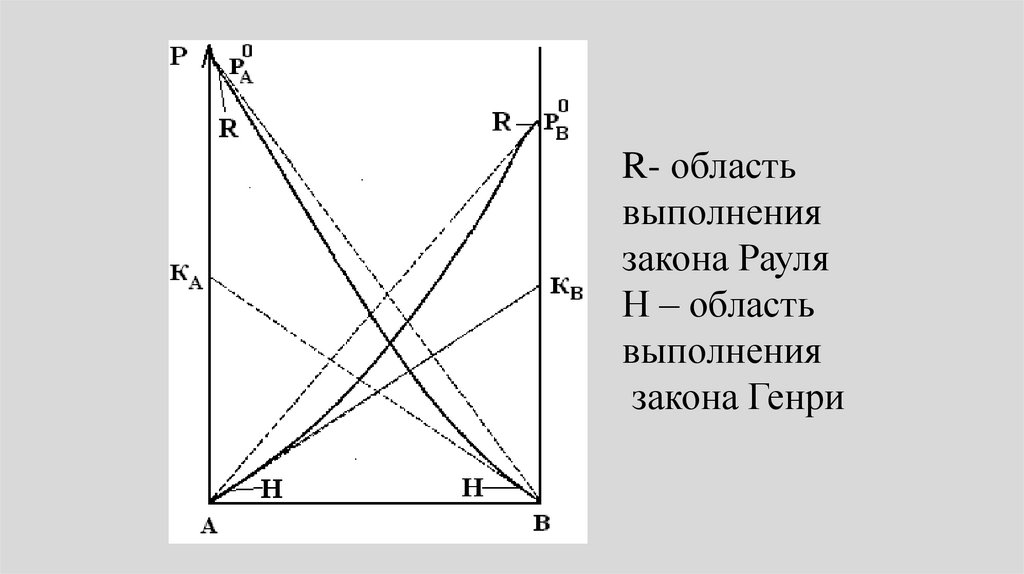
R – областьвыполнения
закона Рауля
32.
РР
0
РА
РВ0
Р
Р
область выполнения закона
Рауля
33.
•т.е. при малых концентрациях(x1 1) неидеальные растворы
ведут себя как идеальные,
поэтому их называют:
•идеальными предельно
разбавленными растворами.
34.
•Для растворителя в предельноразбавленных растворах
выполняется закон Рауля, а для
растворённого вещества он
выполняется ????
35.
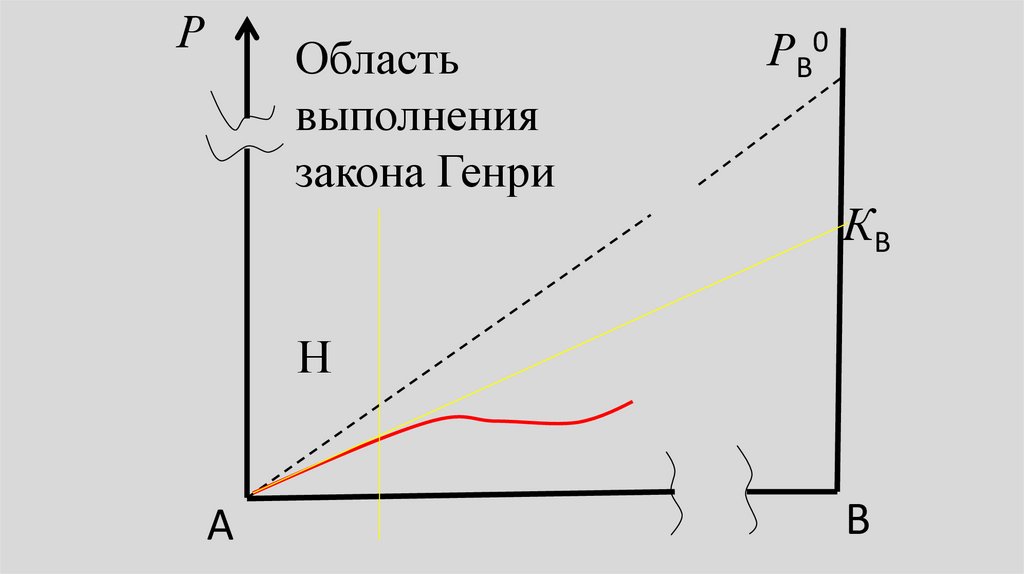
РОбласть
выполнения
закона Генри
РВ0
КВ
Н
А
В
36.
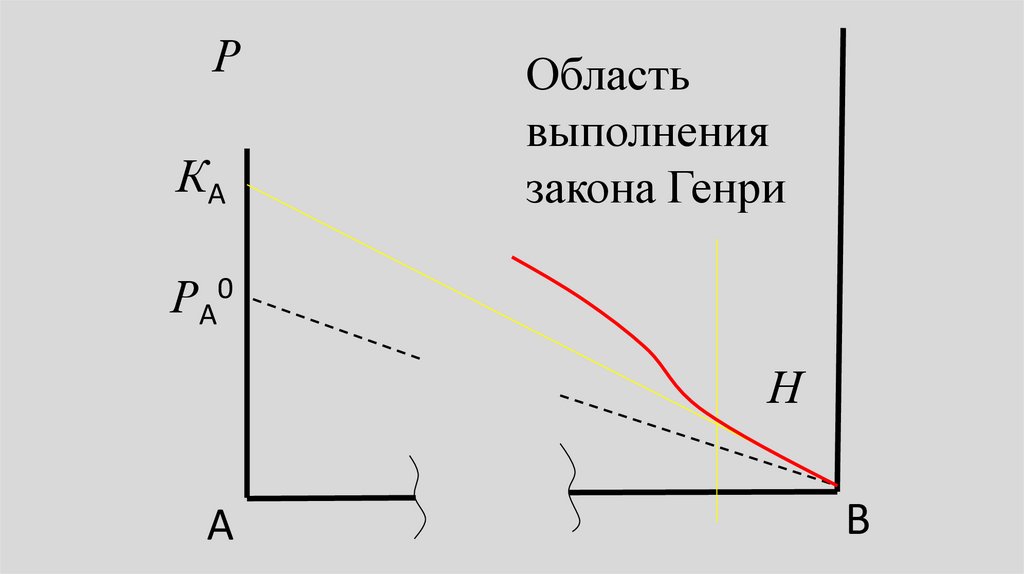
РКА
Область
выполнения
закона Генри
РА0
Н
А
В
37.
• В предельно разбавленном растворепарциальное давление пара
растворенного вещества также
линейно зависит от его молярной
доли в жидкости, но эта прямая не
сливается с линией, отвечающей
закону Рауля.
38.
• Это означает, что давление парарастворенного вещества подчиняется
уравнению, аналогичному закону
Рауля, но вместо Р0 в него входит
некоторая константа К:
• РВ= КВ хB,
РА= КА хА,
(1)
• где хB или хB - молярная доля
растворенного вещества, а KB или КА константа Генри вещества В или А.
39.
•Уравнения (1) называют законом Генри•Области Генри на рисунке (закон Генри
– Дальтона) отмечены буквой Н.
40.
R- областьвыполнения
закона Рауля
Н – область
выполнения
закона Генри
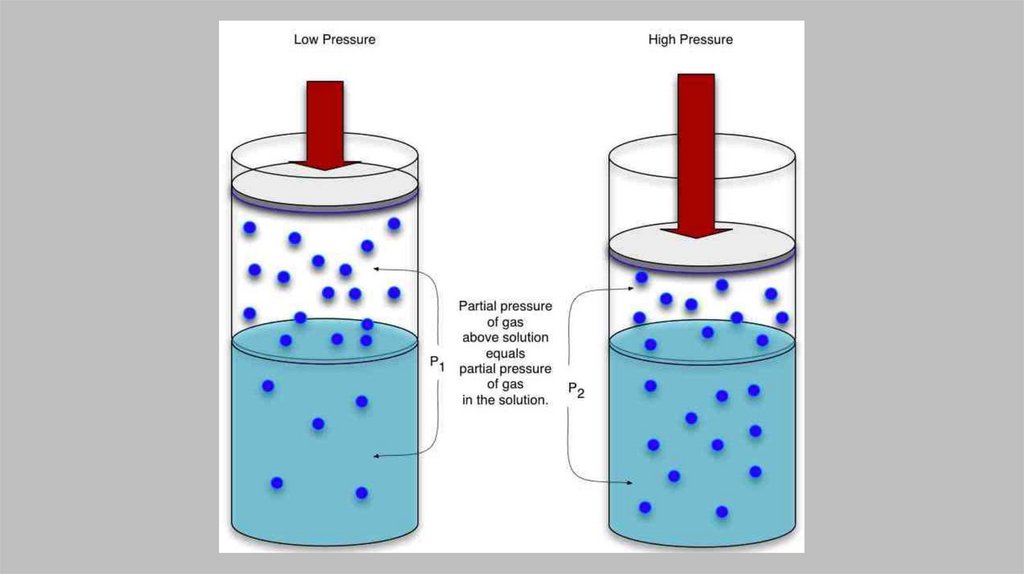
41.
Растворимость газов в жидкостях42.
• Закон получил свое название в честьУ. Генри (1803 г.), который получил
уравнение, описывающее
растворимость газов (они всегда
растворенные вещества) в жидкости в
зависимости от внешнего давления.
43.
Уильям Генри(1774 — 1836 г.г.)
Эксперименты
с
количеством
газов,
поглощаемых водой при различных Т и Р
(закон Генри).
Его сочинение
Elements of Experimental Chemistry (1799
г) выдержало одиннадцать изданий в течение
30 лет.
Был одним из основателей Института
механики
(Манчестерский институт науки и технологии
44.
•«Растворимость газа в жидкостипропорциональна его давлению».
•Закон выполняется при невысоких
давлениях газов, химически не
взаимодействующих с
растворителем.
45.
•Термодинамическая записьзакона Генри:
•Р2 = К2 х2
•При такой записи растворимость
газа тем выше, чем меньше
константа Генри.
46.
47.
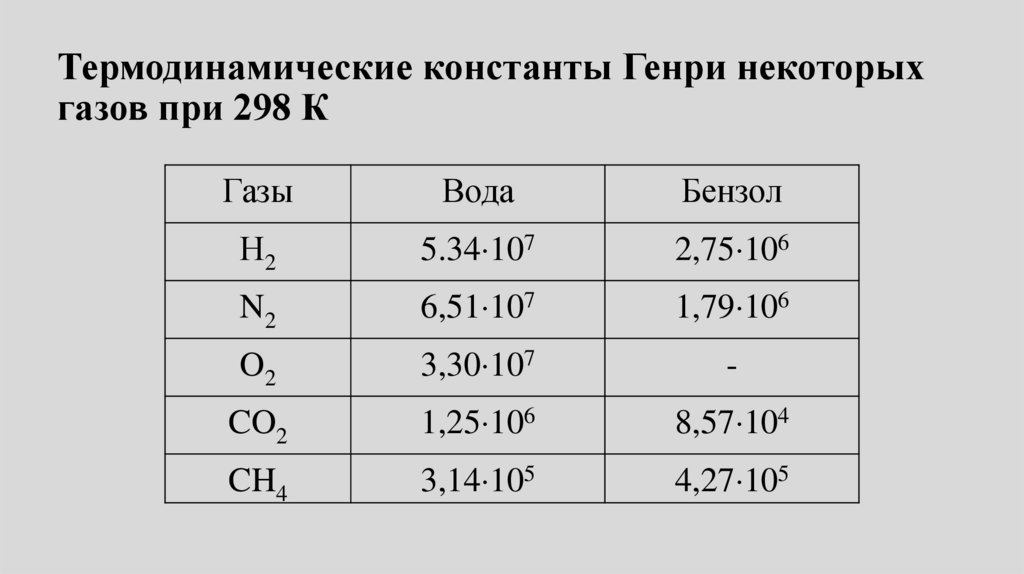
Термодинамические константы Генри некоторыхгазов при 298 К
Газы
Вода
Бензол
Н2
5.34 107
2,75 106
N2
6,51 107
1,79 106
O2
3,30 107
-
CO2
1,25 106
8,57 104
CH4
3,14 105
4,27 105
48.
•Из таблицы следует, что при 298Кв воде лучше всего растворяется
метан (у него меньше всего
значение константы Генри), а в
бензоле - диоксид углерода.
49.
• Чаще применяют закон Генри втакой записи:
• S = КГ Р
Здесь S – растворимость газа в
жидкости, Р – давление газа
(парциальное давление газа).
При такой записи чем больше
константа Генри КГ, тем больше
растворимость при данном Р
50.
•Закон Генри констатирует простойфакт: чем выше давление газа над
поверхностью жидкости, тем
труднее растворенному в ней газу
высвободиться и перейти в
газовую фазу.
51.
• Если газ и растворитель между собойхимически не взаимодействуют, то
концентрация газа в растворе невелика.
• Например, при н.у. в дм3 воды
растворяется около 0,002 г водорода.
• Также плохо растворяются в воде
кислород и азот.
52.
• Растворимость газов, вступающих вовзаимодействие с растворителем
(например, NH3, SO2, CO2, HCl c водой),
может быть очень велика. Например, при
н.у. в 1 дм3 воды растворяется 875 г
аммиака.
• В этом случае закон Генри не
выполняется: растворимость таких газов
хоть и растет с повышением давления, но
описывается более сложной
зависимостью.
53.
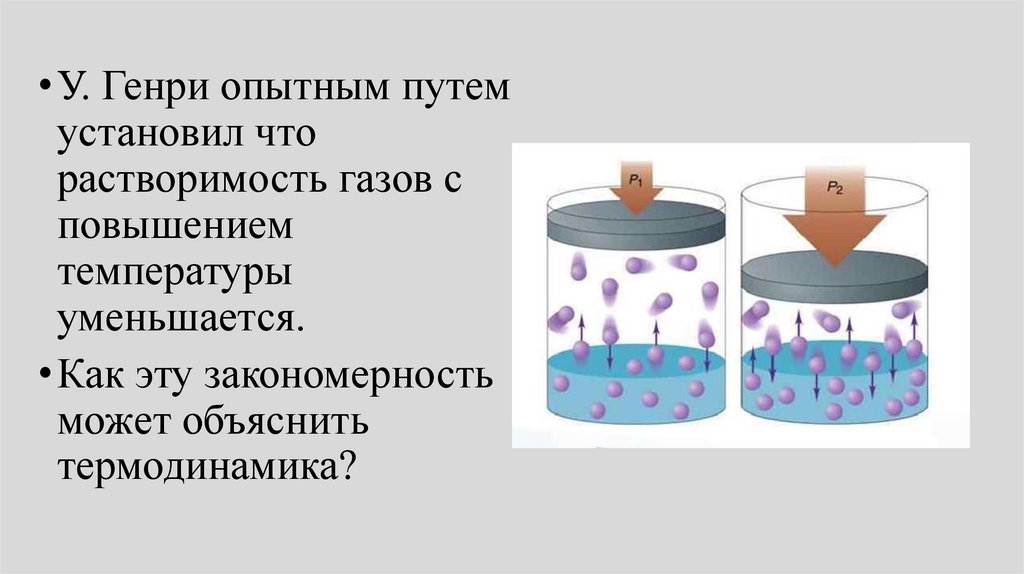
Влияние температуры нарастворимость газов в
жидкостях
54.
• У. Генри опытным путемустановил что
растворимость газов с
повышением
температуры
уменьшается.
• Как эту закономерность
может объяснить
термодинамика?
55.
•Реальный процесс растворения газов вжидкостях представим как бы состоящим из
2-х процессов:
•1. фазового перехода – конденсации;
•2. сольватации молекул растворённых
веществ молекулами растворителя.
• Так как начальное и конечное состояние системы одинаковое, то
изменение функций состояния смH, смS и смG будет одинаковым.
56.
•Тепловой эффект растворениясмH:
• смH = кондH + сольвH
• кондH < 0, сольвH.< 0
•т.е. всегда: смH < 0.
57.
• Вспомним полюбившуюся нам, изобарухимической реакции (изобару Вант-Гоффа)
для константы Генри КГ, полученную
интегрированием при смН = const:
0
Δсм


































































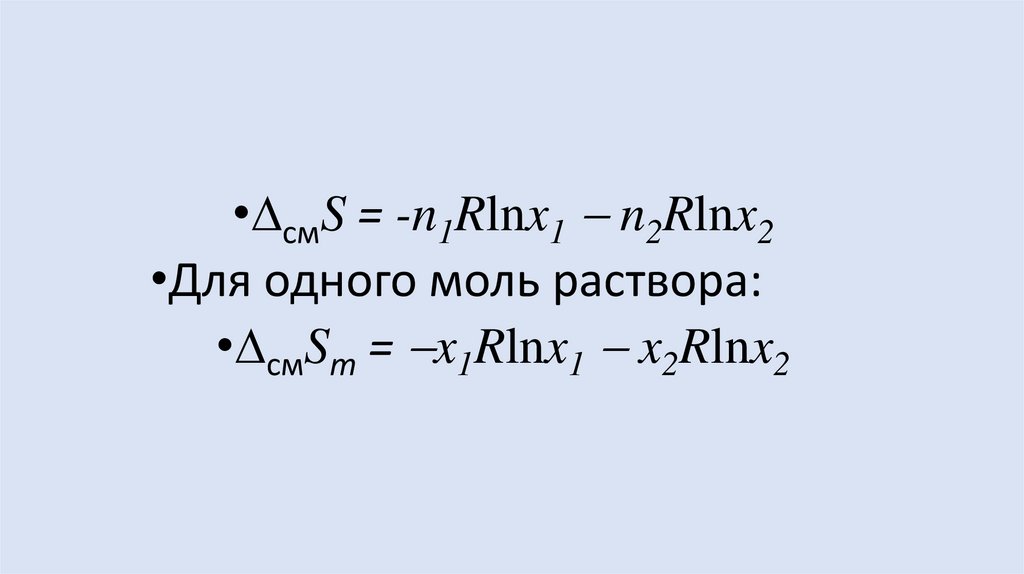


































































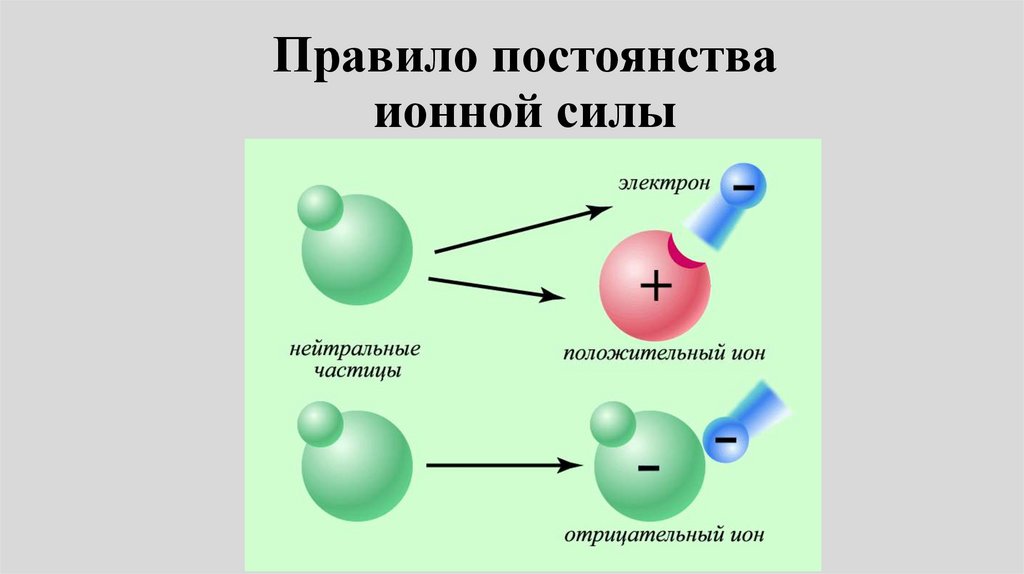








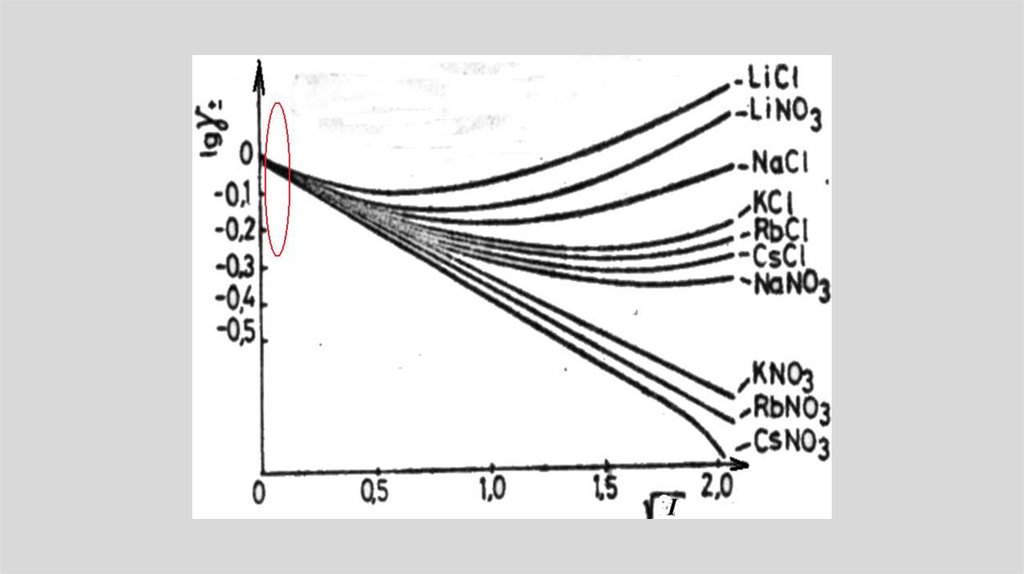

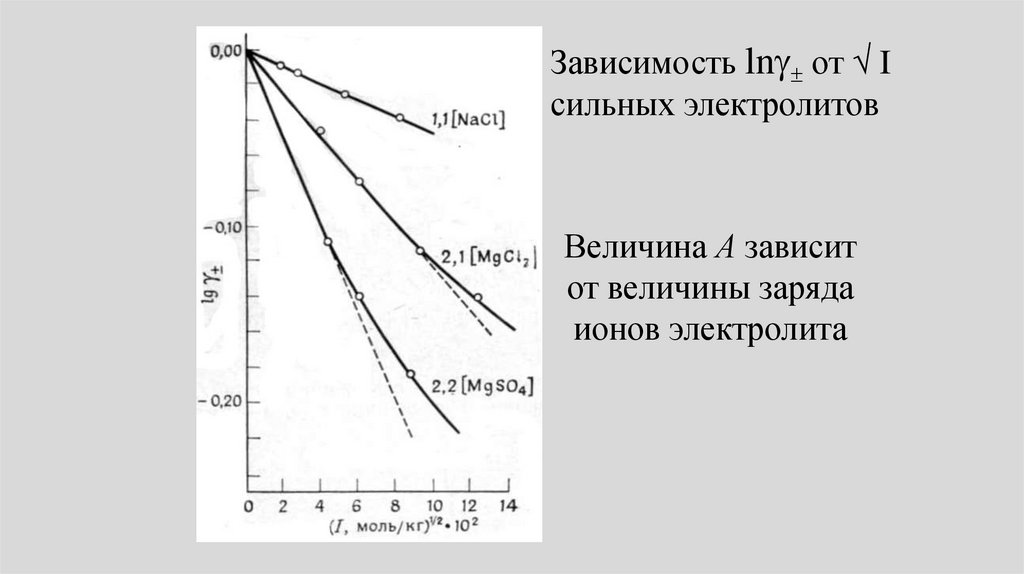

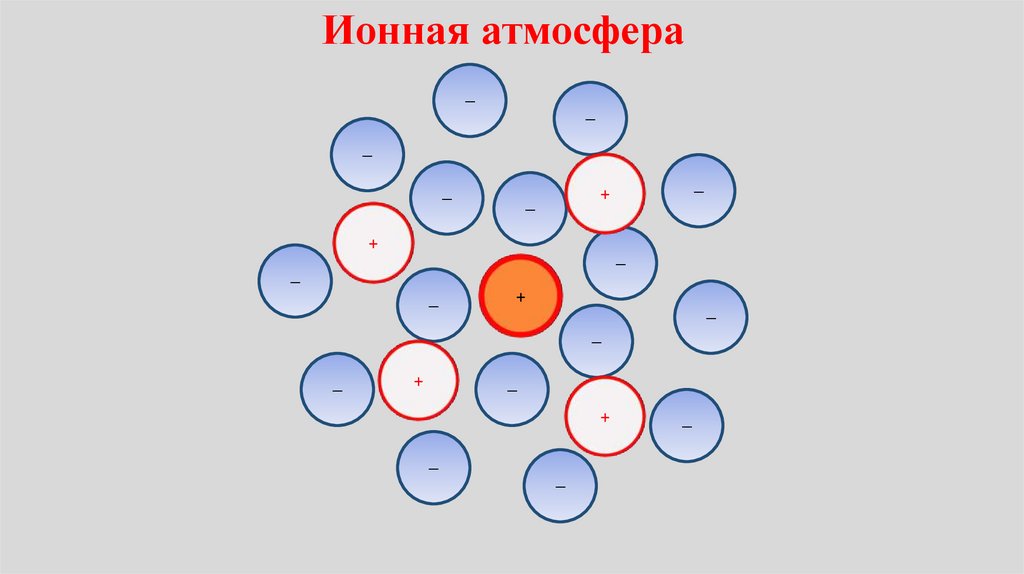
































 Химия
Химия








