Похожие презентации:
Неидеальные растворы
1.
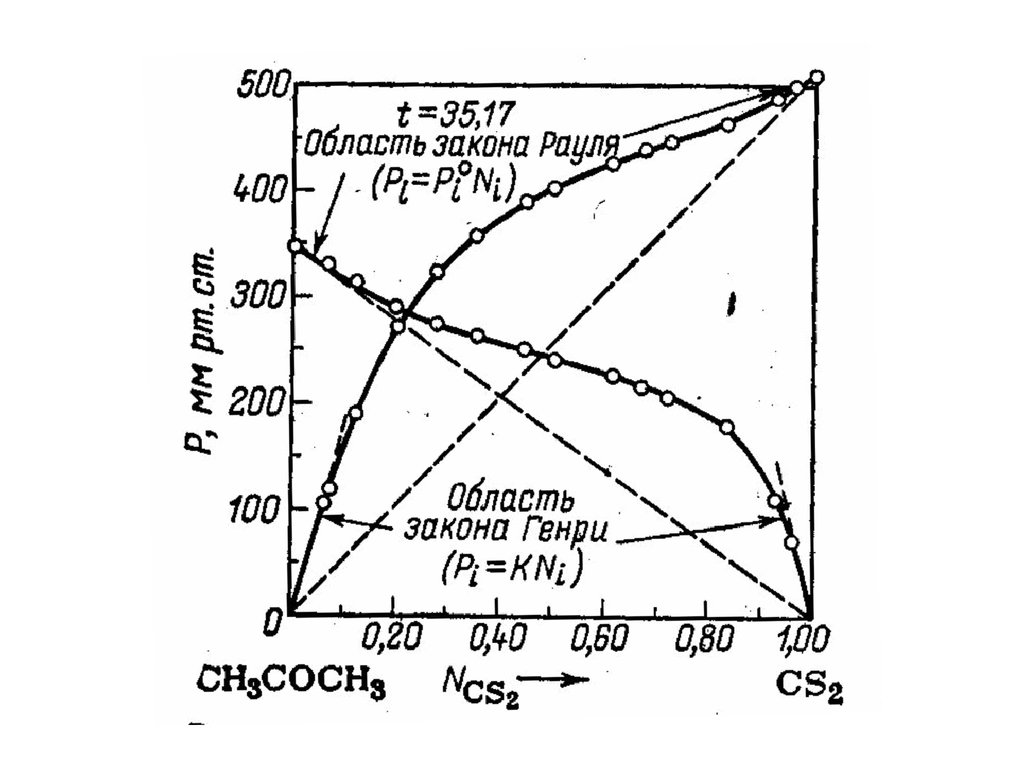
Неидеальные растворыПоложительные отклонения от закона Рауля –
парциальные давления компонентов и общее
давление пара выше, чем по закону Рауля.
Энергия однородных взаимодействий больше,
чем разнородных. Hсмеш 0
Отрицательные отклонения от закона Рауля –
парциальные давления компонентов и общее
давление пара ниже, чем по закону Рауля.
Энергия однородных взаимодействий меньше,
чем разнородных. Hсмеш 0
2.
Примеры систем с положительными отклонениямиБензол - ацетон
3.
4.
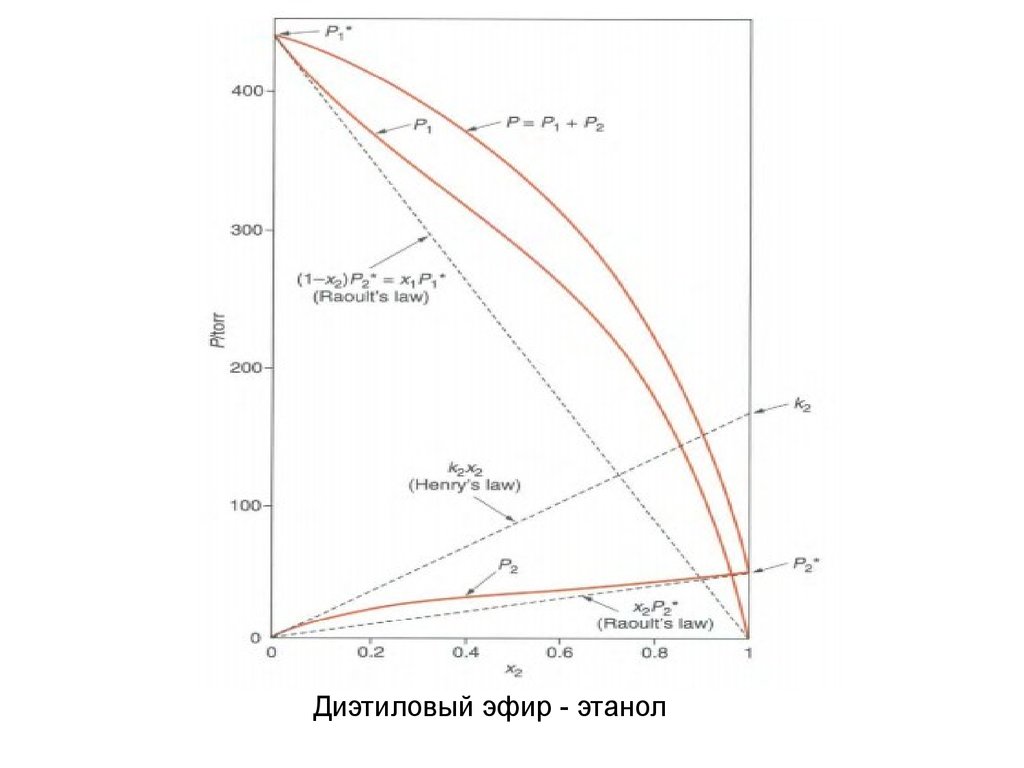
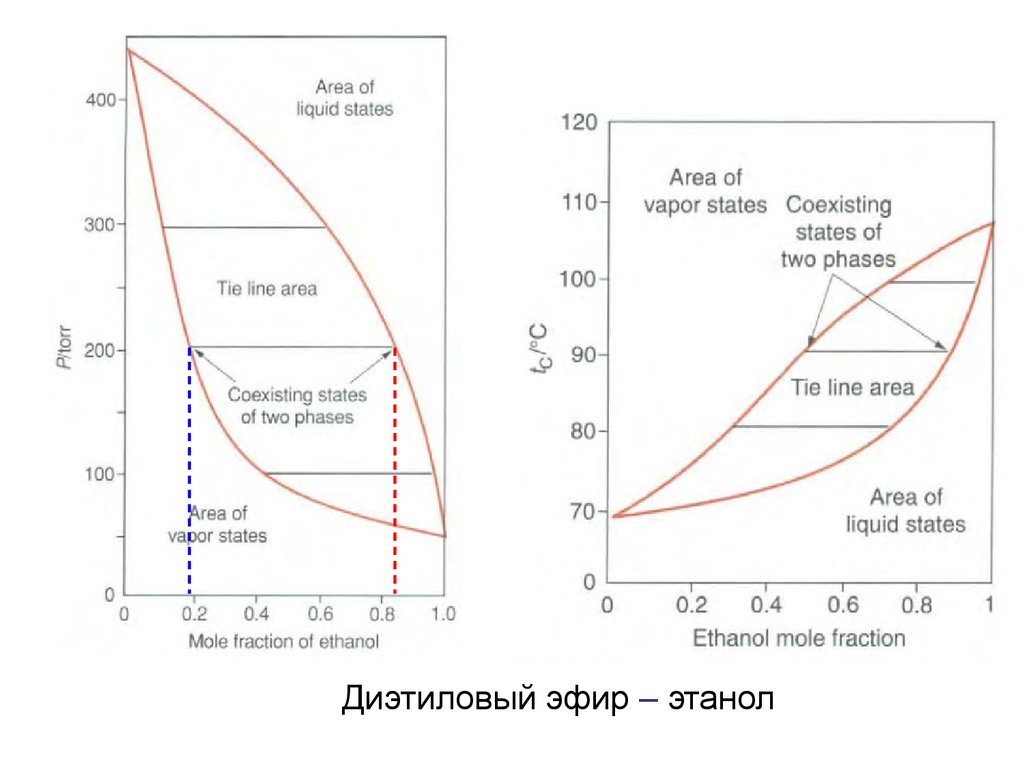
Диэтиловый эфир - этанол5.
Примеры систем с отрицательными отклонениямиХлороформ – этиловый эфир
6.
Парциальные давления компонентовнад жидким раствором ацетон - хлороформ
7.
Активности компонентов раствораi RT ln xi
pi
газ
i i RT ln
pi
i
i RT ln ai
i
ai pi / p
o
i
ai
pi
i o
xi pi xi
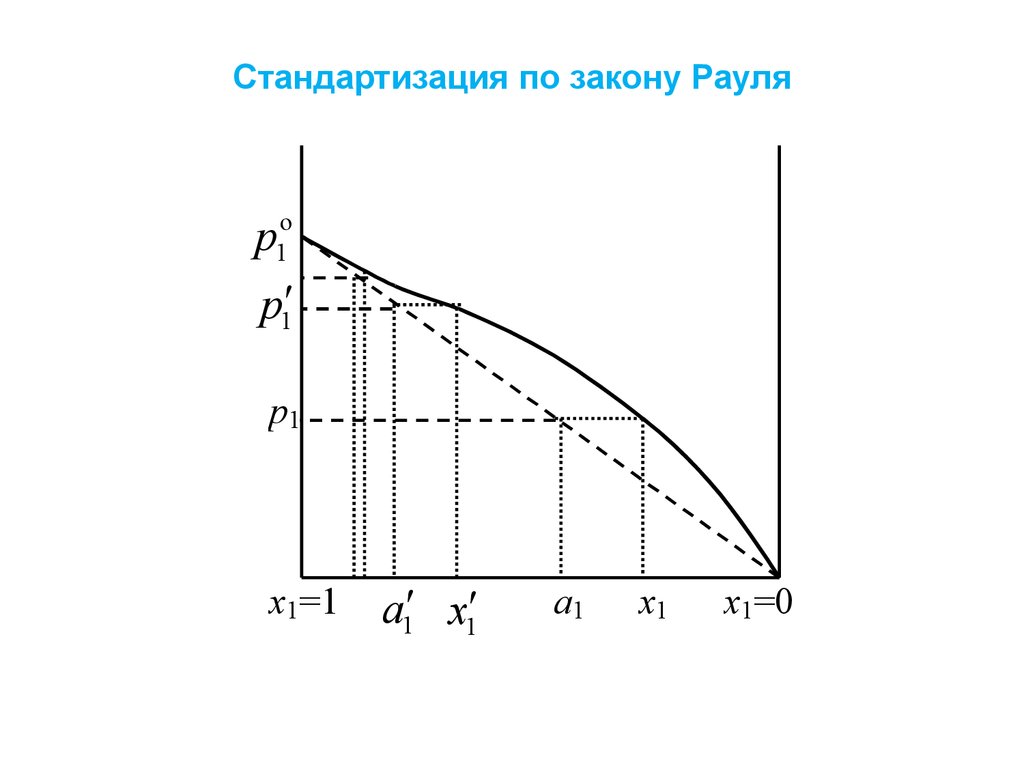
Стандартизация активности
aio = 1;
io = 1
ai f i / f i o
8.
Стандартизация по закону Рауляp1o
p1
p1
x1=1
a1 x1
a1
x1
x1=0
9.
Стандартизация по закону Генриp
k
o
p2
p2o
p2
p2
x2=0
a2 x2 a2
x2
x2=1
10.
Растворимость газов в жидкостяхх = f2/ f 2o = p2/ f 2o = 1/ f 2o
х = kp2
нас.р p
2
газ
2
2нас.p p
2нас.p p
2газ
dT
dx
dT
T p , x
x p ,T
T p , x
2G
S
i
Si
T p ni T p
ni p ,T
11.
2нас.p p xнас.p p
газ
S
S
2
2
x T
p ,нас.p p
p ,T
2нас.p p 2 RT ln a2нас.p p
2нас.p p 2 RT ln x нас.p p
2нас.p p
RT
lnx
x
RT
RT
x
x p ,T
x x p ,T
x p ,T
S 2нас.p p
S 2газ
H2
T
12.
H2lnx
2
T
RT
p ,нас.p p
lnx
нас.p p
H2
const
RT
x ( 2 ) H 2 ( T2 T1 )
ln ( 1 )
x
RT1T2
13.
Равновесие жидкость – пар в бинарных системахР = р1 + р2 = p1o х1 + p2o х2 = p1o (1 – х) + p2o х
у = р2/Р =
p2o х/Р ;
y1 = (1 – y) = p1o(1 – х)/Р
p2o x / P
y
x
o
1 y p1 (1 x) / P 1 x
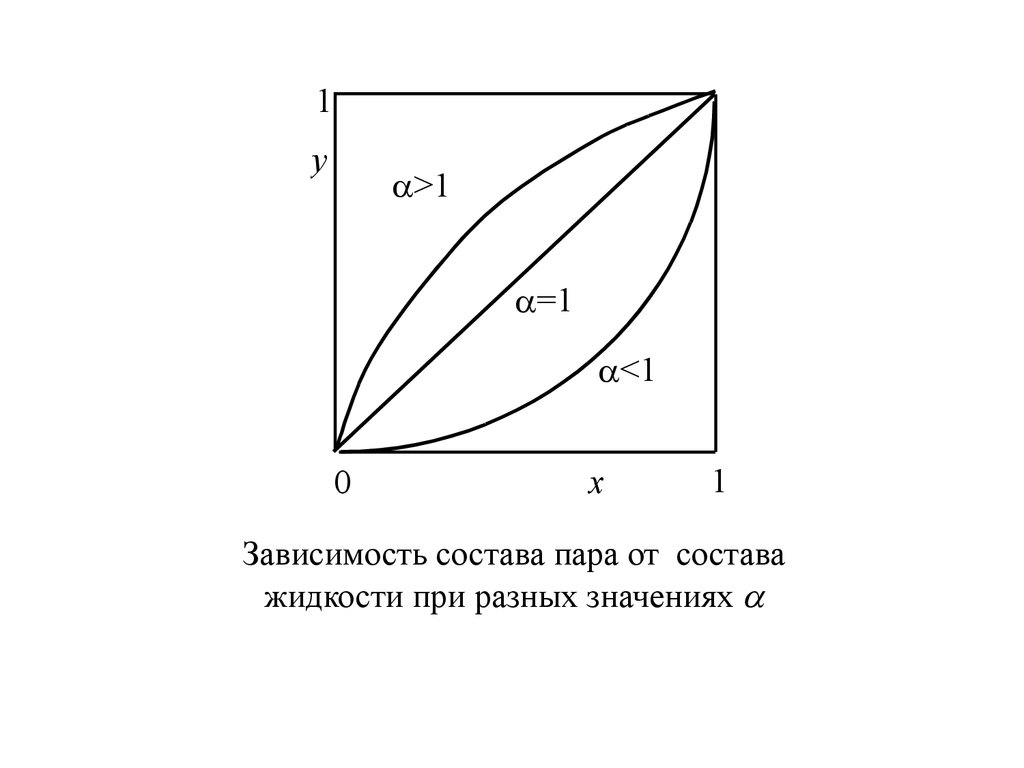
= 1 y = x;
> 1 y > x;
o o
p
= 2 / p1
< 1 y < x;
первый закон Коновалова
14.
1y
>1
=1
<1
0
x
1
Зависимость состава пара от состава
жидкости при разных значениях
15.
Диэтиловый эфир – этанол16.
Правило рычага (правило химических моментов)T=const
pAo
p2
k
a
k - фигуративная точка
системы
Жидкость
b
d
c
Пар
A
x1
pBo
x4 x0
x2
x3
a – b, c – d – фигуративные
точки сосуществующих
фаз
ab, cd – ноды
B
n - общее количество компонентов А и В
(или m - общая масса) в системе
х0 (ω0) - мольная (массовая) доля В в исходной
системе
nI + nII = n
(mI + mII = m)
17.
х1nI + х2nІІ = х1nI + х2(n – nІ) = xonω1mI + ω2mІІ = ω1mI + ω2(m – mІ) = ωom.
nI
nI
x0 x2 kb
II
I
n
n n
x1 x0 ak
mI
mI
0 2 kb
II
I
m
m m 1 0 ak
18.
Разделение компонентов раствораФракционная перегонка
p=const
T
Пар
b1
b2
a2
a1
d1
c1
o
TA
A
o
TB
Жидкость
x3
xo
x1
x2
x0 B
19.
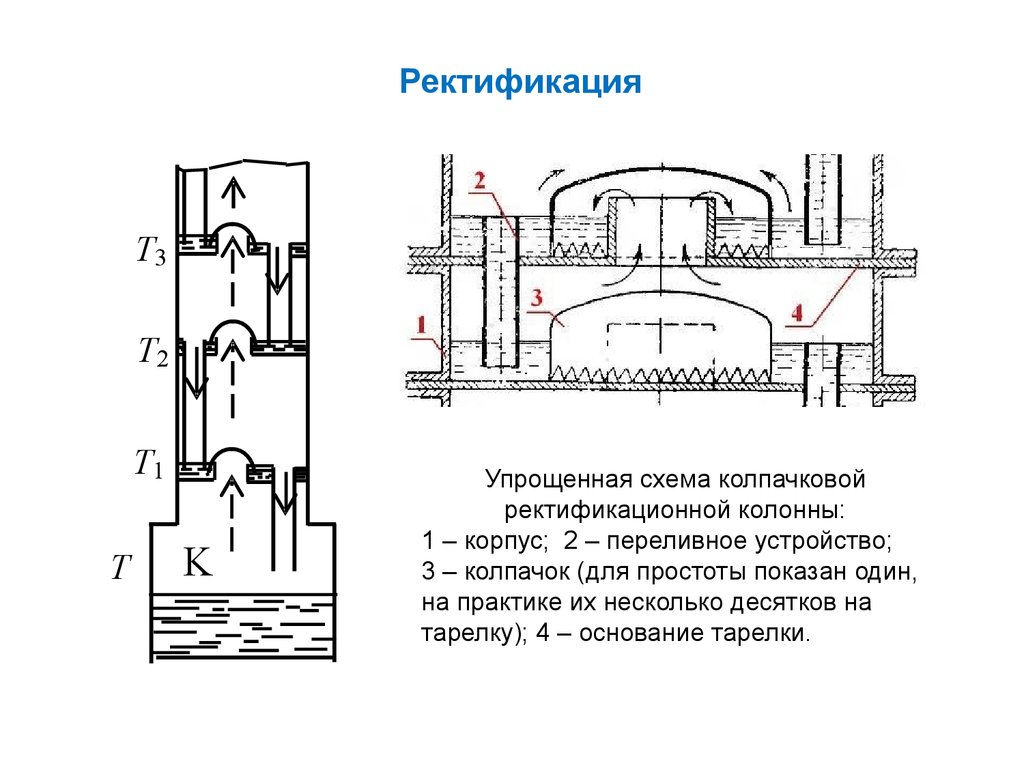
РектификацияT3
T2
T1
T
K
Упрощенная схема колпачковой
ректификационной колонны:
1 – корпус; 2 – переливное устройство;
3 – колпачок (для простоты показан один,
на практике их несколько десятков на
тарелку); 4 – основание тарелки.
20.
21.
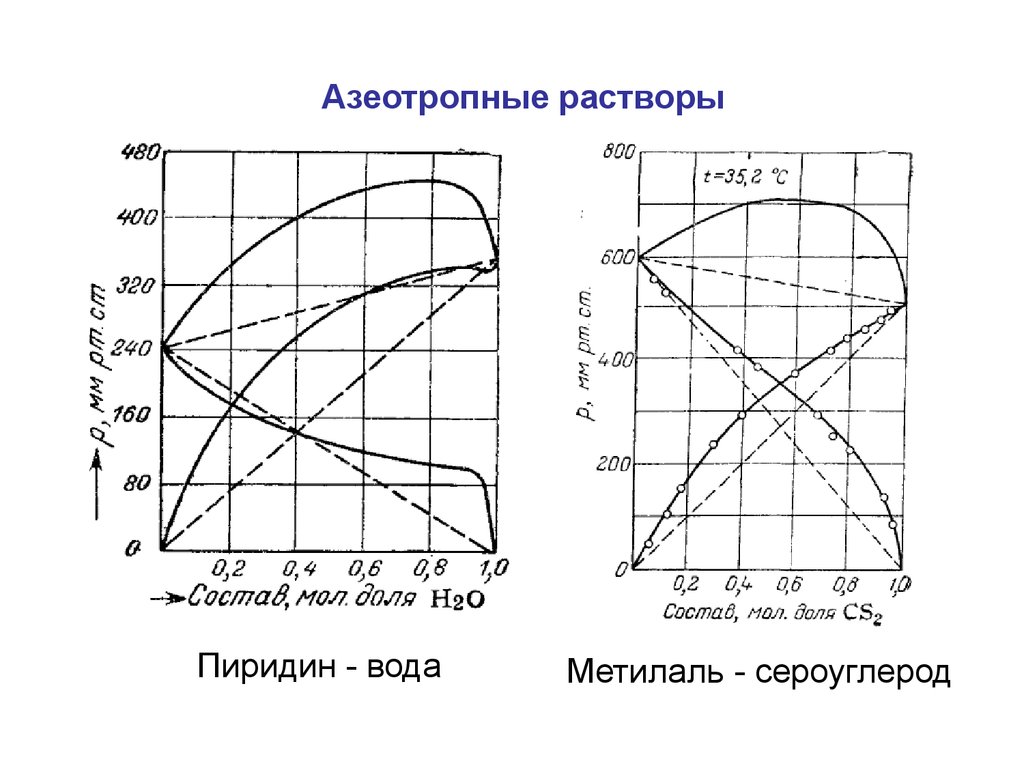
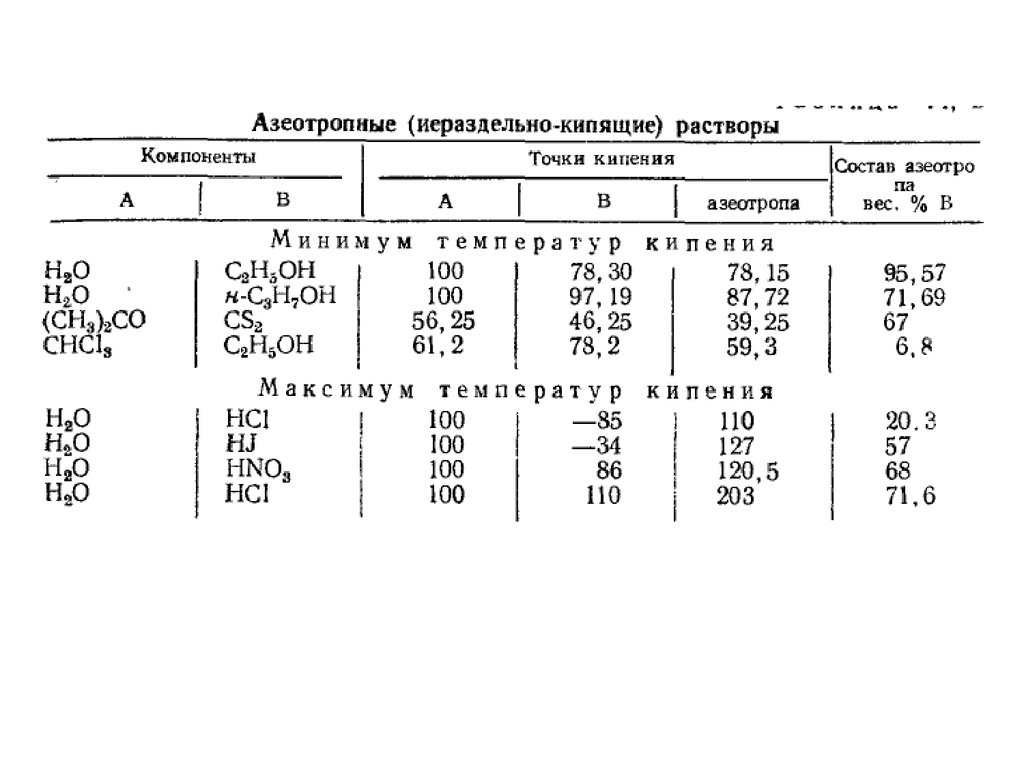
Азеотропные растворыПиридин - вода
Метилаль - сероуглерод
22.
Второй закон Коновалова(1 – х) d lnp1 = – х d lnp2
dp1
dp2
(1 x)
x
p1
p2
x p1
dp1
dp2
1 x p2
р2 = yР ;
р1 = (1 – у)Р
x( 1 y )
dp1
dp2
(1 x ) y
dР = dp1 + dp2
23.
y xx(1 y )
dp2
dP 1
dp2 =
(1 x) y
(1 x) y
dP
y x dp2
dx (1 x) y dx
(dP/dx)ex = 0,
I закон:
dP/dx > 0;
xex = yex
dp2/dx > 0;
y>x
24.
25.
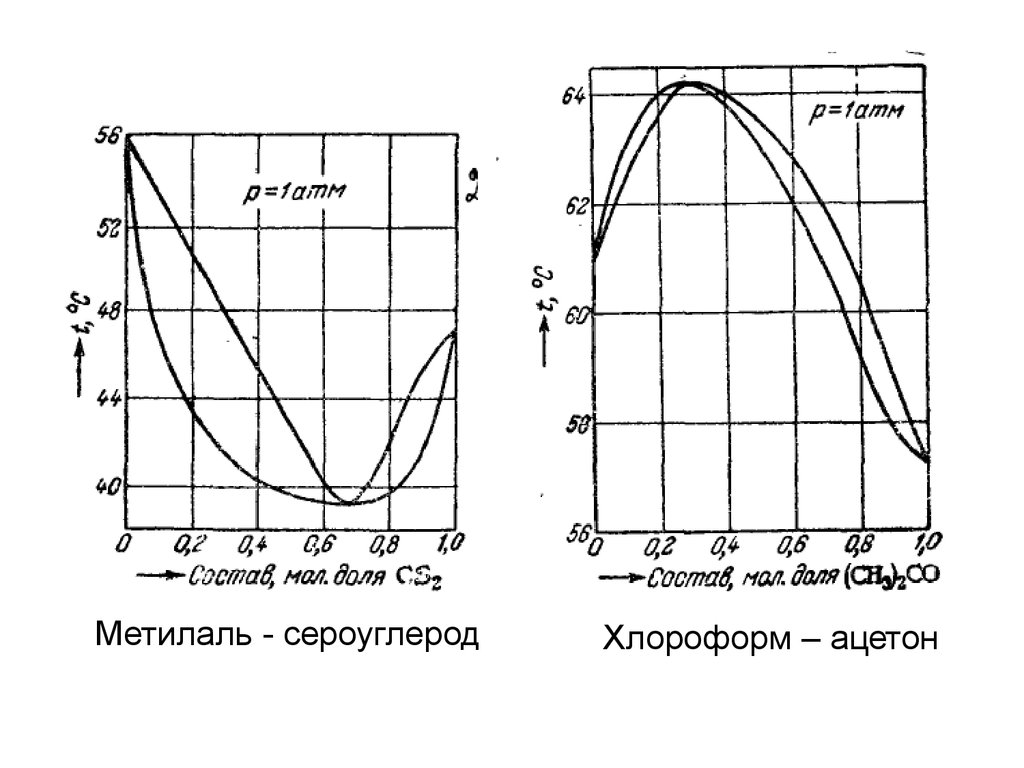
Метилаль - сероуглеродХлороформ – ацетон
26.
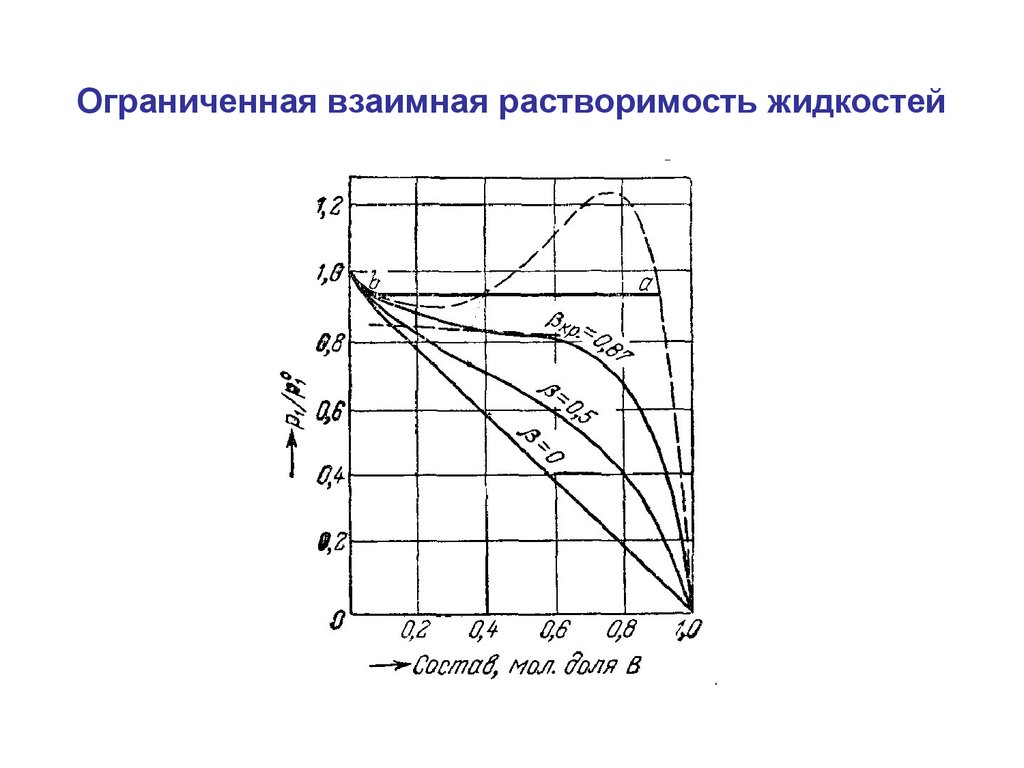
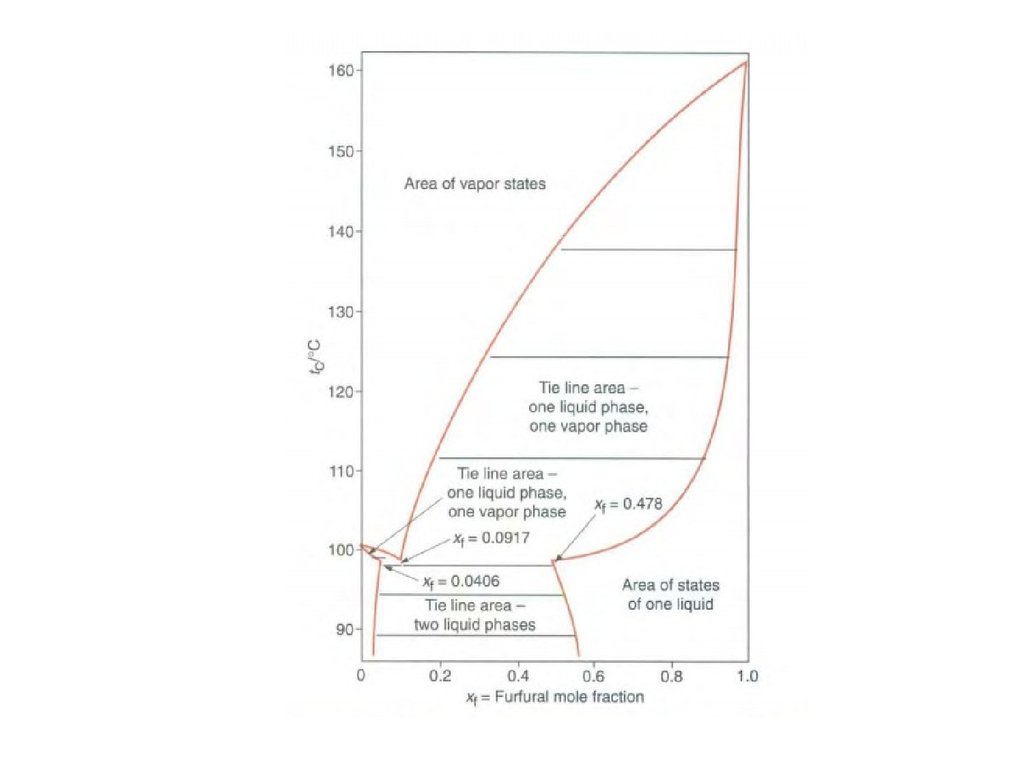
Ограниченная взаимная растворимость жидкостей27.
Зависимость энергии Гиббса от состава при образовании бинарного раствораG
а)
GB
G
G
б)
GB
GA
GA
b
c
а
Gx
А
х
i
0;
xi T , p
В
А
х
2G
2
0
xi T , p , x j
В
28.
Вода - фенол29.
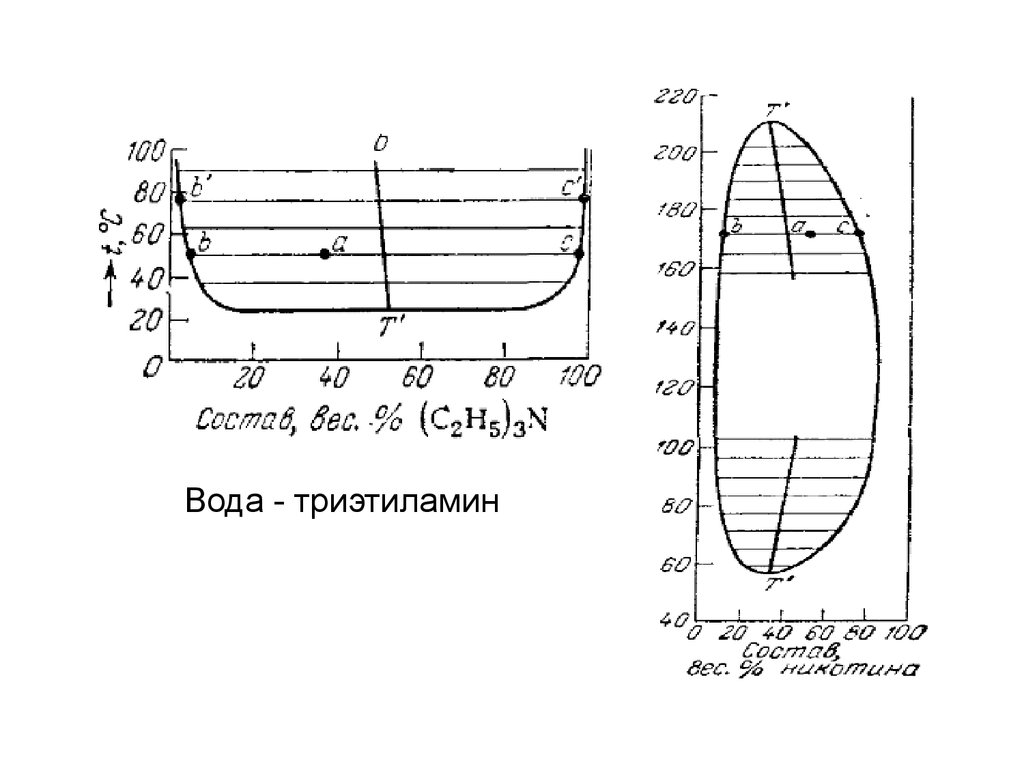
Вода - триэтиламин30.
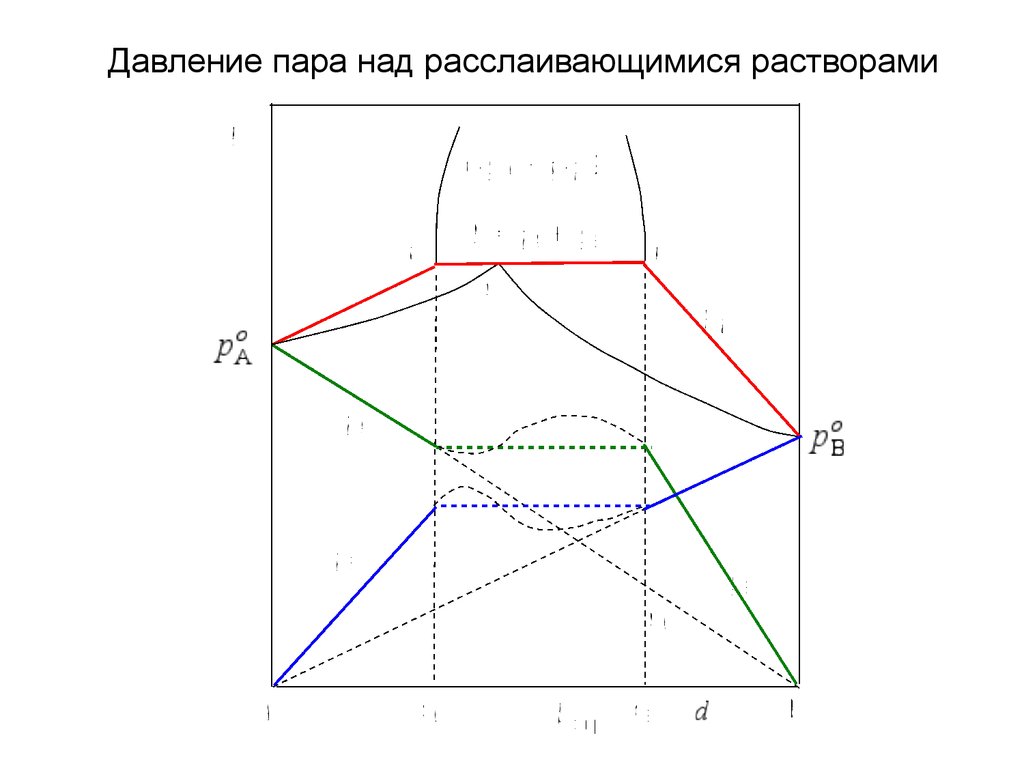
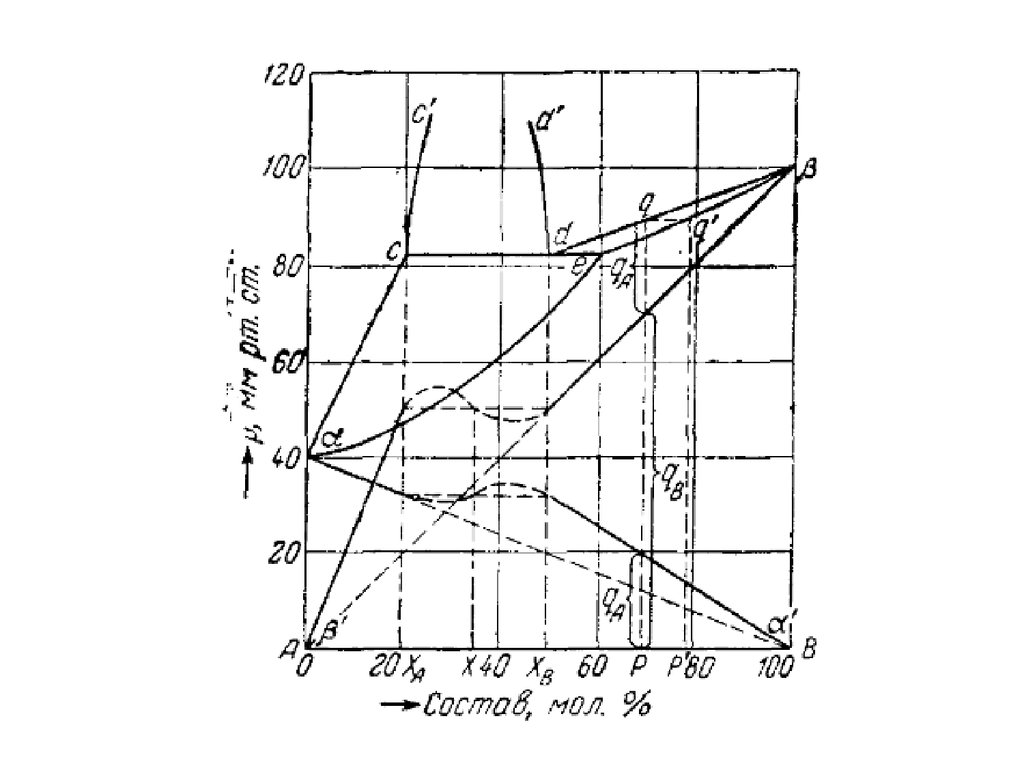
Давление пара над расслаивающимися растворами31.
32.
33.
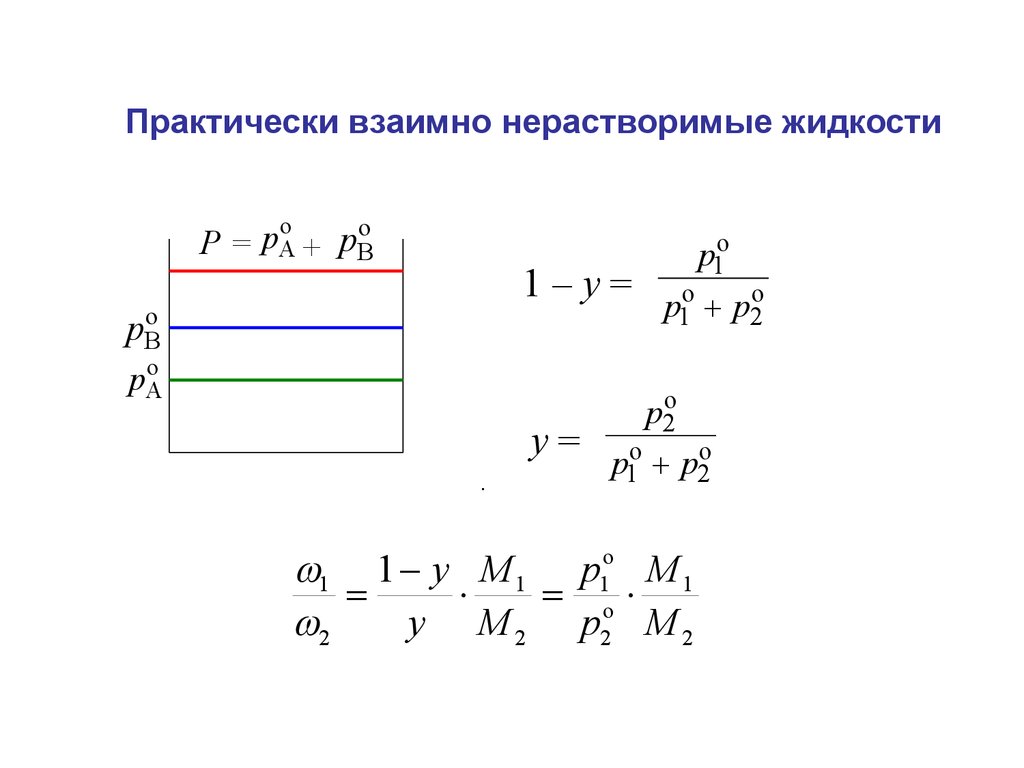
Практически взаимно нерастворимые жидкостиo
o
Р = pA + pB
1–у=
pBo
pAo
у=
.
p1o
p1o p2o
p2o
p1o p2o
1 1 y M 1 p1o M 1
o
2
y M 2 p2 M 2







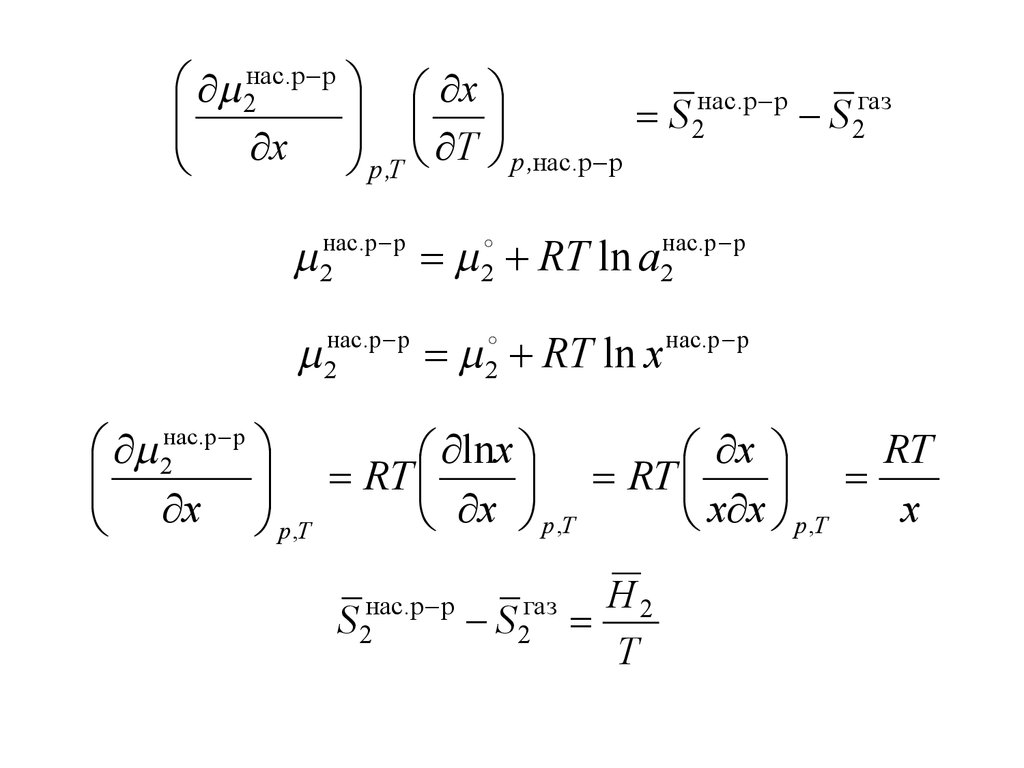










 Химия
Химия








