Похожие презентации:
Молекулярная физика. Тепловые явления
1. Молекулярная физика. Тепловые явления.
2.
Рассматриваемые вопросы:1. Основы молекулярно-кинетической
теории.
2. Температура. Энергия теплового
движения молекул.
3. Уравнение состояния идеального газа.
Газовые законы.
4. Взаимные превращения жидкостей и
газов.
5. Твердые тела.
6. Основы термодинамики.
3.
Основы молекулярнокинетической теорииДомашнее задание: п.п 56-59
4. Молекулярно-кинетическая теория - учение о строении и свойствах вещества, использующее представления о существовании атомов и
Молекулярно-кинетическая теория учение о строении и свойствах вещества,использующее представления о
существовании атомов и молекул как
наименьших частиц химического
вещества.
5.
МКТ объясняет свойства макроскопических тел итепловых процессов, на основе представлений о
том, что все тела состоят из отдельных,
беспорядочно движущихся частиц.
Макроскопические тела – тела, состоящие из
большого количества частиц.
Микроскопические тела – тела, состоящие из
малого количества частиц.
6. Основы МКТ
Основные положения МКТ
Молекулярно-кинетическая теория
Масса и размеры молекул
Количество вещества
Строение газов, жидкостей и твердых тел
Идеальный газ
Среднее значение квадрата скорости молекул
Основное уравнение МКТ
7. Основные положения МКТ
1. Все вещества состоят из молекул2. Молекулы находятся в непрерывном
беспорядочном движении
3. Между молекулами действуют силы
взаимного притяжения и
отталкивания
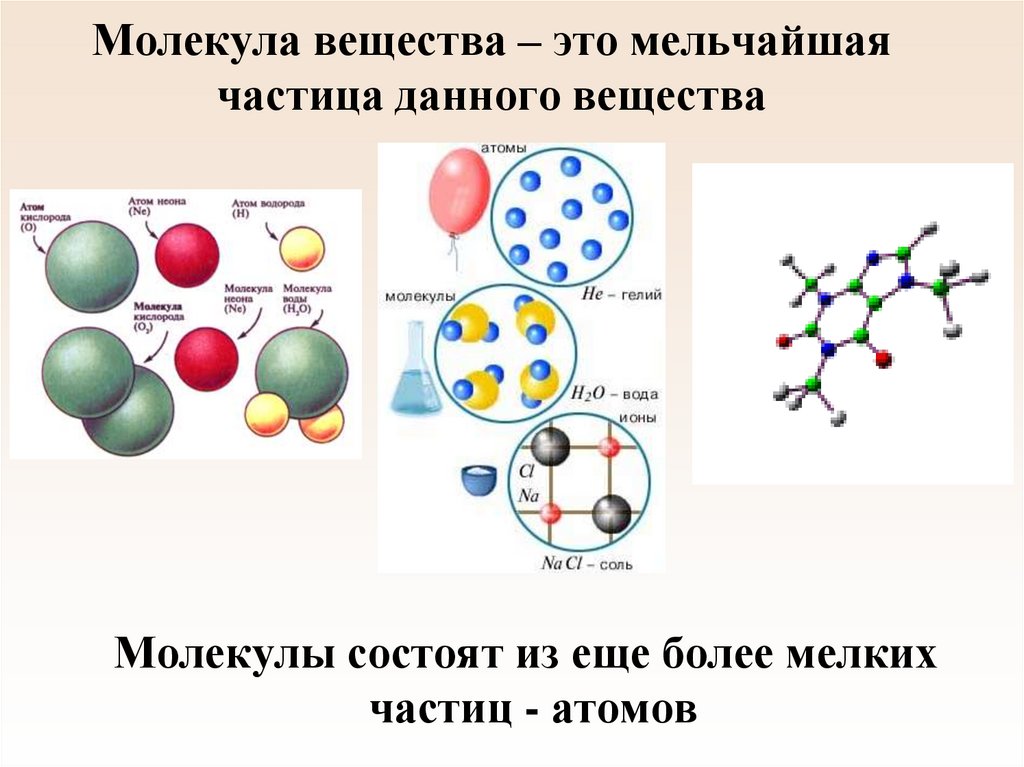
8. Молекула вещества – это мельчайшая частица данного вещества
Молекулы состоят из еще более мелкихчастиц - атомов
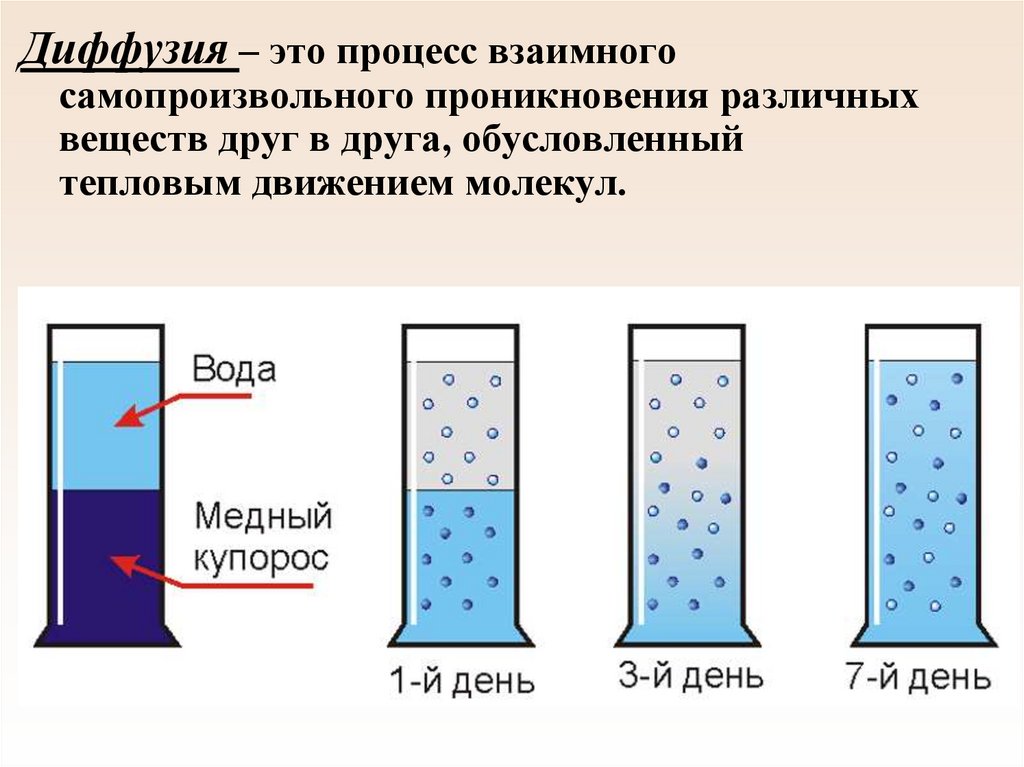
9.
Диффузия – это процесс взаимногосамопроизвольного проникновения различных
веществ друг в друга, обусловленный
тепловым движением молекул.
10. Броуновское движение
• Причина броуновскогодвижения состоит в том,
что удары молекул
жидкости о частицу не
компенсируют друг друга.
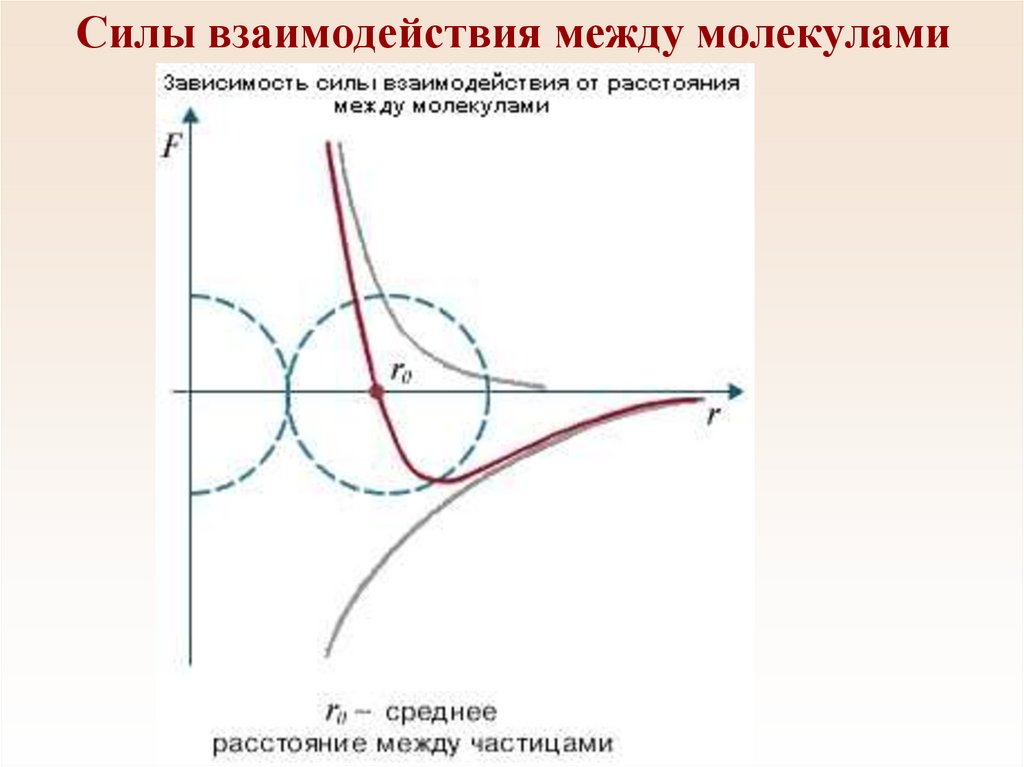
11.
Силы взаимодействия между молекулами12.
Масса и размеры молекулкофе
этанол
13.
14. Масса молекул
В 1 г воды содержится 3,7 * 1022 молекул.m0 воды
1г
3,7 10
22
2,7 10
23
г
Массы молекул в макроскопических масштабах
чрезвычайно малы.
15. Масса молекул. Количество вещества
1961 годОтносительной молекулярной (или атомной)
массой вещества (Мr) называют отношение массы
молекулы (или атома) m0 данного вещества к 1/12
массы атома углерода m0C.
Mr
m0
1
m0C
12
Для каждого вещества записана в таблице
Менделеева в г/моль
16. Количество вещества
Количество вещества наиболее естественно былобы измерять числом молекул или атомов в теле.
Но число частиц в любом макроскопическом теле
так велико, что в расчетах используют не
абсолютное число частиц, а относительное.
моль
Один моль – это количество вещества, в котором
содержится столько же молекул или атомов,
сколько содержится в углероде массой 12 г.
17.
В 1 моле любого вещества содержится одно и то жечисло атомов или молекул.
1
N A 6,022 10
- постоянная Авогадро
моль
23
Количество вещества равно отношению числа
молекул в данном теле к постоянной Авогадро.
N
NA
18.
Молярной массой вещества называют массувещества, взятого в количестве 1 моль.
m0 N A
кг
моль
m0 - масса одной молекулы или атома
m0
NA
19.
m m0 Nm – масса вещества
m
N
N N A N A
m
- формула
для расчета
числа частиц в теле
20.
Основное уравнениемолекулярно-кинетической
теории
Домашнее задание: п.п 60-63
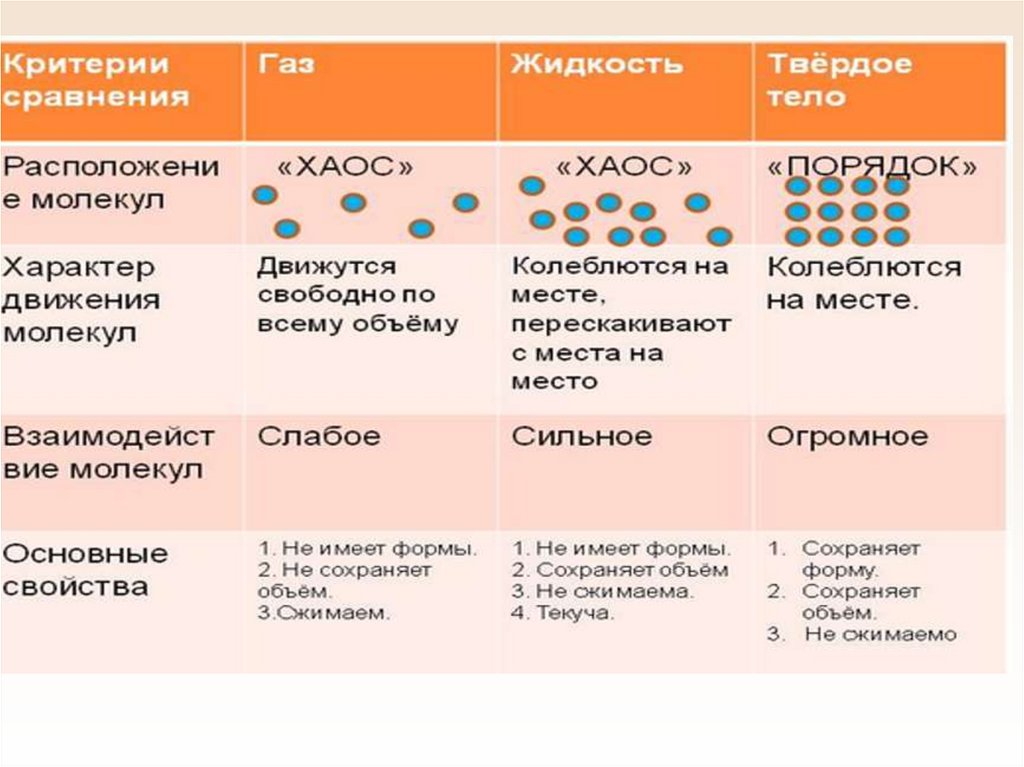
21. Строение газов, жидкостей и твердых тел
22.
23. Идеальный газ
Идеальный газ – это газ, в котором• Частицы – материальные точки
• Частицы взаимодействуют только при
соударениях
• Удары абсолютно упругие
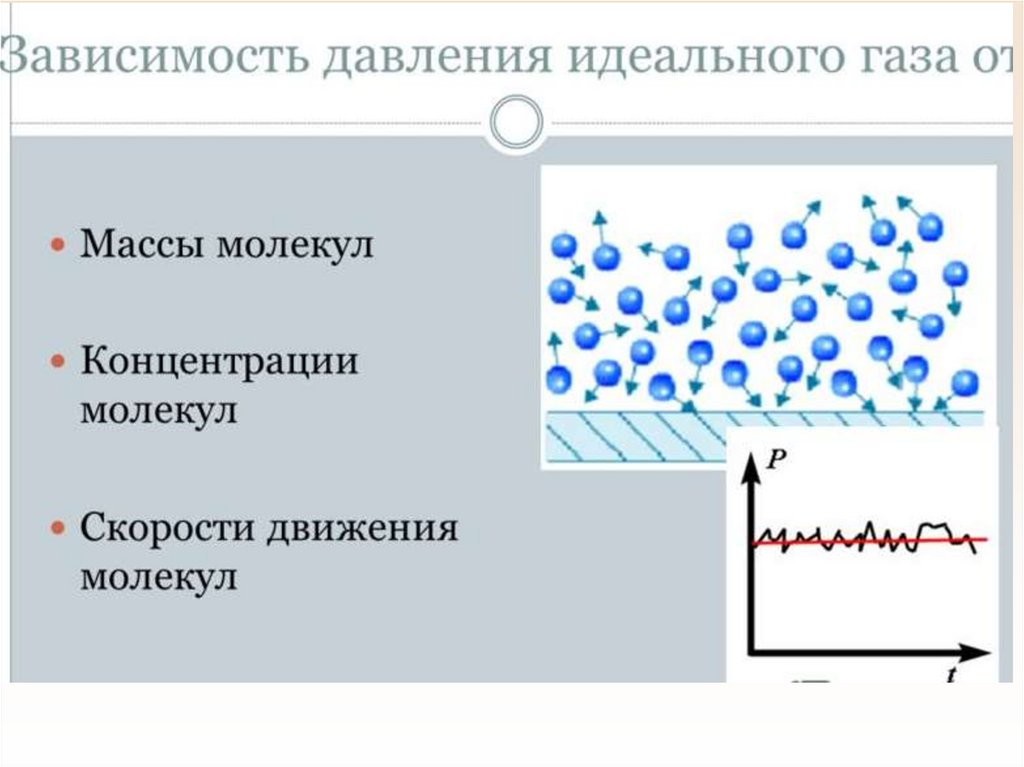
24. Основное уравнение мкт
•Основное уравнение мкт устанавливаетзависимость давления газа от средней кинетической
энергии его молекул.
•Газ оказывает давление на стенки сосуда путем
многочисленных ударов молекул (или атомов).
25.
26. Среднее значение квадрата скорости молекул
• Скорость – величина векторная, поэтому средняяскорость движения частиц в газе равна нулю.
27. Среднее значение квадрата скорости молекул
22 3 ...
2
1
2
2
N
x y z
2
2
2
x y z
2
x
2
2
1 2
3
2
2
0
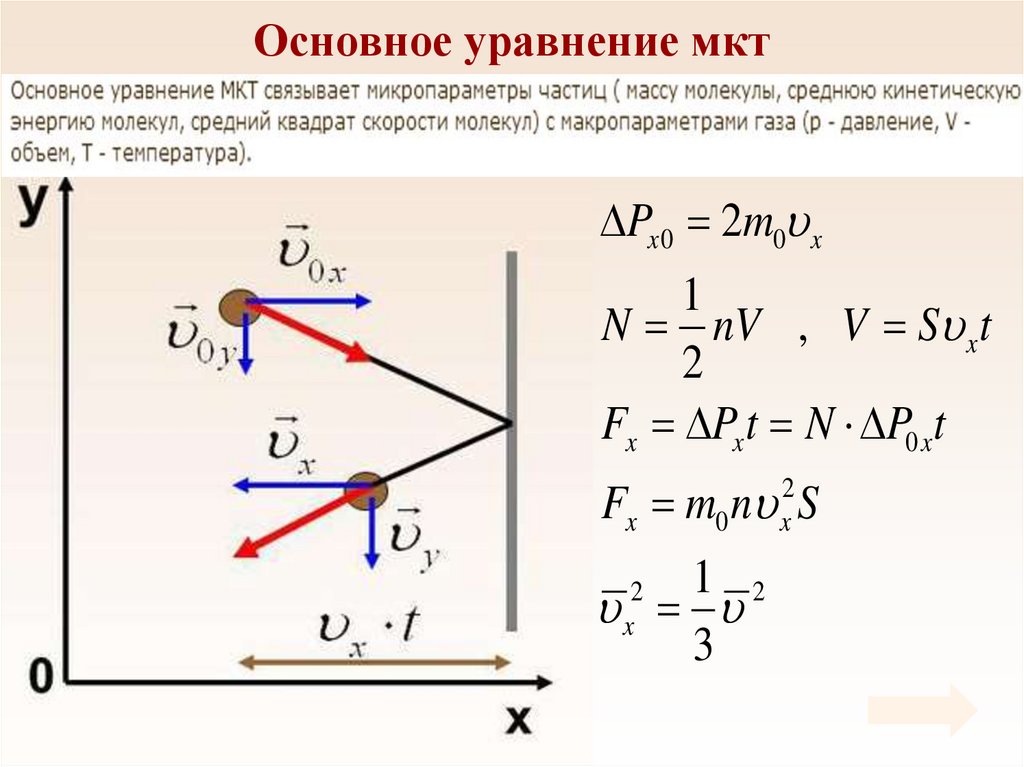
28. Основное уравнение мкт
Px 0 2m0 x1
N nV , V S xt
2
Fx Pxt N P0 xt
Fx m0 n S
2
x
1 2
3
2
x
29.
30.
31.
Решение задач по теме:«Основы молекулярнокинетической теории»
Домашнее задание: п.п 56-63, упр.11
32.
1. Какое количество вещества в молях составляют5,418х1026 молекул? (900 моль)
2. Какова масса в килограммах 450 молей кислорода О2?
(14,4 кг)
3. Вычислить массу одной молекулы водорода (Н2),
кислорода (О2), озона (О3), углекислого газа (СО2),
метана (СН4). (3,3х10-27 кг, 5,3х10-26 кг, 8,0х10-26 кг,
7,3х10-26 кг, 2,7х10-26 кг)
33.
34.
35.
36.
1. Какое давление на стенки сосуда производиткислород, если средняя квадратичная скорость его
молекул 400 м/с и число молекул в 1 куб.см равно
2,7х1019? (7,7х104 Па)
2. Определить число молекул водорода в 1 куб.м, если
давление равно 26,6 кПа, а средняя квадратичная
скорость его молекул равна 2400 м/с. (4,1х1024
1/куб.м).
3. 6Какое давление на стенки сосуда производят
молекулы газа, если масса газа 3,0 г, объем 0,50 л, а
средняя квадратичная скорость молекул 500 м/с?
(5,0х104 Па)
37. Температура и энергия теплового движения молекул Домашнее задание: п.64-67
38.
• Температура и тепловое равновесие• Температура – мера средней
кинетической энергии молекул
• Скорости молекул
39. Температура и тепловое равновесие
• Макроскопические параметры(макропараметры) – величины,
характеризующие состояние
макроскопических тел без учета
молекулярного строения. (V, p, t ).
• Тепловым равновесием называют такое
состояние, при котором все макроскопические
параметры всех тел системы остаются
неизменными сколь угодно долго.
40.
• Любое макроскопическое тело или группамакроскопических тел при неизменных внешних
условиях самопроизвольно переходит в
состояние теплового равновесия.
• Все тела системы, находящиеся друг с другом в
тепловом равновесии имеют одну и ту же
температуру.
41.
• Термометр – прибор для измерениятемпературы тела.
• Термометр входит в состояние теплового
равновесия с исследуемым телом и показывает
свою температуру.
42.
Основная деталь термометра –термометрическое тело, то есть тело,
макропараметры которого изменяются при
изменении температуры. (Например, в ртутных
термометрах термометрическим телом является
ртуть – при изменении температуры изменяется
ее объем.)
43.
• Изобретателем термометра являетсяГалилео Галилей (ок. 1600 г.)
• Термометрическим телом в его термометре
являлся газ – при повышении температуры
его объем увеличивался, вытесняя
жидкость.
• Недостатком термометра Галилея являлось
отсутствие температурной шкалы.
44.
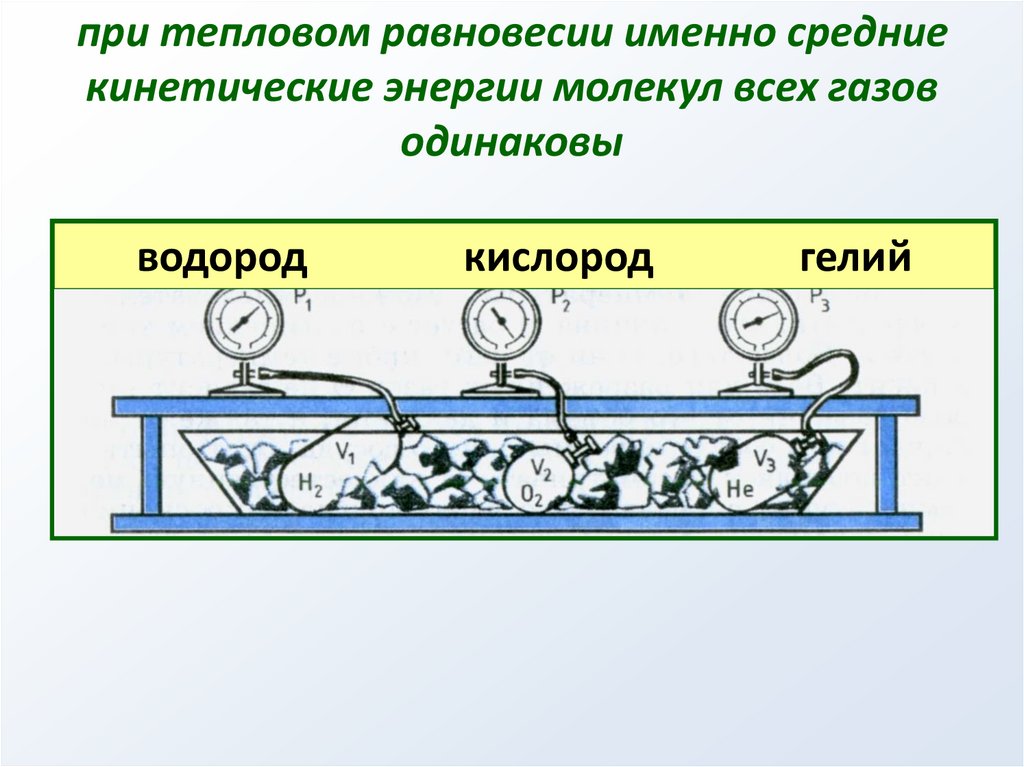
при тепловом равновесии именно средниекинетические энергии молекул всех газов
одинаковы
водород
кислород
гелий
45.
22N
р nE
E
3
3V
рV 2
E
N 3
m
N
NA
M
рV
21
0 3,76 10 Дж
N
рV
21
100 5,14 10 Дж
N
46.
- температура в энергетическихединицах
kT
Т- температура в градусах Кельвина
(абсолютная температура)
k- коэффициент пропорциональности,
постоянная Больцмана.
100 0 kT2 kT1 k (T2 T1 )
47.
100 0 kT2 kT1 k (T2 T1 )100 0
k
T2 T1
(5,14 3,76) 10
100 К
23 Дж
1,38 10
K
21
Дж
Постоянная Больцмана связывает температуру в
энергетических единицах с температурой в Кельвинах.
48.
рV 2E kT
N 3
2
E kT
3
температура
–
мера
3
E kT средней кинетической
2
энергии молекул.
49.
Абсолютная температура иабсолютный нуль
• Из полученного равенства следует, что при Т = 0 должны
равняться нулю или давление (т.е. движение и соударение
молекул со стенками прекращается) или объём газа (т.е.
сжатие до нуля).
• Отсюда понятие абсолютного нуля температуры (0 К) –
температуры, при которой должно прекратиться
движение молекул.
• Установим связь между абсолютной температурой и
температурой по Цельсию:
т. к. при t = 0 kT = 3,76*10 -21 Дж,
где k = 1,38*10-23 Дж/K,
то T = 3,76*10 -21/ 1,38*10-23 ≈ 273,15 (K)
Таким образом Т ≈ t + 273
50.
ΔТ = Δ tТ = t + 273
51. Зависимость давления газа от температуры и концентрации молекул газа
3Ek kT
2
2
p nEk
3
p nkT
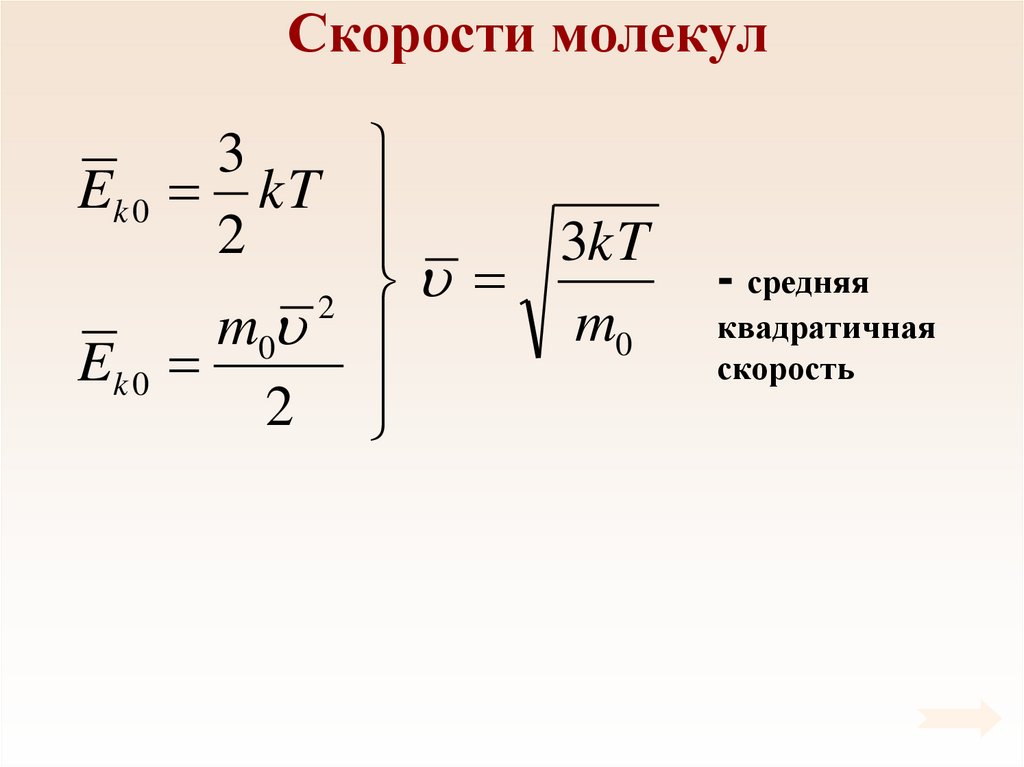
52. Скорости молекул
3Ek 0 kT
2
3kT
2
m0
m0
Ek 0
2
- средняя
квадратичная
скорость
53.
54.
55.
56. Уравнение состояния идеального газа Домашнее задание: п.68-69
57.
• Уравнение Менделеева-Клапейрона• Газовые законы
- Изотермический процесс
- Изобарный процесс
- Изохорный процесс
58. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
Np nkT kT
V
m
N N A N A
pV
Дж
N A k R 8,31
моль К
- универсальная
m
RT
газовая постоянная
59.
Если в ходе процесса масса газаостается неизменной, то
pV m
R const
T
p1V1 p2V2 p3V3
...
T1
T2
T3
60. Изопроцессы
- Изотермический процесс- Изобарный процесс
- Изохорный процесс
61. Изотермический процесс
• Процесс, происходящий с газомнеизменной массы при постоянной
температуре называется изотермическим.
• Изотермический процесс описывается
законом Бойля – Мариотта (конец 17 века):
pV
const
T
p1V1 p2V2
для газа данной массы при постоянной
температуре произведение газа на его
объем постоянно
62. Изобарный процесс
• Процесс, происходящий с газомнеизменной массы при постоянном
давлении называется изобарным.
• Изобарный процесс описывается законом
Гей-Люссака (1802 г.):
pV
const
T
V1 V2
T1 T2
для газа данной массы при постоянном
давлении отношение объема к
температуре постоянно
63. Изохорный процесс
• Процесс, происходящий с газомнеизменной массы при постоянном объеме
называется изохорным.
• Изохорный процесс описывается законом
Шарля (1787 г.):
pV
const
T
p1 p2
T1 T2
для газа данной массы отношение
давления к температуре постоянно, если
объем не меняется
64. Графики изопроцессов
65. Решение задач на газовые законы Домашнее задание: п.68-69
66.
1. Определите среднюю кинетическую энергию молекулыодноатомного газа и концентрацию молекул при температуре 290К и
давлении 0,8 МПа. (5х10-21 Дж, 2х1026 м-3)
2. Вычислите среднюю кинетическую энергию молекул идеального
газа при температуре 27С. (6,2х10-21 Дж)
3. Чему равно отношение произведения давления газа на его объем
к числу молекул при температуре 300С? (7,9х10-21 Дж)
4. Некоторое количество водорода находится при температуре 200К
и давлении 400Па. Газ нагревают до температуры 10000К, при
которой молекулы водорода практически полностью распадаются на
атомы. Определите значение давления газа при температуре Т2,
если его объем и масса остались без изменения. (40 кПа)
67.
1. Какой объем займет 1 кмоль газа при давлении 1,0 МПа и температуре100С? (3,1 куб.м)
2. Имеется 12л углекислого газа под давлением 9,0х105 Па и температуре 288
К. Найти массу газа. (0,20 кг)
3. В сосуде вместимостью 500 куб.см содержится 0,89 г водорода при
температура 17 С. Найти давление газа. (2,1 МПа)
4. В баллоне вместимостью 40 л находится 1,98 кг углекислого газа. Баллон
выдерживает давление не более 30х105 Па. При какой температуре
возникает опасность разрыва баллона? (48С)
5. Какова плотность гелия при температуре 127С и давлении 8,3х10 5 Па? (1,0
кг/куб.м)
68.
1. Построить изобару в координатных осях VT, РV, PT2. Построить изотерму в координатных осях РV, VT, PT
3. Построить изохору в координатных осях PT, РV, VT
4. В цилиндре под поршнем изобарически охлаждают 10 куб.м газа от 100С до
0С. Каков объем охлажденного газа? (8,5 куб.м)
5. В конце процесса сжатия газа в цилиндре двигателя внутреннего сгорания
давление было 9*105 Па, в конце процесса сгорания топлива стало равным
35*105 Па. Определите температуру газа в цилиндре в конце процесса
сгорания топлива. Температура в конце процесса сжатия равна 400С. Поршень
в процессе сгорания топлива можно считать неподвижным. (2600К)
6. Во сколько раз изменится объем пузырька воздуха при всплывании его со дна
озера глубиной 20м к поверхности воды? Температура воды у дна озера и у
поверхности одинакова. Атмосферное давление принять равным 10 5 Па,
плотность воды 103 кг/м3. (в 3 раза)
69.
Взаимные превращенияжидкостей и газов
Домашнее задание:
П.п.70-72,
70.
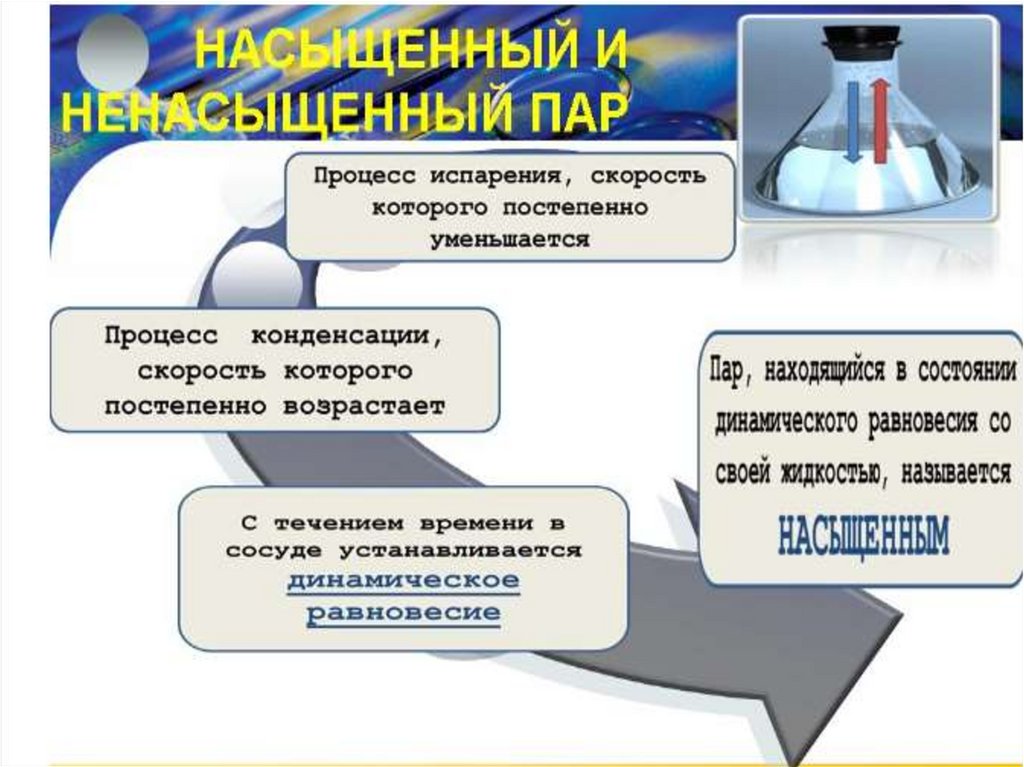
Насыщенный пар
Испарение и кипение
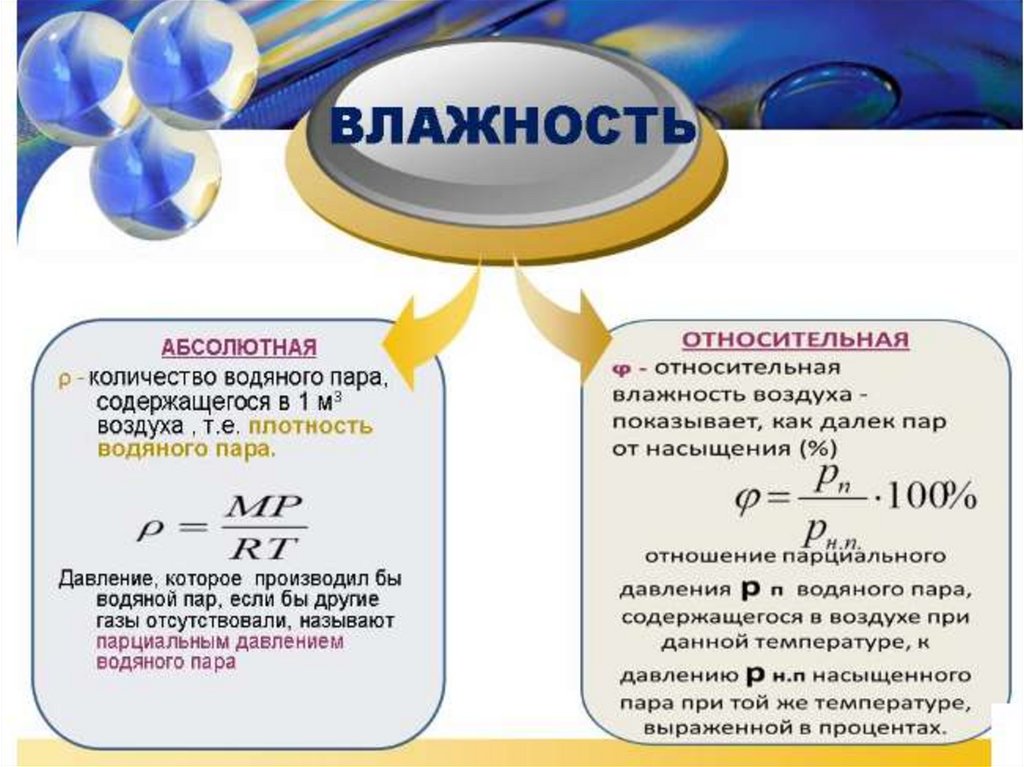
Влажность воздуха
Измерение влажности
71.
72. Давление насыщенного пара
p1 , V 1p2 , V 2
p1 = p2
Давление насыщенного пара не зависит от
занимаемого объема.
73. Давление насыщенного пара
Давление насыщенного пара зависит толькоот температуры.
p0
T
74. Давление насыщенного пара
Точка росы – этотемпература, при
которой
ненасыщенный пар
становится
насыщенным .
p0
p
T
Tр
T
75.
76. Испарение и кипение
Процесспарообразования с
поверхности
жидкости.
Происходит при
любой
температуре.
Скорость испарения зависит от:
•Вида жидкости
•Температуры
•Площади поверхности
•Наличия ветра
Процесс
парообразования
по всему объему
жидкости.
Происходит при
температуре
кипения.
Чем ниже давление,
тем ниже температура
кипения.
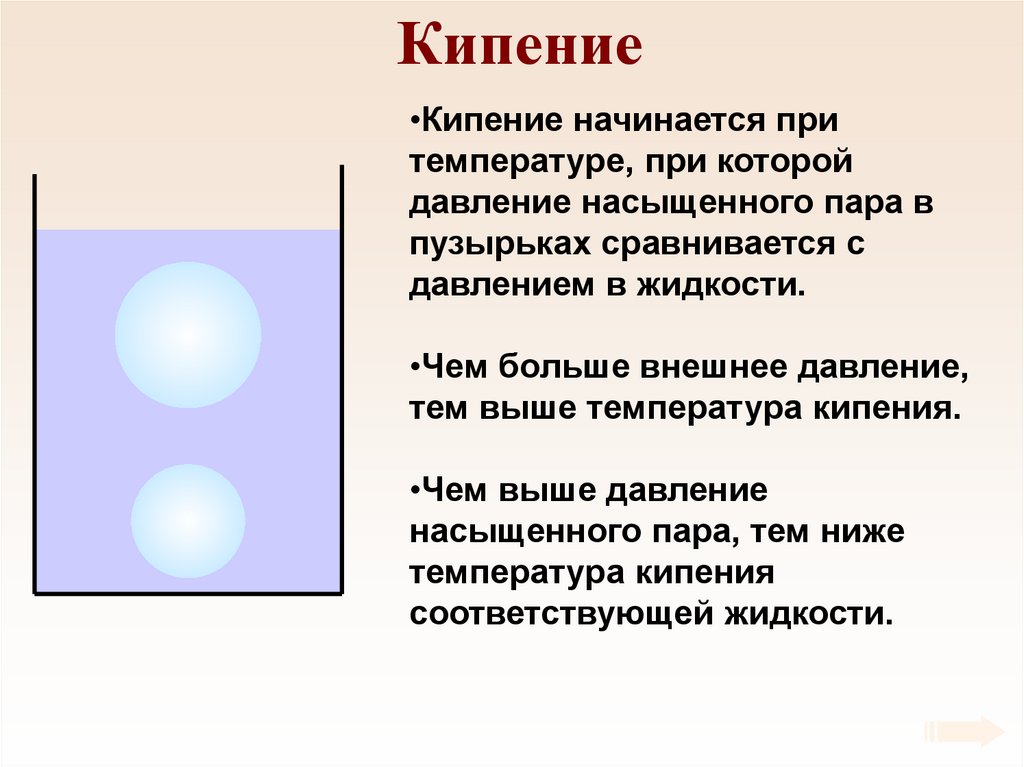
77. Кипение
•Кипение начинается притемпературе, при которой
давление насыщенного пара в
пузырьках сравнивается с
давлением в жидкости.
•Чем больше внешнее давление,
тем выше температура кипения.
•Чем выше давление
насыщенного пара, тем ниже
температура кипения
соответствующей жидкости.
78.
79. Измерение влажности
Приборы для измерения влажности:• Психрометр
• Гигрометр
80.
Решение задач на определениевлажности воздуха
Домашнее задание:
П.п.70-72, упр. 14
81.
Измерьте влажность воздуха в кабинете при помощипсихрометра.
Вычислите массу насыщенного водяного пара в 1 куб.м
воздуха при температуре 20С. Давление насыщенного
пара при этой температуре равно 2,33 кПа. (1,7х10-2 кг)
В воздухе насыщенный водяной пар содержится при 30С.
Определить массу воды, выпавшей в виде росы, из 1
куб.м воздуха при его охлаждении до 15С.
Давление насыщенного пара при 30С – 4,23 КПа, а при
15С – 1,70 кПа. (1,8х10-2 кг)
82.
Твердые телаДомашнее задание: п.п.73-74
83.
• Закон Гука• Кристаллические тела
• Аморфные тела
84.
Кристаллические телаКристаллы - твердые тела, в которых атомы
или молекулы расположены упорядочение и
образуют периодически повторяющуюся
внутреннюю структуру
Кристаллическая решетка
поваренной соли
85.
монокристаллыАнизотропия –
зависимость физических
свойств от направления
внутри кристалла.
поликристаллы
86. Аморфные тела
• Нет строгого порядка в расположенииатомов.
• Все аморфные тела изотропны, т.е их
физические свойства одинаковы по всем
направлениям.
• Аморфные тела не имеют определенной
температуры плавления.
• При внешних воздействиях аморфные тела
обнаруживают одновременно упругие
свойства, подобно твердым телам, и
текучесть, подобно жидкости.
87. Основы термодинамики
Внутренняя энергия
Работа в термодинамике
Количество теплоты
Первый закон термодинамики и его
применение к различным процессам
• Тепловые двигатели
88. Внутренняя энергия
Внутренняя энергия макроскопическоготела равна сумме кинетических энергий
беспорядочного движения всех молекул
(или атомов) тела и потенциальных
энергий взаимодействий всех молекул
друг с другом (но не с молекулами
других тел).
U Дж
U N E k N En
89.
В идеальном газе частицы не взаимодействуютмежду собой, следовательно их потенциальные
энергии равны нулю.
U N Ek
N NA
m
3
Ek kT
2
NA k R
3m
U
RT
2
3
U RT
2
3
U pV
2
90.
3•Коэффициент
применим только для одноатомного
2
газа.
i
•В общем случае используется коэффициент
, где i
2
– число степеней свободы движения частицы.
Одноатомный газ (неон, аргон, гелий) – i = 3.
Двухатомный газ (водород, азот) – i = 5.
Трехатомный газ (углекислый газ, озон) – i = 6.
3m
U
RT
2
91.
Способы изменения внутреннейэнергии:
• Передача теплоты
• Совершение работы
92. Работа в термодинамике
Работа газа:A F s cos F , d
p s h p V
По третьему
закону Ньютона:
F F
Работа внешних
сил над газом:
A A p V
93. Работа в термодинамике
• Если процесс не изобарный, используетсяграфический метод: работа равна площади
фигуры под графиком процесса в осях pV.
• Работа газа считается положительной, если объем
газа увеличивается и отрицательной, если объем
газа уменьшается.
•В случае изохорного
процесса работа газа
равна нулю.
p
S
0
V
94. Количество теплоты
Количество теплоты – это энергия полученная илиотданная телом в процессе теплопередачи.
Виды теплопередачи:
• Теплопроводность
• Конвекция
• излучение
Q Дж
95. Количество теплоты
• Q = cm(t02-t01) – нагревание(охлаждение)
• Q= m - плавление (отвердевание)
• Q = Lm - парообразование
(конденсация)
• Q = qm – сгорание топлива
96. Первый закон термодинамики
Обмен энергией между термодинамическойсистемой и окружающими телами в результате
теплообмена и совершаемой работы
97.
Изменение внутренней энергии системы припереходе ее из одного состояния в другое равно сумме
работы внешних сил и количества теплоты,
переданного системе:
U Q A
Если А - работа внешних сил, а А' - работа газа, то
А = - А' (в соответствии с 3-м законом Ньютона).
Тогда:
Q U A
другая форма записи первого закона термодинамики
98. Применение первого закона термодинамики к различным процессам
Изотермический процесс
Изобарный процесс
Изохорный процесс
Адиабатный процесс
99. Изотермический процесс (Т=const)
100.
101. Изобарный процесс (p=const)
102.
103. Изохорный процесс (V=const)
104.
105. Адиабатный процесс
106.
107. Тепловые двигатели
Машины, преобразующие внутреннююэнергию в механическую работу, называют
тепловыми двигателями
Тепловые
двигатели
Двигатели
внутреннего
сгорания
Карбюраторные
(внешнее
смесеобразование)
Паровые
двигатели
Дизельные
(внешнее
смесеобразование)
Имя
Турбины
Паровые
Газовые
108. Тепловые двигатели
КПД теплового двигателяA Q1 Q 2
Q2
1
1
Q1
Q1
Q1
Кпд реальных двигателей:
турбореактивный - 20 -30%;
карбюраторный - 25 -30%,
дизельный - 35-45%.
Энергетическая схема
тепловой машины: 1 –
нагреватель; 2 –
холодильник; 3 – рабочее
тело, совершающее
круговой процесс.
109.
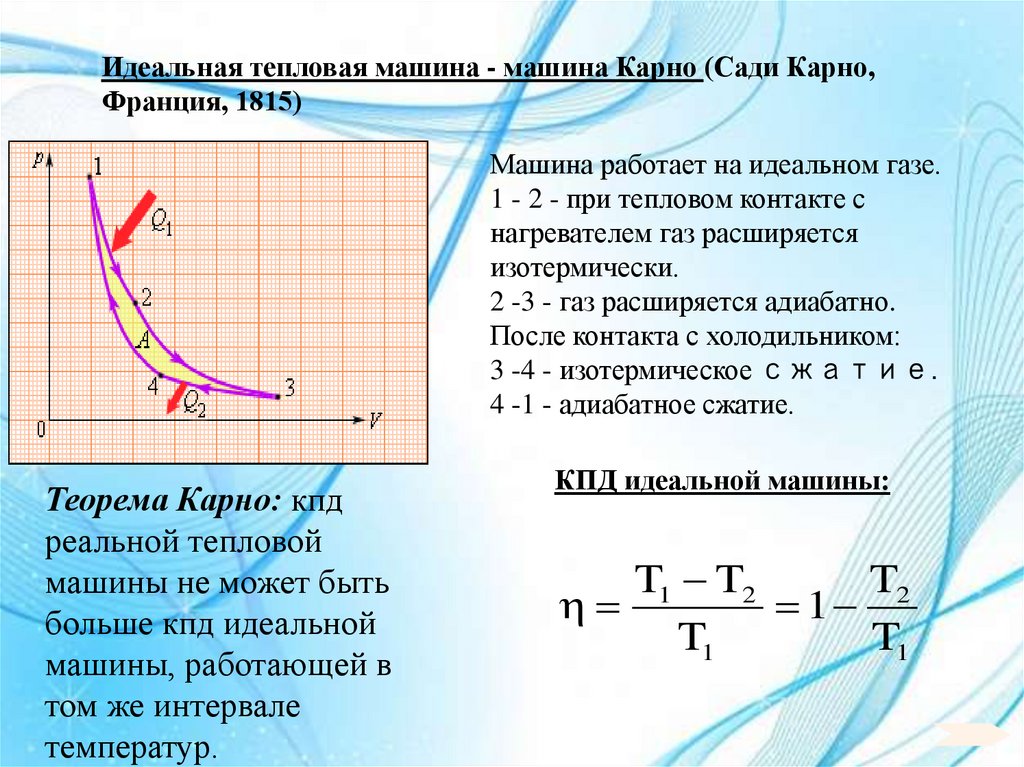
Идеальная тепловая машина - машина Карно (Сади Карно,Франция, 1815)
Машина работает на идеальном газе.
1 - 2 - при тепловом контакте с
нагревателем газ расширяется
изотермически.
2 -3 - газ расширяется адиабатно.
После контакта с холодильником:
3 -4 - изотермическое сжатие.
4 -1 - адиабатное сжатие.
Теорема Карно: кпд
реальной тепловой
машины не может быть
больше кпд идеальной
машины, работающей в
том же интервале
температур.
КПД идеальной машины:
T1 T2
T2
1
T1
T1
110.
Спасибо завнимание!













































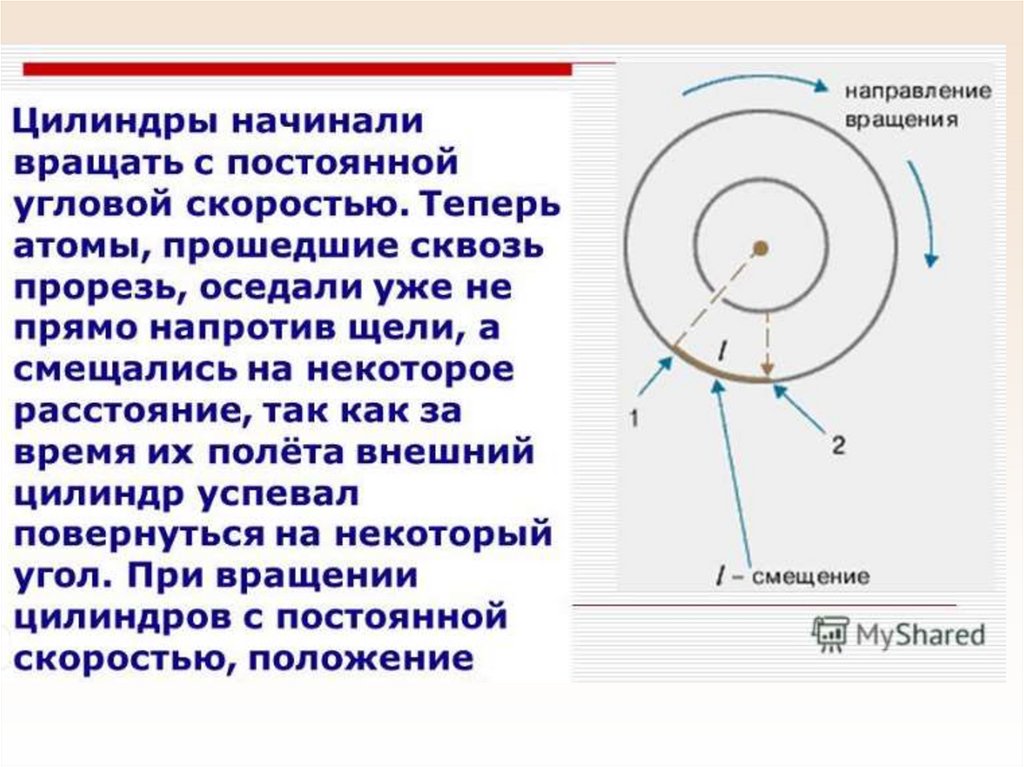




















































 Физика
Физика








